Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 supl.3 Ciudad de México jul./sep. 2005
Revisión de temas cardiológicos
Centenario de la doctrina de la coagulación sanguínea
The centennial of blood coagulation doctrine
Raúl Izaguirre Ávila*
* Departamento de Hematología. Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Raúl Izaguirre Ávila.
Departamento de Hematología. Instituto Nacional de Cardiología Ignacio Chávez.
(INCICH, Juan Badiano No. 1 Col. Sección XVI, Tlalpan 14080 México D.F.).
Teléfono: 55 73 29 11. Telecopiadora: 55 73 09 94.
Correo electrónico: rizagui@yahoo.com.
Resumen
El misterio de la coagulación de la sangre estimuló durante siglos la curiosidad de los investigadores. El conocimiento sobre este fenómeno se ha incrementado notablemente en el último siglo y ha permitido comprender numerosos fenómenos fisiopatogénicos en diversas enfermedades hemorrágicas y trombóticas. Con ello ha sido posible la aparición de variados medicamentos de probada eficacia para prevenirlas y tratarlas. Esta era se inició en 1905, cuando Paul Morawitz publicó una extensa monografía sobre los cuatro factores de coagulación conocidos hasta entonces (fibrinógeno, trombina, trombokinasa y calcio). En ese trabajo propuso un modelo de coagulación dividido en dos etapas: la generación de trombina y la coagulación del fibrinógeno. A partir de la década de 1940 se vivió una verdadera época de oro de la coagulación, cuando aparecieron los frutos de la prueba de laboratorio de coagulación más empleada desde entonces, el tiempo de protrombina descrito por Armand Quick en 1935; éstos incluyeron el descubrimiento y clasificación de numerosos factores involucrados en esta función. El descubrimiento y la introducción de la heparina y los cumarínicos en la terapéutica anticoagulante abrió un panorama inconmensurable para el advenimiento de los nuevos medicamentos antitrombóticos. A mediados del siglo XX se había logrado descifrar el mecanismo de la coagulación prácticamente en forma completa y se propusieron diversos modelos basados en funciones enzimáticas secuenciales, llamadas en cadena primero y en cascada después. En la segunda mitad del siglo XX se identificaron numerosos mecanismos de regulación de la coagulación y aparecieron diversas pruebas de laboratorio que han permitido diagnosticar con alta precisión numerosas enfermedades. Las técnicas de separación sanguínea permitieron producir concentrados de factores para uso clínico. Con la identificación de los genes que codifican la síntesis de los factores de coagulación se ha hecho posible su producción portécnicas de biología molecular, siendo los de mayor trascendencia clínica la de los factores VIII, IX y VII. El modelo actual de la coagulación se basa en la activación por el factor tisular y en la participación de las células, conceptos que ya estaban implícitos en la teoría clásica de Morawitz.
Palabras clave: Fisiología de la coagulación. Hemostasia y trombosis. Historia de la medicina.
Summary
For centuries, the mystery surrounding blood coagulation stimulated the curiosity of researchers. The knowledge about this function has increased notably in the last century and has permitted to understand numerous physiopatho logical phenomena in several hemorrhagic and thrombotic diseases, and has made it possible to develop diverse drugs of proved efficacy for prevention and therapy. All this was initiated in 1905, when Paul Morawitz published an extensive monograph on the four factors of blood coagulation known until then (fibrinogen, thrombin, thrombokinase, and calcium). In that work, he proposed a blood coagulation model in two stages: thrombin generation and fibrinogen coagulation. In the 1940s a true golden age in coagulation was started with the results of Quick's prothrombin time test, described in 1936, and since then the most employed coagulation test. Besides numerous factors involved in this function were discovered and classified. The discovery and introduction of heparin and coumarin in the anticoagulant therapeutics opened a measureless panorama for the arrival of new antithrombotic drugs. By the middle of the XX century, the mechanism of coagulation had been practically deciphered and diverse models based on sequential enzymatic function were proposed, called first chain reactions and in cascade reactions later. In the second half of the XX century, numerous regulatory mechanisms of coagulation were identified and diverse laboratory tests appeared that have allowed highly precise diagnoses of a variety of diseases. Blood separation techniques have permitted to produce factor concentrates for clinical use. With the identification of the genes that encode the synthesis of coagulation factors, it has been possible to produce them by means of molecular biology techniques, being the most significant the production of factors VIII, IX, and VII. The present model of coagulation is based on tissular factor activation and the participation of cells, concepts that were already implicit in the classical theory of Morawitz.
Key words: Blood coagulation. Hemostasis and thrombosis. History of medicine.
El conocimiento sobre la coagulación de la sangre se ha incrementado notablemente en el último siglo y ha permitido comprender numerosos fenómenos fisiopatogénicos en diversas enfermedades, incluyendo algunas que representan problemas de salud, como la enfermedad arterial coronaria. El desarrollo de los enormes conocimientos que sobre esta función se han alcanzado, se inició hace 100 años, cuando, entre 1904 y 1906, Paul Morawitz (Fig. 1) publicó varios estudios en los que resumió el saber que existía sobre la coagulación de la sangre hasta ese momento.1–3 En el más extenso, aparecido en 1905, Morawitz integró una nueva teoría sobre la coagulación. El propósito de este trabajo es recordar cómo se logró elaborar un esquema fisiológico sobre este fenómeno que, después de varias modificaciones, aún continúa vigente. Dividiremos las etapas del saber sobre la coagulación de la sangre en los siguientes períodos: de la época antigua hasta el descubrimiento de la fibrina, y, de acuerdo a Quick,4 los períodos preclásico (del descubrimiento de la fibrina hasta 1905), clásico (1905–1934), y el de la protrombina (1934 – 1943). Agregamos la edad de oro de la coagulación, que se extiende desde el descubrimiento del quinto factor hasta la descripción de los factores anticoagulantes y el período actual, iniciado a partir del concepto celular de la coagulación.

De la época antigua al siglo XVIII
Desde la época más antigua, la coagulación de la sangre estimuló la curiosidad para penetrar en el misterio de su origen. Este notable fenómeno atrajo la atención de numerosos filósofos, médicos y naturalistas, que desde el inicio de la investigación científica propusieron explicaciones para el prodigio por medio del cual, la sangre líquida, ante nuestros ojos, cambia a un estado sólido en breves instantes. Sus ideas pueden ser resumidas en cuatro teorías: la del enfriamiento, la del contacto con el aire, la detención del movimiento de la sangre y la pérdida de la fuerza vital.
Teoría del enfriamiento y del contacto con el aire. Los antiguos filósofos y médicos griegos pensaron que la coagulación de la sangre se producía a través de la solidificación por enfriamiento. Galeno sostiene que la sangre que se aleja del corazón pierde paulatinamente el calor innato y, al enfriarse, se vuelve espesa y se coagula, como la transformación del agua en hielo. Piensa que al salir de una herida y al contacto con el aire, la sangre se enfría, deteniendo la hemorragia por el horror al vacío. Este concepto prácticamente no sufrió cambios durante más de quince siglos. William Harvey, en su obra De Motu Coráis, publicada en 1628, aún sostenía el concepto aristotélico sobre el calor innato emanado del corazón. Está de acuerdo con Galeno en que la sangre lejos del corazón se enfría y se espesa para coagularse a partir de una mucosidad fibrosa presente en ella. El descubrimiento de la circulación sanguínea permite afirmar que la sangre tiene que volver al corazón para dos fines: licuarse mediante el calor del corazón y preñarse del espíritu vital venido de la respiración. Así, la sangre presta su beneficio gracias a que se mantiene líquida por el calor corporal. En el cadáver, los coágulos contienen sustancias en descomposición y putrefacción debidas al frío de la muerte. Además de Harvey, la teoría del enfriamiento era defendida en Inglaterra por varios clínicos, entre ellos Thomas Sydenham (1624 –1689), quien menciona: "... los coágulos se forman en la superficie de la sangre, porque allí se enfría más rápido. Se derivan de la parte fibrosa de la sangre y de los corpúsculos rojos". En el siglo XVIII, Friederich Hoffmann (1660 –1742), en Alemania, aún sostenía la teoría del enfriamiento y pensaba que el coágulo se deriva de una gelatina presente en la sangre líquida. También relacionó los procesos inflamatorios con la coagulación y el espesamiento discrásico como causa de estasis y bloqueo parcial de los vasos sanguíneos. Afirmó que la gangrena y la necrosis son resultado de un bloqueo vascular completo.
La teoría del enfriamiento fue rebatida en la segunda mitad del siglo XVIII por el inglés William Hewson (1739 – 1774), quien observó cómo ocurre la coagulación bajo condiciones variables de temperatura. Demostró que la sangre recién extraída de los vasos coagula a mayor velocidad y que ésta no se coagula por el enfriamiento, sino por el calor. También observó que se puede mantener incoagulable al agregarle ciertas sales, como el sulfato de sodio. En contra de la teoría de Galeno, encontró que el frío retrasa o impide la coagulación y que ésta podía ocurrir sin la presencia de los glóbulos rojos, concluyendo que es una propiedad exclusiva del plasma.
Teoría de la detención del flujo sanguíneo. La difusión de la teoría circulatoria a partir de 1628 introduce un concepto de dinamismo en el líquido hemático. Los fisiólogos de la época atribuyen al movimiento circulatorio varias propiedades que mantienen líquida la sangre; así, la formación de un coágulo se interpreta como el cese de este movimiento vital. El problema de la precipitación de la sangre para formar un coágulo fue abordado en el siglo XVII por Marcelo Malpighi (1628 –1694), quien estudiando cuidadosamente los coágulos cadavéricos de las cavidades cardíacas, logró eliminar las partículas rojas mediante varios lavados, lo que le permitió descubrir la fibrina. En la obra De Polypo Coráis,5 publicada en 1666, menciona: "... Hay en la sangre una materia más abundante para formar la costra... tras repetidos lavados ...todo el coágulo se vuelve pálido. Si os complace la vista de una cosa bella, examinad esta sangre al microscopio. Veréis un tejido fibroso y una red de hilos. Creo que esta retícula blanca de la sangre es la fuerza de todo el coágulo, prestando mayor firmeza a su estructura ...La blanca estructura de la sangre se halla constituida por una apretada red definas mallas, con lo que la costra que se forma es muy compacta ". Malpighi piensa que la red de fibras está compuesta por la aglutinación de filamentos más pequeños que viajan en el torrente sanguíneo en forma diminuta, separadas entre sí gracias a la mezcla originada por la fuerza impelente del corazón. Menciona: "Za consistencia de la sangre se debe a las blancas partículas fibrosas y a las partículas rojizas incorporadas en sus licores. Tales sustancias tienden a precipitarse y a solidificarse. La naturaleza emplea gran ingeniosidad para lograr una mezcla fluida de ellas y conservar su independencia; las confina a espacios pequeños que hacen que no se aglomeren entre sí ni se precipiten, a pesar del contacto con elementos inmediatos diferentes. La fluidez de la sangre se debe al movimiento incesante producido por el corazón, que de esta manera da independencia a cada material integrado y mezcla las partículas en una agitación similar a la de los licores fermentados. Cuando cesa el movimiento, la sangre posee la consistencia del barro. Los quesos y requesones muestran un estado análogo cuando su sustancia está cuajada". Malpighi también se refiere a un suero coagulable que se espesa en algunas enfermedades para producir la costra de sangre sobre los coágulos. Compara esta viscosidad a la que posee la sustancia albuminoide del huevo. Seguramente se refiere a dos de las proteínas más abundantes en la sangre: el fibri–nógeno y la albúmina, que serán descritas en forma completa varios siglos después. El pensamiento malpighiano acerca del fenómeno fisiológico por el que la sangre se mantiene líquida y se previene la coagulación resulta sorprendente en la actualidad, teniendo en cuenta que en el siglo XVII no se habían descrito las propiedades antitrombóticas del endotelio ni los sistemas de proteínas anticoagulantes del plasma. Malpighi pensaba que al cesar el movimiento de la sangre, ocurría separación y agregación de sus partes, con lo que se producía la coagulación. Este razonamiento fue sostenido varios años después por Hermann Boerhave (1668 – 1738) y su alumno Gerhard van Switen (1700 – 1772) en la Universidad de Leiden.
Teoría de la pérdida de la fuerza vital. Harvey pensaba que la sangre contiene una fuerza vital que la mantiene líquida y que al extraerla de los vasos, esa fuerza se evapora. Thomas Willis (1621 – 1675), quien estudiaba medicina en Oxford durante la época en que Harvey dio cursos allí para demostrar experimentalmente la doctrina de la circulación de la sangre, pensaba que ésta se forma en el interior de las venas por unafermentatio natural y que la coagulación es similar a la formación del cuajo láctico. Encontró que el suero contiene una sustancia similar al ovi albumen (la albúmina del huevo). Otros exponentes del vitalismo, como Jan Baptista van Helmont (1579 – 1644), y Franz de le Boe (Silvio) (1614 – 1672) suponían que la sangre perdía su fuerza vital debido a la formación de ácido. En el mismo siglo XVII aún se discutía si la coagulación de la sangre sólo ocurría con la muerte o si también podría desarrollarse en el interior de los vasos durante la vida para cumplir alguna función. Fue hasta 1731 en que el francés Jean Louis Petit (1674 – 1750) describió los coágulos en las arterias lesionadas de individuos vivos; concluyó que participan en la detención de la hemorragia y que no son sólo la consecuencia del enfriamiento corporal que sigue a la muerte.6 Aún por entonces, John Hunter (1728 – 1793), otro de los exponentes del vitalismo en Inglaterra, suponía que la sangre estaba animada y que la retracción del coágulo era la acción final de su animación, relacionando este fenómeno con el rigor mortis de los músculos cadavéricos. A finales del siglo XVIII, Hewson atribuía la coagulación a la linfa coagulable de la sangre, que seguramente era el fibrinógeno, descubierto casi un siglo después en la Universidad de Upsala por Olaf Harmmarsten (1841 – 1912).
Período pre–clásico
Al iniciarse el siglo XIX se conocía bien la existencia de la fibrina y se consolidaba la idea de Hewson de que la coagulación es una propiedad del plasma. Para 1832 Johannes Müller (1801 –1858), en Alemania, ataca la teoría de la fuerza vital, afirmando que la sangre no está animada, debido a que sus células carecen de movimiento propio. Descarta a los glóbulos sanguíneos como la fuente de la fibrina y reafirma que ésta se encuentra disuelta en el plasma. Pero aún no se explicaba cómo es que aparece la fibrina. Se creía que la disuelta en el plasma tenía una tendencia natural a precipitarse, especialmente al detenerse el movimiento de la sangre. La demostración en contra la hizo el escocés Alexander Buchanan (1798 – 1882) quien en 1836, comunicó que el líquido mucinoso de los hidroceles no coagula en forma espontánea, sino que lo hace sólo al agregarle tejidos y suero.7–8 Así aparece el concepto de que la coagulación podría ser un fenómeno en el que participan varias sustancias, algunas de ellas procedentes de los tejidos. Cada vez se intuye con mayor convicción la existencia de un precursor de la fibrina en el plasma y en otros líquidos, como la linfa, que no se ha logrado demostrar. Rudolph Virchow, el destacado patólogo alemán, piensa que el oxígeno tiene efecto sobre la coagulación y en 1856 destaca la importancia de estudiar los exudados, que podrían proporcionar datos para explicar el fenómeno; también afirma que la fibrina no existe en los fluidos en un estado líquido, sino que debe haber un precursor de características completamente diferentes, para el que propone el término fibrinógeno, aún sin demostrarlo.
Cada vez se piensa con mayor certeza que la coagulación puede ser un fenómeno enzimático en el que intervienen tanto sustancias de la sangre como de los tejidos. En 1861 Alexander Schmidt (1831 – 1894), nacido en Estonia, también observa que el líquido del pericardio, del peritoneo y de los hidroceles, coagula al agregarle suero sanguíneo, y concluye que el proceso requiere de dos sustancias: una sustancia proplástica o antecesora de fibrina y una sustancia fibrinoplástica que promueva la conversión.9 En los siguientes años,10 Schmidt mezcló el suero y los coágulos con grandes volúmenes de alcohol y logró aislar una sustancia que podía coagular completamente soluciones de plasma aun pH neutro y a 37 grados de temperatura. Después de la reacción, el suero remanente aún contenía actividad procoagulante. Esto le convenció de la naturaleza enzimática de la reacción y llamó a la sustancia procoagulante fermento de la fibrina y posteriormente trombina. Al mezclar la sangre entera con alcohol, no ocurría lo mismo, por lo que concluyó que dicho fermento no existe en la sangre como tal, sino en forma de un precursor. Pensó que se encontraba en los leucocitos, ya que éstos están presentes en los líquidos que coagulan y no así los eritrocitos. Pensaba que la trombina es liberada desde los granulos de los leucocitos durante el proceso de la coagulación de la sangre. Más tarde Cornelius Pekelhearing (1848 – 1922) llamó protrombina a ese precursor. Entre 1877 y 1879, Olav Hammerstein (1841 – 1932), de la Universidad de Upsala, observó que la velocidad de la coagulación y la cantidad de fibrina generada varían con la concentración de calcio, como ocurre en la leche. Clasificó al calcio como una sustancia fibrinoplástica. Por vez primera logró aislar fibrinógeno del plasma en una forma muy pura, precipitándolo después de saturar el plasma con cloruro de sodio y, por ser insoluble enagua, lo clasificó como globulina. En 1890, el francés Maurice Arthus (1862 – 1945) también descubrió que el calcio es necesario para la coagulación de la sangre,11 de manera similar a lo que ocurre en la leche, en la que el calcio es necesario para la conversión del caseinógeno en caseína. Hammerstein observó en 1899 que el fibrinógeno puro no coagula al agregarle calcio, sino sólo cuando éste se mezcla con la trombina. Así se concluyó que el calcio sólo es necesario para la aparición de trombina y no para la generación de fibrina.
Período clásico
A principios del siglo XX aún prevalecía un gran desconcierto sobre la coagulación de la sangre. Se habían descrito varios hechos en forma aislada, como la capacidad de los tejidos de acelerar la coagulación, observada por Buchanan, la presencia de un fermento procoagulante tanto en los coágulos como en el suero, descrita por Schmidt y la necesidad del calcio para que ocurriera. Estos conocimientos fueron revisados extensamente por Paul Morawitz, quien logró integrar una teoría unitaria que ha resultado clásica a partir de su difusión en 1905.
Paul Morawitz había nacido en San Petersburgo, Rusia, el 3 de abril de 1879 y había estudiado en Jena, Leipzig y Munich. Su formación al lado de Von Krehl le enseñó el método de Diógenes basado en una búsqueda constante de la verdad a través de un riguroso método para examinar y re–examinar los problemas y una deliberada actitud de incertidumbre ante los hechos. Trabajó en diversos centros clínicos en las ciudades de Góttingen, Tubingen, Heidelberg, Freiburg y Würzburg. En Leipzig fue jefe de la clínica universitaria. Max Wintrobe le conoció personalmente durante una estancia en Alemania a principios de la década de 1930 y lo describe como un hombre de personalidad refinada, genuino, entusiasta y modesto.12 Era un organizador y administrador excepcional y su departamento funcionaba con una colaboración eficaz y una puntualidad militar. Publicó numerosos trabajos en el área de la Medicina Interna, pero su principal interés se enfocó a la sangre. Publicó un breve tratado de hematología que fue traducido al español en 1929. Morawitz murió el 1 de julio de 1936.
Entre 1903 y 1906 Morawitz publicó una serie de trabajos13 (Fig. 2) sobre la coagulación de la sangre, que fueron resultado de la cuidadosa revisión de los conocimientos existentes hasta entonces, en especial el trabajo de Fuld y Spiro de 1904.13 En la nueva teoría, Morawitz reunió los cuatro factores descubiertos hasta esa época: fibrinógeno, protrombina, calcio y factor de los tejidos. La nueva teoría, dada a conocer en 1905 en una extensa monografía de más de 100 páginas y 490 citas bibliográficas,3 fue la base del enorme desarrollo que experimentó el conocimiento sobre la fisiología de la coagulación durante el siglo XX. Morawitz propuso que la coagulación de la sangre ocurre en dos etapas. La primera era la conversión de protrombina a trombina mediante la acción del factor tisular en presencia de calcio y la segunda mediante la conversión de fibrinógeno a fibrina gracias a la acción de la trombina:
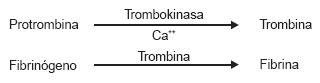

Introdujo el término trombokinasa para designar la sustancia activa de los jugos tisulares y prefería el término trombógeno (en lugar del término protrombina) para designar al precursor de la trombina. Consolidó el concepto enzimático de la coagulación, al comparar esta función con la generación de tripsina a partir del tripsinógeno mediante la acción de la enterokinasa. En el capítulo 4 de la monografía, Morawitz resume la doctrina de la coagulación con las siguientes palabras: "En el plasma de la sangre circulante existen fibrinógeno, sales de calcio y probablemente también trombógeno. Una vez que la sangre sale de los vasos, los elementos formes, especialmente las plaquetas cuando se irritan por el contacto con cuerpos externos, liberan trombokinasa dentro del plasma. La trombokinasa, a su vez, forma trombina, junto con trombógeno y sales de calcio".
Sorprendentemente, la nueva teoría no produjo acuerdo entre los investigadores, sino que originó una variedad de teorías. El belga Pierre Nolf (1873 – 1953) postuló en 1908 que la coagulación del plasma se debe a tres sustancias, el fibrinógeno y el trombógeno, originadas en el hígado y la trombozima, originada en el endotelio, las plaquetas, los ganglios linfáticos y los leucocitos. Mencionó que sólo existen adyuvantes para coagular y propuso reunirlos todos bajo la designación de sustancias tromboplásticas a las que también llamaba agentes coagulantes de tercer orden (extractos tisulares con alcohol, algunos extractos salinos y agentes químicos). Jules Bordet (1870 – 1961), mejor conocido por el descubrimiento del agente causal de la tos ferina, sostenía que el factor tisular provenía de las células, motivo por el que le llamó citozima. Estos conceptos permanecieron vigentes durante varios años. Maurice Arthus los menciona en su libro de fisiología de 191214, asi como Roger Douris en su guía sobre análisis de sangre, donde aparecen las técnicas de la época para estudiar la coagulación en el laboratorio clínico.15 William Henry Howell (1860 – 1945), mejor conocido por haber descrito las inclusiones de los eritrocitos (cuerpos de Howell–Jolly), también mostró un gran interés por la coagulación. En la segunda edición de su tratado de fisiología, publicado en 190816 menciona la teoría de Morawitz prácticamente sin modificaciones. En los siguientes años estudió el factor tisular, al que dio el nombre de tromboplastina, término que se ha empleado hasta la actualidad. Al estudiar las propiedades procoagulantes de la tromboplastina, su alumno Jan MacLean descubrió en 191617 un principio anticoagulante, al que el propio Howell llamó heparina. Este hecho hizo que Howell modificara el concepto sobre la coagulación y en su tratado de fisiología de 191918 sostenía que la heparina era una anti–protrombina que viaja en el plasma unida a la protrombina para impedir la coagulación y que la tromboplastina separa esta unión, liberando a la protrombina para que mediante la acción del calcio se convierta a trombina. La heparina disociada, a su vez, se unía al exceso de tromboplastina para limitar el proceso de coagulación. La teoría de Howell terminó por imponerse a través de numerosos escritos19 y libros para mantenerse por largos años. Las técnicas de laboratorio para estudiar la coagulación de la sangre se apoyaban en su teoría.20 De acuerdo a Jaques,21 el papel dominante de Howell en el ámbito científico de Norteamérica hizo imponer y mantener su teoría por muchos años e impidió que los siguientes descubrimientos fueran aceptados con facilidad. Eso influyó para que los editores de numerosas revistas no aceptaran la divulgación de nuevos conocimientos, como la aparición de la prueba de protrombina de Armando Quick, la preparación y la naturaleza de la protrombina y el descubrimiento de la globulina antihemofílica.
Período de la protrombina
Desde los primeros estudios sobre el papel de las grasas en la dieta, se hizo evidente que uno de sus compuestos era esencial en la fisiología de la coagulación. A fines de la década de 1920, Henrik Dam, trabajando en la Universidad de Copenhague, diseñó experimentos para demostrar el papel del colesterol en la dieta. Descubrió que en los pollos alimentados sin grasas se desarrollaba una enfermedad hemorrágica, que se corregía administrando un extracto lipídico de alfalfa. Sus estudios le llevaron, a principios de la década de 1930, a aislar y caracterizar el compuesto activo, la filoquinona, que se conoció como la vitamina de la coagulación.22 Debido a que el término en danés se escribe con k, se le denominó vitamina K. Por su parte, Edward A. Doisy, trabajando en San Luis Missouri,23 demostró que además de las plantas verdes, numerosas bacterias sintetizan vitamina K. A ambos investigadores se les concedió el Premio Nobel en 1941 por el descubrimiento de esta vitamina liposoluble. El descubrimiento de la vitamina K significó un avance en el conocimiento sobre la bioquímica de la coagulación y su empleo en clínica originó resultados espectaculares en la enfermedad hemorrágica del recién nacido y en la hemorragia colémica. Desde 1912 Whipple había demostrado una ausencia de protrombina en casos de melena e ictericia neonatal. Por otra parte, en 1924 Frank Schofield observó una enfermedad hemorrágica en el ganado que se alimentaba del trébol dulce en descomposición. Las autopsias de los animales revelaron hemorragia profusa en las visceras. Lee M. Roderick encontró disminución en la protrombina en la sangre de los animales y en 1939 H. Campbell y Karl P. Link identificaron la sustancia responsable, llamada bis–hidroxicumarina. Poco tiempo después se introdujo otro compuesto menos tóxico y más eficaz, que se registró con el nombre del dueño de la patente como warfarina, término acuñado de las iniciales del lugar donde se obtuvo: Winsconsin Alumni Research Foundation (WARF), seguido del sufijo tomado del principio original, la cumarina.24
A mediados de la década de 1930, Armand Quick (1894 – 1978) desarrolló un método de laboratorio para reproducir la teoría de la coagulación de Morawitz. En esa prueba añadía extractos de tejido al plasma en presencia de calcio para convertir la protrombina a trombina y ésta a su vez transformar el fibrinógeno en fibrina. Debido a que el trabajo de Quick tenía como fundamento la teoría de Morawitz y no coincidía con la teoría de Howell, fue rechazado ocho veces de las revistas más influyentes, antes de ser publicado en 1936.25 Como sólo se conocían cuatro factores, se pensaba que el proceso se iniciaba al activar la protrombina, lo que explica el nombre con el que aún se conoce esta prueba de coagulación (Tiempo de Protrombina o TP). La nueva prueba permitió entender la función de la vitamina K y las enfermedades hemorrágicas en que ésta disminuye, así como vigilar el tratamiento con los anticoagulantes orales recién descubiertos. Hasta la actualidad, el TP es la prueba de coagulación que se realiza con más frecuencia.
Edad de oro de la coagulación
El propio Quick observó algunas discrepancias en los resultados del TP: encontró que si la prueba se hacía varias horas después de la extracción de sangre, el tiempo de coagulación se prolongaba, y si se practicaba inmediatamente a la extracción de sangre, el tiempo de coagulación era más breve. Corroboró que en el primer caso, el tiempo de coagulación se abreviaba al agregar el plasma de pacientes tratados con cumarínicos. En 1948 postuló la existencia de dos factores más; un quinto factor que acelera la coagulación y que se destruye durante el almacenamiento, por lo que le llamó acelerina o factor lábil y de un sexto o factor estable. A la postre, resultaron ser variantes de la misma sustancia, así que este último se eliminó de la lista de factores de la coagulación. Casi en forma simultánea, Paul Owren (1905 – 1990), en Noruega, también descubrió el quinto factor.
Al año siguiente (1949) André de Vries propuso la existencia de un factor que mejora la conversión de protrombina en el suero, que fue descrito en forma independiente el mismo año por Benjamín Alexander (1909 – 1978) y el mismo Owren en 1950. Este último llamó convertina al nuevo factor y proconvertina a su precursor, al que correspondió el número séptimo entre los factores que causan la coagulación del plasma. Arthur Patek encontró en 1936 que al agregar plasma normal al plasma de un enfermo con hemofilia se corrige el tiempo de coagulación y sugirió que la fracción cruda del plasma normal contiene un principio al que se llamó factor antihemofilico.26 Fue descubierto antes que la acelerina y la convertina, por lo que realmente le correspondía ser el quinto. En 1947 en Buenos Aires, Alfredo Pavlovsky (1907 – 1984) comunicó que el tiempo de coagulación de la sangre de un hemofílico se abreviaba al agregar sangre de otro hemofílico27 y que la transfusión de plasma de ciertos enfermos con hemofilia también abreviaba el tiempo de coagulación de otro hemofílico, con lo que se postuló la existencia de dos tipos de esta enfermedad. Así, en 1952 Paul Aggeler (1911 – 1969) e Irving Shulman en Inglaterra postularon la existencia de otro factor, al que llamaron componente tromboplastínico del plasma, y que para algunos fue la largamente postulada y buscada tromboplastina del plasma, que suponían era análoga en función a la tromboplastina de los tejidos. Realmente, el concepto de tromboplastina plasmática se amplió al descubrir la interacción de los fosfolípidos de las plaquetas, el calcio y los factores VIII y IX de la coagulación como un proceso que genera trombina. La imposibilidad para generar esta tromboplastina del plasma2* se identificó como causa de la hemofilia. El mismo año, Rosemary Biggs (1912 – 2001), Stuart Douglas y Robert MacFarlane (1907 – 1987) comunicaron haber encontrado siete enfermos con una anomalía hemorrágica diferente a la hemofilia clásica, a la que llamaron Enfermedad de Christmas29 por el nombre de uno de los niños que la padecía (Stephen Christmas). A este nuevo factor descubierto se le llamó también/actor de Christmas y posteriormente le correspondió el número IX.30 En 1955 Francois Duckert (1922 – 1998) encontró una alteración de la coagulación en una mujer llamada Audrey Prower y describió un principio al que identificó como un/actor del suero que se encuentra disminuido en enfermos que ingieren anticoagulantes orales y en los que sufren hepatitis. Al año siguiente (1956) y de manera independiente, Telfer comunicó la primera deficiencia familiar de este factor y un año después (1957) Cecil Hougie encontró una alteración similar en un enfermo llamado Rufus Stuart. Más adelante, al nuevo factor de Stuart–Prower le correspondió el número X. Robert Rosenthal descubrió una tercera clase de hemofilia en 1953 que, a diferencia de las previamente descritas, afectaba a dos mujeres y un varón de una familia. Atribuyó la enfermedad a la falta de un factor al que llamó antecedente tromboplastínico del plasma. A la enfermedad la llamó Hemofilia C. Varios años después, a este factor se le asignó el número XI. En 1955 Osear Ratnoff comunicó un defecto en la coagulación de un ferrocarrilero llamado John Hageman y su estudio le llevó a descubrir un nuevo factor al que dio el nombre del propio enfermo (factor de Hageman). Cinco años después se le asignó el número XII. Entre 1944 y 1948 Robbins y Laki describieron el factor estabilizador de la fibrina, que en 1963 pasó a ser el número XIII.
Para mediados de la década de 1950 se habían descrito tantos factores con nombres y propiedades diferentes, que existía una gran confusión sobre los compuestos que participaban en la coagulación. La trombokinasa de Morawitz había resultado ser la suma de numerosas fracciones diferentes. Varios investigadores habían descubierto el mismo factor y habían propuesto términos diferentes, así que se hizo necesario establecer una nomenclatura que dejara claro cuantas sustancias existían. La idea vino de Irving Wright (1901–1997), profesor de Medicina Interna en Cornell University, quien hizo la propuesta en 1954 durante una conferencia internacional de trombosis. El mismo año se estableció el Comité Internacional para Nomenclatura de los Factores de Coagulación bajo la presidencia del propio Wright y contó con 23 miembros, entre los que sobresalen los nombres de Kenneth Brickhous, Robert MacFarlane, Paul Owren, Alfredo Pavlovsky, Armand Quick, Oscar Ratnoff, Walter Seegers, Jean Pierre Soulier y Marc Verstraete. La primera reunión ocurrió en Oxford en 1955 y después de 3 años de deliberaciones, se designaron los factores I a IX que fueron aprobados en la reunión de Roma en 1958, cuya ciudad sede probablemente influyó para emplear números romanos. Éstos dieron mayor objetividad a la terminología, independientemente de los diversos idiomas y del reclamo sobre la prioridad de los descubrimientos por los autores. Los factores X a XIII fueron agregados entre 1959 y 1963 (Fig. 3).
En cuanto al mecanismo fisiológico por el que operan los factores de la coagulación, Fischer, desde 1935, describió el proceso como una reacción en cadena que podría perpetuarse de manera infinita.31 Desde un punto de vista teleológico, este mecanismo cumple la función de asegurar la suficiente generación de fibrina para consolidar el coágulo. Milstone32 explicó en 1949 que durante la lesión vascular, la sangre se pone en contacto con los jugos tisulares, que producen la primera aparición de un coágulo para sellar la herida. Esta primera capa aisla a la sangre del estímulo tisular y si cesara el proceso por falta de estímulo, el coágulo inicial podría ser insuficiente para contener la hemorragia. Una reacción en cadena perpetuada después de que se pierde el contacto con el factor tisular, permite continuar la reacción hasta generar la suficiente cantidad de fibrina y consolidar el coágulo hasta hacerlo muy firme mediante la retracción. Este concepto continúa siendo fundamental en la moderna concepción de la coagulación. A mediados del siglo XX los estudios sobre esta función se encontraban en una etapa de efervescente desarrollo. Se habían introducido nuevos términos, a menudo en forma prematura, sin esperar la comprobación de los nuevos factores. No estaba totalmente claro qué tan diferentes eran éstos de los antiguos factores y se tenía la esperanza de que el reino de la confusión pronto terminaría, apoyándose en los conceptos en que la mayoría de los investigadores estaban de acuerdo y abandonando las viejas ideas discordantes.33 En 1964 dos grupos de investigadores concibieron, casi en forma simultánea, una serie de reacciones enzimáticas secuenciales, en las que el producto de una serie activa a la siguiente, y la compararon a una reacción en cascada, término que aún se emplea en un amplio sector de la comunidad científica. El concepto sobre una cascada de la coagulación se debe a Osear Ratnoff en colaboración con Davie34 en los Estados Unidos, y a MacFarlane en Inglaterra.35 El modelo establecía que la coagulación se inicia de dos maneras. Una por la activación del factor de contacto (XII), a lo que se denominó vía intrínseca, y otra a través del factor VII y el factor tisular, a lo que se denominó vía extrínseca. Ambas vías conducen a la activación del factor X hasta generar fibrina, a lo que se llamó vía común. En el terreno de la clínica, pronto se explicaron numerosas enfermedades hemorrágicas al descubrir deficiencias de los factores de coagulación, tanto hereditarias como adquiridas. Con la identificación de la coagulación intravascular diseminada se dio mayor importancia fisiológica y patogénica a la vía intrínseca. Por otra parte, desde 1937 había surgido el concepto de trombofilia36 en oposición al cada vez más amplio concepto de hemofilias. Así, a mediados del siglo XX se vivió una verdadera edad de oro en el conocimiento sobre la coagulación, cuando se dilucidó prácticamente en forma completa su mecanismo. Inmediatamente se descubrieron varios sistemas de regulación de la hemostasia: los diferentes tipos de antitrombinas, siendo la más importante la III, el sistema fibrinolítico, el sistema de las proteínas C (autoprotrombina II anticoagulante),37 S y trombomodulina. También se descubrieron las innumerables interrelaciones de la coagulación con otros sistemas de defensa orgánica, como los de la inflamación,38 complemento y de la regulación del tono y crecimiento vascular.
Época actual
En la década de 1980 se cuestionó el modelo de la coagulación basado en las vías extrínseca, intrínseca y común. No era suficiente para explicar la hemorragia grave que ocurre en los hemofílicos y la vía intrínseca perdió importancia. Se corroboró que el principal mecanismo que inicia la coagulación es el complejo del factor tisular39–41 unido a fosfolípidos y al factor VII activado42 (convertina), y que todas las reacciones que siguen ocurren en la superficie celular para generar trombina.43 A este mecanismo se le ha denominado vía del factor tisular o vía primaria y a la activación por contacto se le ha denominado vía accesoria.44 Se han conocido los sistemas de cooperación celular con la coagulación y los mecanismos de reparación tisular; se han descifrado las secuencias aminoacídicas de las moléculas involucradas, así como los genes que codifican su síntesis y regulación. En su sentido más amplio, el concepto actual sobre la coagulación no difiere notablemente de la doctrina de Morawitz. La idea unitaria de una trombokinasa estuvo basada en la capacidad que tienen los extractos crudos de tejido para coagular la sangre. El constante reto frente al misterio de la aparición de la fibrina para solidificar la sangre, originó arduos estudios durante el siglo XX. Éstos han llevado a colocar en la ecuación básica de Morawitz, en el lugar donde la trombokinasa convierte protrombina a trombina, al conjunto de factores que hoy conocemos. La trombokinasa ha resultado ser más que el solitario factor tisular, postulado desde mediados del siglo XIX. Al fraccionarla, la trombokinasa resultó ser el conjunto de la tromboplastina tisular de Howell, la tromboplastina plasmática de los años 50, las vías intrínseca, extrínseca y común, en boga desde la mitad del siglo XX, y los actuales complejos enzimáticos denominados diez–asa, protrombinasa y factor tisular unido al factor Vila (convertina), incluyendo a los fosfolípidos de los tejidos, de las plaquetas y del endotelio. Incluso la fase de contacto tan valorada entre 1960 y 1980, está presente en la trombokinasa, pues ya Morawitz describía la acción que tiene el contacto de la sangre con otras sustancias ajenas a ella. La moderna visión de la coagulación da énfasis al papel de las células como fuente de factor tisular y de fosfolípidos de superficie para integrar los complejos enzimáticos.45 Siendo el componente primordial de los tejidos, las células ya estaban incluidas también en la trombokinasa.
Entre los hitos de este siglo de la coagulación se encuentran las numerosas técnicas de laboratorio46 que exploran casi la totalidad del sistema y permiten hacer diagnósticos de alta precisión.47 Los resultados inmediatos sobre la terapéutica hemostática, anticoagulante, antiplaquetaria y fibrinolítica han sido evidentes. Con el perfeccionamiento de las transfusiones de sangre48 se logró separar sus fracciones49 y preparar concentrados de factores específicos a partir del plasma.50,51 Una aportación mayor ha sido la producción de algunos de ellos mediante la biotecnología (factores VHIr, IXr y Vllr).52,53 También se han producido concentrados de proteínas anticoagulantes, como la antitrombina–III, la proteína C activada y el inhibidor de la vía del factor tisular, que se han empleado no sólo en las enfermedades trombóticas, sino también en sepsis grave.54–56 La genética ha permitido descubrir la transmisión de enfermedades hemorrágicas y trombóticas y numerosos polimorfismos genéticos asociados a ellas.57 Con la integración de la doctrina de la coagulación hace 100 años se abrió un panorama inconmensurable en la fisiología, en la patogenia y en la terapéutica médicas, que se ha extendido al campo no sólo de las enfermedades hemorrágicas, sino también de las trombóticas, en problemas de salud pública tan importantes y variados que van desde la aterosclerosis58,59 y su más grave complicación, el infarto agudo del miocardio, hasta la pérdida gestacional recurrente60 y los estados de preeclampsia.61 Prácticamente no hay patología ni procedimiento médico o quirúrgico, que no tenga alguna relación con la fisiología y patología de la coagulación, porque la sangre y sus propiedades, normales o alteradas, están presentes en el cotidiano ejercicio de la medicina.
Agradecimientos
Al Biólogo Mario Fuentes, Jefe de la Biblioteca del Instituto Nacional de Cardiología, por haber obtenido copias de los trabajos originales de Morawitz en bibliotecas de Alemania. Al personal de la misma biblioteca por las facilidades para localizar material bibliográfico antiguo del propio acervo.
Al Dr. Alfredo de Micheli por revisar el manuscrito.
Referencias
1. Morawitz P: Beiträge zur kenntnis der blutgerinnung. Beitr Chem Physiol Pathol 1904; 5: 133–141. [ Links ]
2. Morawitz P: Beiträge zur kenntnis der blutgerinnung. 2 Mitteilung. Deutsche Arch Klin Med 1904; 79: 215–233. [ Links ]
3. Morawitz P: Die Chemie der Blutgerinnung. Ergebn Physiol 1905; 4: 307–423. [ Links ]
4. Quick A: Hemorrhagic diseases and thrombosis. Philadelphia. Lea & Febiger. 1966: 15–33. [ Links ]
5. Malpighi M: De viscerum structura exercitatio anatómica. Accedit dissertatio eiusdem de Polypo Cordis. Bolonia, Iacobo Monti, 1666. [ Links ]
6. Forge E: Histoire de la Chirurgie. En: Lavastine L. Ed. Histoire Genérale de la Médecine, de la Pharmacie, de l'art dentaire et de l'art vétérinaire. París. Albin Michel Editeurs, 1936; 2: 351. [ Links ]
7. Buchanan A: Contributions to the physiology and pathology of the animal fluids. London Med Gaz 1836; 18: 50–54. [ Links ]
8. Buchanan A: On the coagulation of the blood and other fibrinifemus liquids. J Physiol 1879; 2: 158–163. Reimpreso de : London Med Gaz o J Pract Med 1845; 1:617. [ Links ]
9. Schmidt A: Ueber den faserstoff und die ursachen seiner gerinnung. Reichert DuBois Reymond's P. Arch Anat Physiol 1861: 545–587, 675–721. [ Links ]
10. Schmidt A: Weiteres über den faserstoff und die ursachen seiner gerinnung. Arch Anat Physiol 1862: 428–469. [ Links ]
11. Arthus M: La coagulation du sang et les seis de chaux (refutation experiméntale des objections d 'Alexander Schmidt). Arch Physiol 1896; 8: 47–61. [ Links ]
12. Wintrobe M: Hematology, the bloosoming of a science: a story of inspiration and effort. Philadelphia: Lea & Fabiger, 1985: 102–103. [ Links ]
13. Fuld E, Spiro K: Der Einfluss einige gerinnungshemmender Agienten auf das Vogelplasma. Hofmeisters Beitr Chem Physiol Pathol 1904: 171–190. [ Links ]
14. Arthus M. Précis de Physiologic Paris: Masson & Cie Éditeurs, 1912: 32–37. [ Links ]
15. Douris R. Guide practique pour l'Analyse dun sang. Paris: Vigot Fréres, Éditeurs, 1925:18–28. [ Links ]
16. Howell Wh: A text–book of Physiology. 2a. Ed. Philadelphia: W.A. Saunders Company, 1908: 426–436. [ Links ]
17. McLean J: The thromboplastic action of cephalin. Am J Physiol 1916; 41: 250–257. [ Links ]
18. Howell WH: A textbook of Physiology. 7ma. Ed. Philadelphia: WA. Saunders Company, 1919: 453–469. [ Links ]
19. Howell WH: Theories of blood clotting. Physiol Rev 1935;15: 435–470. [ Links ]
20. Beck R. Laboratory Manual of Hematologic Technic. Philadelphia: W.B. Saunders Company, 1938: 30–43. [ Links ]
21. Jaques B: The Howell theory of blood coagulation: a record of the pernicious effects of a false theory. Can Bull Med His 1988; 5: 143–165. [ Links ]
22. Dam H: Vitamin K, its chemistry and physiology. Adv Enzymol 1942; 2: 285–324. [ Links ]
23. Doisy EA, Binkley SB, Thayer SA: Vitamin K. Chem Rev 1941; 28: 477–517. [ Links ]
24. Link KP: The discovery of dicumarol and its sequels. Circulation 1997; 19: 97–107. [ Links ]
25. Quick A, Stanley–Brown M, Bancroft FW: A study of the coagulation defect in hemophilia and in jaundice. Am J Med Sci 1935; 190: 501–511. [ Links ]
26. Patek AJ, Taylor FHL: Hemophilia II. Some proprieties of a substance obtained from normal plasma effective in accelerating the clotting of hemophiliac blood. J Clin Invest 1937; 16: 113–124. [ Links ]
27. Pavlovsky A: Contribution to the pathogenesis of hemophilia. Blood 1947; 2: 185–191. [ Links ]
28. Biggs R, Douglas A: The thromboplastin generation test. J Clin Pathol 1953; 6: 23–29. [ Links ]
29. Biggs R, Douglas A, MacFarlane R: Christmas disease. A condition previously mistaken for haemophilia. BMJ 1952; 2: 1378–1382. [ Links ]
30. Izaguirre R: Historia de la Hemofilia. En: Martínez, C. Ed: Hemofilia. México: Editorial Prado, 2001:1–17. [ Links ]
31. Fischer A: Coagulation of the blood as a chain reaction. Nature 1935; 1075: 135. [ Links ]
32. Milstone JH: The chain reaction of the blood clotting mechanism in relation to the theory of hemostasis and thrombosis. Blood 1949; 4: 1290–1297. [ Links ]
33. Milsone JH: Evolution of blood clotting theory. Medicine 1952; 31: 411–447. [ Links ]
34. Davie EW, Ratnoff OD: Waterfall sequence for intrinsec blood clotting. Science 1964; 145:1310–1312. [ Links ]
35. MacFarlane RG: An enzyme cascade in the blood clotting mechanism and its function as a biochemical amplifier. Nature 1964; 202: 498–499. [ Links ]
36. Nygaard K, Brown G: Essential thrombophilia. Report of five cases. Arch Int Med 1937; 59: 82–106. [ Links ]
37. Ulutin ON, Seegers WH: Autoprothrombin Hand Autoprothrombin II anticoagulant. Thromb Diath Haemorrh 1962; 7(S): 256–263. [ Links ]
38. Esmon CT, Taylor FB, Snow TR: Inflammation and coagulation. Linked processes potentially regulated through a common pathway mediated by protein C. Thromb Haemost 1991; 66: 160–165. [ Links ]
39. Nemerson Y: Tissue factor and hemostasis. Blood 1988; 71: 1–8. [ Links ]
40. Bach RR: Initiation of coagulation by tissue factor. CRC Crit Rev Biochem 1988; 23: 339–368. [ Links ]
41. Camerer E, Kolsto AB, Pryds H: Cell biology of tissue factor, the principal initiator of blood coagulation. Thromb Res 1996; 81: 1–41. [ Links ]
42. Morrissey JH: Tissue factor and factor VII initiation of coagulation. En: Colman RW, Hirsh J, Marder VJ, et al. Eds. Hemostasis and thrombosis: basic principles and clinical practice. Philadelphia: Lippincott Williams & Wilkins, 2001: 89–101. [ Links ]
43. Hoffman M, Monroe DM: A cell–based model of hemostasis. Thromb Haemost 2001; 85: 958–965. [ Links ]
44. Brummel–Ziedins K, Orfeo T, Swords J, et al: Blood coagulation and fibrinolysis. En: Greer J, Foerster J, Lukens J, et al. Wintrobe's Clinical Hematology. Philadelphia: Lippincott Williams & Wilkins 2004: 677–774. [ Links ]
45. Hoffman M: Remodeling the blood coagulation cascade. J Thromb Thrombolysis 2003; 16: 17–20. [ Links ]
46. Owen C: Historical account of tests of Hemostasis. Am J Clin Pathol 1990; 93(suppl 1): s3–s8. [ Links ]
47. Walenga JM: Molecular and automated assesments of coagulation. En: Corriveau DM, Fritsma GA: Hemostasis and thrombosis in the clinical laboratory. Philadelphia: Lippincott Company 1998: 367–416. [ Links ]
48. Izaguirre R, de Micheli A: En torno a la historia de las transfusiones sanguíneas. Rev Invest Clin 2002; 54: 552–558. [ Links ]
49. Cohn EJ: The separation of blood into fractions of therapeutic value. Ann Intern Med 1947; 26: 341–352. [ Links ]
50. Kekurck RA, Wolf P: A concentrate of human antihemophilic factor. Its use in six cases of haemophilia. Lancet 1957; 1: 647. [ Links ]
51. Pool JD, Shannon AE: Production of high–potency concentrates of antihemophilic globulin in a closed bag system. NEJM 1965; 273: 1443–1447. [ Links ]
52. Manno CS: The promise of third–generation recombinant therapy and gene therapy. Sem Hematol 2003; 40: s23–s28. [ Links ]
53. Roberts HR, Monroe DM, Hoffman M: Safety profile of recombinant factor Vila. Sem Hematol 2004; 41: s101–s108. [ Links ]
54. Bernard GR, Vincent JL, Lattere PF, et al: Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001; 344: 699–709. [ Links ]
55. Larosa SP, Opal SM: Tissue factor pathway inhibitor and antithrombin trial results. Crit Care Clin 2005; 21: 433–448. [ Links ]
56. Kaiser B, Hoppendsteadt DH, Fareed J: Recombinant TFPI and variants: potential implications in the treatment of cardiovascular disorders. Expert Opin Investig Drugs 1998; 7: 1121–1137. [ Links ]
57. Simmonds R, Hermosa J, Rezende S: Haemostatic genetic risk factors in arterial thrombosis. Thromb Haemost 2001; 86: 374–385. [ Links ]
58. Falk E, Fuster V, Prediman S: Interrationship between atherosclerosis and thrombosis. En: Verstraete M, Fuster V, Topol E, Eds. Cardiovascular thombosis. Philadelphia: Lippincot Raven, 1998: 45–58. [ Links ]
59. Folsom A: Hemostatic risk factors for atherothrombotic disease: an epidemiologic view. Thromb Haemost 2001; 86: 366–373. [ Links ]
60. Bick R, Hoppensteadt: Recurrent miscarriage syndrome and infertility due to blood coagulation protein/platelet defects. A review and update. Clin Appl Thromb Hemost 2005; 11: 1–13. [ Links ]
61. O'Riordan MN, Higgins JR: Haemostasis in normal and abnormal pregnancy. Best Pract Res Clin Obstet Gynaecol 2003; 17: 385–396. [ Links ]














