Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 supl.3 Ciudad de México jul./sep. 2005
Investigación Clínica
Infartos miocárdicos con onda Q y sin onda Q
On Q–wave and non–Q wave myocardial infarcts
Alfredo de Micheli,* Alberto Aranda,* Gustavo A Medrano*
* Del Instituto Nacional de Cardiología Ignacio Chávez. México.
Correspondencia:
Alfredo de Micheli.
Instituto Nacional de Cardiología Ignacio Chávez.
(INCICH, Juan Badiano No. 1, Col. Sección XVI,
Tlalpan. 14080 México, D.F.).
Resumen
Se habló mucho, y se sigue hablando, de infartos miocárdicos con onda Q y sin onda Q en las derivaciones correspondientes. Y se trata de relacionar el cuadro electrocardiográfico con las arterias coronarias afectadas y con la ubicación de la zona de miocardio inactivable. Pero debe tenerse presente que la existencia o no de ondas Q anormales –pueden hallarse ondas Q normales en las derivaciones que ven alejarse el primer vector de la activación ventricular– depende de la relación que se establece entre la extensión de la zona miocárdica dañada y la amplitud del llamado endocardio eléctrico. Tal relación varía en los diferentes individuos de la misma especie y según el nivel ventricular en donde se sitúa el miocardio dañado. De hecho, debe tenerse presente que el endocardio eléctrico, i.e. el territorio de distribución de la red de Purkinje, se encuentra en su mayor parte en la mitad inferior de ambos ventrículos y es prácticamente ausente en las regiones básales. Constituye éste una entidad histofuncional porque las fibras de Purkinje, que reciben al mismo tiempo los impulsos de activación, se despolarizan simultáneamente sin producir diferencias de potencial. Por lo tanto, no pueden dar una contribución eléctrica propia ni en condiciones normales, ni cuando sufren un daño circunscrito. Pero si el área dañada rebasa los límites externos de dicho endocardio, p. ej. en sitios donde éste es escaso, los electrodos exploradores correspondientes pueden registrar ondas Q anormales, debido a los frentes de activación que se alejan, seguidas de ondas R originadas en tiras de miocardio respetado. Presentamos dos ejemplos característicos, respectivamente, de las manifestaciones electrocardiográficas de un infarto transmural del ventrículo izquierdo (complejos ventriculares QS) y de un infarto subendocárdico que rebasa los límites externos del endocardio eléctrico (complejos ventriculares QR). En ambos casos, los hallazgos electrocardiográficos se correlacionan bien con los datos anatómicos.
Palabras clave: Infarto subendocárdico. Infarto intramural. Infarto subepicárdico. Infarto transmural.
Summary
Much has been said, and is still being said, on Q–wave and non–Q wave myocardial infarcts, trying to relate this electrocardiographic behavior with the culprit coronary arteries and the location of the damaged myocardium. However, it seems logic to bear in mind that the presence or absence of abnormal Q waves depends on the relation established between the zone of damaged myocardium and the width of the electrical endocardium. It must be recalled that the presence of normal Q waves is possible in leads that seem to move away from the first vector of ventricular activation. Besides, the electrical endocardium, i.e., the territory of distribution of Purkinje's network, is situated mainly in the lower half of the ventricles and is virtually absent in basal regions. This endocardium constitutes a histological–functional entity, since the Purkinje fibers, which receive at the same time the activation impulses, are depolarized simultaneously without producing differences in potential. Therefore, these fibers cannot supply an electrical contribution either in normal condition or in the presence of limited damage. Nevertheless, when the damaged zone reaches beyond the exterior limits of this endocardium, for example, in regions where it is small, the exploring electrode can register abnormal Q waves, due to the activation fronts that are moving away, followed by R waves originated in contiguous bands of non–damaged myocardium. We present two characteristic examples of the electrocardiographic manifestations of a transmural left ventricle infarct (QS complexes) and of a subendocardial infarct, reaching beyond the borders of the electrical endocardium (QR complexes). In both of these cases, the electrocardiographic data agree with the anatomical findings.
Key words: Subendocardial infarction. Intramural infarction. Subepicardial infarction. Transmural infarction.
Se ha hablado mucho, y todavía se habla, de los llamados infartos con onda Q y sin onda Q, terminología propuesta hace tiempo por D.H. Spodick.1 Con base en tal distinción se clasifican los infartos del miocardio como subendocárdicos, sin onda Q, y transmurales, con onda Q. Y ni siquiera se describen las características morfológicas y cronológicas de dichas ondas Q, las que permitirían diferenciarlas de ondas Q normales.
Esta clasificación que se ha popularizado sobremanera, ameritaría ser revisada a la luz de datos electrofisiológicos2 y anatómicos.
Infarto transmural
Se sabe que un verdadero infarto transmural, i. e. una zona de miocardio inactivable transmural que se comporta como una "ventana eléctrica" según la expresión de Wilson, permite al electrodo externo correspondiente registrar las morfologías intracavitarias. Esto ha sido comprobado a su tiempo por estudios experimentales realizados en nuestro laboratorio.2 De todos modos cabe tener presente que un infarto transmural de la pared libre ventricular izquierda, que debería manifestarse por complejos QS en las derivaciones cercanas, cuando se asocia a trastornos de la conducción ventricular homolateral de tipo periférico, puede dar origen a complejos QR o QRs aparentando ser subendocárdico.3 Es posible también que los electrodos de las derivaciones del electrocardiograma convencional no exploren la zona afectada. Por eso resulta siempre útil el registro de un circulo torácico completo.4 Tal vez convendría utilizar derivaciones unipolares a nivel del cuarto y sexto espacio intercostal izquierdo, por encima o abajo de la posición de los electrodos de V3a V5. Éstos podrían registrar complejos ventriculares qR con las pequeñas ondas Q sugestivas de la existencia de miocardio inactivable.
Por otra parte, las derivaciones que exploran una zona de infarto posterolateral quedan más alejadas de ésta que las que miran hacia una región infartada anterosuperior, situada más cerca de las mismas. Por lo tanto, la zona afectada, que se sitúa en el ámbito del ángulo sólido comprendido por las derivaciones correspondientes, es menor en el primer caso que en el segundo. Este hecho causa inexactitudes más acentuadas en el diagnóstico electrocardiográfico de infartos localizados en regiones posteroinferiores derechas o izquierdas respecto a las que pueden ocurrir cuando la localización del infarto es anterior.
También cabe mencionar que, en la fase aguda del síndrome de infarto miocárdico, la onda Q anormal puede resultar enmascarada por la manifestación de una importante lesión transmural, lo que da origen a ondas monofásicas puras (sin vértice) o impuras (con vértice). Durante la evolución favorable del cuadro de infarto, al reducirse gradualmente los signos de lesión, aparecen los de "necrosis" –i. e. de miocardio inactivable–y de isquemia transmural o subepicárdica. Por su lado, el retardo de los potenciales de las fibras específicas y de las contráctiles aumenta cuando la excitabilidad eléctrica está deprimida (lesión) pero no hay tejido cicatricial.5 Tal hecho significa que no existen relaciones entre los fenómenos eléctricos de las fibras específicas y los de las fibras contráctiles, dado que estas últimas son activadas por vía de las fibras circunvecinas respetadas.
Infarto subendocárdico
Se considera, de manera algo simplista, como infarto subendocárdico aquél que no da origen a ondas Q en el complejo ventricular. No es éste un dato suficiente para el diagnóstico. Se sabe que, en presencia de un infarto miocárdico, puede faltar la inscripción de ondas Q anormales i. e. empastadas y de duración prolongada, por diferentes causas: p. ej. la derivación utilizada no explora el centro de la zona afectada, coexisten bloqueos periféricos localizados en la misma región, hay miocardio inactivable en territorios opuestos.6 En fin, debe tenerse presente que el endocardio eléctrico no es igual al endocardio anatómico. ¿Qué entendemos, pues, por endocardio eléctrico?
Endocardio eléctrico
Al considerar dicho endocardio en la pared libre del ventrículo izquierdo, vemos que en algunas regiones coincide con el endocardio anatómico mientras que, en otras, llega hasta porciones cercanas al epicardio. Sus límites externos se consideran, en general, como una frontera irregular entre los tercios inferior y medio de la pared ventricular. El endocardio eléctrico abarca la zona de distribución de la red de Purkinje, por la que llegan los impulsos de activación a las fibras contráctiles. Si las fibras específicas reciben los impulsos al mismo tiempo, y así los transmiten a las contráctiles, éstas se activan simultáneamente sin dar origen a diferencias de potencial. Por eso no pueden dar una contribución eléctrica propia ni en condiciones normales ni en condiciones patológicas, puesto que los registros electrocardiográficos son la consecuencia de diferencias de potencial. Así pues, una zona inactivable localizada estrictamente dentro de los límites del endocardio eléctrico no puede dar manifestaciones eléctricas directas: ondas Q anormales.
Debe mencionarse que en las porciones básales de la pared libre del ventrículo izquierdo, en donde no hay fibras de Purkinje o éstas son muy escasas, no existe en realidad endocardio eléctrico.7 Pero el espesor de la pared libre ventricular izquierda no parece jugar un papel importante en la distribución de las fibras de Purkinje.
Por las razones expuestas arriba aquellos infartos, que no rebasan los límites externos del endocardio eléctrico, no producen signos electrocardiográficos directos de miocardio inactivable.8 Pero, si son recientes, pueden dar origen a signos de lesión subendocárdica más o menos acentuada. Más aún, en ciertos casos, pueden existir unas pequeñas ondas Q normales, i. e. limpias y de duración no prolongada, correspondientes a la manifestación del primer vector septal izquierdo.
Para que el infarto pueda manifestarse con ondas QR, i. e. ondas Q empastadas y de duración prolongada respecto a la normal, debe sobrepasar los límites externos del endocardio eléctrico. Este último tiene una amplitud variable en los individuos de una misma especie y en los diferentes niveles de las paredes libres ventriculares y del tabique interventricular. En los infartos que aquí se consideran, debido a la persistencia de bandas externas de miocardio activable, se originan los complejos ventriculares QR ya mencionados.
En la superficie endocárdica y en la subendocárdica, donde se registran potenciales de fibras de Purkinje,7 se obtienen morfologías unipolares QS correspondientes a las morfologías intraventriculares izquierdas.8 Por lo tanto, la variabilidad en la distribución de las fibras específicas es responsable verosímilmente de las variaciones individuales de la captación de los complejos QS, como se observó a su tiempo en los experimentos realizados en nuestro laboratorio de electrovectocardiografía.6
De todos modos, es lógico tener presente que la localización de las fibras de Purkinje puede realizarse con cierta facilidad en los animales de experimentación, gracias al registro de sus potenciales de Purkinje, o bien a la tinción del tejido específico, rico en glucógeno, con soluciones yodo–ioduradas: p. ej. la solución de Lugol. Pero no es posible evidenciarlas en corazones de humanos vivos.
Infarto intramural
Nuestro estudio experimental en corazones de perros6 ha mostrado que el daño miocárdico intramural da origen a complejos ventriculares de diferentes morfologías en las derivaciones correspondientes: W, qRS, qrS, qrSr', rSRS'. Si ellos se inician con ondas Q, la duración de éstas no aparece prolongada de manera significativa. Los potenciales de las fibras de Purkinje no resultan afectados, pese al discreto retardo del proceso de activación y al empastamiento de los complejos QRS. Dichos potenciales pueden explicarse por la colisión de dos frentes de activación: uno subendocárdico y otro subepicárdico. Este hecho sería la causa de una ligera aberrancia de los complejos ventriculares, semejante a la producida por el bloqueo periférico izquierdo, y capaz de ocultar la verdadera extensión de la zona de infarto.9–11
Infarto subepicárdico
Si la zona de infarto queda fuera de los límites externos del territorio de distribución de la red de Purkinje (endocardio eléctrico), reduce la cantidad de miocardio parietal activable y el miocardio despolarizado en medida importante constituye un medio conductor. Esto hace que disminuya la magnitud del vector resultante de las fuerzas de activación de la pared libre del ventrículo izquierdo (vector Ili) y que el electrodo explorador vea alejarse múltiples frentes de onda básales. Como consecuencia, disminuye el voltaje de la onda R mientras que aumenta el voltaje, y sobre todo la duración, de la onda S en las derivaciones epicárdicas y precordiales izquierdas (criterio esencialmente comparativo).
Por otro lado, si la zona de miocardio inactivable rebasa las capas subepicárdicas hacia adentro, invadiendo el endocardio eléctrico, permite al electrodo explorador correspondiente registrar el complejo intraventricular izquierdo (normalmente QS), puesto que las regiones subendocárdicas no dan una contribución eléctrica propia.
Ejemplos
Infarto transmural
El electrocardiograma de la Figura 1 pertenece a un nombre de 51 años, fumador (1 cajetilla diaria), y se ha registrado cinco días antes de su defunción por infarto miocárdico. RS 88/m P–R 0.17 seg. QRS 0.10 seg. ÂP + 55°. ÂQRS + 95°. ÂT 0º. Q–Tc = VM + 0.06 seg en DII. P2 = 0.10 seg. QS en DI qRs en DII, Rs en DIII y aVF, Qrs en aVL, rsr' (TIDI = 0.06 seg) en aVR, rS en V1 y V2, rS con caída del voltaje de la onda r en V3 (S = 54 mm en V2 y 52 mm en V3), QS en V4 y V5, qRs (TIDI = 0.045 seg) en V6. Desnivel positivo de convexidad superior del segmento RS–T en D1 aVL y de V2 a V5. Onda T englobada en el segmento RS–T en D1 aVL y de V2 a V5 aplanada en V6.

TS: Aumento de la magnitud del vector Illd, tal vez por hipertrofia basal del ventrículo derecho. Zona inactivable transmural ápico–antero–lateral, que abarca porciones paraseptales izquierdas anteriores altas (aVL). Signos de lesión subepi–cárdica o transmural, compatibles con la existencia de una amplia zona miomalácica o aneurismática.
El examen anatómico confirmó la hipertrofia basal derecha: espesor de la pared libre de 7 mm contra un esperado de 4 mm. La Figura 2 exhibe un corte longitudinal del corazón, que corresponde al ventrículo derecho. El tabique interventricular muestra una gran cavidad dilatada correspondiente a un aneurisma postinfarto, que abarca el tabique interventricular y la pared anterior y lateral del ventrículo izquierdo.

Infarto subendocárdico
El electrocardiograma de la Figura 3 se obtuvo en un hombre de 64 años, que ya había padecido de un infarto miocárdico en 1988 y presentó otro episodio coronario agudo en febrero del año 2000, falleciendo el mismo día de su ingreso en nuestro Instituto. Tenía una historia de hipertensión arterial sistémica de 4 años de duración, por la que había sido tratado en los últimos dos años con inhibidores de la ECA.

RS 75/m P–R 0.12 seg QRS 0.14 seg ÂP 0º. ÂQRS + 100°. ÂT + 55°. Q–Tc = VM + 0.07 seg en aVF. P2 = 0.08 seg. qR enDI, qRs enDII, qR en DIII, rSr' en aVR (TIDI = 0.120 seg), rS en aVL, qR en aVF (TIDI 0.09 seg), rSR (TIDI = 0.09 seg) en VI rSr' (TIDI = 0.09 seg) en V2 y V3, QS con muesca en el tercio superior de su rama descendente en V4, qR
enDI, qRs enDII, qR en DIII, rSr' en aVR (TIDI = 0.120 seg), rS en aVL, qR en aVF (TIDI 0.09 seg), rSR (TIDI = 0.09 seg) en VI rSr' (TIDI = 0.09 seg) en V2 y V3, QS con muesca en el tercio superior de su rama descendente en V4, qR (TIDI = 0.05 seg) en V5, qRs (TIDI = 0.05 seg) en V6. Onda T positiva en DI DII, aVL y de V4 a V6, negativa de ramas asimétricas en V1 y V2, difásica ± en V3. Extrasístole ventricular en V3.
(TIDI = 0.05 seg) en V5, qRs (TIDI = 0.05 seg) en V6. Onda T positiva en DI DII, aVL y de V4 a V6, negativa de ramas asimétricas en V1 y V2, difásica ± en V3. Extrasístole ventricular en V3.
TS: Crecimiento del ventrículo izquierdo. Zona inactivable subendocárdica, que rebasa los límites externos del endocardio eléctrico, en la mitad inferior del tabique interventricular. En el tercio inferior de dicho tabique (punta del ventrículo izquierdo), la zona inactivable parece ser transmural. Pero la muesca rápida en el tercio superior de la rama descendente del complejo ventricular en V4 podría corresponder a la despolarización de haces de músculo subepicárdico. Estos hechos ya se observaron en infartos subendocárdicos o intramurales experimentales.6 Coexiste un BRDHH de grado intermedio.
La Figura 4 exhibe dos rebanadas transversales del corazón del mismo individuo a quien pertenece el ECG de la Figura 3. Muestra los ventrículos en su mitad inferior. Puede verse una zona necrótica subendocárdica anteroseptal, que tiende a hacerse transmural en su punta distal. Corresponde a una zona blanca de fibrosis y, por tanto, a un infarto miocárdico antiguo.

Por su parte, el electrocardiograma de la Figura 5 corresponde a un hombre de 43 años con un infarto septal antiguo. Las derivaciones unipolares aVL y V1 a V6, registradas en los puntos habituales, sugieren la existencia de una zona inactivable, que abarca el tercio inferior del tabique interventricular y regiones paraseptales anteriores izquierdas. Las derivaciones unipolares altas (VA) 2, 3 y 4 sugieren una mayor extensión de la zona inactivable septal, mientras que las unipolares bajas (VB) 2 y 3 no proporcionan más información de la obtenida con las derivaciones en los puntos sólitos.

Comentario
La Figura 6 muestra un corte frontal del tabique interventricular, de las superficies septales derecha e izquierda y de ambos ventrículos en un corazón canino. Las áreas en donde se han registrado en mayor número los potenciales de las fibras específicas de Purkinje son: el tercio medio de la superficie septal izquierda, las porciones anteriores del tercio medio de la superficie septal derecha y las áreas medias de ambas masas septales. Las regiones en donde los potenciales mencionados eran muy escasos o ausentes se sitúan en: la punta del ventrículo izquierdo, la zona trabecular del ventrículo derecho y las porciones medias subendocárdicas de la pared libre del ventrículo izquierdo. En las regiones básales de ambos ventrículos se han registrado muy pocos potenciales, lo que sugiere escasez o ausencia de fibras de Purkinje en tales territorios. A su vez, la morfología de los complejos intraventriculares izquierdos es de tipo QS porque todos los principales vectores resultantes de la activación ventricular se alejan de la cavidad cardíaca considerada. La morfología de los complejos ventriculares es de tipo rS en la punta del ventrículo derecho adonde se acerca el primer vector de la activación ventricular (Ii), originado en la masa septal izquierda media. Debe tenerse presente que el diagnóstico electrocardiográfico de la extensión de la zona de miocardio inactivable se basa esencialmente en los puntos siguientes.
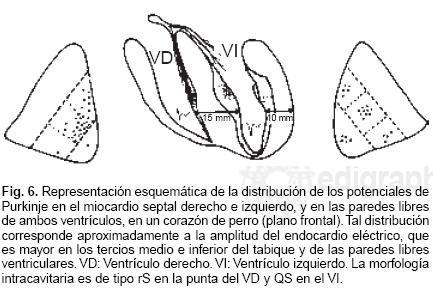
"Necrosis" parietal
a. Subendocárdica
Si queda circunscrita en el territorio de distribución de la red de Purkinje, i. e. en el endocardio eléctrico12 –una entidad esencialmente funcional y de amplitud variable– no va a tener una manifestación electrocardiográfica directa. Pero, si se encuentra en la fase aguda, puede inferirse por la presencia de signos de lesión subendocárdica más o menos acentuada en las derivaciones correspondientes.
Si rebasa los límites externos del endocardio eléctrico, el tejido inactivable se comporta como un medio conductor, permitiendo al electrodo explorador registrar fuerzas electromotrices que se alejan. Por consiguiente, se inscriben ondas Q anormales en las derivaciones epicárdicas y precordiales que exploran la zona afectada.
b. Subepicárdica
Dado que el electrodo explorador registra los efectos de frentes de onda que se le alejan en vez de acercársele, se observa una disminución de voltaje de las ondas R, y un aumento de duración de las S, en las derivaciones correspondientes. Estos hechos deben evaluarse en comparación con los hallazgos obtenidos en trazos previos.
c. Transmural
La "necrosis" que abarca todo el espesor de una determinada región de la pared libre del ventrículo izquierdo crea una "ventana eléctrica", a saber, una amplia zona de tejido inactivable que se comporta como medio conductor. El electrodo registra entonces la morfología del complejo intraventricular, que es negativa en el ventrículo izquierdo (complejos QS) en presencia de activación ventricular normal.
"Necrosis" septal
Puede localizarse en la masa septal izquierda media y suprimir la manifestación del primer vector septal izquierdo tanto en las derivaciones que deberían verlo acercarse (V1 y V2) como en las que deberían verlo alejarse (V5, V6, aVF y/o aVL, D1). Si el síndrome de infarto no es reciente, se impone el diagnóstico diferencial con un bloqueo troncular izquierdo de grado menor. Sin embargo, este bloqueo hace desaparecer no sólo la manifestación del primer vector septal izquierdo (Ii), sino también la del vector basal derecho (IIId). Esto no ocurre en presencia de una zona inactivable septal media no complicada.
Cuando la zona inactivable se sitúa en la masa septal derecha anteroinferior, cancela completa o parcialmente la manifestación del vector resultante de las fuerzas electromotrices originadas en dicha estructura: IIs. Por eso, se registran complejos ventriculares de tipo QS o QR en las derivaciones transicionales: V3 y/o V4.
Si la "necrosis" se localiza exclusivamente en la masa septal izquierda anteroinferior, no puede manifestarse en el electrocardiograma porque las fuerzas electromotrices, originadas en dichas porciones del tabique interventricular, quedan enmascaradas por las fuerzas más importantes y casi simultáneas de la pared libre del ventrículo izquierdo.
Conviene añadir que tanto el estudio electrogenético como el semiológico del complejo ventricular en la derivación aVL, demuestran que la presencia de signos de "necrosis" en esta derivación no corresponde necesariamente a una localization lateral alta del área de infarto. Parece justificado afirmar que los signos mencionados pueden deberse tanto a un infarto lateral alto como a una "necrosis" anterior del ventrículo izquierdo, localizada en la pared libre o en el tabique o en ambas estructuras.13 Para obtener un diagnóstico topográfico más preciso, deben registrarse derivaciones de V1o V2 hasta V4 –V6, según los datos clínicos o la sospecha electrocardiográfica, en el tercer o en el quinto espacio intercostal izquierdo. En caso de infartos septales, que se manifiestan sólo por la presencia de ondas Q en una porción pequeña de la superficie torácica (V1 y V2), el dato es muy valioso. En otros términos, las necrosis, las lesiones y los bloqueos locales se extienden tanto en sentido horizontal como en sentido vertical. Dichas derivaciones suplementarias podrían constituir así una valiosa ayuda para determinar con exactitud la presencia o ausencia de ondas Q de "necrosis". El procedimiento descrito es útil también para el diagnóstico de los infartos que se manifiestan sólo por la presencia de ondas T negativas en V2 y/o V3 y V4. Se desprende así la gran utilidad de un mapeo eléctrico torácico dirigido.
No debe olvidarse que los infartos septales, desde el punto de vista electrocardiográfico, se reconocen mejor cuando coexiste un bloqueo de rama con fenómeno de "salto de onda",14,15 que causa una neta predominancia de las fuerzas electromotrices del tabique interventricular sobre las parietales de los ventrículos. En estos casos, puede ser difícil la valoración cuantitativa de la zona afectada, porque el bloqueo reduce la manifestación del tejido inactivable y el cambio secundario de la repolarización ventricular, debido al bloqueo, se superpone al cambio primario provocado por la isquemia–lesión subepicárdica o transmural.16
Más aún, no debe olvidarse que la dificultad del diagnóstico de una zona inactivable circunscrita en el tercio medio del tabique interventricular ya había sido señalada por Sodi Pallares y cols,17 en 1959.
Conclusiones
Infartos pequeños pueden cursar sin alteraciones de los complejos QRS en las derivaciones correspondientes. El signo electrocardiográfico característico de amplios infartos transmurales de la pared libre del ventrículo izquierdo consiste en el registro de complejos intraventriculares QS en las derivaciones que exploran la región afectada. Los complejos  R pueden deberse también a una "necrosis" transmural a la que se ha asociado un bloqueo periférico izquierdo.3
R pueden deberse también a una "necrosis" transmural a la que se ha asociado un bloqueo periférico izquierdo.3
En realidad, los datos electrofisiopatológicos permiten establecer el diagnóstico de "necrosis" subendocárdica cuando la zona de infarto, no reciente, abarca un espesor considerable de la pared libre del ventrículo izquierdo. Pero, en casos de "necrosis" subendocárdica o transmural pequeña, pueden faltar signos directos de miocardio inactivable en el electrocardiograma convencional. Además, si la extensión de una zona inactivable es longitudinal más que transversal, probablemente no se manifiesta en las derivaciones correspondientes. De ahí la utilidad de un mapeo eléctrico torácico dirigido.
Infartos con y sin ondas Q anormales pueden localizarse en regiones subendocárdicas, puesto que su manifestación electrocardiográfica depende de la relación que se establece entre la extensión de la zona afectada y la amplitud del endocardio eléctrico en dicha región. A su vez, la coexistencia de un bloqueo periférico izquierdo puede reducir la manifestación de la zona afectada, que aparenta ser subendocárdica mientras que de hecho es transmural. Creemos por tanto que, desde el punto de vista electrofisiopatológico, no se puede considerar a la ausencia o presencia de ondas Q como un signo definitivo de la extensión y de las posibles repercusiones de una zona de miocardio inactivable.
Agradecimiento
Los autores desean expresar su más vivo agradecimiento al Sr. Rodrigo Velázquez, quien ha preparado las figuras de las piezas anatómicas.
Referencias
1. Spodick DH: Q–wave infarction versus S–T infarction. Non specificity of electrocardiographic criteria for differentiating transmural and nontransmural lesions. (Abstract). Am J Cardiol 1983; 51(5): 913–915. [ Links ]
2. Medrano GA, de Micheli A, Sodi–Pallares D: Estudio experimental electrocardiográfico y vectocardiográfico del infarto septal y del infarto parietal del ventrículo izquierdo. Arch Inst Cardiol Mex 1966; 36(5): 513–535. [ Links ]
3. De Micheli A , Medrano GA: "Necrosis" septales y parietales con bloqueos periféricos monofasciculares. Arch Cardiol Mex 2004; 74(4): 306–314. [ Links ]
4. De Micheli A , Medrano GA, Iturralde P: El círculo torácico en la exploración eléctrica del corazón. Arch Inst Cardiol Mex 2000; 70(2): 187–196. [ Links ]
5. Bullock GR: Structural changes at cardiac cell junctions during ischemia. J Mol Cell Cardiol 1986; 18(Suppl4): 1–5. [ Links ]
6. Medrano GA, de Micheli A: Electrocardiographic features in experimental subendocardial infarctions in canine hearts. J Electrocardiol 1994; 27(3): 263–273. [ Links ]
7. Medrano GA, Sodi–Pallares D, de Micheli A, Bisteni A, Polansky B, Hertault J: A study of the potentials of the Purkinje tissue. Am Heart J 1960; 60: 562–580. [ Links ]
8. Sodi–Pallares D, Medrano GA, de Micheli A, Testelli MR, Bisteni A: Unipolar QS morphology and Purkinje potential of the free left ventricular wall. Circulation 1961; 23(6): 836–846. [ Links ]
9. De Micheli A, Medrano GA: El diagnóstico de zona inactivable miocárdica con bloqueo intraventricular izquierdo. Arch Inst Cardiol Mex 1988; 58(5): 461–473. [ Links ]
10. De Micheli A, Medrano GA: El diagnóstico de zona inactivable miocárdica con bloqueos intraventriculares derechos y bilaterales. Arch Inst Cardiol Mex 1988; 58(6): 575–586. [ Links ]
11. De Micheli A, Medrano GA, Iturralde P: Diagnóstico electrovectocardiográfico en clínica. México. Méndez Eds, 1992: 103–118. [ Links ]
12. Kennamer R, Bernstein JL, Maxwell MH, Prinzmetal M, Shaw CM: Studies on the mechanism of ventricular activity. V. Intramural depolarization potentials in the normal heart with a consideration of currents of injury in coronary artery disease. Am Heart J 1953; 46(3): 379–400. [ Links ]
13. De Mcheli A, Medrano GA: Electrocardiograma y vectocardiograma en el infarto del miocardio. México. La Prensa Médica Mexicana, 1971: 156. [ Links ]
14. Sodi–Pallares D: New bases of electrocardiography. St Louis Mo. The C V Mosby Co., 1956: 404. [ Links ]
15. Medrano GA, de Micheli A, Aranda A, Iturralde P, Chávez Domínguez R: An experimental contribution to the concept of "Jumping wave" phenomenon in the interventricular septum. Arch Cardiol Mex 2002; 72(4): 282–289. [ Links ]
16. De Micheli A, Medrano GA: Aspectos electrocardiográficos de los bloqueos ventriculares. En: El comportamiento del miocardio en la isquemia y en la reperfusión. (Coord. S. M. Férez, E. Lupi Herrera). Madrid. Elsevier España S. A., 2004: 681, 683. [ Links ]
17. Sodi–Pallares D, Anselmi G, Contreras R, Medrano GA: Proceso de activación y correlación anatómica en cortes seriados, como base de una nueva clasificación de los infartos. En: Aterosclerosis y Enfermedad coronaria. (Coord. I. Chávez). México. Ed. Interamericana S. A., 1960: 189–209. [ Links ]














