Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 supl.3 Ciudad de México jul./sep. 2005
Investigación básica
Modificación de un dispositivo hidráulico para el bandaje controlado del tronco de la arteria pulmonar en caninos
Modification of a hydraulic device for controlled banding of the trunk of the pulmonary artery in dogs
Luis Efrén Santos Martínez,* José Gotés,* Pedro Flores,** Carlos Tena,*** Verónica Graullera,*** Tomás Pulido,* Edgar Bautista,* Óscar Infante,** María Luisa Martínez Guerra,* Alicia Castañón,* Samuel Ramírez,**** Mauricio Soule,**** Julio Sandoval Zarate*
* De los Departamentos de Cardioneumología.
** Instrumentación Electromecánica.
*** Bioterio.
**** Cirugía Cardíaca.
Del Instituto Nacional de Cardiología Ignacio Chávez
Correspondencia: M. en C. Luis Efrén Santos Martínez.
Instituto Nacional de Cardiología Ignacio Chávez.
Departamento de Cardioneumología.
(INCICH Juan Badiano No. 1, Col. Sección XVI, Tlalpan 14080.
México D.F.). Teléfono 55 73 29 11 extensión 1355.
E–mail: sanlui@cardiologia.org.mx
Resumen
Diversas enfermedades congénitas o adquiridas incrementan la presión sistólica del ventrículo derecho. Este incremento se ha realizado con el bandaje del tronco arterial pulmonar con cintas de lino o dispositivos hidráulicos. Presentamos un nuevo dispositivo hidráulico para ser usado en sujetos experimentales menores a 15 kilogramos.
Material y métodos: Se realizó una fase experimental de laboratorio donde los dispositivos hidráulicos fueron probados contra presiones hasta de 80 mm Hg; posteriormente se colocaron en el tronco de la arteria pulmonar de perros donde se les determinó la presión sistólica del ventrículo derecho, la de la arteria pulmonar y el gradiente de ambos. Los valores se expresaron en medias ± desviación estándar.
Resultados: El peso de los perros fue 12.6 ± 2.2 kilogramos. El diámetro del tronco de la arteria pulmonar encontrado en los perros fue de 12.4 ± 1.4 mm y 27.5 ± 1.6 mm de largo. Las presiones sistólicas ventriculares derechas en condición basal y de máxima elevación fueron: 25.5 ± 1.9 mm Hg vs 50.3 ± 6.9 mm Hg, p < 0.0001; las presiones sistólicas de la arteria pulmonar para estas mismas condiciones fueron: 24.7 ± 2 mm Hg vs 21.5 ± 6.9 mm Hg, p < 0.043; y el respectivo gradiente de ambas para estas presiones fueron: 0.8 ± 1.4 mm Hg vs 28.8 ± 4.2 mm Hg, p < 0.0001.
Conclusiones: El DH permite el incremento agudo controlado de la presión sistólica del ventrículo derecho.
Palabras clave: Función ventricular derecha. Hipertensión arterial pulmonar. Cirugía cardíaca. Enfermedad cardíaca congénita.
Summary
Different congenital or acquired diseases increase the right ventricular systolic pressure. The elevation is achieved by pulmonary artery banding with linen tape or hydraulic devices. We introduce a new hydraulic device to be used in experimental subjects of less than 15 kilograms.
Methods: An experimental laboratory phase was conducted. In this phase, the hydraulic devices were tested against pressures as high as 80 mm Hg; later on the hydraulic devices were placed on the dogs' main pulmonary artery; the right ventricular systolic pressure, pulmonary artery pressure, and their differences were obtained. The values are expressed in average ± standard deviation.
Results: The average weight of the dogs was 12.6 ± 2.2 kg. The average diameter found in the main pulmonary artery was 12.4 ± 1.4 mm and 27.5 ± 1.6 mm length. Right ventricular systolic pressure of basal condition to maximum pressure obtained was 25.5 ± 1.9 mm Hg vs 50.3 ± 6.9 mm Hg, p < 0.0001; pulmonary artery pressures under the same conditions were 24.7 ± 2 mm Hg vs 21.5 ± 6.9 mm Hg, p < 0.043; and the differences between them were 0.8 ± 1.4 mm Hg vs 28.8 ± 4.2 mm Hg, p < 0.0001, developed by the hydraulic device respectively.
Conclusions: The hydraulic device allows attaining a controlled acute increase in right ventricular systolic pressure.
Key words: Right ventricular function. Pulmonary hypertension. Cardiac surgery. Congenital heart disease.
El ventrículo derecho (VD) es una cámara de paredes delgadas, de forma piramidal y adaptada para el manejo de bajas presiones; su funcion y estructura se ve afectada por diversas enfermedades cardiopulmonares de origen congénito, adquirido1 o idiopático,2 y por condiciones agudas3 o crónicas.4 La tromboembolia pulmonar (TEP) aguda3 y crónica,4 y la hipertensión arterial pulmonar primaria25 (HAPP) son entidades que cursan con hipertensión arterial pulmonar (HAP) y sobrecarga de presión al VD. El comportamiento hemodinámico, las intervenciones terapéuticas y la historia natural de estas enfermedades son difíciles de estudiar debido a lo infrecuente de la enfermedad, porque los procedimientos no son éticos en los enfermos o por la dificultad en estudiar pacientes en estadios tempranos de la enfermedad. Por estas razones ha sido necesario el desarrollo de modelos animales experimentales. Los mecanismos utilizados en estos modelos para desarrollar HAP y sobrecarga de presión al VD han sido: los coágulos sanguíneos,6 gelfoam,7,8 microesferas de vidrio,9 destrucción del parénquima pulmonar,10 vasoconstricción hipóxica,11 la inflamación y el hiperflujo.12 La sobrecarga de presión al VD desarrollada con estos modelos, no son controlables del todo, dado que el grado de incremento inicial o un nuevo incremento de la post–carga al VD, pueden llevar al animal a la falla ventricular aguda y a la muerte.13,14 La sobrecarga de presión al VD (sin desarrollo de HAP), como la vista en la estenosis pulmonar o infundibular, se ha obtenido también a nivel experimental con el bandaje del tronco de la arteria pulmonar (BTAP). La cinta de lino (cinta umbilical) ha sido el medio experimental más utilizado para producir el BTAP.15 La principal limitación que tiene el BTAP con cintas de lino es que sólo permite el incremento de la presión sistólica del VD en una ocasión, y no siempre es lo deseado. El BTAP se ha realizado en diversas especies animales con pesos corporales desde 4.5 kg a 28 kg.16–25 Recientemente se ha informado del uso de sistemas telemétricos para controlar el BTAP16 y la colocación del BTAP por toracoscopía.25 En nuestro medio hemos validado el BTAP con un DH en condición de incremento agudo y crónico de la presión sistólica del VD.19 Sin embargo, se requiere su generalización y por ende la modificación de este DH para especies menores de 15 kg. En este trabajo presentamos un DH para el bandaje del tronco de la arteria pulmonar en caninos de menos de 15 kg de peso corporal. Además, este DH tiene la ventaja de ser utilizado para una mejor preparación ventricular, previo a corrección quirúrgica de transposición de grandes vasos o en aquellas cardiopatías congénitas que cursan con hiperflujo pulmonar.1,26
Material y métodos
Presentamos el desarrollo y la modificación de un DH19 previamente elaborado en el Departamento de Instrumentación Electromecánica y en el Laboratorio de Estudios Experimentales del Departamento de Cardioneumología del Instituto Nacional de Cardiología "Ignacio Chávez". El proyecto consistió en una fase experimental de laboratorio del DH, y su posterior prueba en un modelo canino:
a) La modificación de un diseño previo19 y la construcción del DH.
b) El desarrollo de presión de la cámara–reservorio del DH ante el incremento de un volumen conocido de agua.
c) La construcción de un tubo flexible de silicon de grado médico tipo A, Dow Corning, para simular un tronco vascular artificial y su respectiva prueba con la adición de un volumen conocido de agua. Se probaron los DH a diferentes niveles de resistencias ofrecidas por el tronco (20 mm Hg, 40 mm Hg, 60 mm Hg y 80 mm Hg).
d) El comportamiento de las presiones de las cámaras–reservorios de los dispositivos hidráulicos, mediante la construcción de curvas de presión/volumen en condiciones de reposo (20 mm Hg) y a diferentes niveles de resistencias estáticas ofrecidas por el tronco vascular artificial (40 mm Hg, 60 mm Hg y 80 mm Hg).
e) Una vez colocados los DH en el tronco de la arteria pulmonar, el comportamiento de la presión sistólica del ventrículo derecho (PSVD) ante la adición aguda a un volumen conocido en la cámara–reservorio de los DH.
Diseño y construcción del DH: En una publicación previa, diseñamos y validamos19 un dispositivo oclusor hidráulico para el bandaje controlado del tronco de la arteria pulmonar en un modelo canino. El diseño previo del DH se basó en el sistema de las cámaras neumáticas de los autos, pero de manera inversa, un centro distensible y la porción periférica rígida. De esta manera al ser infladas con aire, aumentan su volumen de la periferia hacia el centro, con lo que el diámetro interno se va reduciendo conforme el aire ingresa a la cámara. El efecto está dado por el soporte fijo periférico que le impone la base rígida de metal. Un diseño más parecido sería el que utilizan los manguitos de los esfingomanómetros para la obtención de la presión arterial, sólo que en vez de emplear aire, se usa agua. Para la construcción de este nuevo DH se utilizó el mismo tipo de material biocompatible que en el DH previo.
El DH consta de una banda semi–flexible externa de teflón (número 3 en la Fig. 1), la cual evita que la presión sea ejercida hacia la periferia, sobre esta banda lleva adosada una cámara–reservorio distensible que alojará agua en su interior (número 4 en la Fig. 1), y una cápsula–válvula removible (número 2 en la Fig. 1) que conecta a la cámara–reservorio mediante un tubo flexible de silastic (número 1 en la Fig. 1), por donde se inyecta agua a la cámara–reservorio. Las partes que integran al dispositivo hidráulico se describen enseguida y se ilustran en la Figura. 1:

1. Banda de teflón de 4 mm x 95 mm x 1 mm, con perforaciones en la línea media para el paso del hilo de seda que fija la cámara–reservorio de silicon.
2. Cámara–reservorio de silicon de grado médico tipo A Dow Corning, con un diámetro de 3/8" y 20 mm de largo. Está conectada con la cápsula–válvula a través de un tubo de silastic.
3. Tubo de silastic de 2 mm de diámetro x 15 mm de longitud que se conecta con la cápsula–válvula.
4. Cápsula–válvula de acero inoxidable con un conector para el tubo de silastic.
La cápsula–válvula está obstruida por silicon de grado médico en sus dos tercios superiores de la cavidad, lo que mantiene el agua dentro de la cámara–reservorio una vez que ésta se inyecta al dispositivo en el 1/3 libre (inferior) de la cápsula–válvula. El ingreso de agua aumenta la presión interna de la cámara–reservorio y se dilata, por ende, disminuye la luz interna del anillo que se forma al unir los extremos de la banda de teflon (Fig. 1).
La cápsula que actúa como válvula, es de forma cilindrica, se elaboró por separado y consta de la Figura 2:
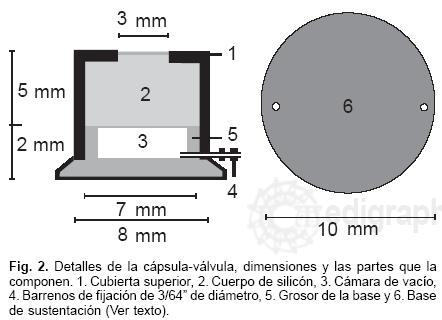
1. Cabezal de la cápsula–válvula (cubierta superior, número 1 de la Fig. 2) con diámetro superior de 7 mm, y un diafragma superior de silicon de 3 mm de diámetro, que permite la inyección de agua en diversas ocasiones y evita la fuga de ésta.
2. Dos tercios superiores de la cámara interna del cabezal están obstruidos con silicon, lo que constituye el cuerpo de silicon de la cámara (número 2 de la Fig. 2).
3. Tercio inferior de la cámara interna de vacío del cabezal (sin silicon, número 3 de la Fig. 2).
4. Barrenos de fijación de 3/64" de diámetro, (conector de acero inoxidable, número 4 de la Fig. 2), el cual lleva en su extremo externo el tubo de silastic que está conectado a la cámara–reservorio del DH.
5. Grosor de la base del DH de 1 mm, con un borde circular superior por donde se aloja el cabezal de la cápsula (número 5 de la Fig. 2).
6. Base de sustentación de forma circular de 10 mm de diámetro, con 2 perforaciones laterales para fijarla a estructuras adyacentes (número 6 de la Fig. 2).
Cada una de las partes del dispositivo se elaboró por separado y al final fueron ensambladas.
Comportamiento de la cámara–reservorio del DH: Los extremos de las bandas de teflón del DH fueron unidos con seda 3–0, de modo que el diámetro del DH fue de 2 centímetros (cm) en todos los dispositivos. Cada una de las cámaras–reservorios del DH fueron probadas de esta manera y, mediante la inyección de un volumen conocido de agua, se obtuvo la presión de la cámara–reservorio, primero sin volumen de agua, y posterior a la inyección de agua a la cámara–reservorio de 0.1 mL (mililitro) por vez, hasta llegar a 1.0 mL.
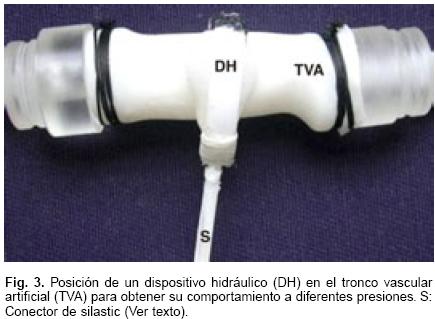
Curvas de presión–volumen: Diseñamos y construimos un tubo de silicon de grado médico tipo A Dow Corning de 56 mm de longitud y 13 mm de diámetro a semejanza de un tronco vascular artificial (TVA), del cual obtuvimos su comportamiento al agregarle agua a un volumen conocido y capturamos la presión que se desarrolló cada vez que adicionamos agua en su interior, desde un volumen de 0 mL hasta 10 mL.
Una vez construido y probado su respuesta a volumen de este tronco vascular artificial, ajustamos con la adición de agua, su presión intra–cavitaria a 20 mm Hg y se colocó un DH en el tronco (Fig. 3). Acto seguido, se obtuvo la presión interna de la cámara–reservorio del DH sin agua y después de añadir 0.1 mL de agua a la misma hasta completar 1.0 mL. Posteriormente se volvió a ajustar la presión del tronco a 40 mm Hg y se registró la presión interna de la cámara–reservorio del DH, de volumen cero, en cada incremento de 0.1 mL de agua, hasta 1.0 mL. Esta misma maniobra fue repetida con el incremento de presión en el tronco a 60 mm Hg y finalmente después de llevar la presión del tronco a 80 mm Hg, en donde se determinaron los valores de presión interna de la cámara–reservorio del DH a los mismos volúmenes previos de agua. Después de obtener los valores de la presión en cada aumento de agua en las cámaras–reservorios, y habiendo llegado a 1.0 mL, éstas fueron vaciadas totalmente. De este modo, estando el tronco con 20 mm Hg, 40 mm Hg, 60 mm Hg y 80 mm Hg, el volumen interno de la cámara–reservorio del DH al inicio de cada obtención de datos, fue de cero mL.
Colocación del dispositivo hidráulico en modelo canino: Seleccionamos 10 perros mestizos menores a 15 kg de peso, los cuales, para la colocación del DH en el tronco de la arteria pulmonar, fueron anestesiados con pentobarbital sódico a razón de 25 mg/kg,27 e intubados con un tubo flexible endotraqueal 8F y se colocaron en ventilación mecánica (CF Palmer (London) LTD, Effra Road, London, S.W.2), a un volumen corriente de 15 mL/kg10,19 y fracción inspirada de oxígeno al 50%. Mediante técnica estéril se procedió a realizar toracotomía lateral izquierda entre los espacios intercostales cuarto y quinto. Se realizó disección cuidadosa de los planos musculares hasta localizar el pericardio, y a través de una pequeña incisión en éste, se localizó la base del tronco de la arteria pulmonar. Ésta se separó de la porción ascendente de la aorta en su porción media y se colocó un DH (Fig. 4), que se ajustó al tronco de la arteria pulmonar sin causar compresión. Una vez colocado el DH, se cerró cuidadosamente el pericardio con sutura absorbible, y el tubo de silastic se exteriorizó por planos hacia la porción dorsal del cuello de los perros, donde se fijó la cápsula–válvula al tejido celular subcutáneo. Finalmente se cerró por planos la cavidad torácica del perro.

Intervención hemodinámica en el grupo de perros: Determinamos la PSVD y la presión sistólica de la arteria pulmonar (PSAP) 10 días previos a la colocación del DH. Se realizó procedimiento quirúrgico de colocación del DH y 15 días después, una vez recuperados los animales del procedimiento quirúrgico, obtuvimos los valores hemodinámicos en las mismas condiciones anestésicas y bajo ventilación mecánica, como fue referido previamente. Los valores hemodinámicos fueron obtenidos mediante la colocación de un catéter Millar de alta fidelidad en la cavidad del VD, (modelo TCB–500, Millar Instruments Inc. 6001 Gulf Freeway, Houston, Texas 77023, U.S.A.), y un catéter de Swan–Ganz (KMA–9601–5F; KMA, Inc, Oklahoma City) en el tronco de la arteria pulmonar por delante del DH.
Utilizando el DH de cada perro, a través de la cápsula–válvula de éstos, se inyectó agua a la cámara–reservorio del DH, 0.1 mL cada vez hasta completar 1.0 mL de agua. En cada adición de agua, se obtuvo al mismo tiempo la PSVD y la PSAP desde la condición de reposo (sin agua en el DH) y en cada 0.1 mL de agua adicionada. Una vez obtenidos ambos valores, se calculó el gradiente que se forma entre la PSVD y la PSAP (PSVD – PSAP).
Para probar la facilidad y el control en el manejo de los DH en condiciones agudas, al final de la obtención de los datos hemodinámicos, al DH colocado en el tronco de la arteria pulmonar de cada perro estudiado, se le adicionó agua en la cámara–reservorio e inmediatamente ésta se retiró.
Sistema de captura de presiones hemodinámicas: Las presiones desarrolladas en la fase experimental de laboratorio del DH y las registradas en el modelo canino, fueron obtenidas con un sistema hemodinámico de registro experimental diseñado en nuestra Institución y validado recientemente.19 Descrito de manera breve, al sistema lo integran una computadora personal (PC), una tarjeta para convertir las señales analógicas a digitales (C A/D), filtros, sistemas adecuadores y convertidores. La tarjeta convertidora analógica/ digital es una tarjeta de diseño específico que permite la adquisición simultánea de hasta 8 canales analógicos. En el primer canal se adquiere la señal del electrocardiograma (ECG) en la derivación estándar II. El segundo y tercer canal adquieren señales de catéteres de alta fidelidad tipo Millar que pueden ser colocados en la cavidad del ventrículo derecho y en la del ventrículo izquierdo. Las señales se obtienen directamente de la salida del sistema de amplificación de los catéteres Millar y se alimenta al C A/D sin sufrir ninguna modificación. El cuarto y quinto canales nos permiten adquirir señales provenientes de catéteres colocados en la aurícula derecha, en el tronco de la arteria pulmonar y/o en una arteria sistémica. La presión de la arteria pulmonar y de la aurícula derecha pueden ser obtenidas de un catéter de flotación tipo Swan–Ganz colocado en el tronco de la arteria pulmonar. La presión arterial sistémica se monitoriza mediante la colocación de un catéter de silastic colocado en la aorta o en la arteria femoral. Se utilizan transductores convencionales para adquirir la señal de los catéteres de presión y la salida se acopla a un sistema de amplificación y filtrado electrónico. En los 3 canales restantes será posible adquirir en un futuro, las señales provenientes de cristales ultrasónicos, lo que nos permitirá el poder comparar en cada ciclo cardíaco de cada ventrículo su relación presión/dimensión sistólica y diastólica.
La programación en la PC es elaborada utilizando el lenguaje Turbo Pascal y se ejecuta en modo real bajo el sistema operativo MS DOS o compatible. El programa graba la ficha de identificación de cada sujeto experimental (sexo, peso, etc.) y puede capturar hasta 350 muestras/segundo de las diferentes señales a analizar. Las muestras son guardadas en la memoria en el disco duro de la PC o bien en disquetes para su estudio en detalle en fechas posteriores. También, puede reconstruir adecuadamente las frecuencias analógicas de hasta 120 Hz. Además, el diseño del programa facilita el análisis de las señales y permite el poder realizar operaciones como amplificación, atenuación, suma, multiplicación, filtrado, derivación, integración, su observación en diferentes bases de tiempo y poder correlacionarlas entre ellas. El programa puede realizar cálculos estadísticos de las señales adquiridas como podrían ser: el promedio o la desviación estándar de las diferentes variables de interés, tanto del registro completo o bien en segmentos. Estas operaciones nos facilitan la identificación y medición (visual o automática) de los diferentes componentes de los trazos hemodinámicos de interés clínico [relajación isovolumétrica, dP/dT, presiones, frecuencia cardíaca y el intervalo Q–pP [tiempo entre la onda Q del electrocardiograma (ECG) y el pie del pulso sanguíneo], por mencionar algunas aplicaciones clínicas del sistema.
Consideraciones éticas: El cuidado humanitario de los perros se realizó de acuerdo a las normas para el cuidado de los animales de experimentación del Instituto Nacional de Cardiología "Ignacio Chávez" y las Guías del Consejo Nacional de Investigación para el cuidado y sacrificio del animal de experimentación.28
Análisis estadístico: Los valores se expresan en media ± desviación estándar (M ± DS). La prueba T para muestras dependientes fue utilizada para determinar la diferencia entre las presiones sistólicas de la arteria pulmonar pre y post–colocación de los DH, las diferencias entre las PS AP de la condición basal a las PSAP obtenidas al mismo nivel de máxima elevación de la PSVD, y el gradiente PSVD–PSAP correspondientes para la condición basal y el de máxima elevación de la PSVD. Una p < 0.05 fue considerada con significación estadística.
Resultados
Una vez probadas cada una de las partes de los dispositivos, éstas fueron ensambladas. Se construyeron 15 DH y se les realizaron pruebas del comportamiento de la presión de la cámara–reservorio a volumen conocido.
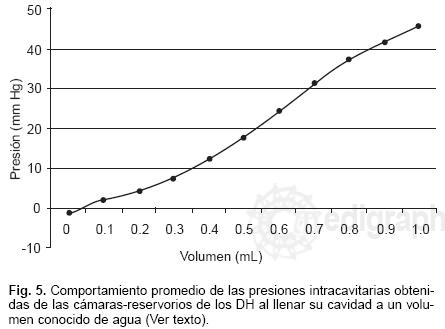
Fase experimental de laboratorio: Las presiones de las cámaras–reservorios de los DH en condición de reposo (sin agua) 0 mL hasta 1.0 mL de agua, fueron respectivamente: 0 mL: –1.1 ± 2.2 mm Hg, 0.1 mL: 2.2 ± 5.4 mm Hg, 0.2 mL: 4.4 ± 5.2 mm Hg, 0.3 mL: 7.4 ± 4.8 mm Hg, 0.4 mL: 12.3 ±6.6 mm Hg, 0.5 mL: 17.7 ±7.1 mm Hg, 0.6 mL: 24.2 ± 6.4 mm Hg, 0.7 mL: 31.5 ± 7.3 mm Hg, 0.8 mL: 37.3 ± 9 mm Hg, 0.9 mL: 41.9, 1.0 mL: 45.9 ± 10.9 mm Hg (Fig. 5).
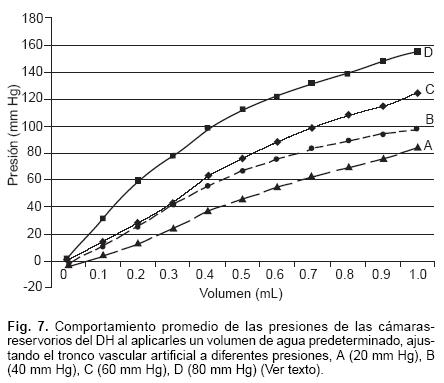
El tronco vascular artificial construido para generar una resistencia estática fue probado mediante la inyección paulatina de agua en su interior, desde un volumen de 0 mL hasta 10 mL, determinamos la presión intra–cavitaria del TVA en cada incremento. Las presiones del tronco vascular artificial fueron: 0 mL: 3 mmHg, 1 mL: 31 mm Hg, 2 mL: 49, 3 mL: 60, 4 mL: 68 mm Hg, 5 mL: 71 mm Hg, 6 mL: 77 mm Hg, 7 mL: 80.5 mm Hg, 8 mL: 82 mm Hg, 9 mL: 87 mm Hg, 10 mL: 90 mm Hg (Fig. 6). Al final de la obtención de datos, retiramos agua hasta dejar en el tubo vascular una presión de 20 mm Hg. Se le colocó al tubo secuencialmente un DH, y a cada uno se les determinó la presión intra–cavitaria que se desarrolló en la cámara–reservorio de los DH posterior a añadir 0.1 mL de agua, desde 0 mL hasta completar 1.0 mL. El comportamiento de las presiones en las cámaras–reservorios de los DH a 20 mm Hg fueron: 0 mL: –2.9 ± 2.7 mmHg, 0.1 mL: 4.1 ± 4.2 mmHg, 0.2 mL: 13 ± 8.1 mm Hg, 0.3 mL: 24.4 ± 12.9 mm Hg, 0.4 mL: 37.8 ±11.4 mmHg, 0.5 mL: 45.7±14.3 mmHg, 0.6 mL: 55 ± 15.8 mmHg, 0.7 mL: 62.7 ± 12.6 mm Hg, 0.8 mL: 69.4 ± 9.4 mm Hg, 0.9 mL: 76.1 ±8.8 mmHg, 1.0 mL: 84.7± 12.9 mm Hg (Fig. 7, curva A). Una vez obtenidos estos valores, vaciamos completamente las cámaras–reservorios de cada uno de los dispositivos e incrementamos la presión del tubo vascular de silicon a 40 mm Hg y nuevamente incrementamos el volumen de las cámaras–reservorios de los DH 0.1 mL por vez, desde 0 mL hasta 1.0 mL y determinamos las presiones en cada aumento: 0 mL: –0.7 ± 1.2 mmHg, 0.1 mL: 9.9 ± 5.7 mmHg, 0.2 mL: 25.7 ± 10.8 mm Hg, 0.3 mL: 41.7 ± 10.8 mm Hg, 0.4 mL: 55.8 ± 13.3 mm Hg, 0.5 mL: 66.5 ± 16.3 mm Hg, 0.6 mL: 75.3 ± 15.3 mm Hg, 0.7 mL: 83.1 ± 15.9 mmHg, 0.8 mL: 89.2 ± 16.5 mmHg, 0.9 mL: 94± 19.4 mmHg, 1.0 mL: 97.9 ± 21.9 mmHg, (Fig. 7, curvaB). Quitamos nuevamente toda el agua de las cámaras–reservorios de los DH y aumentamos la presión del tubo vascular de silicon a 60 mm Hg, se adicionó volumen a las cámaras–reservorios de 0.1 mL cada vez, de volumen 0 hasta completar 1.0 mL, con lo que obtuvimos los siguientes valores: 0 mL: 0.14 ± 1 mm Hg, 0.1 mL: 14.1 ± 6.7 mm Hg, 0.2 mL: 28.3 ± 8.9 mm Hg, 0.3 mL: 42.8 ± 10.7 mm Hg, 0.4 mL: 62.8 ± 13.3 mm Hg, 0.5 mL 76.1 ± 16.5 mm Hg, 0.6 mL: 88.5 ± 12.2 mm Hg, 0.7 mL: 98.9 ± 12.3 mm Hg, 0.8 mL: 108.4 ± 12.6 mm Hg, 0.9 mL 115.2 ± 15.4 mm Hg, 1.0 mL: 124.4 ± 16.6 mmHg, (Fig. 7, curva C). Retiramos toda el agua de las cámaras–reservorios de los DH e incrementamos la presión del tubo vascular de silicon a 80 mm Hg, finalmente agregamos agua a las cámaras–reservorios de los DH de manera similar a las previas y se adquirieron las siguientes presiones: 0 mL: 1.7 ± 0.9 mm Hg, 0.1 mL: 31.2 ± 11.9 mm Hg, 0.2 mL: 59.8 ± 14.6 mm Hg, 0.3 mL: 78.5 ± 14.8 mm Hg, 0.4 mL: 98.5 ± 14.9 mmHg, 0.5 mL: 112.3 ± 17.7 mm Hg, 0.6 mL: 121.7 ± 17.7 mm Hg, 0.7 mL: 131.7 ± 22.9 mm Hg, 0.8 mL: 139 ± 27.1 mmHg, 0.9 mL: 148.3 ± 31.1 mmHg, 1.0 mL: 155 ± 31.6 mmHg, (Fig. 7, curva D).

Fase experimental en caninos: El peso de los perros fue 12.6 ± 2.2 kg de peso corporal. El tamaño del tronco de la arteria pulmonar encontrado en los perros fue 27.5 ±1.6 mm de largo y 12.4 ±1.4 mm de ancho. No hubo complicaciones en el procedimiento de colocación de los DH, ni en el funcionamiento de éste. Las presiones sistólicas ventriculares derechas previas a la colocación del DH fueron: 24.8 ± 2.3 y las obtenidas posterior a la colocación del mismo fueron 25.5 ±1.9 mm Hg, p < 0.38, (previo a agregarle agua a los DH).
El comportamiento de las PSVD ante la adición de 0.1 mL por vez, desde 0 mL hasta 1.0 mL de agua al DH fue así: 0 mL: 25.5 ± 1.9 mm Hg, 0.1 mL: 26 ± 2.2 mm Hg, 0.2 mL: 30 ± 2.8 mm Hg, 0.3 mL: 33.2 ± 4.7 mmHg, 0.4 mL: 36.3 ± 5 mm Hg, 0.5 mL: 40.4 ± 6.4 mmHg, 0.6 mL: 43.3 ± 8 mm Hg, 0.7 mL: 45.5 ± 7 mm Hg, 0.8 mL: 50.3 ± 6.9 mmHg, 0.9 mL: 49.2 ± 5.5, 10 mL: 49.3 ± 8.4 mm Hg, (Fig. 8). Los valores obtenidos de la PSAP simultáneamente a los de la PSVD fueron 0 mL: 24.7 ± 2 mm Hg, 0.1 mL: 25 ± 2.7 mm Hg, 0.2 mL: 26.1 ± 3 mmHg, 0.3 mL: 26.4± 3.6 mm Hg, 0.4 mL: 25.6 ± 3.8 mm Hg, 0.5 mL: 24.7 ± 4.8 mm Hg, 0.6 mL: 23.6 ± 5.5 mm Hg, 0.7 mL: 22.3 ± 6.1 mm Hg, 0.8 mL: 21.5 ± 6.9 mm Hg, 0.9 mL: 19.5 ± 8.3, 1.0 mL: 18.8 ± 9.4 mm Hg. Con estos dos valores se determinó el gradiente (PSVD – PSAP) que se forma entre el VD y la arteria pulmonar en cada adición de agua al DH. El gradiente entre la PSVD y la PSAP fue así: OmL: 0.8 ± 1.4 mm Hg, 0.1 mL: 1 ± 2 mm Hg, 0.2 mL: 3.9 ± 3.3 mmHg, 0.3 mL: 6.8 ± 4.2 mm Hg, 0.4 mL: 10.7 ± 6 mm Hg, 0.5 mL: 15.7 ± 6.6 mm Hg, 0.6 mL 19.7 ± 6.1 mm Hg, 0.7 mL: 23.2 ± 4.9 mm Hg, 0.8 mL: 28.8 ± 4.2 mm Hg, 0.9 mL: 29.7 ±8.1 mmHg, 1.0 mL: 30.5 ± 12.4 mm Hg (Fig. 8).
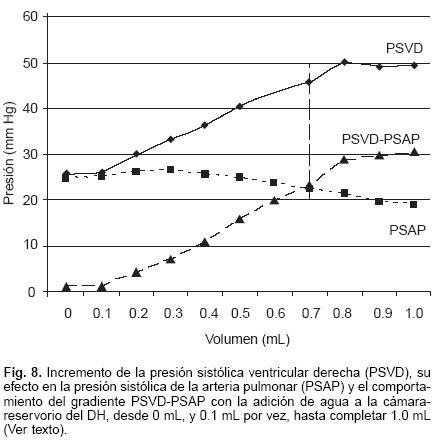
Las presiones básales y las máximas PSVD obtenidas fueron: 25.5 ± 1.9 mm Hg vs 50.3 ± 6.9 mmHg, p < 0.0001; las presiones sistólicas de la arteria pulmonar correspondientes para esta máxima elevación de la PSVD fueron: 24.7 ± 2 mm Hg vs 21.5 ± 6.9 mm Hg, p < 0.043, y el gradiente entre ambas, que correspondió respectivamente para estas presiones fueron: 0.8 ± 1.4 mm Hg vs 28.8 ± 4.2 mm Hg, p < 0.0001. Finalmente, la respuesta controlada de la PSVD a la maniobra de adición y retiro de agua de manera aguda en los DH se muestra en la Figura 9.

Discusión
El dispositivo ideal debe reunir una serie de ventajas, como el ser inerte (biocompatible), de colocación y fijación segura, de tamaño acorde a la especie estudiada y práctica en su función, entre otros requisitos que cubre el DH que estamos presentando.
Fase experimental en el laboratorio: Las pruebas realizadas en esta fase demostraron que el material utilizado en la elaboración de las cámaras–reservorios de los DH, es lo suficientemente distensible como para acomodar un volumen conocido de agua en su interior y conservar su capacidad de generar presión una vez que se le adiciona agua a la cámara–reservorio. En esta misma fase, se diseñó y construyó un tronco vascular artificial de silicon, (mismo material de las cámaras–reservorios) el cual conservó las características observadas en las cámaras–reservorios de los DH. Una vez que se prefijaron las presiones en el tronco vascular artificial en 20 mm Hg, 40 mm Hg, 60 mm Hg y 80 mm Hg de presión interna, los dispositivos hidráulicos (con la adición de agua) fueron capaces de generar la presión necesaria en la cámara–reservorio como para rebasar la resistencia estática impuesta por las presiones previamente establecidas en el TVA. De esta manera demostramos que el DH tiene la capacidad de desarrollar presiones mayores a 80 mm Hg previamente establecidas en el TVA. Además, el control sobre el incremento de la presión intra–cavitaria de las cámaras–reservorios es adecuado, ya que permitió añadirle agua paulatinamente, de modo que fue posible ajustar la presión deseada en el TVA y, con esto, obturar de manera controlada el tronco vascular artificial.
Fase experimental en perros: En condiciones normales el VD tolera incrementos agudos de la PSAP de alrededor de 40 mm Hg,1,3 incrementos mayores lo llevan a la falla ventricular derecha aguda (FVDA), como se ha visto en la TEP aguda.3,13 Una de las principales complicaciones hemodinámicas con el uso del BTAP, es el desarrollo de la falla ventricular derecha aguda. Los parámetros hemodinámicos utilizados en el ajuste del grado de oclusión del tronco arterial pulmonar con el bandaje en condiciones experimentales o clínicas, para evitar la FVDA, han sido la presión pulmonar, la presión aórtica, la presión sistémica, y la relación presión ventricular derecha/presión ventricular izquierda.21–25 En el presente estudio, el efecto del grado de oclusión del tronco de la arteria pulmonar, fue evaluado con la determinación hemodinámica de la PSVD y su repercusión en la presión sistolica de la arteria pulmonar, además del gradiente (PSVD–PSAP) que ambas formaron. De esta manera la maniobra permitió conocer cómo la adición pausada y paulatina de volumen en la cámara–reservorio de los DH, aumentaron la PSVD. El efecto del incremento de la PSVD conduce a la disminución progresiva de la PSAP, creando un gradiente que se incrementa progresivamente. El punto donde el gradiente tiene significación clínica para el desarrollo de la FVDA es a 0.7 mL de volumen de agua en las cámaras–reservorios, como puede observarse en la Figura 8. La máxima PSVD desarrollada correspondió a 0.8 mL de agua en la cámara–reservorio del DH. La disminución de la PSAP y el gradiente PSVD–PSAP observado, puede ser vista en la TEP masiva,3 como efecto del incremento de la PSVD por obstrucción mecánica del lecho vascular pulmonar.
Consideraciones del bandaje del tronco arterial pulmonar: Los modelos realizados utilizando el BTAP con cintas de lino y de teflón,15 y en algunos otros que han desarrollado mecanismos diferentes para el incremento de la PSVD,6–15 tienen el inconveniente de no poder incrementar la PSVD más allá de 40 mm Hg, dado que el estímulo, aunque sostenido, no es suficiente para desarrollar mayor presión, y debido a la imposibilidad de volver a incrementar la PSVD. En los modelos de BTPA con efecto mecánico (cintas de lino y teflón), sólo cuando éste se ha realizado en animales de 24 a 48 horas de nacidos,29–31 se ha tenido éxito para obtener presiones mayores a 40 mm Hg. Sin embargo, el ritmo de incremento de la PSVD no es controlable en el tiempo. El poder manipular la PSVD con el DH en forma externa disminuye el riesgo de mortalidad de los perros por falla ventricular derecha aguda, lo cual confiere la posibilidad de hacer incrementos o decrementos repetidos en el tiempo de manera controlada sobre la PSVD. El aumento controlado de la PSVD podría remedar los incrementos de las presiones del VD vistas en la HAPP grave y otras entidades relacionadas al compromiso vascular pulmonar.1–5 El BTAP se ha utilizado para el desarrollo controlado de hipertrofia ventricular derecha de manera rápida22 como preparación ventricular en la operación de Jatene, así como de manera paulatina y crónica18,19 lo que podría remedar la progresión de entidades crónicas como la HAPP y la TEP crónica. El efecto del incremento y el decremento controlado de la presión intraventricular derecha en forma segura al utilizar el DH se muestra en la Figura 9.
Potencial uso en cirugía de algunas cardiopatías congénitas: El BTAP es un procedimiento realizado habitualmente con cintas de lino o teflon en cirugía de cardiopatías congénitas como un procedimiento paliativo previo a la corrección definitiva de la cardiopatía. Hay un interés creciente por el BTAP en jóvenes con transposición de grandes arterias corregidas congénitamente, donde la preparación ventricular para tolerar la postcarga sistémica a que se enfrentará este ventrículo en el futuro es muy importante, así como parte de una cirugía de doble–switch arterial. Dicho DH puede ser utilizado para esta preparación ventricular, previamente a la corrección quirúrgica de la transposición de grandes vasos o en aquellas cardiopatías congénitas que cursan con hiperflujo pulmonar.1,26 El procedimiento del BTAP resulta útil en cambios agudos de las condiciones de carga ventricular. Debido a cambios en el estado postoperatorio, el estado de conciencia, el patrón respiratorio y porque el ajuste de la banda durante el procedimiento quirúrgico no es guiado por parámetros hemodinámicos o ecocardiográficos, el nivel deseado de presión sistólica ventricular derecha no puede ser obtenido. Bajo estas consideraciones el límite para llevar el ventrículo a la falla aguda es muy estrecho. Este ajuste del bandaje del tronco arterial pulmonar puede ser optimizado con el uso de un DH como el que presentamos en este estudio.
En nuestro medio, hemos desarrollado dos DH, uno para el desarrollo de hipertrofia ventricular derecha,19 el cual probó ser efectivo en su uso por 6 meses que duró el estudio y el segundo que es la modificación del DH previo (diseñado y construido con materiales biocompatibles similares al primer DH), ajustado a troncos de arterias pulmonares de caninos menores de 15 kg de peso corporal.
El uso clínico de los DH en intervenciones quirúrgicas de pacientes con anomalías cardíacas para el BTAP es limitado y con resultados aún controversiales.32,33 Por lo que una vez probada la utilidad en condiciones agudas y crónicas, y establecida la funcionalidad de la modificación de los DH (menor tamaño), este dispositivo hidráulico será utilizado en un estudio controlado de tales entidades cardíacas congénitas.
Limitaciones del estudio: Aunque en este estudio la modificación del dispositivo hidráulico para el incremento y decremento agudo de la PSVD fue efectiva, la aplicación clínica en pacientes va más allá de un modelo experimental. El uso del DH en modelos animales pequeños y grandes ha demostrado su efectividad, lo que justifica su aplicación en la clínica. Su uso podría ser útil en la clínica de pacientes con enfermedades congénitas corregibles mediante cirugía paliativa o definitiva, lo cual reduciría el número de intervenciones quirúrgicas, complicaciones, estancia hospitalaria y probablemente la mortalidad en estos pacientes. Sin embargo, su uso mediante estudios clínicos controlados nos dará la exacta dimensión de su papel en estos pacientes.
Conclusión
El dispositivo hidráulico modificado y aquí presentado permitió el incremento de la presión sistólica del ventrículo derecho en forma aguda mediante la oclusión controlada del tronco de la arteria pulmonar.
Agradecimientos
A Florencio Hernández Lizardi, Alma Delia Ferreira Vidal, Mario Pérez Sánchez, María de Lourdes Torres Peláez y a Elvira Sánchez por su entusiasta colaboración en el proyecto.
Referencias
1. Barnard D, Alpert JS: Right ventricular function in health and disease. Curr Probl Cardiol 1987; 12: 422–449. [ Links ]
2. Rich S, Dantzker DR, Ayres SM, Bergofsky EH, Brundage BH, Detre KM, et al: Primary pulmonary hypertension: A national prospective study. Ann Intern Med 1987; 107: 216–223. [ Links ]
3. Wood K: Major pulmonary embolism: Review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary embolism. Chest 2002; 121: 877–905. [ Links ]
4. Fedullo PF, Auger WR, Channick RN, Moser KM, Jamieson SW: Chronic thromboembolic pulmonary hypertension. Clin Chest Med 1995; 16: 353–374. [ Links ]
5. Runo JJ, Loyd JE: Primary pulmonary hypertension. Lancet 2003; 361: 1533–1544. [ Links ]
6. Hirsch LJ, Rooney MW, Wat SS, Kleinmann B, Mathru M: Norepinephrine and phenylephrine effects on right ventricular function in experimental canine pulmonary embolism. Chest 1991; 100: 796–801. [ Links ]
7. Lupi HE, Furuya MEY, Ramírez JC, Maxwell R, Sandoval J: Efecto de la dopamina en la mecánica vascular pulmonar. Su estudio en un modelo canino de lóbulo aislado embolizado con gelfoam. Arch Inst Cardiol Méx 1990; 61: 341–345. [ Links ]
8. Dell 'Italia LJ, Pearce DJ, Blackwell GG, Ross SH, Bishop SP, Pohost GM: Right and left ventricular volumes and function after acute pulmonary hypertension in intact dogs. J Appl Physiol 1995; 78: 2320–2327. [ Links ]
9. Ghignone M, Girling BL, Prewitt RM: Volume expansion versus norepinephine in treatment of a low cardiac output complicating an acute increase in right ventricular afterload in dogs. Anesthesiology 1984; 60: 1135–1323. [ Links ]
10. Gómez A, Unruh H, Mink S: Altered left ventricular chamber stiffness and isovolumic relaxation in dogs with chronic pulmonary hypertension caused by emphysema. Circulation 1993; 87: 247–260. [ Links ]
11. Rabinovitch M, Fisher K, Gambie W, Reid I, Treves S: Thallium–201 quantitation of right ventricular hypertrophy in chronically hypoxic rats. Radiology 1979; 130: 223–225. [ Links ]
12. Wercham PM, Summer WR, Gerdes AM, Mc Donough KH: Right Ventricular performance after monocrotaline–induced pulmonary hypertension. Am J Physiol 1989; 256: HI1328–11336. [ Links ]
13. Vlahakes GJ, Turley K, Hoffman JIE: The pathophysiology of failure in acute right ventricular hypertension: hemodynamic and biochemical correlations. Circulation 1981; 63: 87–95. [ Links ]
14. Austen GW, Morrow AG, Berry WB: Experimental Studies of the surgical treatment of primary pulmonary hypertension. J Thorac Cardiovasc Surg 1964; 48: 448–455. [ Links ]
15. Bache RJ: Effects of hypertrophy on the coronary circulations. Prog Cardiovasc Dis 1988; 21: 403–440. [ Links ]
16. Corno AF, Sekarski N, Bernath MA, Payot M, Tozzi von Segesser LK: Pulmonary artery banding: Long–term telemetric adjustment. Eur J Cardiothorac Surg 2003; 23: 317–322. [ Links ]
17. Higgins ChB, Pavelec R, Vatner SF: Modified technique for production of experimental right–sided congestive heart failure. Cardiovasc Res 1973; 7: 870–874. [ Links ]
18. Murray PA, Vatner SF: Abnormal coronary vascular response to exercise in dogs with severe right ventricular hypertrophy. J Clin Invest 1981; 67: 1314–1323. [ Links ]
19. Santos–Martínez LE, Gómez–González A, Infante–Vázquez O, Flores–Chávez P, Tena–Betancourt C, Pulido–Zamudio T, et al: Desarrollo de un modelo canino de hipertensión ventricular derecha crónica progresiva. Arch Cardiol Méx 2001; 71: 266–277. [ Links ]
20. Solis E, Heck CF, Seward JB, Kaye MP: Percutaneously adjustable pulmonary artery band. Ann Thorac Surg 1986; 41: 65–69. [ Links ]
21. Higashidate M, Beppu T, Imai Y, Kurosawa H: Percutaneously adjustable pulmonary artery band. An experimental study. J Thorac Cardiovasc Surg 1989; 97: 864–869. [ Links ]
22. Dias CA, Assad RS, Caneo LF, Abduch MC, Aiello VD, Dias AR, et al: Reversible pulmonary trunk banding. II. An experimental model for rapid pulmonary ventricular hypertrophy. J Thorac Cardiovasc Surg 2002; 124: 999–1006. [ Links ]
23. Sang CP, Bartley PG, Siewers RD, Hardesty RL, Ladowsky R, Zoltun RA, et al: A Percutaneously adjustable device for banding of the pulmonary trunk. Intern J Cardiol 1985; 9: 477–484. [ Links ]
24. Leeuwemburgh BPJ, Schoof PH, Steendijk P, Baan J, Mooi W, Helbing WA: Chronic and adjustable pulmonary artery banding. J Thorac Cardiovasc Surg 2003; 125: 231–237. [ Links ]
25. Le Bret E, Bonhoeffer P, Folliguet TA, Sidi D, Laborde F, R de Leval M, et al: A new percutaneosly adjustable thoracoscopically implantable pulmonary artery banding: An experimental study. Ann Thorac Surgery 2001; 72: 1358–1361. [ Links ]
26. Horowitz MD, Culpeper III WS, Williams III LS, Sundgaard–Riise MS, Ochsner XL: Pulmonary artery banding analysis of a 25–year experience. Ann Thorac Surg 1989; 48: 444–50. [ Links ]
27. Unruh HW, Wang R, Bose D, Mink SN: Does pentobarbital anesthesia depress left ventricular contractility in dogs? Am J Physiol 1991; 261(Heart Circ Physiol 30): H700–H706. [ Links ]
28. Wolfle TL, Rozmariek CM, Grossblatt N: Guía para el cuidado y uso de los animales de laboratorio. National Research Council: National Academy of Sciences. 1996: 1–146. [ Links ]
29. Monahar M, Thurmon JC, Tranquilli WJ: Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves with severe concentric right ventricular hypertrophy. Circ Res 1981; 48: 785–796. [ Links ]
30. Archie JP, Fixler DE, Ullyot DG: Regional myocardial blood flow in lambs with concentric right ventricular hypertrophy. Circ Res 1974; 34:143–154. [ Links ]
31. Monahar M: Transmural coronary vasodilatador reserve and flow distribution during tachycardia in conscious young swine with right ventricular hypertrophy. Cardiovasc Res 1985; 19: 104–112. [ Links ]
32. Dabritz S, Sachweh J, Tiete A, Engelhardt W, von Bernuth G, Messmer BJ: Experience with an adjustable pulmonary artery banding device in two cases: initial success–midterm failure. (Abstract). Thorac Cardiovasc Surgery 1999; 47: 51–52. [ Links ]
33. Maeta H, Atsumi N, Jikuya T, Hori M: A percutaneosly controllable pulmonary artery banding device: clinical application. (Abstract). Kyobu Geka 1995;48: 536–541. [ Links ]














