Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 no.4 Ciudad de México oct./dic. 2005
Investigación clínica
Cierre transcatéter del conducto arterioso permeable con coils de liberación controlada: Resultados inmediatos y seguimiento a mediano plazo
Transcatheter occlusion of the patent ductus arteriosus with detachable coils: immediate results and intermediate–term follow–up
José Rafael Parra–Bravo,* José Luis Acosta–Valdez,* Ana Luisa Girón–Vargas,** Luisa Gracia Beirana–Palencia,** Lydia Rodríguez–Hernández,** María de Jesús Estrada–Loza,** José Alfredo Galicia–Galicia,** César Lazo–Cárdenas,** Leticia Santillán–Pérez**
* Departamento de Hemodinamia Pediátrica.
** Departamento de Cardiología Pediátrica. Hospital de Pediatría. Centro Médico Nacional, Siglo XXI. Instituto Mexicano del Seguro Social. México, DF.
Correspondencia:
Dr. José Rafael Parra Bravo.
Servicio de Cardiología Pediátrica y Hemodinamia. Hospital de Pediatría, Centro Médico Nacional Siglo XXI.
Av. Cuauhtemoc Num. 330 Col. Doctores
06720 México, D.F.
Teléfono: 5627.6900 extensión 22270.
Correo electrónico: rafaelparrabravo@yahoo.com.mx rafaparra_bravo@hotmail.com.mx
Recibido: 23 de agosto de 2005
Aceptado: 15 de noviembre de 2005
Resumen
Objetivo: Determinar la frecuencia de éxito y seguridad del cierre percutáneo del conducto arterioso permeable (CAP) con coils de liberación controlada.
Método: Cuarenta y un pacientes pediátricos con conducto arterioso permeable (CAP), de un tamaño pequeño a moderado (diámetro mínimo < 4 mm), fueron sometidos a cierre percutáneo con coils de liberación controlada. Los resultados se establecieron mediante estudios angiográficos y ecocardiográficos. La media de edad fue de 2.0 ±1.3 años (rango, 0.6–5.6 años); la media de peso fue de 10.0 ± 3.4 kg (rango, 4.5–18.0 kg). La media del diámetro mínimo del CAP fue de 1.69 ± 0.6 mm (rango, 0.5–4 mm).
Resultados: En 39/41 pacientes se logró la implantación del dispositivo (95%). La relación media del coil/CAP fue de 3.41 ±1.1. Inmediatamente posterior a la oclusión con el coil, 18 conductos arteriosos no mostraron flujo residual por angiografía; 18 tenían un cortocircuito residual trivial, 3 leve y 2 leve. No se presentaron complicaciones significativas con el procedimiento. En las primeras 24 horas posteriores a la implantación del coil, el control ecocardiográfico mostró oclusión completa en 35 pacientes. En los 4 pacientes con flujo residual, el seguimiento ecocardiográfico demostró ausencia del cortocircuito 3 meses después en 2 pacientes y 6 meses después en un paciente. En uno, no se ha logrado la oclusión completa a un año. En dos pacientes (5%) se abandonó el procedimiento: en un paciente, por mostrar flujo residual moderado y movimiento del extremo pulmonar del coil, que debió de ser retirado con un catéter lazo y en otro, por migración del coil. Ambos pacientes fueron enviados a cirugía. En un seguimiento medio de 29.5 ± 16.5 meses (rango, 0 a 60 meses) de los 39 pacientes, no se observó flujo residual por ecocardiografía Doppler color, excepto en uno.
Conclusión: Nuestros resultados, en concordancia con otros autores, sugieren que la oclusión del conducto arterioso permeable con coils de liberación controlada, es un método seguro, efectivo y de bajo costo. La oclusión con coil deberá ser el procedimiento de elección en pacientes mayores de 6 meses de edad con conductos arteriosos permeables de un tamaño pequeño a moderado (< 4 mm). En la extensión de este procedimiento a recién nacidos y a pacientes con conductos arteriosos más grandes, deberá considerarse otro tipo de dispositivo oclusor.
Palabras clave: Persistencia del conducto arterioso. Oclusión transcatéter con coil. Enfermedad cardíaca congénita.
Summary
Objective: To determine the success rate and safety of percutaneous closure of patent ductus arteriosus (PDA) with a detachable coil.
Methods: Forty–one children with small–to moderate–size PDA (maximum diameter < 4 mm) underwent percutaneous coil occlusion. The results were assessed by angiography and echocardiography The mean age was 2.0 ± 1.3 years (range 0.6 to 5.6 years); mean weight was 10.0 ± 3.4 kg (range 4.5 to 18.0 kg). The mean minimum diameter of the PDA was 1.7 ± 0.6 mm (range, 0.5 to 4.0 mm).
Results: The occlusion device was inserted in 39 of 41 patients (95%). The mean coil/PDA ratio was 3.41 ±1.1. We observed angiographic cessation of blood flow through the PDA after coil insertion in 18 patients; 18 patients had residual shunt, 3 mild shunt and 2 moderate shunt. No complications were observed during the procedure. Thirty–five patients showed absence of blood flow through PDA 24 hours after coil occlusion by echocar–diography The other four patients with residual shunt showed flow cessation after 2 months in two patients and after 6 months in the other two. Failure of coil insertion in two patients was due to detachment of the pulmonary edge of the coil, which was subsequently removed in one, and due to coil migration in the other, both patients underwent surgical PDA closure. Mean follow–up at 29.5 ± 16.5 months showed no residual blood flow through the occluded PDA, except for one patient.
Conclusion: Our results, as many others, suggest that PDA coil occlusion is a safe, effective, and cheap procedure. PDA coil occlusion should be the elective method for PDA closure in patients older than 6 months of age with small–to moderate size PDA(< 4 mm). The procedure in newborn infants and patients with larger PDA must be made with a different type of occlusive device.
Key words: Patent ductus arteriosus. Transcatheter coil occlusion. Congenital heart disease.
Introducción
El conducto arterioso permeable (CAP) se presenta en 5–10% de los pacientes con enfermedad cardíaca congénita, representando el sexto defecto cardíaco congénito más común en grandes centros pediátricos.' En México, ocupa el primer lugar en varios centros hospitalarios.2 El conducto arterioso grande, puede causar una significativa sobrecarga de volumen al lecho vascular pulmonar y al ventrículo izquierdo. Si no son tratados, los conductos arteriosos grandes pueden evolucionar a enfermedad vascular pulmonar irreversible, insuficiencia cardíaca congestiva y arritmias. A pesar de que los conductos arteriosos pequeños tienen un riesgo relativamente bajo de desarrollar hipertensión pulmonar e insuficiencia cardíaca, su evolución puede complicarse por la presencia de endanteritis bacteriana, con un riesgo tan alto como 0.45% por año.3
El manejo médico del CAP con digoxina y diuréticos proporciona una mejoría temporal de la sobrecarga de volumen, pero la terapéutica definitiva requiere del cierre del CAP. En 1938, Gross y Hubbard4 llevaron a cabo la primera ligadura quirúrgica de un CAP; un procedimiento que inició la era actual del manejo quirúrgico de las cardiopatías congénitas. El CAP fue también, una de las primeras lesiones cardíacas tratadas con abordaje intervencionista percutáneo. En 1967, Porstmann et al.5 describen el uso de mallas de Ivalon para cerrar CAPs con introductores arteriales muy grandes (21F). En 1979, Rashkind y Cuaso6 reportan el uso exitoso de un pequeño dispositivo de sombrilla único para cerrar un CAP en un recién nacido. Este dispositivo, fue posteriormente modificado a un sistema oclusor de CAP de doble sombrilla.7–9 A pesar de la amplia experiencia reportada con la utilización de la doble sombrilla de Rashkind, el uso de este dispositivo ha sido abandonado por varias razones: altos costos, la necesidad de grandes introductores venosos, su limitación a sólo dos tamaños, una incidencia superior al 20% de fuga residual y el riesgo de estenosis de la arteria pulmonar izquierda en los niños.10
A partir de esta fecha, otros dispositivos transcatéter han sido utilizados para cerrar percutáneamente CAPs. La oclusión de conductos arteriosos pequeños con coils de Gianturco fue descrita en 1992,11y han sido utilizados por otros autores con resultados muy favorables.12,13 El coil de Gianturco, es una espiral de acero inoxidable con fibras de lana y Dacron, que promueven la trombogénesis y el cierre del conducto arterioso. Su principal desventaja, es la de no tener un control en su liberación. A partir de este coil, fue desarrollado el coil de liberación controlada de Jackson {Cook detachable coil), con la ventaja de poder ser implantado a través de un catéter y un sistema de liberación.1415 Si bien, en el cierre del conducto arterioso pequeño (< 4 mm) se han obtenido resultados bastante satisfactorios con el uso de los coils de liberación controlada, la incidencia de cortocircuito residual, hemolisis y embolización, es más elevada en los conductos arteriosos de mayor tamaño.16
El cierre transcatéter del conducto arterioso persistente en la edad pediátrica, es a la fecha, una práctica bien establecida, con una alta frecuencia de éxito y una baja incidencia de complicaciones. El razonamiento para el cierre del conducto arterioso en esta población etaria, es la de reducir el riesgo de endarteritis y la posibilidad de falla cardíaca en otras etapas tardías de la vida.13 Este reporte, describe nuestra experiencia en la oclusión de CAPs, con un tamaño pequeño a moderado (< 4 mm) con coils de liberación controlada (Cook detachable coils), en cuarenta pacientes pediátricos.
Pacientes y método
Pacientes
Desde mayo del 2000 a mayo de 2005, 41 niños (16 niños y 25 niñas) con diagnóstico de conducto arterioso permeable < 4 mm en su diámetro interno, fueron sometidos a cierre percutáneo. En todos se realizó ECG, radiografía de tórax y ecocardiograma previo al procedimiento, y se obtuvo el consentimiento informado de sus padres o tutores. Los criterios de inclusión fueron: peso mayor de 4 kg, resistencias vasculares pulmonares < 8 unidades Wood/m2, y el tamaño del conducto arterioso en su diámetro mínimo < de 4 mm.
Dispositivo y selección
El coil (oclusor) utilizado durante este estudio, fue un coil de liberación controlada (Cook detachable coils, Europe), que es un alambre de acero inoxidable de 0.038 pulgadas que está recubierto de fibras sintéticas, que favorecen la trombogénesis. La nominación de los coils (espirales de oclusión) hace referencia al tamaño en milímetros del diámetro que tiene una vez formada la espiral y a la longitud total de la misma; Cook detachable coils: IMWCE3–PDA3, 5–PDA3, 5–PDA4, 5–PDA5, 6–PDA5, 6.5PDA5. Este alambre de acero inoxidable, está unido a un cable de liberación por un mecanismo sencillo de unión, y tiene la ventaja de que una vez implantado el coil, es posible extraerlo mientras permanece atornillado al cable liberador.
Procedimiento de implantación
El procedimiento se realizó bajo anestesia con midazolam y ketamina por vía intravenosa. Con la técnica percutánea de Seldinger, se canalizó la arteria y la vena femoral en 26 casos, una arteria femoral en 12 casos y ambas arterias femorales en 3 casos. Se administró 100 U/kg de peso de heparina sódica, tras canalizar la arteria. Después de registrar las presiones pulmonares y sistémicas y toma de saturaciones para cálculo de relación de gastos, se realizó una angiografía en aorta en proyección lateral con un catéter pigtail 4F (Coráis, Miami, Flo) para definir la morfología y tamaño del conducto arterioso (Fig. 1A). El diámetro mínimo interno del conducto fue medido con el uso del catéter pigtail como factor de corrección. El conducto arterioso se canalizó por la vía anterógrada en 26 casos y en el restante por la vía retrógrada. El conducto arterioso fue cruzado desde el tronco de la arteria pulmonar a la aorta descendente (vía anterógrada), o de la aorta descendente al tronco de la arteria pulmonar (vía retrógrada), con un catéter multipropósito 5F (Cook, Bloomington, Ind.). El coil (Cook detachable coil), fue seleccionado con un diámetro aproximadamente dos o tres veces más grande (pero no menos de 1.7), que el diámetro mínimo interno del conducto arterioso. La longitud del coil elegida fue lo suficiente para formar al menos tres asas. Así que, atornillado a la punta del cable liberador, y avanzado a través del catéter multipropósito, 2 o más asas del coil, fueron colocadas dentro del extremo aórtico del conducto arterioso y de 1 a 1.5 asas dentro del extremo pulmonar (Fig. 1B). Con el coil aún anclado al cable liberador, se realizó una angiografía en aorta en proyección lateral, con un catéter pigtail para detectar posible flujo residual, en aquellos casos con abordaje anterógrado y en los casos con abordaje biarterial femoral. Una vez corroborada una posición adecuada del coil y la ausencia de fuga residual o presencia de fuga trivial, éste fue liberado mediante rotación antihoraria del cable liberador (Fig. 1C). Enlos 12 casos conabordaje retrógrado y una única vía arterial, el coil fue liberado, previo a la angiografía de control en la aorta. Diez minutos después de la liberación se realizó una angiografía en aorta para valorar la presencia de cortocircuito residual hacia el tronco pulmonar (Fig. 1D). Si se observó un flujo residual trivial, el coil fue reposicionado con un movimiento leve de la punta del catéter multipropósito, contra el coil en su extremo aórtico y una nueva angiografía en la aorta fue realizada. Una dosis única de cefazolina fue indicada (50 mg/kg). Se retiraron los catéteres y se logró la hemostasia manual. El paciente fue dado de alta al día siguiente del procedimiento. Una evaluación clínica, apoyada con radiografía de tórax y ecocardiogramabidimensional Doppler/color, se realizaron a las 24 horas, 3, 6 y 12 meses.
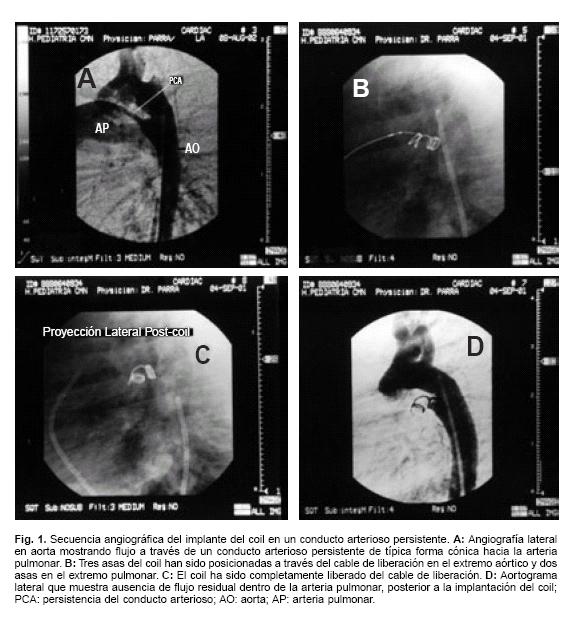
Análisis
El grado de cortocircuito angiográfico previo a la oclusión con el coil, se estableció de la siguiente manera: leve = opacificación de una parte del tronco arterial pulmonar y de la rama pulmonar izquierda; moderado = opacificación del tronco arterial pulmonar hasta la válvula pulmonar y ambas ramas pulmonares; severo = opacificación de la misma densidad en ramas pulmonares y aorta. El grado de cortocircuito residual a través del CAP por angiografía, se estableció de la siguiente manera: trivial = presencia de un jet fino del medio de contraste limitado al área inmediata del coil; leve = opacificación de una parte del tronco arterial pulmonar y de la rama izquierda pulmonar; moderado = opacifi–cación del tronco arterial pulmonar hasta el nivel de la válvula pulmonar y opacificación densa de ambas ramas pulmonares; severo = opacificación de la misma densidad en las arterias pulmonares y en la aorta. Los datos son presentados como rangos, valores medios y desviación estándar.
Resultados
En 95% (39/41) de los pacientes se consiguió la implantación del dispositivo. Los datos clínicos de los pacientes se muestran en la Tabla I. La edad de los pacientes osciló entre los 6 meses y los 5.6 años (2.0 ±1.3 años), con pesos comprendidos entre los 4.5 y los 18 kg (10.0 ± 3.4). Veinticuatro pacientes tenían un conducto arterioso permeable aislado. En tres pacientes se trataba de un conducto residual tras una ligadura quirúrgica. Como anomalías asociadas presentaron: comunicación interventricular pequeña (5 casos), comunicación interauricular (4 casos), estenosis leve de rama pulmonar derecha, insuficiencia aórtica leve, coartación de aorta, origen anómalo de arteria subclavia derecha, postoperado de tetralogía de Fallot (1 caso cada uno, respectivamente), ocho pacientes eran portadores de síndrome de Down y dos de anomalías mendelianas.
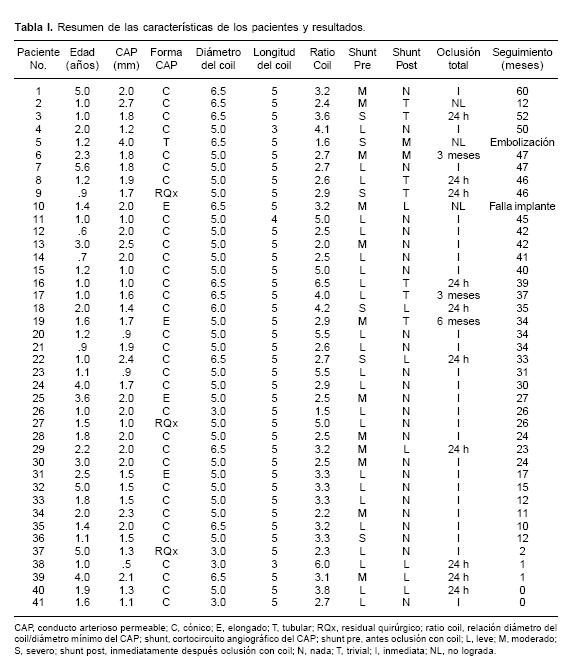
El diámetro mínimo del conducto arterioso permeable osciló entre los 0.5 y los 4.0 mm (1.69 ± 0.6). Según la clasificación de Krichenko et al,17 33 conductos fueron del tipo cónico, 4 del tipo elongado, 1 del tipo tubular y 3 residuales a ligadura quirúrgica del conducto. Quince de los 41 pacientes (36.5%), presentaban hipertensión pulmonar con relación de presión pulmonar/sistémica > 35%, que disminuyó o se normalizó tras el cierre del conducto arterioso. El tamaño de los coils implantados fue 3–3 en 1 paciente, 3–5 en 3 pacientes, 5–3 en 1 paciente, 5–4 en 1 paciente, 5–5 en 23 pacientes, 6–5 en 1 paciente y 6.5–5 en 11 pacientes. En dos pacientes, la implantación del coil fue abandonada. En el caso 5 de la serie, se observó migración del coil hacia la rama pulmonar izquierda. En el caso 10 de la serie, posterior a la colocación y liberación del coil, se observó un desplazamiento del coil hacia el extremo pulmonar del conducto, sin migrar en forma completa hacia la rama pulmonar, pero observándose un movimiento en vaivén de las asas del coil en su extremo pulmonar con los latidos cardíacos. En ambos casos se retiró el coil, con un catéter lazo {snare catheter) sin complicaciones. No se intentó implantar otro coil y fueron enviados a cirugía.
Se consiguió la oclusión completa en forma inmediata en 26 de los 39 casos (66.5%) y en 35 de los 39 casos (89.7%), en el control ecocardiográfico realizado a las 24 horas. De los 4 pacientes restantes; en dos, se corroboró la oclusión completa en el control eco Doppler–color realizado al tercer mes y en uno a los 6 meses. En un solo paciente, no se logró la oclusión completa a un año de seguimiento. Ningún paciente presentó gradiente a través del arco aórtico en la valoración hemodinámica postimplante del coil. No se presentaron complicaciones significativas durante el procedimiento. Un paciente mostró migración del coil y en otro, se falló en el implante. Ninguno de los pacientes mostró disminución en los pulsos femorales, estenosis de la rama izquierda de la arteria pulmonar, hemolisis, infección o fenómeno tromboembólico.
El 95.1% (39/41) de los pacientes acudió a las revisiones clínicas, en las que además se realizó ECG, radiografía de tórax y ecocardiograma Doppler–color. El tiempo de seguimiento osciló entre 0 y 60 meses (29.5 ± 16.5). Todos los pacientes se encontraban asintomáticos y en la radiografía de tórax, todos los coils se observaron en la misma posición y tenían la misma configuración, como se observaron inmediatamente posterior al procedimiento de implante. Excepto en un caso, en ninguno se observó aceleración del flujo en la arteria pulmonar izquierda que superase 1.5 m/s.
Discusión
Cuando el coil de Jackson (Cook detachable coil) es liberado del interior del catéter multipropósito y de su sistema de liberación, éste adquiere una forma de espiral cilindrico. El diámetro del coil, se refiere al diámetro del tubo cilindrico formado por el coil, posterior a su liberación. La longitud del coil, se refiere a la verdadera longitud del coil en su configuración más estrecha. Así, en cada una de sus asas formadas, el coil se acorta por la longitud de su circunferencia. La longitud del coil a ser utilizada, está determinada en base al número de asas que son deseadas tanto en el extremo pulmonary aórtico de la porción más estrecha del CAP. El objetivo de varios autores,13,14 es el de colocar entre 1–1.5 asas en el extremo pulmonar y al menos 2 asas en el extremo aórtico del conducto arterioso. La relación recomendada del diámetro del coil al diámetro mínimo del CAP es de 2.0 a 3.0.15 Aunque el número de pacientes de nuestro estudio, quienes han tenido un seguimiento de 5 años es considerablemente bajo cuando comparamos con el registro europeo, la frecuencia de éxito en la oclusión inmediata y en el seguimiento alcanzada en este estudio (66.5% y 89.7%, respectivamente) se compara favorablemente con otras series.15–18 En un reporte de más de 371 pacientes, la oclusión inmediata del conducto se logró en el 69.6% de los casos y la oclusión total en el 94.3%, en un seguimiento medio de 8.1 ± 7.8 meses.13 Tomando en cuenta únicamente conductos arteriosos menores de 4 mm, la prevalencia de fuga residual a 12 meses es del 6%.16,19
El objetivo de eliminar cualquier cortocircuito residual en el laboratorio de hemodinamia, mediante la técnica de reposicionamiento del coil,15 fue utilizada por nosotros, para evitar la necesidad de implantar coils adicionales. Esta técnica puede parcialmente mejorar la frecuencia de éxito del procedimiento, debiéndose tomar en cuenta, que para conductos mayores de 4 mm, debe considerarse la opción de utilizar otro tipo de coils o múltiples coils.19,20 Así mismo, el tamaño del conducto y los datos morfológicos de éste, determinarán el éxito de la oclusión, ya que conductos tipo ventana o grandes conductos tubulares tienen una frecuencia muy baja de oclusión completa.16–20 De acuerdo al registro del estudio europeo,16 un incremento en el diámetro mínimo del conducto y la presencia de morfología tubular del conducto, están positivamente asociados con un resultado poco favorable. Una mayor frecuencia de fugas triviales o en los casos con fuga hasta un seguimiento de 6 meses, la observamos en los conductos de forma tubular/ elongada. Con la curva de aprendizaje, y tomando en cuenta un conducto de forma cónica y < 1.0 mm, optamos por realizar la oclusión retrógrada utilizando únicamente una vía arterial. Sólo se presentaron dos complicaciones significativas con la implantación del coil en nuestra serie. En uno, por migración del coil, y en el otro, por falla en el implante. La embolización del coil a las arterias pulmonares distales se ha reportado en 12% y a las arterias sistémicas en 3%.13–16 La mayoría de estos coils migrados pueden ser retirados por métodos percutáneos sin complicaciones.
La estenosis proximal leve de la arteria pulmonar izquierda causada por el abultamiento de las asas del coil, se ha descrito en 2–6% de los pacientes.16,21 En sólo uno de nuestros casos, la aceleración de flujo en la rama izquierda pulmonar alcanzó 1.9 m/s. Las complicaciones de los vasos femorales, incluyendo disminución de los pulsos o hematoma, ocurren en 2%. La hemolisis puede ocurrir. La migración tardía del coil, coartación, complicaciones tromboembólicas o recanalización del conducto no han sido reportadas.
Para reducir la incidencia de migración del coil a las arterias pulmonares o sistémicas inmediatamente después de la implantación, algunos autores han utilizado catéter lazo, fórceps o coils de liberación controlada,18–22 los cuales permiten un mejor anclaje de las asas y un mejor control en la liberación del coil. Con el uso de coils de liberación controlada, la facilidad en su implantación, la frecuencia de cortocircuito residual a las 24 horas y en el seguimiento intermedio tienen rangos de 94–99%, 7–28%y 3–12%, respectivamente.22,23 Por la disponibilidad en nuestro hospital, nosotros decidimos utilizar los coils de liberación controlada, con resultados similares, excepto con una frecuencia ligeramente mayor de cortocircuito residual en las primeras 24 horas postimplante. Estos métodos pueden ser útiles cuando se intenta cerrar conductos grandes. Sin embargo, algunos conductos arteriales no son candidatos para cualquier método de oclusión con coil y requieren, ya sea de ligadura quirúrgica u oclusión usando un sistema transcatéter alternativo.
En 1998, Masura et al24 publicaron la primera serie de cierre percutáneo del conducto utilizando el dispositivo oclusor de Amplatz, especialmente diseñado para los conductos de tamaño moderado a grande. En últimas fechas, hemos utilizado en dos casos (no reportados en esta serie) otro coil con sistema de liberación controlado, el Nit–Occlud Coil que tiene forma de reloj de arena o de doble hélice.25,26
Como con cualquier técnica intervencionista transcatéter, los resultados deberán ser comparados con alternativas bien establecidas. La ligadura quirúrgica del conducto ha sido llevada a cabo en muchos centros con una alta frecuencia de éxito y baja mortalidad. Sin embargo, la evidencia por Doppler/color de flujo residual del conducto posterior a la ligadura quirúrgica se ha reportado en 6–23% de los pacientes. Por esta razón, muchos cirujanos a la fecha ligan y seccionan el conducto. En la era actual de altos costos, los aspectos económicos para la oclusión con coil, son relevantes para los países en vías de desarrollo. Han sido ampliamente comparados los gastos económicos del cierre del conducto arterioso por cirugía, con aquéllos por oclusión transcatéter.27 Ventajas adicionales de la oclusión transcatéter del conducto sobre la cirugía son más difíciles de cuantificar.
Conclusiones
El cierre percutáneo del conducto arterioso < 4 mm, con coils de liberación controlada (espirales de oclusión) es un método seguro, efectivo y de bajo costo. Estudios clínicos de grandes series de pacientes, han confirmado estos datos. El estudio muestra una baja incidencia en complicaciones y fuga residual. Conductos arteriosos de un tamaño mayor a 4 mm o de forma tubular, requieren de un sistema de oclusión alternativo. El uso de coils de liberación controlada puede ser un buen punto de inicio, cuando se está iniciando un programa de cierre transcatéter del conducto arterioso en una institución.
Referencias
1. Moore P, Brook MM, Heyman MA: Patent ductus arteriosus. En: Allen HD, Clark EB, Gutgesell HP, Driscoll DJ, eds. Moss and Adams 'heart disease in infants, children and adolescents, including the fetus and young adult. 6th ed. Philadelphia: Lippincott, Williams and Wilkins, 2001; 1: 652–69. [ Links ]
2. Zamora–González C: Aspectos epidemiológicos de las cardiopatías congénitas en México: qué sabemos y qué ignoramos. En: Sánchez–Torres, ed. Epidemiología de las enfermedades cardiovasculares en México. México: Sociedad Mexicana de Cardiología, 1992:67–78. [ Links ]
3. Campbell M: Natural history of persistent ductus arteriosus. Br Heart J 1968; 30: 4–12. [ Links ]
4. Gross RE, Hubbard IP: Surgical ligation of a patent ductus arteriosus: report of the first successful case. JAMA 1939; 112: 729–31. [ Links ]
5. Porstmann W, Wierny L, Warnke H: Der verschluss des ductus arteriosus persistens ohne thorakotomie. Thoraxchirurgie 1967; 15: 199–203. [ Links ]
6. Rashkind WJ, Cuaso CC: Transcatheter closure of patent ductus arteriosus: successful use in a 3.5 kilogram infant. Pediatric Cardiol 1979; 1: 3–7. [ Links ]
7. Rashkind WJ, Mullins CE, Hellenbrand WE, Tait MA: Nonsurgical closure of patent ductus arteriosus: clinical application of the Rashkind PDA occluder system. Circulation 1987; 75: 583–92. [ Links ]
8. Wessel DL, Keane JF, Parness I, Lock JE: Outpatient closure of the patent ductus arteriosus. Circulation 1988; 77: 1068–71. [ Links ]
9. Hosking MCK, Benson LN, Musewe N, Dick JD, Freedom RM: Transcatheter occlusion of the persistently patent ductus arteriosus. Circulation 1991; 84: 2313–7. [ Links ]
10. Gray DT, Fyler DC, WalkerAM, Wenstein MC, Chalmers TC: Clinical outcomes and costs of transcatheter as compared closure surgical of patent ductus arteriosus. The Patent Ductus Arteriosus Closure Comparative Study Group. N Engl J Med 1993; 329: 1517–23. [ Links ]
11. Cambier PA, Kirby WC, Wortham DC, Moore JW: Percutaneous closure of the small (< 2.5 mm) patent ductus arteriosus using coil embolization. Am J Cardiol 1992; 69: 815–16. [ Links ]
12. Moore JW, George L, Kirkpatrick JW, Spicer RL, Uzark K: Percutaneous closure of the small patent ductus arterious using occluding springs coils. J Am Coll Cardiol 1994; 23: 759–65. [ Links ]
13. Lloyd TR, Fedderly R, Mendelson AM, Sandhu SK, Beekman RH III: Transcatheter occlusion of patent ductus arteriosus with Gianturco coils. Circulation 1993; 88: 1412–20. [ Links ]
14. Tometzki AJP, Arnold R, Peart I, Sreeram N, Abdulahmed JM, Godman MJ, et al: Transcatheter occlusion of the patent ductus arteriosus with Cook detachable coils. Heart 1996; 76: 531–5. [ Links ]
15. RothmanA, Lucas VW, Sklansky MS, Cocalis MW, Kashani IA: Percutaneous coil occlusion of patent ductus arteriosus. J Ped 1997; 130: 447–454. [ Links ]
16. Magee AG, Huggon IC, Seed PT, Qureshi SA, Tynan M: Transcatheter coil occlusion of the arterial duct. Results of the European Registry. Eur Heart J 2001; 22: 1817–21. [ Links ]
17. Krichenko A, Benson LN, Burrows P, Moes CAF, Mc Laughlin P, Freedom RM, et al: Angiographic classification of the isolated, persistently patent ductus arteriosus and implications for percutaneous catheter occlusion. Am J Cardiol 1989; 63: 877–80. [ Links ]
18. Hashino K,Akagi T, Kasue T, Sugimura T, MaenoY, Kato H: A new transvenous coil embolization of patent ductus arteriosus using a screwing detachable coil and delivery system. Circulation 1995; 92: 309–11. [ Links ]
19. Cheung Y, Leung M, Chau K: Transcatheter closure of persistent arterial ducts with different types coil. Am Heart J 2001; 141: 87–91. [ Links ]
20. Hijazi ZM, Geggel RL: Transcatheter closure of large patent ductus arteriosus (> 4 mm) with multiple Gianturco coils: immediate and mid–term results. Heart 1996; 76: 536–40. [ Links ]
21. Lloyd TR, Beekman RH, Moore JW, Hijazi ZM, Hellenbrand WE, Sommer RJ, et al: For the PDA Coil Registry Investigators. The PDA coil registry: 250 patients–years of follow–up. (Abstract). J Am Coll Cardiol 1996; 27: 34A. [ Links ]
22. Ing FF, Bierman FZ: Percutaneous transcatheter coil occlusion of the patent ductus arteriosus aided by the nitinol snare: further observations. Cardiovasc Intervent Radiol 1995; 18: 222–6. [ Links ]
23. Bermudez–Cañete R, Santoro G, Bialkowsky J, Herraiz I, Formigari R, Szkutnik M, Ballerini L: Patent ductus arteriosus occlusing using detachable coils. Am J Cardiol 1998; 82: 1545–47. [ Links ]
24. Uzum O, Dickinson D, Pearson J, Gibbs JL: Residual and recurrent shunts after implantation of Cook detachable coil. Heart 1998; 79: 220–22. [ Links ]
25. Masura J, Walsh KP, Thanopoulous B: Catheter closure the moderate to large sized patent ductus arteriosus using the new Amplatzer occluder: immediate and short term results. J Am Coll Cardiol 1998; 31: 878–82. [ Links ]
26. Tometzki A, Chan K, De Giovanni J, Houston A, Martin R, Redington A, et al: Total UK multi–centre experience with a novel arterial occlusion device (Duct Occludpfm). Heart 1996; 76: 520–4. [ Links ]
27. Celiker A, Aypar E, Karagoz T, Dilber E, Ceviz N: Transcatheter closure of patent ductus arteriosus with Nit–Occlud coils. Catheter Cardiovasc Interv 2005; 65: 569–76. [ Links ]
28. Fedderly RT, Beekman RH, Mosca RS, Bove EL, Lloyd TR: Comparison of hospital charges for closure of patent ductus arteriosus by surgery and by transcatheter coil occlusion. Am J Cardiol 1996; 77: 776–79. [ Links ]














