Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 no.2 Ciudad de México abr. 2005
Comunicaciones breves
Hipertensión ventricular derecha severa secundaria a obstrucción metastásica por hepatocarcinoma
Severe right ventricular hypertension secondary to metastatic obstruction due to hepatocarcinoma
Luis Efrén Santos Martínez,* Jesús Martínez Reding,** Jorge Kuri Alfaro,*** José Gotés,* Alberto Aranda,**** Miguel Zúñiga,* Edgar Bautista,* Tomás Pulido,* Arturo Carrillo,* Norberto García,* Alicia Castañón,* Julio Sandoval*
Instituto Nacional de Cardiología, "Ignacio Chávez".
* Departamento de Cardioneumología.
** Cardiología Adultos, Tercer Piso.
*** Subdirector de Especialidades Médico–Quirúrgicas.
**** Departamento de Patología.
Correspondencia:
M en C. Luis Efrén Santos Martínez.
Adscrito al Departamento de Cardioneumología. Instituto Nacional de Cardiología "Ignacio Chávez"
(INCICH, Juan Badiano No. 1 Col. Sección XVI, Tlalpan
14080 México, D.F.). Teléfono: 55732911 Ext. 1355
E–mail: sanlui@cardiologia.org.mx
Recibido: 25 de febrero de 2004
Aceptado: 22 de octubre de 2004
Resumen
La hipertensión ventricular derecha es una entidad esperada en enfermedades cardiopulmonares. La obstrucción mecánica del tracto de salida del ventrículo derecho es una de ellas. Presentamos el caso clínico de un paciente masculino de 69 años de edad con historia de hepatocarcinoma previamente tratado, quien presentó hipertensión ventricular derecha por obstrucción metastásica única al ventrículo derecho. El comportamiento clínico es de un síndrome de hipertensión venosa sistémica. Los estudios no invasivos, como el ecocardiograma y la tomografía axial computarizada la delimitaron. No se demostró actividad neoplásica o metástasis en otros órganos. La neoformación intra–ventricular derecha fue corroborada mediante cardio–angiografía y la biopsia tumoral confirmó el diagnóstico.
Palabras clave: Ventrículo derecho. Tumores cardíacos. Metástasis cardíacas. Hipertensión ventricular derecha.
Summary
Right ventricular hypertension (RVH) is an entity that could be expected in various cardiopulmonary diseases. Mechanical obstruction to the right ventricle outflow tract is a cause of RVH. We present the case of a 69 year–old male with a history of hepatocarcinoma previously treated. The developed RVH due to mechanical obstruction secondary to metastatic infiltration of the right ventricle. The clinical syndrome was characterized by systemic venous hypertension. Non–invasive studies, such as electrocardiogram and computed tomography scan limited the metastasis to the right ventricle; the diagnosis was confirmed by cardio–angiography and endocardial biopsy. The studies did not demonstrate neoplastic activity at any other level. (Arch Cardiol Mex 2005; 75: 170–177).
Keywords: Right ventricle. Cardiac tumors. Cardiac metastasis. Right ventricular hypertension.
La hipertensión ventricular derecha (HVD), es una alteración frecuentemente encontrada como repercusión de la hipertensión arterial pulmonar de diversas etiologías.1 Además se presenta en la obstrucción del tracto de salida del ventrículo derecho como ocurre en la estenosis de la válvula pulmonar o del infundíbulo, y, a nivel terapéutico o experimental en el bandaje del tronco de la arteria pulmonar.2 Sin embargo, la obstrucción mecánica del tracto de salida del ventrículo derecho (VD) de otro origen, como el neoplásico, que puede ser productora de hipertensión ventricular derecha, es una entidad rara.
Los tumores cardíacos primarios malignos representan el 25% de todos los tumores del corazón.3,4 Sin embargo, la forma secundaria (metástasis) son más frecuentes en una relación de 1 a 4,5 y ocurren en menos del 20% en autopsias de pacientes con carcinoma.7,8 La presentación metastásica con ocupación ventricular que obstruye el tracto de salida del ventrículo derecho se ha reportado proveniente de cánceres primarios de diferentes sitios,9 hasta el momento (Agosto 2004), han sido descritos en 23 casos,9–17 de los cuales sólo 712–17 han sido metastásicos de un hepatocarcinoma. Presentamos un caso más, el número 24 con obstrucción al tracto de salida del VD y que es el octavo caso, cuyo origen es un hepatocarcinoma.
Caso clínico: Masculino 69 años de edad, campesino, analfabeta, portador por 25 años de Diabetes Mellitus tipo II, tratada con hipoglucemiantes orales, con hábito tabáquico por 50 años a razón de 3 cigarrillos diarios. Cirugías, apendicectomía y colecistectomía hace 20 años.
Tres años y medio previos a su ingreso a nuestro Instituto, fue operado en otro hospital por evidencia de masa dura pulsátil en hipocondrio derecho asociada a astenia, adinamia, y pérdida de peso de 3 meses de evolución; se reportó hepatocarcinoma con patrón trabecular sólido, y metástasis a epiplón, con hiperplasia linforreticular en 6 ganglios linfáticos del epiplón y 5 procedentes de curvatura mayor; sin evidencia macro y microscópica de cirrosis. Se le realizó resección lateral de lóbulo izquierdo que incluyó la totalidad del tumor, y se asoció al tratamiento quirúrgico 5 dosis de adriamicina intra–arterial y 30 mg de atiliblastina. Posteriormente se hizo revisión mediante arteriografía hepática, reportándose con trayectos tortuosos pero respetados de proceso tumoral. El paciente se mantuvo en clasificación funcional de Karnofsky de 90. Durante el seguimiento no se demostró evidencia de metástasis a ningún nivel por 3 años, y los marcadores tumorales (alfa fetoproteína y antígeno carcinoembrionario) fueron reportados como normales. Portomografía axial computarizada (TAC) de abdomen no se demostró metástasis o neoformación hepática. El paciente se refirió asintomático en general y específicamente del área cardiovascular hasta 4 a 5 meses previos a su ingreso, en que notó disnea de grandes esfuerzos, que progresó paulatinamente hasta ser de medianos y pequeños esfuerzos, además se agregó edema de miembros inferiores ascendente y progresivo, pérdida del apetito y pérdida de peso aproximada de 7 kg, por lo que se realizó otra TAC, en donde se apreció crecimiento de masa intra–ventricular derecha a considerar como primera posibilidad trombo antiguo, sin poderse descartar malignidad primaria o metástasis de la tumoración resecada.
Exploración física: Talla 1.53 metros, peso corporal 53 kilogramos, tensión arterial 110/70, frecuencia cardíaca 78 latidos por minuto, temperatura 36.2° C, frecuencia respiratoria 22 por minuto. Adelgazado, asténico, adinámico con plétora yugular grado III a 45 grados de inclinación, sin adenomegalias, tórax normolíneo, con choque de la punta en quinto espacio intercostal izquierdo, en la línea medio clavicular, los ruidos cardíacos rítmicos, el primer ruido apagado, y el segundo ruido normal, con soplo regurgitante en foco tricuspideo II/IV, que incrementó con la maniobra de Rivera Carballo, y en focos de la base, soplo sistólico expulsivo I/TV. No se apreciaron síndromes pleura–pulmonares. Abdomen sin dolor o masas palpables, sólo cicatrices abdominales de procedimientos quirúrgicos previos. Pulsos periféricos débilmente perceptibles, llenado distal adecuado.
Laboratorio: Leucocitos 6.7 x 103/uL, Eritrocitos 6.23 x 106/uL, hemoglobina 18.3 g/dL, hematócrito 56.4 %, volumen corpuscular medio (VCM) 90.5 fl, hemoglobina corpuscular media (HCM) 29.6 pg, concentración media de hemoglobina corpuscular (CMHC) 32.7 g/dL, Plaquetas 214,000/uL; Glucosa 147 mg/dL, creatinina 1.08 mg/dL, nitrógeno de urea 26 mg/dL, cloro 99 mEq/L, sodio sérico 138 mEq/L, potasio sérico 4.7 mEq/L, calcio sérico 9.6 mg/dL, fósforo sérico 3.7 mg/mL, fosfatasa alcalina 159 U/L, bilirrubina total 1.67 mg/dL, aspartato aminotransferasa (TGO) 25 U/L, transaminasa glutámica–pirúvica (TGP) 24 U/L, deshidrogenasa láctica (DHL) 103 U/L, tiempo de protrombina (TP) 16/14 segundos, tiempo parcial de tromboplastina (TPT) 66/34 segundos. Proteínas totales 6.7 g/mL, albúmina 3.7 g/mL, globulina 3 g/mL, colesterol 149 mg/dL, creatinfosfocinasa (CPK) sérica 46 U/L.
Antígeno de superficie para hepatitis B, negativo por ELISA.
Alfa fetoproteína sérica 8.30 ng/mL, (Normal: 0–8.5); Antígeno carcinoembrionario 4.9 ng/mL (Normal: 0–10).
Estudios de Gabinete: Electrocardiograma (ECG) (Fig. 1): En ritmo sinusal, con frecuencia cardíaca de 71 latidos/minuto, eje de ÁQRS 180°, dilatación y sobrecarga sistólica del VD, y bloqueo de grado intermedio de la rama derecha del haz de His.
Radiografía del tórax (Fig. 2): En proyección postero–anterior donde se apreciaron partes blandas y óseas sin alteraciones, silueta cardíaca con índice cardio–torácico de 0.54, el parénquima pulmonar sin infiltrados, aparente disminución discreta de la vasculatura pulmonar. La serie cardíaca fue normal.

Prueba de Función Respiratoria: Reportada como normal, con los siguientes porcentajes del valor predicho: Capacidad vital forzada (CVF) 101%, volumen espiratorio forzado en el primer segundo (VEF1) 112%, relación VEF1/CVF 110%. Los gases sanguíneos al 21% de fracción inspirada de O2, pH = 7.46, PaO2 = 72 mm Hg, PaCO2, 30mmHg.
Gammagrafía Pulmonar Ventilatoria/Perfusoria: Negativa para tromboembolia pulmonar. Gammagrama Óseo: Negativo para patología metastásica. Centelleografía Hepato–Esplénica con 99mTc–sulfuro coloidal, fue referida como de características normales y con ausencia funcional del lóbulo hepático izquierdo. Perfusión Miocárdica con MIBI Tecnecio 99: El ventrículo izquierdo (VI) pequeño, gran dilatación del ventrículo derecho en reposo que incrementó con el esfuerzo comprimiendo al VI y desplazó al septum interventricular hacia la izquierda. No áreas de isquemia ventricular izquierda.
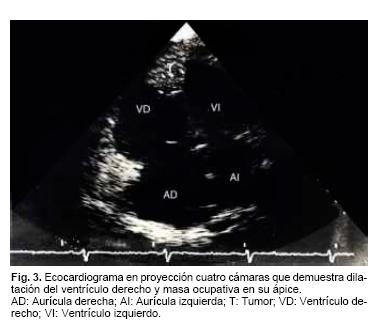
El Ecocardiograma transtorácico (Figs. 3 y 4) demostró dilatación del ventrículo derecho con masa que ocupó desde la parte media del ápice ventricular hasta el tracto de salida y la válvula pulmonar; las paredes del VD con aspecto infiltrativo. La función sistólica del VI conservada (fracción de expulsión 67%).

Ecografía de compresión bidimensional (Eco–Duplex) de miembros inferiores sin evidencia de obstrucción.
TAC de Tórax y Abdomen: Se apreció imagen hipodensa de 7 centímetros de longitud y 4.4 centímetros de diámetro en el ventrículo derecho (Fig. 5). No se evidenció extensión a la aurícula derecha, la arteria pulmonar, a la vena cava o al abdomen.

En el Cateterismo Derecho e Izquierdo se encontró la presión auricular derecha de 9 mm Hg, presión sistólica del ventrículo derecho 71 mm Hg, presión final diastólica del VD 14 mm Hg, presión sistólica de la arteria pulmonar 29 mm Hg, presión diastólica de la arteria pulmonar 11 mm Hg, presión capilar pulmonar 6 mm Hg, presión sistólica del VI 100 mm Hg, presión final diastólica del VI3 mm Hg, presión sistólica aórtica 100 mm Hg, presión diastólica aórtica 53 mm Hg. La saturación venosa mixta 64.2% y en aorta la saturación arterial 93.7%. Gasto sistémico 2.9 L/min.
En el disparo del medio de contraste en el VD, se apreció masa muy vascularizada (Fig. 6) de localización paraseptal, apical del infundíbulo, la cual protruye sobre la válvula pulmonar en sístole, produciendo obstrucción con gradiente de 42 mm Hg.

En la coronariografía se apreciaron 2 lesiones en la arteria circunfleja del 40%, y en el tercio medio de la arteria coronaria derecha una lesión del 20%. El ventrículo izquierdo sin alteraciones morfológicas.
Durante el cateterismo, se realizó biopsia tumoral. Los fragmentos fueron reportados en histopatología como blandos, amarillentos, de superficie discretamente vellosa, y microscópicamente reportaron células epiteliales malignas que se disponen en cordones o papilas y dejan luces vasculares. Las características individuales de abundante citoplasma, las identifican como epiteliales y los núcleos irregulares pleomórficos y con nucléolos muy aparentes las caracterizan como malignas, características de un carcinoma metastásico (Fig. 7).

Ulteriormente el paciente evolucionó con mayor deterioro hemodinámico secundario a la metástasis y falleció a los 6 meses del diagnóstico.
Discusión
El carcinoma hepatocelular es una de las neoplasias malignas más comunes en el mundo. Sin embargo, su incidencia varía geográficamente y de acuerdo a la población estudiada. En México, es un tumor raro y representa sólo el 1.4% de todas las neoplasias reportadas.18 Su presentación es igual en ambos géneros, y se asocia hasta en un 51% a cirrosis hepática y en 56% a enfermedad hepática crónica (hepatitis B, C).19,20
El hepatocarcinoma es un tumor vascular que habitualmente se disemina vía el sistema venoso portal a tejidos adyacentes. Por estudios de necropsias, los pulmones han sido el sitio principal de metástasis extra–hepáticas, seguidos por ganglios linfáticos, órganos intraperitoneales, peritoneo, glándulas suprarrenales, hueso y cerebro.21 Cualquier neoplasia puede invadir al corazón o estructuras adyacentes. En pacientes con neoplasias generalizadas, el involucro cardíaco es menor al 20%.7,8 Se ha estimado que los tumores metastásicos del corazón son 20 a 40 veces más frecuentes que los tumores primarios del mismo.3,4,7,8 Las metástasis al VD pueden provenir de neoplasias del tubo digestivo,9 siendo el intestino grueso de los más frecuentes, aunque cualquier estructura pélvico–abdominal puede ser el origen. La presentación de metástasis de un hepatocarcinoma que obstruye el tracto de salida del VD como presentación única, es aún más infrecuente; existen reportados 7 casos con esta característica.12–17 La diseminación neoplásica puede ser por vía hematógena, linfática, y por contigüidad.3 Se ha descrito la invasión metastásica al corazón a través de la vena cava y la aurícula derecha por el hepatocarcinoma, el cáncer renal y el de ovario, sin embargo, la invasión limitada al VD es muy infrecuente.9–17El VD recibe el drenaje venoso y linfático sistémico, por lo tanto puede ser asiento de metástasis, lo que podría explicar las metástasis en las cavidades derechas del corazón.3,5 Sin embargo, el porqué una metástasis puede ser única al VD no está del todo claro. Recientemente con el análisis de los genes que se encuentran activados en las células tumorales se podría predecir si el hepatocarcinoma celular va a derivar o no en metástasis, esto debido a que se han identificado los genes presentes en las células de los hepatocarcinomas y sus metástasis. Se ha comprobado que los genes que se expresaron en estas metástasis eran idénticos a los que se encontraban en el tumor original, a diferencia de los que no se extendían a otros tejidos. El gen cuya acción originó la metástasis se conoce como osteopontin, produce una proteína que al estar elevada, favorecería la invasión del cáncer a otros tejidos.22 En nuestro caso, por estudios de gabinete no se comprobó la diseminación por la vena cava inferior o la aurícula derecha (contigüidad), lo que hizo pensar en las otras posibilidades.
La pobreza de síntomas y signos y el antecedente de carcinoma hepatocelular previo, motivó que se hiciera una evaluación extensa del paciente, en cuanto a condiciones generales, diversos estudios para valorar la posibilidad de enfermedad hepática crónica, de trombos en miembros inferiores y/o pulmonares y la posible actividad tumoral en el sitio primario o a otro nivel. Finalmente, una vez localizada y limitada al VD, la neoformación fue estudiada en cuanto a sus características, como la presencia o no de vascularidad, grado de obstrucción, posibilidad quirúrgica para aliviar la obstrucción.
Por lo tanto, la importancia del presente caso clínico reside, en que el paciente primero desarrolla un hepatocarcinoma sin tener factores de riesgo conocidos; en la rareza de la metástasis aislada al VD que al causar obstrucción contribuyó a la hipertensión ventricular derecha y en el pronóstico que dependió no sólo de la estirpe histológica de la neoplasia primaria, sino también de la obstrucción mecánica.
En la presentación clínica se consideró que el desarrollo de la enfermedad habitualmente es de tipo insidioso, paulatino y progresivo, y comparten como antecedente, el habérseles detectado y tratado en la mayoría de los casos, una neoplasia. Misma que en las más de las veces, no es posible detectar neoformación o reactivación en el sitio primario, y la única evidencia pareciera estar relacionada a efectos residuales, como en nuestro caso, que presentó ligera alteración de las pruebas hepáticas.
El síndrome de hipertensión venosa sistémica y la disnea pueden ser el denominador común a estos pacientes, debido al compromiso hemodinámico de la obstrucción del tracto de salida del VD, no obstante en 4 de los 14 pacientes de la serie de Labib et al,9 se diagnosticaron hasta la cirugía o la autopsia. En nuestro paciente, la presencia de soplo sistólico en la exploración del área cardíaca nos hizo pensar en diversas causas, sin embargo, en el contexto de un paciente con estas características, sugirió la posibilidad de compromiso tricuspídeo y/o de obstrucción del tracto de salida del VD.
No obstante el estrecho seguimiento que tuvo el paciente, se pudo definir la masa intra–ventricular derecha hasta que dio manifestaciones clínicas de compromiso del VD, lo que obligó a hacer la búsqueda intencionada de la causa, debido a que pocos son los estudios que en la actualidad nos pueden dar la certeza diagnóstica al 100%. De los estudios no invasivos para detectar la neoformación intra–ventricular y su compromiso fueron, el ECG, la Ecocardiografia y la TAC, y de los estudios invasivos, la coronariografía fue la que brindó información importante y adicional, al delimitar la tumoración y demostrar su vascularidad (Fig. 6). Los trastornos en el ECG, tales como el eje de ÁQRS desviado a la derecha, crecimiento y dilatación ventricular derecha, además de trastornos de la conducción como el bloqueo de grado intermedio de la rama derecha del haz de His han sido comunes en pacientes con obstrucción del tracto de salida del VD9 de origen tumoral, y por ser inespecíficos, inducen a pensar como primera posibilidad en otras enfermedades productoras de hipertensión ventricular derecha que ocurren de manera frecuente, como en la enfermedad pulmonar obstructiva crónica, la tromboembolia pulmonar, o bien, en la hipertensión arterial pulmonar primaria.1,23 La determinación de la alfa fetoproteína sérica tiene una sensibilidad del 85–90%, y una especificidad del 70–80%,24 luego entonces podemos tener pruebas falsas–negativas. El 10–15%de los hepatocarcinomas no tienen elevada la alfa fetoproteína sérica, aun en estadios avanzados de la enfermedad,24 lo que puede limitar el diagnóstico y el seguimiento de estos pacientes con marcadores tumorales.
El ecocardiograma16 transtorácico, el intra–esofágico, y la modalidad Doppler, son métodos seguros de realizar, que además han demostrado su utilidad para el diagnóstico de trombos y neoplasias intra–cardíacas, la evaluación de la dinámica de flujos intra–cardíacos, el patrón sugestivo de infiltración de estructuras o la extensión a otras cavidades como sucedió en el caso presentado. La evaluación de la tumoración por TAC complementa el análisis de estas neoplasias, sobre todo cuando la detección depende del tamaño de la masa, en nuestro caso de 7 cm de longitud y 4.4 cm de diámetro (Fig. 5). En la actualidad la resonancia magnética nuclear permite una evaluación morfológica más detallada, que desafortunadamente en nuestro caso no se hizo.
Se le realizó cateterismo derecho e izquierdo con toma de biopsia y coronariografía, sin complicaciones. Se encontró hipertensión ventricular severa con la presión sistólica del VD en 71 mm Hg. En la serie de Labib et al,9 la presión sistólica del VD reportada en 2 casos fue de 70 y de 60 mm Hg, con una presión final diastólica de 13 y 16 mm Hg respectivamente, en 4 no se determinó y de los 8 restantes el gradiente VD–arteria pulmonar mínimo encontrado fue de 24 mm Hg y el máximo de 60 mm Hg. En nuestro caso el gradiente fue de 42 mm Hg. Además, se ha reportado deterioro hemodinámico durante el cateterismo y la inyección de contraste en el ventrículo derecho en este tipo de pacientes, debido al incremento de la presión intra–cavitaria. De los casos revisados, 3 presentaron inestabilidad hemodinámica y dos de ellos fallecieron por este motivo. Dicha eventualidad hace del estudio hemodinámico o de la colocación de un catéter de flotación en la arteria pulmonar, un procedimiento con un riesgo extra, y lo limita a casos donde el diagnóstico no es sustentado por otros métodos.
El pronóstico del hepatocarcinoma al momento del diagnóstico puede depender del tamaño del tumor. Si el tumor no es resecable, la sobrevida del paciente a 5 años es nula, y si su tamaño es < 3 cm, la sobrevida a 5 años se reduce al 50%.24 De los 23 casos reportados9–17 con obstrucción del tracto de salida del VD por neoplasias diversas, sólo en 7 casos fueron llevados a resección quirúrgica de la obstrucción, 5 de ellos fallecieron. De los siete casos reportados con metástasis al VD secundario a hepatocarcinoma,12–15 3 fueron llevados a cirugía para liberación de la obstrucción con buenos resultados, a uno más se le realizó resección parcial de la obstrucción y falleció por insuficiencia hepática,15 a uno se le realizó quimio–embolización transcoronaria exitosa y los 2 restantes fallecieron por la aparente repercusión funcional de las metástasis de la neoplasia primaria. Kotani et al,17 han informado del tratamiento exitoso mediante quimio–embolización transcoronaria de una metástasis vascularizada del VD, cuyo origen fue un hepatocarcinoma. El gradiente disminuyó significativamente después del procedimiento. La quimio–embolización transcoronaria, puede ser un procedimiento alternativo al quirúrgico para el tratamiento de las metástasis vascularizadas de hepatocarcinomas, que están implantadas no sólo en el VD, sino también en la aurícula derecha.25 En nuestro paciente, a pesar de que se le ofreció procedimiento quirúrgico paliativo para liberar la obstrucción del tracto de salida del VD y tomando en cuenta la mortalidad del procedimiento, éste fue rechazado por el paciente. En México es posible realizarla quimio–embolización transcoronaria dado que se cuenta con laboratorios de hemodinámica con experiencia, específicamente el del Instituto Nacional de Cardiología "Ignacio Chávez"; la relativa limitación para este procedimiento en nuestro medio es la disponibilidad del fármaco anti–canceroso (ácido estirenomaleico conjugado a neocarzinostatina) y a que su uso se ha reportado sólo en 2 casos.17,25
La evolución del paciente fue hacia el deterioro hemodinámico, falleciendo a los 6 meses del diagnóstico.
Se requieren mayores estudios para poder hacer conclusiones adecuadas, sin embargo, la limitada muestra que existe en el mundo, lo impide.
Referencias
1. Sandoval Zarate J, Gómez González A, Martínez Guerra ML, Cueto G, Gamboa F, Yurico Furuya ME: La Hipertensión Pulmonar en las Cardiopatías y en las Neumopatías. Neumol Cir Tórax 1992; 3: 21–47. [ Links ]
2. Santos Martínez LE, Gómez González A, Infante Vázquez O, Flores P, Tena C, Pulido T, et al: Desarrollo de un modelo canino de hipertensión ventricular derecha crónica progresiva. Arch Inst Cardiol Méx 2001; 71: 266–277. [ Links ]
3. Abad C: Tumores Cardíacos (II). Tumores Primitivos Malignos. Tumores Metastásicos. Tumor Carcinoide. Rev Esp Cardiol 1998; 51: 103–114. [ Links ]
4. Young JM, Goldman IR: Tumor Metastasis to the Heart. Circulation 1954; 9: 220–229. [ Links ]
5. Prichard RW: Tumors of the Heart. Review of the subject and report of one hundred and fifty cases. Arch Pathol 1951; 51: 98–128. [ Links ]
6. DeLoach JF, Haynes JW: Secondary Tumors of Heart and Pericardium. Review of the subject and report of one hundred thirty–seven cases. Arch Intern Med 1953; 91: 224–249. [ Links ]
7. Abraham KP, Reddy V, Gattuso P: Neoplasms Metastatic to the Heart: review of 3,314 consecutive autopsies. Am J Cardiol 1990; 3: 195–198. [ Links ]
8. Klatt EC, Heitz DR: Cardiac metastases. Cancer 1990; 65: 1456–59. [ Links ]
9. Labib SB, Schick EC, Isner JM: Obstruction of Right Ventricular Outflow Tract Caused by Intracavitary Metastatic Disease: Analysis of 14 Cases. J Am Coll Cardiol 1992; 19: 1664–1668. [ Links ]
10. Senzaki H, Uemura Y, Yamamoto D, Kiyozuka Y, Ueda S, Isumi H, Tsubura A: Right intraventricular metastasis of squamous cell carcinoma of the uterine cervix: An autopsy case and literature review. Pathology International 1999; 49: 447–452. [ Links ]
11. Ewald FW, Scherff AH: A 60–Year–Old Man with a Malignant Tumor of the Upper Airway and Unexplained Respiratory Failure. Chest 1997; 111:239–241. [ Links ]
12. Marakawa T, Takamoto S, Ezure M, Ono M, Kawauchi M, Tanaka O: Metastatic Hepatocellular carcinoma obstructing the right ventricular outflow tract. Jpn J Thorac Cardiovasc Surg 2000; 48: 516–519. [ Links ]
13. Lei MH, Ko YL, Lien WP, Chen DS: Metastasis of Hepatocellular Carcinoma to the Heart: Unusual Patterns in Three Cases with Antemortem Diagnosis. J Formos Med Assoc 1992, 91: 457–461. [ Links ]
14. Yu Lin T,Ming Chiu K, Yen Chien Ch, Jiuh Wang M, Hsun Chu S: Unusual sites of metastatic involvement. J Clin Oncol 2004; 22: 1152–1153. [ Links ]
15. Masci G, Magagnoli M, Grimaldi A, Covini G, Carnaghi C, Rimassa L, et al: Metastasis of hepatocellular carcinoma to the heart: a case report and review of the literature. Tumori 2004; 90: 345–7. [ Links ]
16. Steffens, MA, Mayer HS, Das SK: Echocardiographic Diagnosis of a Right Ventricular Metastatic Tumor. Arch Intern Med 1980; 140: 122–123. [ Links ]
17. Kotani E, Kiuchi K, Takayama M, Takano T, Tabata M, Aramaki T, et al: Effectiveness of Transcoronary Chemoembolization for Metastatic Right Ventricular Tumor Derived from Hepatocellular Carcinoma. Chest 2000; 117: 289–291. [ Links ]
18. Registro Histopatológico de Neoplasias en México: Secretaría de Salud y Asistencia; 1993–1996. [ Links ]
19. Mondragón Sánchez R, Ochoa Carrillo FJ, Ruiz Molina JM, Herrera Goepfer R, Oñate Ocaña LF, Crocifoglio VA: Carcinoma hepatocelular. Experiencia en el Instituto Nacional de Cancerología. Rev Gastroenterol Méx 1997; 62: 34–40. [ Links ]
20. Hernández Castillo E, Mondragón Sánchez R, Garduño López AL, Gómez Gómez E, Ruiz Molina JM, Oñate Ocaña LF: Carcinoma hepatocelular en jóvenes: Un análisis comparativo con hepatocarcinoma en adultos. Rev Gastroenterol Méx 2003; 68: 94–99. [ Links ]
21. The Liver Cancer Study Group of Japan: Primary liver cancer in Japan. Ann Surg 1990; 211: 277–283. [ Links ]
22. Tang ZY, Ye SL, Liu YK, Qin LX, Sun HC, Ye QH, et al: A decade's studies on metastasis of hepatocellular carcinoma. J Cancer Res Clin Oncol 2004; 130: 187–196. [ Links ]
23. Gómez González A, Sandoval Zarate J, Martínez Guerra ML, Cueto G, Gamboa F, Yurico Furuya ME: La función ventricular en el neumópata. Neumol Cir Tórax 1992; 3: 21–47. [ Links ]
24. Regan LS: Screening for Hepatocellular Carcinoma in High–Risk individuals. A Clinical Review. Arch Intern Med 1989; 149: 1741–1744. [ Links ]
25. Dazai Y, Katoh T, Sueda S, Yoshida R: Effectiveness of chemoembolization therapy for metastatic right atrial tumor thrombus associated with Hepatocellular carcinoma. Chest 1989; 96: 434–436. [ Links ]














