Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 no.2 Ciudad de México abr. 2005
Investigación clínica
Correlación anatomo–ecocardiográfica del síndrome de cimitarra en el adulto y comentario embriológico
Anatomo–echocardiographic correlation of Scimitar Syndrome in adults
Nilda Espínola–Zavaleta,* Luis Muñoz–Castellanos,** Silvio Játiva–Chávez,*** Carlos Zamora–González****
* Médico adscrito ECO–CE.
**Jefe de Dpto. Embriología.
*** Médico residente
**** Médico adscrito CE Pediátrico.
Correspondencia:
Nilda Espinóla Zavaleta.
Consulta Externa. Instituto Nacional de Cardiología "Ignacio Chávez"
(INCICH, Juan Badiano No. 1, Col. Sección XVI, Tlalpan
14080 México, D.F.).
Teléfono 55732911 – Ext. 1196, Fax–55730994,
Correo electrónico: niesza2001@hotmail.com
Recibido: 1 de abril de 2005
Aceptado: 23 de mayo de 2005
Resumen
Estudio retrospectivo de 7 pacientes adultos con síndrome de cimitarra mediante examen clínico y ecocardiográfico, este último se correlacionó con un espécimen anatómico equivalente. Los resultados fueron: Infección respiratoria y disnea de medianos esfuerzos en el 90%, signo de Cimitarra en 4 (57%), comunicación interatrial en 5 (71 %), uno de ellos con persistencia de conducto arterioso; dos (28.6%) sólo con persistencia de conducto arterioso, dextrocardia en 5 (71%), dilatación de cavidades derechas en 5 (71%) y borde romo en 6 (85.7%). En 2 el colector drenó a la porción baja de la aurícula derecha, en tres a la unión del atrio derecho con la vena cava inferior y en 2 a la vena cava inferior a través de un colector. Seis fueron a cirugía. La correlación mostró concordancia entre la imagen ecocardiográfica y el espécimen anatómico. El síndrome de la Cimitarra es raro, su diagnóstico y seguimiento se puede realizar mediante ecocardiografía en un alto porcentaje (86%). Se resalta la base embriológica de este síndrome.
Palabras clave: Síndrome de la cimitarra. Correlación anatomo–ecocardiográfica. Embriología.
Summary
It is a retrospective study of 7 patients with clinical and echocardiographic assessment, the last was correlated with morphologic features of one equivalent anatomic specimen. The results are: respiratory infections and dyspnea in 90% of cases, scimitar sign in four (57%), interatrial septal defect in five (71%), one of them with patent ductus arteriosus, two (28.6%) only with patent ductus arteriosus. Dextrocardia was found in 5 (71 %), dilation of the right cavities in 5 (71%) and blunt edge in 6 (85.7%). In two the colector drained into the right atrium, in one to the junction of the right atrium and inferiorvena cava and in the other three into the inferior vena cava through the colector. Six patients with cardiac abnormalities went to surgery. The correlation shows agreement between the echocardiographic image and the anatomic specimen. Scimitar syndrome is a rare entity, which diagnosis and follow up can be performed by echocardiography in a great percentage (86%). The embryologic basis of this syndrome is enhanced. (Arch Cardiol Mex 2005; 75: 165–169).
Keywords: Scimitar syndrome. Anatomo–echocardiographic correlation. Embryology.
Introducción
El síndrome de la cimitarra es una entidad cuya incidencia es baja, en el Instituto Nacional de Cardiología la incidencia en la población adulta con cardiopatías congénitas es de 0.39%. Este síndrome se caracteriza por presentar conexión anómala de las venas pulmonares derechas a la porción suprahepática de la vena cava inferior o al atrio derecho por encima de la desembocadura de esta vena; incluye dextroposición del corazón debido a dextrorrotación, hipoplasia del pulmón derecho, hipoplasia de la arteria pulmonar derecha, anomalías sistémicas de la irrigación arterial al pulmón derecho (arterias colaterales aortopulmonares que pueden provocar un cortocircuito de izquierda a derecha), secuestro broncopulmonar con agenesia de bronquio derecho superior o medio y otras anomalías. El 25% de los pacientes presentan malformaciones cardíacas siendo la más frecuente la comunicación interatrial.1–4
El diagnóstico de primera intención se hace por la imagen radiográfica. La ecocardiografía permite identificar el trayecto del drenaje anómalo de las venas pulmonares derechas hacia el colector curvo, la presencia de obstrucciones y el sitio de conexión en la porción suprahe–pática de la vena cava inferior. La técnica transtoracica tiene limitaciones diagnósticas hasta en el 33% de los casos, de ahí la importancia de complementarla con un estudio transesofágico.5,6
Los objetivos de esta publicación son: a) comunicar el comportamiento clínico y ecocardiográfico de siete pacientes adultos con síndrome de cimitarra estudiados de enero de 1985 a junio del 2004, b) mostrar la utilidad diagnóstica de la correlación anatomo–ecocardiográfica y c) proponer una explicación embriológica sobre el origen de este síndrome.
Material y métodos
Se estudiaron retrospectivamente siete pacientes del sexo femenino con diagnóstico de Síndrome de Cimitarra de la clínica de cardiopatías congénitas del adulto. A todos los pacientes se les realizó historia clínica completa, radiografía de tórax, ecocardiograma transtorácico y transesofágico y cateterismo cardíaco izquierdo y derecho. A dos se les practicó tomografía computarizada y a tres resonancia magnética.
El estudio ecocardiográfico se realizó con equipos Philips sonos 1000 y 5500 con sonda transtorácica de 2.5 mHz y transesofágica biplanar y multiplanar. Para el análisis ecocardiográfico se utilizaron las guías específicas y no específicas descritas previamente.4,6 En el corte paraesternal a nivel de ambas arterias se determinó el diámetro de la arteria pulmonar y de sus ramas. Se utilizaron cortes transtorácicos apical y subcostal de cuatro cámaras para valorar con modo bidimensional las características del defecto septalinteratrial, la conexión de las venas pulmonares, el drenaje de la vena cava inferior, la presencia de obstrucción en el colector venoso, la dilatación de cavidades derechas y la detección de colaterales aortopulmonares. Con Doppler color y continuo en un corte apical de cuatro cámaras, se colocó la muestra de volumen a nivel de las valvas tricuspídeas, se determinó el gradiente de presión entre el atrio y el ventrículo derechos por el método de Bernoulli y se multiplicó por el factor de corrección de 1.23 para obtener la presión sistólica de la arteria pulmonar.
Mediante la técnica transesofágica de cuatro cámaras se valoró el tamaño y la localización del defecto septal interatrial, la forma de conexión de las venas pulmonares y la repercusión a cavidades derechas, en el corte longitudinal a 70° se midió el diámetro de la arteria pulmonar y a 0º el de las ramas pulmonares. Se consideró que la arteria pulmonar era hipoplásica cuando el diámetro de ésta fue menor de 18 mm y de las ramas cuando su diámetro fue inferior a 10 mm.6 En la correlación anatomo–ecocardiográfica se compararon las imágenes de los estudios con los rasgos anatómicos de un espécimen equivalente para mostrar la precisión diagnóstica imagenológica.
Resultados
La sintomatología más frecuente fue la respiratoria (tos crónica, disminución de tolerancia al ejercicio e infección recurrente de vías respiratorias) y la progresión de disnea de grandes a medianos esfuerzos en el 90% de los casos. La radiografía de tórax mostró signo de cimitarra en cuatro de ellos (57%).
El estudio ecocardiográfico transtorácico permitió hacer el diagnóstico en el 41% de los casos y con el ecocardiograma transesofágico se incrementó el porcentaje de diagnóstico hasta el 86%; las anomalías cardíacas asociadas fueron: comunicación interatrial en 5 (71%), uno de ellos con persistencia de conducto arterioso, dos sólo con persistencia de conducto arterioso.
Se encontró dextrocardia en 5 pacientes, dilatación de cavidades derechas e hipoplasia de la arteria pulmonar y sus ramas en 5 y presencia de borde romo (ausencia de venas pulmonares derechas en la aurícula izquierda) en 6 pacientes. La conexión venosa pulmonar fue a la porción baja del atrio derecho en dos, en tres a la unión del atrio derecho con la vena cava inferior y en dos a la vena cava inferior a través de un colector, tres pacientes tuvieron estrechamiento del colector a nivel de la desembocadura de la vena cava inferior (Figs. 1A, B, C y D).
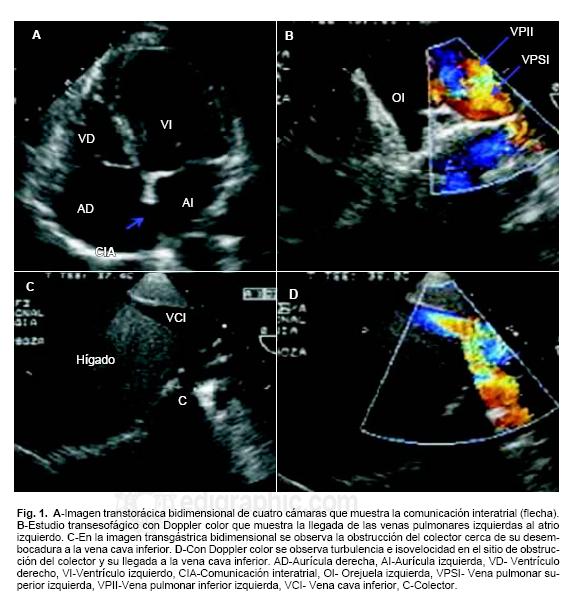
El diagnóstico ecocardiográfico tuvo alta concordancia con los hallazgos obtenidos por cateterismo cardíaco; este último permitió valorar la circulación colateral aortopulmonar observada en un caso. La correlación anatomo–ecocardiográfica mostró la correspondencia entre los hallazgos ecocardiográficos y anatómicos en lo que respecta a la ausencia de conexión de las venas pulmonares derechas con el atrio izquierdo, la comunicación interauricular, el trayecto del colector curvo, su desembocadura a la porción suprahepática de la vena cava inferior, la presencia de hipoplasia y secuestro del pulmón derecho y la arteria colateral aortopulmonar (Fig. 2). Seis pacientes fueron llevados a cirugía para corrección de la anomalía cardíaca asociada y reimplante de las venas pulmonares, sólo en uno de éstos el reimplante se efectuó en un segundo tiempo. El paciente restante con comunicación interatrial pequeña y sin hipertensión arterial pulmonar no fue operado, ya que se encontró en clase funcional I. Los pacientes que fueron operados están en clase funcional I.

Discusión
En el desarrollo temprano el seno venoso pulmonar se comunica por pequeños canales con las venas sistémicas del embrión. Este drenaje primitivo desaparece cuando la vena pulmonar común del atrio izquierdo se conecta con dicho seno.7,8 La agenesia de esta vena condiciona la persistencia de los primeros canales lo que origina los diferentes tipos de conexión anómala. En el síndrome de la cimitarra el seno venoso pulmonar presenta doble conexión, del lado izquierdo con el atrio izquierdo y del lado derecho con el segmento suprahepatico de la vena cava inferior derivado de la vena vitelina derecha del embrión; esto favorece la separación del seno venoso pulmonar en dos porciones, la izquierda se integra al atrio izquierdo y la derecha se continúa con el colector curvo (Fig. 3).

La desembocadura de las venas pulmonares derechas a nivel infradiafragmático ya sea a la vena porta o a la vena cava inferior son tipos que se apartan del síndrome de la cimitarra. La conexión venosa pulmonar anómala parcial al atrio derecho sin colector curvo y sin hipoplasia pulmonar derecha debe excluirse del síndrome de la cimitarra.
Este síndrome se clasifica entres grupos de acuerdo con la edad de los pacientes como se ha referido en un estudio multicéntrico de 122 pacientes con edades entre 1 y 58 años. El grupo I es la forma adulta sin hipertensión arterial pulmonar (HAP) y con comunicación interatrial pequeña mejor tolerado como lo observamos en uno de nuestros pacientes, el grupo II tiene anormalidades congénitas complejas que modifican la sintomatología y la historia natural de este síndrome; a este grupo pertenecen los 6 pacientes restantes. El grupo III es el infantil caracterizado por HAP severa y pobre pronóstico.2,4,5,9 Los síntomas más comunes presentes en todos nuestros pacientes fueron respiratorios y disnea progresiva.4,5,10
En algunos casos el signo radiográfico de la cimitarra no se observa por la dextrorrotación cardíaca o porque el colector venoso no es curvo ni ancho sino más bien recto, delgado o múltiple. Este signo se presenta en un 70%, debido a que generalmente la hipoplasia del pulmón derecho está ausente en adultos.1,2
El diagnóstico ecocardiográfico tuvo una buena correlación con el cateterismo cardíaco. La ecocardiografía transtorácica tiene más valor en niños con este síndrome; en los adultos se debe complementar el diagnóstico con ecocardiograma transesofágico para valorar las estructuras posteriores como el septum interatrial, el tamaño, número, morfología y localización de los defectos y la conexión de las venas pulmonares que no pueden ser bien valoradas por la técnica transtorácica. La ecocardiografía transesofágica también es útil para detectar las obstrucciones de los tubos colocados para el reimplante como sucedió en uno de los casos estudiados que se corroboró por resonancia magnética.2,4,6,9
Es muy importante determinar los niveles de la conexión supradiafragmática para un mejor manejo quirúrgico. Una alternativa quirúrgica podría ser el reimplante del colector a la pared posterior del atrio izquierdo sin circulación extracorpórea, como lo realizaron Brown y colaboradores.5,10,11
Conclusiones
En base a nuestro estudio concluimos que el síndrome de cimitarra es raro, cuyo diagnóstico se realiza en la mayoría de los casos mediante ecocardiografía. Con el desarrollo de técnicas no invasivas12,13 sólo en algunos casos el diagnóstico se complementa con cateterismo cardíaco.
La correlación anatomo–ecocardiográfica es de gran utilidad porque muestra la correspondencia entre el rasgo anatómico y su imagen diagnóstica lo que confiere un grado de precisión al diagnóstico ecocardiográfico que es fundamental para la decisión quirúrgica.
Referencias
1. Mohamed T, Idris, FRCP: Diagnostic Aid of Transesophageal Echocardiography in an Adult Case of Scimitar Syndrome: Confirmation of the Findings at Surgery and Review of the literature. J Am Soc Echocardiogr 1998; 11: 387–392. [ Links ]
2. Geggel RL: Scimitar Syndrome associated with partial anomalous pulmonary venous connection at the supracardiac, cardiac and infracardiac levels. Pediatr Cardiol 1993; 14: 234–237. [ Links ]
3. Mardini MK, Sakati HA, Lewall DB, Cristie R, Nyhan WL: Scimitar syndrome. Clin Pediatr 1982; 21: 350–354. [ Links ]
4. Dupuis C, Charaf LAC, Breviere GM, Abou P, Remy–Jardín M, Helmius G: The "Adult" Form of the Scimitar Syndrome. Am J Cardiol 1992; 70: 502–507. [ Links ]
5. Salazar J: Scimitar Syndrome: Five cases examined with Two–Dimensional and Doppler Echocardiography. Pediatr Cardiol 1995; 6: 283–86. [ Links ]
6. Shibuya K, Smallhorn JE, McCrindle BW: Echocardiographic Clues and Accuracy in the Diagnosis of Scimitar Syndrome. J Am Soc Echocardiogr 1996; 9: 174–181. [ Links ]
7. Auer J: Development of the pulmonary vein and its mayor variations. Anat Rec 1948; 101: 851–95. [ Links ]
8. Van Praagh R, Corsini I. Cor Triatriatum: Pathologic anatomy and a consideration of morphogenesis based on 13 postmortem cases and a study of normal development of the pulmonary vein and atrial septum in 83 human embryos. Am Heart J 1969; 78: 397–405. [ Links ]
9. Depuis C, Charaf L, Breviere GM, Abou P: "Infantile" form of the scimitar syndrome with pulmonary hypertension. Am J Cardiol 1993; 71: 1326–1330. [ Links ]
10. Cobanoglu A, Hanlon JT, Combs DT, Starr A: Combined intracardiac and extracardiac repair of scimitar syndrome with anomalous pulmonary veins to both cavae. J Thorac Cardiovasc Surg 1984; 88: 142–149. [ Links ]
11. Brown JW, Ruzmetov M, Minnich D, Vijay P, Edwards CA, Uhlig PN, et al: Surgical management of scimitar syndrome: An alternative approach. J Thorac Cardiovasc Surg 2003; 125: 238–245. [ Links ]
12. Inoue T, Ichihara M, Uchida T, Sakai Y: Three–Dimensional computed tomography showing partial pulmonary venous connection complicated by the Scimitar Syndrome. Circulation 2002; 105(5): 663. [ Links ]
13. Rose C, Vosshenrich R: Incomplete Scimitar Syndrome. Cardiol Young 2002: 12; 389–390. [ Links ]














