Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 n.1 Ciudad de México Jan./Mar. 2005
Investigación clínica
Estimación del estrés parietal sistólico del ventrículo izquierdo por imagen de resonancia magnética: Una nueva aproximación al estudio de la poscarga
Estimation of the systolic parietal stress of the left ventricle by magnetic resonance imaging. A new approach to the study of the overload
José Ramón Cué Carpio,* Aloha Meave,** José Fernando Guadalajara Boo***
* Médico Residente en Cardiología. INCICH.
** Jefe del Servicio de Resonancia Magnética. INCICH.
*** Director de Enseñanza. INCICH.
Correspondencia:
Dr. José Ramón Cué Carpió
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH, Juan Badiano No. 1 Col. Sección XVI, Tlalpan 14080 México, D.F.).
Recibido: 3 de febrero de 2005
Aceptado: 10 de febrero de 2005
Resumen
Objetivo: Determinar el estrés meridional parietal sistólico del ventrículo izquierdo por imagen de resonancia magnética en sujetos sanos.
Material y métodos: Se estudiaron 21 sujetos sanos: 11 pertenecían al sexo masculino y 10 al femenino: su edad varió entre 26 y 31 años (29.33). Se les realizó el estudio de resonancia magnética de corazón utilizando el eje corto a nivel de los músculos papilares, de donde se obtuvieron las áreas epicárdicas y endocárdicas de la cavidad ventricular izquierda tanto en diastole como en sístole mediante el trazado con un lápiz electrónico, posteriormente se calculó el radio de cada área trazada, con el valor del radio, se calculó el espesor diastólico y sistólico; para posteriormente obtener la relación grosor/radio. Ya obtenida la relación grosor/radio tanto en diastole como sístole se calculó el grado de cambio entre ambos valores y el porcentaje de dicho cambio. Finalmente se calculó el estrés meridional parietal sistólico desarrollado por el ventrículo izquierdo mediante la siguiente fórmula: S=PVI x A4/A3–A4 x 1.35. PVI: presión sistólica del ventrículo izquierdo (promedio de 5 tomas simultáneas de presión arterial sistólica, obtenidas mediante esfingomanómetro). A4: área endocárdica en sístole; A3: área epicárdica en sístole. El valor obtenido en esta ecuación se multiplicó por 1.35 para convertir mmHg en gm/cm2.
Resultados: La presión arterial sistólica media fue de 103.24 ± 10.27 mmHg; A3 (media 27.58 ± 2.29); A4 (media 6.84 ± 0.71); siendo el estrés meridional sistólico del ventrículo izquierdo de 46.12 ± 4.9 gm/cm2, no existiendo diferencias significativas en cuanto al sexo.
Conclusiones: Con este nuevo método es posible determinar con mayor exactitud de manera no invasiva, a través de la mejor definición de sus bordes epicárdicos y endocárdicos, las áreas y los radios de la cavidad ventricular izquierda tanto en sístole como en diastole, determinar el grosor de la pared y su relación con el radio, esto para una mejor valoración de la función ventricular, en especial en los sujetos con sobrecargas de presión o de volumen que deprimen la función ventricular.
Palabras clave: Estrés parietal. Resonancia magnética. Presión intraventricular. Área. Radio. Grosor.
Summary
Objective: To determine the systolic parietal stress of the left ventricle by image of magnetic resonance in healthy subjects.
Material and methods: 21 healthy subjects studied: 11 male and 10 female: the ages among 26 and 31 years (29.33). A magnetic resonance of heart was made using the short axis at the level of the papillary muscles, from where the epicardio and endocardio areas of the left ventricular cavity were obtained in diastolic as in systolic by means of the layout with an electronic pencil, later the radius of each drawn up area was calculated, with the value of the radius, the diastolic and systolic thickness was calculated; to obtain the relation between thickness/radio. Once the relation was obtained between thickness/radio in diastole as systole the degree of change between both values and the percentage of this change was calculated. Finally, the systolic parietal stress developed by the left ventricle was calculate with the following formula: S=PVI x A4/A3–A4 x 1.35.PVI: systolic pressure of the left ventricle (the average of 5 synchronized systolic arterial pressures, obtained by an esphingomanometer). A4: endocardio area in systole; A3: epicardial area in systole. The value obtained in this equation was multiplied per 1.35 to turn mmHg gm/cm2.
Results: The average of the arterial systolic pressure was of 103.24 ± 10.27 mmHg; A3 (average 27.58 ± 2.29); A4 (average 6.84 ± 0.71); being the systolic stress of the left ventricle of 46.12 ± 4.9 gm/cm2, not existing significant differences between sexes.
Conclusions: With this new method it is possible to determine with greater exactitude in a noninvasive way, through the best definition of its epicardio and endocardic edges, the areas and the radio of the left ventricular cavity in systole as in diastole, to determine the thickness of the wall and its relation with the radius, for one better valuation of the ventricular function, specially in those subjects with overloads of volume or pressure that depress the ventricular function.
Key words: Wall stress. Magnetic resonance. Intraventricular presión. Area. Radius. Thickness.
Introducción
El estrés de la pared del ventrículo izquierdo es un importante determinante de la función ventricular del consumo miocárdico de oxígeno y un modulador de hipertrofia ventricular ante las condiciones de sobrecarga anormal en el corazón. El entendimiento cabal de la postcarga, tiene implicaciones diagnósticas, pronosticas y terapéuticas que son fundamentales en la toma de decisión para el paciente afectado por una cardiopatía.1–3
Normalmente desde el nacimiento el corazón va incrementando el diámetro de sus cavidades y el espesor de sus paredes; en forma proporcional así, el crecimiento del corazón se hace a expensas de un aumento de su radio (volumen) interno y en forma concomitante del espesor de las paredes del corazón (hipertrofia fisiológica); sin embargo, la relación entre el espesor de la pared y el radio de la cavidad en diastole (h/r) permanece constante. Este comportamiento fisiológico permite que el funcionamiento del corazón sea eficiente sin aumento de la postcarga, y sin aumento del costo metabólico (MVO2) de la función; en efecto, de acuerdo con la ley de Laplace: el estrés es directamente proporcional a la presión intracavitaria y al radio de la misma, e inversamente proporcional al espesor de la pared (Fig. 1).

Es decir, al aplicar una fuerza a un área transversal se producirá una tensión determinada (la fuerza que separa las miofibrillas entre sí en centímetros), cuanto mayor sea el radio del ventrículo izquierdo, mayor será la tensión de la pared. A un radio dado, cuanto mayor sea la presión que se desarrolla en el interior del ventrículo izquierdo será también mayor la tensión de la pared. Por el contrario ante un radio y una presión determinada si incrementamos el espesor de la pared se equilibrará el grado de tensión sobre la pared. Cuando esta fuerza separa a las miofibrillas por área (cm2) se habla de estrés parietal. Debido a que las paredes del corazón tienen espesor, es que se cuantifica el estrés parietal y no la tensión.7–9 La geometría ventricular también influye en el grado del estrés parietal, es decir que para una estructura elipsoide, la relación entre el eje longitudinal y el transversal modificará el estrés, es decir, mientras más esférica sea dicha estructura, mayor será el estrés parietal. Durante la sístole el estrés parietal es la fuerza que tiene que vencer la miofibrilla para contraerse, acortarse, reducir el volumen ventricular y expulsar la sangre hacia los grandes vasos o sea representa la postcarga.
Lo anteriormente expuesto es de suma importancia para entender múltiples procesos tanto fisiológicos como patológicos de la función ventricular; por lo tanto el estrés parietal sistólico (postcarga) es uno de los principales determinantes del consumo miocárdico de oxígeno, pues cuanto más estrés exista será mayor el gasto energético. El aumento del estrés sistólico medio es determinante del consumo miocárdico de oxígeno (MVO2), mientras que el incremento del estrés sistólico máximo es uno de los mecanismos gatillo que genera hipertrofia miocárdica.10–13
A través de la Ley de Laplace entendemos las adaptaciones fisiológicas que sufre el miocardio con el fin de equilibrar las cargas tanto de presión como de volumen excesivas, generando hipertrofia (aumento del grosor de la pared). En la estenosis aórtica, el estrechamiento valvular se opone al vaciamiento del ventrículo izquierdo, generando un incremento de la presión intraventricular, lo que aumenta el estrés sistólico máximo de la pared, por lo que este estímulo genera hipertrofia compensadora del ventrículo izquierdo, lo que permite un incremento en el engrasamiento sistólico y una reducción concomitante del radio de la cavidad; ello, normaliza la postcarga (estrés sistólico) por lo que se mantiene una función ventricular normal a pesar que el corazón se contrae en contra de una presión sistolica mayor a la normal que aveces es excesiva.14–24
En la insuficiencia cardíaca congestiva, el corazón dilatado tiene un radio diastólico excesivo, en relación al espesor de la pared (disminución de la relación h/r). La hipertrofia inadecuada no logra normalizar el estrés sistólico por la ineficiente contracción miocárdica, lo cual aumenta la postcarga y reduce aún más la fracción de expulsión y aumenta el MVO2, y se constituye en un círculo vicioso (es decir a mayor postcarga menor función ventricular).25–30
Material y métodos
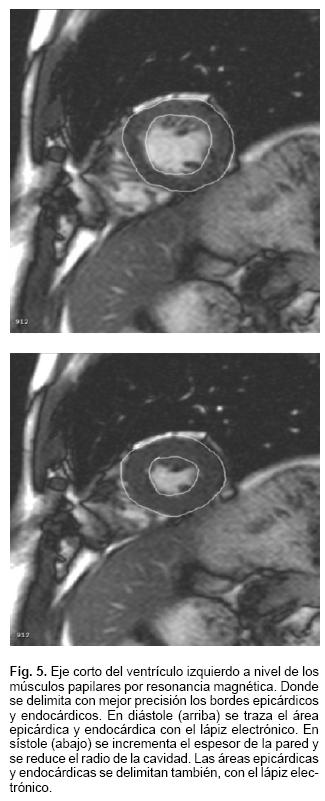
Se estudiaron prospectivamente 21 sujetos sanos: 11 sujetos pertenecían al sexo masculino y 10 al femenino: su edad varió entre 26 y 31 años (29.33). Se les practicó el estudio de resonancia magnética optimizado para corazón con un equipo SIEMENS Magnetom cerrado de 1.5 teslas, modelo Sonata. Se obtuvieron imágenes de corazón morfológico: el cual consta de cortes coronales, transversales y sagitales de la cavidad torácica, una vez localizando el corazón se realizó un cine en 4 cámaras (eje longitudinal) y ejes cortos desde la región apical hasta la base del corazón. En estos últimos se realizaron las mediciones en el eje corto a nivel de los músculos papilares.
Con el sujeto en reposo se obtuvieron 5 tomas de presión arterial consecutiva, utilizando un esfigmomanómetro mercurial y manguito estándar. En forma simultánea, se grabaron las imágenes por resonancia magnética en un disco compacto. Posteriormente estas imágenes se reprodujeron cuadro a cuadro en la computadora hasta alcanzar la onda Q del electrocardiograma simultáneo y en ese momento se trazó con el lápiz electrónico el área epicárdica (Al), expresada en cm2. De la misma manera se obtuvo el área endocárdica (A2), sin tomar en cuenta los músculos papilares. Se avanzó el cine cuadro a cuadro hasta alcanzar el vértice de la onda T del electrocardiograma simultáneo y se trazó el área epicárdica (A3) y el área endocárdica (A4) (Fig. 2). Esta operación se repitió entres latidos y los valores obtenidos fueron promediados. Se calculó el radio de cada área trazada mediante la siguiente fórmula:
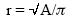
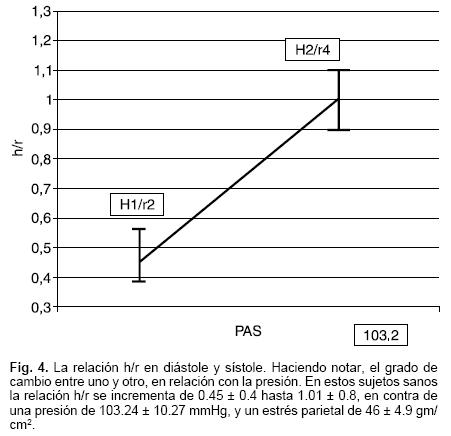
Con el valor del radio, se calculó el espesor diastólico de la pared ventricular: r1–r2 = H1 y se promedio el valor de 3 latidos. El valor de H1 se dividió entre el radio de la cavidad (r2) para conocer la relación grosor/radio (H/r) en diastole: H1/r2. El valor del espesor sistólico de la pared ventricular (H2) se obtuvo mediante la resta r3–r4 y se promedió el valor obtenido en 3 latidos. El valor de H2 = se dividió entre el radio sistólico de la cavidad (r4) para obtener la relación H/r en sístole (H2/r4) (Fig. 3) y se promedió el valor obtenido en 3 latidos.
Ya obtenida la relación grosor/radio en diastole y sístole se calculó el grado de cambio entre ambos valores (delta Δ H/r) mediante la siguiente fórmula (Fig. 4):

Asimismo se cuantificó el porcentaje de dicho cambio (%H/r):
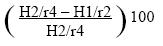
Finalmente se calculó el estrés meridional parietal sistólico desarrollado por el ventrículo izquierdo mediante la siguiente fórmula:

PVI: presión sistolica del ventrículo izquierdo (promedio de 5 tomas simultáneas de presión arterial sistolica, obtenidas mediante (esfignomanometría). A4: área endocárdica en sístole. A3: área epicárdica en sístole. El valor obtenido en esta ecuación se multiplicó por 1.35 para convertir mmHg en gm/cm2 (Fig. 5).
Resultados
En la Tabla I se anotan la edad, peso, talla, presión arterial sistolica, presión arterial diastólica y la fracción de expulsión del ventrículo izquierdo del grupo sujeto de estudio (Tabla I).
En la Tabla II se anotan el resto de las variables, con los resultados de estadísticas no paramétricas (Tabla II).
En la Tabla III se resumen los valores obtenidos en lo referente a las áreas epicárdicas (Al), y endocárdicas (A2), en diastole y en sístole (A3 y A4), así como el radio derivado de dichas áreas diastólicas (rl y r2) y sistólicas (r3 y r4) y los espesores diastólicos (h1) y sistólico (h2) obtenidos. En ella se demuestran la media y la desviación estándar de los sujetos estudiados divididos por sexo (Tabla III). Sin embargo, aun cuando las cifras absolutas de estas medidas son diferentes, la relación grosor de la pared (h1) y el radio de la cavidad (r2) en diastole (h1/r2), muestra valores similares en ambos grupos y ello también sucede cuando dicha relación se hace en sístole (h2/r4), cuando se analiza la delta de la relación h/r (Δ h/r) y el porcentaje de cambio en dicha relación (% h/r) en donde también es clara la similitud en los valores obtenidos en ambos grupos (Tabla IV).
En lo referente al estrés parietal sistólico del ventrículo izquierdo en relación al sexo el siguiente gráfico tampoco muestra diferencias significativas (Fig. 6).

Discusión
Previamente se discutió la importancia que tiene la relación del espesor de la pared con el radio de la cavidad en diastole (h1/r2), en el humano. En efecto, la relación entre los parámetros anotados y la presión intracavitaria, son los que determinan el grado de estrés a la que está sometida la pared ventricular (ley de Laplace) y ésta, a su vez, es una de los principales determinantes del consumo miocárdico de oxígeno (MVO2). En condiciones normales, la relación h/r se mantiene constante si la presión intracavitaria no cambia significativamente, con el objeto de que el corazón realice su función sistólica con el menor MVO2 posible, así, si por cualquier motivo se incrementara el radio de la cavidad (aumento del volumen diastólico), como sucede en atletas, o en el embarazo, el espesor de la pared también lo hace (hipertrofia fisiológica), con el fin de mantener constante la relación h/r, y con ello, el costo metabólico de cada contracción.30 En conclusión, la relación h/r en diastole, es una constante fundamental para el adecuado funcionamiento cardíaco, y por lo tanto, cuando ésta disminuye por debajo de los valores normales (el radio aumenta desproporcionalmente en relación con el aumento del espesor), aumenta el estrés parietal en diastole (aumento de la precarga) se constituye en hipertrofia inadecuada, (insuficiencia cardíaca, miocardiopatía dilatada) y por lo tanto, se deprime la contractilidad miocárdica al ser incapaz el corazón de normalizar la postcarga (estrés sistólico), debido a la relación inversa que estos parámetros guardan con el funcionamiento cardíaco.23,25
Por otro lado, la relación entre el engrasamiento máximo de la pared ventricular (h2), la reducción máxima del radio de la cavidad (r4) y la presión generada dentro de la cavidad ventricular (P) en sístole, es lo que finalmente condiciona el grado de estrés que desarrolla (S) el ventrículo izquierdo durante cada contracción, y ello es directamente proporcional a la carga sistólica o postcarga que se opone al vaciamiento del corazón hacia la circulación sistémica.
En este grupo de sujetos sanos, el estrés del ventrículo izquierdo en sístole fue de 46 ± 4.9 gm/ cm2. El valor de la presión fue calculada promediando el valor de la presión arterial sistólica, medida externamente con un esfigmomanómetro mercurial, aun cuando idealmente se debe obtener la presión intraventricular por cateterismo cardíaco, para calcular con mayor exactitud la postcarga, a la que se enfrenta el ventrículo izquierdo, la cual es de especial utilidad en el paciente con estenosis aórtica e insuficiencia cardíaca.
Mediante la técnica propuesta en este estudio es posible conocer el estado funcional del ventrículo izquierdo, a través de la relación h/r en sístole (h2/r4). En efecto, dado que dicha relación traduce un cambio recíproco entre el espesor de la pared (h aumenta) y el radio de la cavidad (r disminuye), durante la contracción miocárdica, la calidad funcional del ventrículo podrá conocerse a través de este parámetro, o sea, a mayor h2/r4, mejor funcionamiento, y por el contrario, la insuficiencia cardíaca será manifestada por un precario incremento de la relación en sístole. Por esta razón, la delta h/r y el porcentaje (%h/r), también se encontrarán reducidos en comparación a los valores normales.3132 El engrasamiento sistólico del ventrículo izquierdo (h2/r4), es inversamente proporcional al volumen sistólico final, por lo que al aumentar la relación h/r en forma recíproca, disminuye el volumen (Sugay Sagawa).
Utilidad y perspectiva
Dada la importancia de la determinación del estrés parietal del ventrículo izquierdo en la evaluación de las distintas enfermedades cardiovasculares, este método de medición podría resultar especialmente útil en la decisión del tiempo quirúrgico en pacientes con valvulopatias cardíacas. Siendo importante definir la sensibilidad de estos índices no invasivos y más precisos de la función sistólica del ventrículo izquierdo que le sirva al clínico para una evaluación seriada y de detección más temprana del incremento del estrés meridional parietal sistólico.
Limitaciones
1. No en todos los pacientes es posible obtener un adecuado corte transversal de la cavidad ventricular izquierda mediante la resonancia magnética, principalmente en aquéllos con corazón vertical, para realizar los cálculos en forma precisa.
2. Para el cálculo del estrés meridional parietal sistólico del ventrículo izquierdo, no se realizó un registro simultáneo de la presión intraventricular, lo cual puede dar margen de error para el cálculo real de dicho parámetro.
3. La presencia de cardiopatía isquémica invalida los cálculos.
4. Otra importante limitación y posiblemente la más importante, es la disponibilidad del equipo de resonancia magnética.
Conclusiones
1. Mediante este nuevo método diagnóstico es posible determinar con mayor exactitud de manera no invasiva, a través de la mejor definición de sus bordes epicárdicos y endocárdicos, las áreas y los radios de la cavidad ventricular izquierda tanto en sístole como en diastole, así como determinar el grosor de la pared y su relación con el radio de la misma, para valorar la función ventricular, en especial en los sujetos en los cuales las sobrecargas de volumen o presión deprimen la función ventricular.
2. Sin embargo, pese a mejorar la definición de los bordes, áreas y radios, no es un método fácilmente accesible ni disponible en todos los centros, por lo que el ecocardiograma sigue siendo el método más económico y disponible incluso de manera portátil.
3. Los resultados obtenidos en este estudio, no variaron significativamente, respecto a los resultados obtenidos mediante el ecocardiograma bidimensional en estudios previos.
4. La determinación del estrés parietal sistólico del ventrículo izquierdo por cualquier método, es un parámetro de gran utilidad en pacientes con insuficiencia ventricular izquierda de causa no isquémica, en especial aquéllos con valvulopatías mitroaórticas, ya que este parámetro permite sugerir el momento quirúrgico óptimo, el pronóstico en su historia natural así como también a la hora de someterlos a un riesgo quirúrgico, ya que puede evaluar indirectamente el estado contráctil del miocardio insuficiente.
Referencias
1. DePace NL, Ren IF, Iskandrian AS, Kotler MN, Hakki AH, Segal BL: Correlation of Echocardiographic Wall Stress and Left Ventricular Pressure and Function in Aortic Stenosis. Circulation 1983; 67(4): 854–859. [ Links ]
2. Reichek N, Wilson J, Sutton MS, Plappert TA, Goldberg S, Hirshfeld J: Noninvasive Determination of left Ventricular Endsystolic Stress: Validation of the Method and Initial Application. Circulation 1982; 65 (1): 99–108. [ Links ]
3. Sandler H, Dodge H: Left Ventricular Tension and Stress in Man. Circ Res 1963; 13: 91–104. [ Links ]
4. Hood WP, Rackley CE, Rolett EL: Wall Stres in the Normal and Hypertrophied Human Left Ventricle. Am J Cardiol 1968; 22: 550–558. [ Links ]
5. Ford LE: Heart Size. Circ Res 1976; 39: 297–303. [ Links ]
6. Yin Frank CP: Ventricular Wall Stress. Circ Res 1981; 49(4): 829–842. [ Links ]
7. Gaasch H: Left Ventricular radius to Wall Thickness Ratio. Am J Cardiol 1979; 43: 1189–1194. [ Links ]
8. Philip A, McHole, Joseph C, Greenfield Jr: Evaluation of Several Geometric Models for Estimation of Left Ventricular Circumferential Wall Stress. Circ Res 1973; 33: 303–312. [ Links ]
9. Colan SD, Sanders SP, Borow KM: Physiologic Hypertrophy: Effects on Left Ventricular Systolic Mechanics in Athletes. JACC 1987; 9(4): 776–83. [ Links ]
10. Douglas PS, Reichek N, Plappert T, Muhammad A, Sutton MG: Comparison of Echocardiographic Methods for Assessment of Left Ventricular Shortening and Wall Stress. JACC 1987; 9(4): 945–51. [ Links ]
11. Ross Jr J, Franklin D, Sasayama S: Preload, afterload, and the role of afterload mismatch in the descending limb of cardiac function. Eur J Cardiol 1976; 4: 77–86. [ Links ]
12. Gaasch WH, Carroll JD, Levine HJ, Criscitiello MG: Chronic Aortic Regurgitation: Prognostic Value of Left Ventricular End–Systolic Dimension and End–Diastolic Radius/Thickness Ratio. JACC 1983:1(3): 775–82. [ Links ]
13. Iskandrian AS, Hakki AH, Manno B, Amenta A, Kane SA: Left Ventricular Function in Chronic Aortic Regurgitation. JACC 1983; 1(6): 1374–80. [ Links ]
14. Lorell BH, Carabello BA: Left Ventricular Hypertrophy. Pathogenesis, Detection, and Prognosis. Circulation 2000; 102: 470–479. [ Links ]
15. Jiang L, Huang Y, Hunyor S, Remedios CG: Cardiomyocyte apoptosis is associated with increased wall stress in chronic failing left ventricle. Eur Heart J 2003; 24: 742–751. [ Links ]
16. Haykowsky M, Taylor D, Teo K, Quinney A, Humen D: Left Ventricular Wall Stress During Leg–Press Exercise Performed with a Brief valsalva Maneuver. CHEST 2001; 119: 150–154. [ Links ]
17. DeAnda A, Komeda M, Moon MR, Green GR, Bolger AF, Nikolic SD, Daughters GT: Estimation of regional Left Ventricular Wall Stresses in Intact Canine Hearts. Am J Physiol 1998; 275(44): 1879–1885. [ Links ]
18. Balzer P, Furber A: Regional assessment of wall curvature and wall stress in left ventricle with magnetic resonance imaging. Am J Physiol 1999; 277(46): 901–910. [ Links ]
19. Delepine S, Furber A: 3–D MRI assessment of regional left ventricular systolic wall Stress in patients with reperfused MI. Am J Physiol 2003; 284: 1190–1197. [ Links ]
20. Denslow S, Balaji S, Hewett KW: Wall thickness referenced to myocardial volume: a new noninvasive framework for cardiac mechanics. J Appl Physiol 1999; 87(1): 211–221. [ Links ]
21. Zile MR, Gaasch WH, Carroll JD, Levine HJ: Chronic Mitral Regurgitation : Predictive Value of Preoperative Echocardiographic Indexes of Left Ventricular Function and Wall Stress. JACC 1984; 3(2): 235–42. [ Links ]
22. Osbakken M, Bove AA, Spann JF: Left Ventricular Function in Chronic Aortic Regurgitation with Reference to End–Systolic Pressure, Volume and Stress Relation. Am J Cardiol 1981; 47(2): 193–98. [ Links ]
23. Auffermann W, Wagner S: Noninvasive determination of left ventricular output and wall stress in volume overload and in myocardial disease by cine magnetic resonance imaging. Am Heart J 1991; 121(6): 1750–1758. [ Links ]
24. Municino A, Simone G, Roman MJ, Cody RJ, Ganau A, Hahn RT, Devereux RB: Assessment of left ventricular function by meridional and circumferential end–systolic Stress / Minor–Axis Shortening Relation in Dilated Cardiomyopathy. Am Heart J 1996; 78(1): 544–549. [ Links ]
25. Lance K, Lipscomb K, Hamilton GW, Kennedy JW: Relation of left ventricular shape, function and wall stress in man. Am Heart J 1974; 34(6): 627–634. [ Links ]
26. Fujita N, Duerinchx A, Higgins CB: Variation in left ventricular regional wall stress with cine magnetic resonance imaging: Normal subjects versus dilated cardiomyopathy. Am Heart J 1993; 125(5): 1337–1345. [ Links ]
27. Balzer P, Furber A: Simultaneous and correlated detection of endocardial and epicardial borders on short –axis MR images for the measurements of left ventricular mass. Radiographics 1998; 18(4): 1009–18. [ Links ]
28. Nachtomy E, Cooperstein R, Vaturi M, Bosak E, Vered Z, Akselrod S: Automatic assessment of cardiac function from short–axis MRI: procedure and clinical evaluation. Magn Reson Imaging 1998; 16(4): 365–76. [ Links ]
29. Cupps B, Moustakidis P: Severe Aortic Insufficiency and Normal Systolic Function: Determining Regional Left Ventricular Wall Stress by Finite–Element Analysis. Ann Throrac Surg 2003; 76: 668–75. [ Links ]
30. Guadalajara JF, Martínez SC, Gutiérrez PE, Zamora C, Huerta D: La relación Grosor/radio (H/r) del ventrículo izquierdo en sujetos sanos. Arch Inst Cardiol Mex 1989; 59: 293–300. [ Links ]
31. Guadalajara JF, Valenzuela F, Martinez SC, Huerta D: La relación Grosor/radio (H/r) en las miocardiopatías hipertrófica y dilatada. Arch Inst Cardiol Mex 1990; 60: 253–60. [ Links ]
32. Guadalajara JF, Gual J, Martínez SC, Monobe F, Alexanderson E, Cervantes JL: La hipertrofia miocárdica en la insuficiencia aórtica como mecanismo de compensación. Implicaciones para la indicación quirúrgica. Arch Inst Cardiol Mex 1992; 62: 351–360. [ Links ]
33. Gunther S, Grossman W: Determinants of Ventricular Function in Pressure–Overload Hypertrophy in Man. Circulation 1979; 59(4): 679–88. [ Links ]
34. Guadalajara JF, Martínez SC, Gutiérrez E, Zamora C, Huerta D: Estudio de la función ventricular mediante la cuantificación ecocardiográfica de la relación grosor/radio (h/r) del ventrículo izquierdo en sujetos sanos. Arch Inst Cardiol Mex 1989; 59: 293–300. [ Links ]














