Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.74 no.3 Ciudad de México jul./sep. 2004
REVISIÓN DE TEMAS CARDIOLÓGICOS
Tomografía por emisión de positrones (PET): Una herramienta útil para el estudio del metabolismo cardiaco
Positron emission tomography (PET): A useful tool for the assessment of cardiac metabolism
Erick Alexánderson,*** Diana Gómez-Martín,** Israel Benito,** Leonel Ruíz-Ramírez,** Alejandro Ricalde,** Aloha Meave*
* Departamento de Medicina Nuclear y Resonancia Magnética, Instituto Nacional de Cardiología "Ignacio Chávez".
** Unidad PET-Ciclotrón. Planta Baja del Edificio de Investigación, Facultad de Medicina, UNAM, Ciudad Universitaria.
Correspondencia
Dr. Erick Alexánderson Rosas. Instituto Nacional de Cardiología "Ignacio Chávez". (INCICH, Juan Badiano No. 1, Col. Sección XVI, Tlalpan 14080 México, D.F.). Tel: 5272-2886; Fax: 5 272-2678. E-mail: alexanderick@yahoo.com
Recibido: 17 de junio de 2003
Aceptado: 24 de septiembre de 2003
Resumen
En condiciones normales el metabolismo energético del corazón se basa en la oxidación de ácidos grasos y en menor proporción de carbohidratos. La función cardiaca depende del suplemento adecuado de trifosfato de adenosina (ATP) proveniente de dichos sustratos. Sin embargo, la fuente principal de energía está sujeta a modificación porfactorestanto fisiológicos (ejercicio) como patológicos (isquemia-reperfusión). Recientemente, se ha puesto gran atención al papel de la carnitina como regulador del metabolismo de ácidos grasos y carbohidratos mediante la modulación de la relación intramitocondrial de acetil-CoA/CoA. Las alteraciones en el metabolismo de carbohidratos y ácidos grasos a nivel miocárdico se han asociado al desarrollo de diversas patologías cardiovasculares (cardiopatía isquémica, hipertrofia ventricular, y miocardiopatía dilatada) por lo cual el estudio del metabolismo cardiaco cobra gran relevancia para el diagnóstico, y pronóstico de estas patologías. Dentro de la práctica clínica, la tomografía por emisión de positrones (PET) es una de las técnicas más empleadas para la evaluación del metabolismo cardiaco. Los radiotrazadores más ampliamente empleados en imagen PET son "C-palmitato, "C-acetato y 18Fluoro-2-desoxiglucosa (FDG), los dos primeros se emplean para el estudio del metabolismo oxidativo de los ácidos grasos y la FDG nos permite estudiar el metabolismo de carbohidratos.
Palabras clave: Metabolismo cardiaco, Tomografía por emisión de positrones, 18-FDG.
Summary
Under normal conditions, myocardial metabolism is based on the oxidation of fatty acids and in a lesser extent carbohydrates. Cardiac function depends upon an adequate supplement of adenosine triphosphate(ATP) by these substrates. However, the main source of energy is susceptible to change upon a various physiologic (exercise) as well as pathologic (ischemia-reperfusion) conditions. Recently, carnitine has gained attention as a modulator of fatty acids and carbohydrates metabolism by means of modifying intramitochondrial Acetyl-CoA/CoA ratio. Disturbances in fatty acids and carbohydrates metabolism in the myocardium have been associated with cardiovascular diseases (chronic ischemic disease, ventricular hypertrophy and dilated cardiomyopathy). The evaluation of cardiac metabolism attains great value regarding diagnosis, treatment and prognosis of these diseases. Currently, positron emission tomography (PET) is one of the preferred methods to evaluate cardiac energy metabolism in clinical practice. In PET images the tracers most commonly used are "C-palmitate, "C-acetate y 18Fluoro-2-deoxyglucose (FDG), the first two are employed to assess fatty acids oxidation and FDG is used to evaluate carbohydrates metabolism.
Key words: Cardiac metabolism, Positron emission tomography, 18-FDG.
Introducción
El objetivo de este artículo de revisión es enfocarse en los puntos clave del metabolismo cardiaco, sus principales vías (glucólisis, oxidación de carbohidratos, oxidación de ácidos grasos, ciclo de los ácidos tricarboxílicos, entre otras) y factores moduladores (carnitina) para poder comprender la asociación existente entre el desarrollo de diversas patologías cardiovasculares (cardiopatía isquémica, hipertrofia ventricular, miocardiopatía dilatada, y miocardiopatía diabética, entre otras) y las alteraciones en el metabolismo energético del corazón.
La evaluación del metabolismo cardíaco cobra gran relevancia dentro de la práctica clínica cardiológica. Actualmente la tomografía por emisión de positrones (PET) es uno de los métodos de imagen que ofrece mayor precisión y confiabilidad dentro del estudio de las diferentes vías metabólicas en corazón. El metabolismo oxidativo de diversos sustratos energéticos provee al corazón de la energía requerida para mantener el metabolismo basal y hacer posible la contracción de las miofibrillas cardíacas.
El corazón obtiene la mayor parte de sus requerimientos energéticos (70-80%) a través de la oxidación de los ácidos grasos. El resto de la energía requerida proviene de la oxidación de glucosa y lactato. La tasa de actividad de estas vías metabólicas se encuentra acoplada a la tasa del trabajo contráctil que depende a su vez del suplemento de oxígeno y de la tasa de fosforilación oxidativa.1
La fuente energética puede cambiar en relación a diversos factores, tales como la disponibilidad de los sustratos, las demandas energéticas, el suplemento de oxígeno y las condiciones metabólicas del individuo.2
La disponibilidad de los sustratos de energía depende de varios factores, entre ellos: flujo sanguíneo, influencias hormonales, concentración en los vasos aferentes, demanda de oxígeno y carga de trabajo.
En un metabolismo aeróbico, el oxígeno se desempeña como el último receptor de electrones de las vías metabólicas del miocardio.3 La función cardiaca en condiciones normales depende del adecuado suplemento de oxígeno y sustratos oxidables empleados para la producción del ATP necesario para cubrir las demandas energéticas miocárdicas. El consumo de oxígeno refleja el metabolismo mitocondrial y la producción de ATP. Este concepto es importante para el estudio de dicho metabolismo.4
La energía del metabolismo basal es requerida para mantener la integridad celular, es decir, para la síntesis de proteínas y el mantenimiento de la membrana celular.
Oxidación de los ácidos grasos
Los ácidos grasos libres son considerados como el sustrato preferido del metabolismo miocárdico. Los ácidos grasos requeridos provienen de moléculas de ácidos grasos libres unidos a albúmina, ésteres de colesterol dentro de quilomicrones y lipoproteínas de muy baja densidad (VLDL) circulantes.
Una vez dentro de la célula miocárdica, los ácidos grasos son metabolizados a una acil-CoA (ácido graso activado) la cual es transferida a la mitocondria a través de diversas enzimas, tales como la carnitina palmitoil transferasa-1(CPT-1). Dentro de la matriz mitocondrial la acil-CoA ingresa a la vía de la ß-oxidación, cuyo producto final es la acetil-CoA, la cual se incorpora al ciclo de los ácidos tricarboxílicos (Ciclo de Krebs).
Glucólisis
La glucólisis es la vía por la que la glucosa se transforma a piruvato, con la producción neta de 2 moles de ATP por mol de glucosa.
La glucosa es transportada dentro de la célula miocárdica por transportadores como GLuT-1 y GLUT-4. Intracelularmente la glucosa es rápidamente fosforilada a glucosa seis fosfato, la cual puede entrar posteriormente tanto a la glicólisis como a la síntesis de glucógeno.
Dentro de la glucólisis existen varios sistemas enzimáticos con función reguladora, tales como la 6-fosfofructocinasa, la cual es inhibida por concentraciones elevadas de ATP, de citrato y de ácidos grasos de cadena larga, pero es estimulada por el ADP o por el AMP.
La glucólisis desempeña un papel de mecanismo de emergencia capaz de producir energía durante períodos cortos en los que no se dispone de oxígeno.
Oxidación de carbohidratos (Glucosa, lactato)
Además de los ácidos grasos, la otra fuente de acetil-CoA para el ciclo de los ácidos tricarboxílicos es la oxidación de los carbohidratos, particularmente glucosa y lactato. Cuando el organismo es alimentado por carbohidratos, la lipólisis es inhibida por la insulina y subsecuentemente la oxidación de los carbohidratos se incrementa. En este caso los carbohidratos pueden utilizar el 100% del oxígeno miocárdico (glucosa 70% y lactato 30%). Durante el ejercicio intenso (65% de la captación máxima de oxígeno de un individuo), la producción de lactato se convierte en el mayor combustible del corazón, respondiendo por el 60 al 70% del consumo miocárdico de oxígeno.
Bajo condiciones aeróbicas, la mayoría del piruvato es convertido a acetil-CoA, el cual entra al ciclo de los ácidos tricarboxílicos.5
La oxidación de carbohidratos constituye la vía metabólica que une a la glucólisis con el ciclo de los ácidos tricarboxílicos. El acoplamiento entre la glucólisis y la oxidación de carbohidratos es de gran importancia para mantener de manera adecuada el metabolismo energético miocárdico.1
Ciclo de los ácidos tricarboxílicos (Ciclo de Krebs)
Una molécula de acetil-CoA que entra a este ciclo, produce tres moléculas de NADH, una de FADH2, y una de GTP, el cual es también un compuesto de alta energía. El NADH y el FADH2 son oxidados en la cadena respiratoria de electrones produciendo 11 moléculas de ATP. En este ciclo, confluyen las vías metabólicas encaminadas a la oxidación de las moléculas combustibles.
Regulación de la oxidación de carbohidratos y ácidos grasos
El metabolismo oxidativo del corazón se encuentra finamente regulado por diversos factores que modifican la actividad de enzimas clave en cada una de las vías metabólicas previamente referidas.
La activación de la carnitinina palmitoil transferasa-1 (CPT-1) es el paso limitante para la transferencia de los grupos acilo al interior mitocondrial, en donde se realiza la ß-oxidación de los ácidos grasos, esta enzima emplea como cofactor a la carnitina y es inhibida por la malonil-CoA, factores que regulan de manera concertada la oxidación de ácidos grasos.1,6,7 Por su parte el complejo enzimático piruvato deshidrogenasa (PDH) cataliza el paso limitante irreversible en la oxidación de los carbohidratos; su fosforilación depende de la concentración mitocondrial de sus sustratos (CoA, NAD+, piruvato) y productos (acetil-CoA y NADH).1,2,6,8
La carnitina es un compuesto de bajo peso molecular que se obtiene tanto de la dieta como a partir de los aminoácidos esenciales lisina y metionina y desarrolla un papel clave en la regulación de la oxidación mitocondrial de ácidos grasos mediante la acción de diversas aciltransferasas, regulación del radio Acetil-CoA/CoA intramitocondrial, modulación del metabolismo de aminoácidos ramificados, remoción de grupos acilo y oxidación peroxisomal de ácidos grasos.1,2,9,10
Se ha propuesto que existe una regulación conjunta entre metabolismo de la glucosa y la oxidación de ácidos grasos, llevada a cabo principalmente por la carnitina, mediante modulación del radio Acetil-CoA/CoA intramitocondrial.1,2,9,11
La carnitina es capaz de activar la oxidación de carbohidratos mediante la disminución de la relación Acetil-CoA/CoA ocasionando activación del complejo enzimático PDH1,2 (Fig. 1).
Se ha demostrado que tasas elevadas de oxidación de ácidos grasos que ocasionan elevación de los niveles mitocondriales de acetil-CoA y NADH son capaces de inhibir al complejo PDH mediante fosforilación catalizada por la PDH kinasa.1,2,8
Cambios adaptativos en el metabolismo miocárdico. Isquemia y reperfusión
La oxidación preferencial de sustratos energéticos en el corazón se modifica en relación a diversas condiciones tanto fisiológicas (etapa del desarrollo, ejercicio intenso) como patológicas (ayuno prolongado, isquemia y reperfusión).2,12 El resultado de la isquemia, es la reducción en la disponibilidad de oxígeno para mantener el metabolismo oxidativo, lo cual resulta en una disminución en la producción neta de ATP, pudiendo llegar a dañar el músculo cardíaco, ocasionando disminución en el trabajo mecánico.1,2,13-15
Durante la isquemia, la glucólisis anaerobia se convierte en una fuente principal de ATP debido a la depresión del metabolismo oxidativo mitocondrial.
El grado de isquemia determina los cambios metabólicos asociados, una reducción severa en el flujo miocárdico ocasiona una disminución de sustratos a través del complejo PDH, sin embargo, con una reducción parcial del flujo se incrementa la glucólisis y la producción de lactato.2
En un episodio isquémico, el grado de daño tisular se correlaciona de manera inversa con la actividad glucolítica antes y durante dicho episodio. El estudio realizado por Vanoverschelde JL y cols.16 demuestra que la estimulación de la vía glucolítica es capaz de limitar el daño relacionado con la isquemia.
Durante la isquemia se presenta un desacoplamiento entre la glucólisis y la oxidación de glucosa, con lo cual una mayor cantidad de piruvato se convierte a lactato, así mismo, predomina un ambiente ácido debido al incremento en los iones H+ provenientes de la hidrólisis del ATP derivado de la glucólisis, lo cual afecta la integridad funcional y estructural de los miocitos.
Dentro de los cambios en el metabolismo de ácidos grasos se ha reportado un incremento en las cifras tisulares de acilcarnitina, la cual es capaz de dañar la integridad funcional de las membranas de los miocitos debido a su naturaleza amfifílica y que se asocia a disminución en los niveles totales de carnitina, con alteración concomitante en la regulación del metabolismo oxidativo mitocondrial de los ácidos grasos.1,2,17 La disminución en el metabolismo oxidativo de los ácidos grasos durante episodios isquémicos se ha asociado a una disminución en la actividad de la enzima CPT-1 por incremento en los niveles de malonil-CoA.
Durante la reperfusión, la oxidación de ácidos grasos vuelve a retomar relevancia dentro de los sustratos energéticos, presentándose una disminución en la oxidación de carbohidratos.18 La activación del sistema enzimático 5'-AMP- proteína cinasa activada (AMPK) se ha relacionado tanto con un incremento en la ß-oxidación durante la reperfusión como con un aumento en la captación de glucosa y glucólisis durante la isquemia.19 El incremento en el metabolismo oxidativo de la glucosa se ha asociado a una mejoría significativa en la función contráctil durante la reperfusión.20
Patologías cardiovasculares asociadas a alteraciones en el metabolismo energético del corazón
Se ha demostrado en modelos animales y en humanos, que tanto la hipertrofia ventricular como la miocardiopatía dilatada se asocian a una disminución significativa en el transporte y en la oxidación de ácidos grasos, así como alteración en el complejo enzimático del Ciclo de Krebs.2,14
La miocardiopatía diabética se relaciona con disminución en la captación y oxidación de glucosa secundaria a una menor expresión de los transportadores GLUT-1 y GLUT-4 y a la inhibición del complejo Piruvato deshidrogenasa (PDH).11
Otra patología que impacta claramente en el metabolismo es la cardiopatía isquémica, la cual se caracteriza por una disminución significativa del metabolismo oxidativo de los carbohidratos y de la actividad enzimática del ciclo de Krebs, así como desacoplamiento entre la glucólisis y la oxidación de carbohidratos y alteraciones en el metabolismo oxidativo de los ácidos grasos.2
Evaluación del metabolismo cardíaco
Las alteraciones en el metabolismo de carbohidratos y ácidos grasos a nivel miocárdico se han asociado al desarrollo de diversas patologías cardiovasculares (cardiopatía isquémica, miocardiopatía diabética, hipertrofia ventricular y miocardiopatía dilatada, entre otras) por lo cual el estudio del metabolismo cardíaco cobra gran relevancia para el diagnóstico, tratamiento y pronóstico de estas patologías.
El análisis bioquímico de los intermediarios metabólicos (fosfatos de alta energía, ATP) mediante técnicas de espectrofotometría o cromatografía, así como la medición de la actividad y cinética de sistemas enzimáticos clave se han empleado ampliamente para la evaluación del metabolismo energético del corazón, principalmente en el área de investigación básica.21
Dentro de la práctica clínica, los métodos de imagenología tales como: tomografía por emisión de positrones (PET), tomografía computada por emisión de fotón único (SPECT) y resonancia magnética (RMC) actualmente son las técnicas más empleadas para la evaluación del metabolismo cardíaco.21,22
Tomografía por emisión de positrones (PET)
La tomografía por emisión de positrones (PET) constituye una importante herramienta diagnóstica única en su tipo en cuanto a imagen cardiovascular se refiere, sin embargo es en la actualidad un método de baja disponibilidad y elevado costo que requiere una infraestructura de soporte considerable. La aplicación clínica más importante en cardiología consiste en la evaluación de la viabilidad, metabolismo y perfusión miocárdica. Los trazadores usados actualmente para estudios del metabolismo son 11C-palmitato, 11C-acetato y 18Fluoro-2-desoxiglucosa (FDG) (Fig. 2).
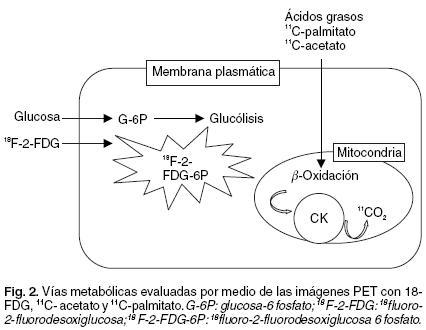
Mediante el empleo del PET con diferentes radiotrazadores (11C-palmitato, 11C-acetato y 18-FDG) pueden estudiarse alteraciones de diversos procesos metabólicos que se correlacionan con el desarrollo de patología cardíaca (cardiopatía isquémica, miocardiopatía dilatada, hipertrofia ventricular) (Tabla I).
Un importante criterio a tomar en cuenta para encontrar el radionúclido adecuado es la vida media la cual debe corresponder con el proceso biológico que será estudiado.
El carbono forma parte de todos los compuestos orgánicos, por lo tanto el uso potencial de 11C, en cuanto a su aplicación en clínica a partir de su síntesis es ilimitada sin mencionar que la ventana de vida media que nos da el 11C es apropiado para el estudio de múltiples etapas en los procesos biológicos.23
Cuando se asume que el trazador puede experimentar cambios metabólicos durante el tiempo de la investigación, la posición del marcaje es importante.
Cuando se emplea el [18F]-FDG, la posición de marcaje es específica, porque el metabolismo del trazador inhibe después la etapa de la fosforilación.24,25 Si se emplea 11C-glucosa marcada específicamente en la posición 1 y 6, puede ser posible obtener información acerca de diferentes etapas del metabolismo de la glucosa y distinguir entre estas rutas.26-28
La distribución de los radiotrazadores en el miocardio está determinada por un número de factores que incluyen la fracción del trazador que cruza la membrana capilar en un solo bolo de inyección (fracción de extracción) y la transferencia del trazador en el miocardio.
11C palmitato
Como ya se mencionó, la principal vía metabólica de los ácidos grasos es la ß oxidación, convirtiendo los ácidos grasos en unidades de acetil-CoA para su subsecuente oxidación en el ciclo del ácido cítrico.
El 11C palmitato es usado como marcador regional del metabolismo de ácidos grasos en miocardio normal e isquémico en la mayoría de los estudios PET.4,29 Su fracción de extracción de primer paso es de aproximadamente 0.67. El 11C palmitato entra a la célula por transporte pasivo y es después metabolizado dentro del miocito. Después de una inyección intravenosa del 11C palmitato, las concentraciones máximas en el miocardio son obtenidas aproximadamente después de 5 minutos y se pueden obtener imágenes dinámicas en los subsecuentes 40 a 60 minutos.
En el miocardio normal, el aclaramiento del trazador es típicamente bioexponencial, el primer componente rápido, representa la oxidación del palmitato y el segundo componente, más lento, refleja una incorporación del trazador en el almacén lipídico intracelular. Durante isquemia aguda, cuando la oxidación de los ácidos grasos en la mitocondria está restringida, el primer componente de la curva de aclaramiento se reduce y el segundo componente se incrementa relativamente.30
Al principio, las investigaciones sobre el metabolismo oxidativo del corazón usaron trazadores implicados en el metabolismo de los ácidos grasos como el 11C palmitato, sin embargo, los procesos asociados con el transporte de los ácidos grasos, la ß-oxidación y el intercambio con la reserva intracelular de triglicéridos, confundieron los resultados obtenidos. Por eso, recientemente se ha preferido usar 11C acetato como trazador del metabolismo oxidativo ya que éste entra prácticamente de manera directa al ciclo de los ácidos tricarboxílicos.
Sin embargo, su uso está lejos de ser desechado ya que la combinación de acetatos marcados con ácidos grasos como el palmitato ofrecen nuevas perspectivas de estudio, tales como la distinción entre el ciclo de los ácidos tricarboxílicos y la ß oxidación en un mismo estudio.
11C acetato
El acetato puede ser considerado como un ácido graso de cadena corta, sirviendo como el producto final de las principales fuentes de energía para el ciclo del ácido cítrico como lo son la ß oxidación de los ácidos grasos y la glucólisis por la oxidación del piruvato, por lo tanto, al marcarlo con 11C en la posición carboxilo, ha probado ser un útil trazador PET al ser un intermediario directo entrando como acetil-CoA en el ciclo de los ácidos tricarboxílicos y siendo oxidado posteriormente a CO2 y agua.
La cinética del acetato marcado con 11C está directamente ligada a la carga de trabajo del corazón (frecuencia cardiaca x presión sistólica) y al consumo de oxígeno miocárdico.
Es importante mencionar que la posición de marcaje ya sea en la posición carboxilo o en la metilo va a determinar cuántas veces el compuesto marcado repetirá el ciclo del ácido cítrico.
El sustrato es usado como trazador de regiones miocárdicas del metabolismo oxidativo.31,32 La distribución inicial del 11C acetato es proporcional al flujo sanguíneo y el aclaramiento a partir del pool sanguíneo es rápido, por lo tanto las imágenes tomadas tempranamente después de la administración del trazador, pueden ser usadas para estudiar la perfusión miocárdica cualitativamente y semicuantitativamente. Este proceso está linealmente relacionado al consumo de oxígeno del miocardio.
La aplicación de modelos dinámicos de adquisición de imágenes permiten la caracterización del metabolismo oxidativo miocárdico bajo diferentes cargas de trabajo. Tales estudios no están incluidos en la práctica clínica común hasta el momento, aunque cada vez hay más evidencia de que el uso del 11C-acetato nos puede brindar información muy valiosa en el cálculo de la respuesta miocárdica a la revascularización en pacientes con cardiopatía isquémica, así como para evaluar la eficiencia metabólica en pacientes con miocardiopatía dilatada o en la enfermedad valvular.23,26,31,32
ß-123-iodometil-iodofenil ácido pentadecanoico
Así mismo, se pueden estudiar ácidos grasos modificados tales como ß-123-iodometil-iodofenil ácido pentadecanoico, el cual es captado de manera preferencial por el miocardio. Esta técnica se ha empleado para el estudio del metabolismo de ácidos grasos en pacientes con miocardiopatía dilatada idiopática. Las zonas de baja perfusión se asocian a tasas bajas de captación de ácidos grasos, lo cual correlaciona con el desarrollo de factores adversos a nivel hemodinámico e histopatológico.33
18F-2-fluoro-2-desoxiglucosa (FDG)
La 18F-2-fluoro-2-desoxiglucosa (FDG) es el trazador más extensamente empleado en estudios PET. La FDG es un análogo de glucosa que es metabolizado de manera similar a la glucosa en el miocardio. Después de la difusión a través de la membrana celular, es fosforilado dentro de la célula al FDG 6-fosfato, el cual es atrapado en el interior de la célula miocárdica, y como no es un sustrato adecuado para seguir el metabolismo en la vía de la glucólisis o en la síntesis de glucógeno y es relativamente impermeable a la membrana del miocito, se mantiene en altas concentraciones dentro del miocardio por un intervalo de tiempo de 40 a 60 minutos, lo que brinda condiciones ideales para la obtención de imágenes.21,22
La utilización de la glucosa por el miocardio depende en gran parte de la concentración del sustrato en el plasma y el estado prandial del individuo, la captación de FDG es heterogénea en estado de ayuno. Se puede emplear la técnica de fijación de insulina "clamp de insulina", donde la insulina, glucosa y potasio son infundidas intravenosamente para obtener niveles plasmáticos constantes antes y durante la imagen.22
Dentro de la evaluación integral del paciente isquémico, la determinación de la presencia de miocardio viable es de gran relevancia. El miocardio en estado de hibernación presenta predominantemente un metabolismo anaerobio de la glucosa, mostrando un incremento en la utilización periférica de glucosa exógena, lo cual es evaluado por el PET mediante el empleo del análogo de glucosa FDG.
El miocardio hibernante se identifica mediante la presencia de un «patrón discordante flujo-metabolismo» caracterizado por una captación de FDG normal o incrementada en presencia de defectos de perfusión.
Los datos provenientes de estos estudios poseen gran valor pronóstico, pues son capaces de predecir la mejoría de la función ventricular posterior a revascularización en pacientes con disfunción ventricular izquierda y enfermedad arterial coronaria.22
También es posible estudiar el metabolismo de la glucosa en pacientes con miocardiopatía asociada a diabetes mellitus, en los cuales se encuentra alterada tanto la captación como la oxidación.11
Una de las principales metas de la investigación realizada con métodos PET es lograr entender la relación existente entre la perfusión, el metabolismo de la glucosa y de los ácidos grasos y la función contráctil.
Resonancia magnética cardiovascular
Una de las técnicas más innovadoras dentro de la evaluación del metabolismo cardíaco es la resonancia magnética cardiovascular (RMC) que permite la evaluación de la estructura molecular y concentración de diversos intermediarios metabólicos. Los sustratos más comúnmente empleados son 31P y 13C.
La RMC con 31P se emplea para la medición de niveles de fosfatos de alta energía (ATP, fosfato inorgánico, entre otros), ADP citosólico libre, actividad del sistema enzimático creatin-kinasa, como medida de la reserva contráctil en diversas patologías tales como insuficiencia cardíaca y miocardiopatía hipertrófica.21
El empleo de 13C permite la evaluación del intercambio de metabolitos miocárdicos, cuantificación de intermediarios metabólicos, la actividad del ciclo de los ácidos tricarboxílicos, la captación de glucosa y el metabolismo del glucógeno.
Dentro de las limitaciones de esta técnica se encuentran el elevado costo de la misma y las dificultades técnicas del análisis cinético.
Conclusiones
Actualmente la evaluación del metabolismo cardiaco mediante técnicas de imagenología como la tomografía por emisión de positrones (PET) nos permite el estudio no invasivo de los diversos procesos metabólicos, cuya alteración se ha asociado al desarrollo de patologías cardiovasculares, tales como cardiopatía isquémica, hipertrofia ventricular y miocardiopatía dilatada, validando su uso dentro de la práctica clínica, especialmente dentro de la evaluación diagnóstica y pronóstica.
Referencias
1. Calvani M, Reda E, Arrigoni-Martelli E: Regulation by carnitine of myocardial fatty acid and carbohydrate metabolism under normal and pathological conditions. Basic Res Cardiol 2000; 95: 75-83. [ Links ]
2. Carvajal K, Moreno-Sánchez R: Heart Metabolic Disturbances in Cardiovascular Diseases. Arch Med Res 2003; 34: 89-99. [ Links ]
3. Neely J, Morgan H: Relationship between carbohydrate and lipid metabolism and energy balance of the heart. Rev Physiol 1974;36: 413-59. [ Links ]
4. Taegtmeyer H: Energy metabolism of the heart : from basic concepts to clinical applications. Curr Probl Cardiol 1994; 19: 59-113. [ Links ]
5. Depre C, Vanoverschelde JL, Taegtmeyer H: Glucose for the heart. Circulation 1999; 99: 578-88. [ Links ]
6. McGarry JD, Millis SE, Long CS, Foster DW: Observations on the affinity for carnitine, and malonyl-CoA sensitivity, of carnitine palmitoyl-transferase 1 in animal and human tissues. Biochem J 1983; 214: 21-8. [ Links ]
7. De Vries Y, Arvidson DN, Waterham HR, Cregg JM, Woldegiogis G: Functional characterization of mitochondrial carnitine palmitoyl-transferases I and II expressed in the yeast Pichia pastors. Biochemistry 1997; 36: 5285-92. [ Links ]
8. Stanley WC, Lopaschuk GD, Hall JL, McCormack JG: Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions. Potential for pharmacological interventions. Cardiovasc Res 1997; 33: 243-57. [ Links ]
9. Lysiak W, Lilly K, DiLisa F, Toth PP, Bieber LL: Quantification of the effect of L-carnitine on the levels of acid-soluble short-chain acyl CoA and CoA in rat heart and liver mitochondria. J Biol Chem 1988; 263: 1511-6. [ Links ]
10. Hoppel C: The role of carnitine in normal and altered fatty acid metabolism. Am J Kidney Dis 2003; 41 (4 Suppl 5): S4-S12. [ Links ]
11. Randle PJ, Priestman DA, Mistry S, Halsall A: Mechanisms modifying glucose oxidation in diabetes mellitus. Diabetologia 1994; 37: S155-S161. [ Links ]
12. Bartelds B, Gratama JWC, Knoester H, Takens J, Smid GB, Aarnoudse JG, et al: Perinatal changes in myocardial supply and flux of fatty acids, carbohydrates, and ketone bodies in lambs. Am J Physiol 1998; 274: H1962-H1969. [ Links ]
13. Rumsey W, Abbot B, Bertelsen D, Msallamaci K, Nelson D, Erecinska M: Adaptation to hypoxia alters energy metabolism in rat heart. Am J Physiol 1999; 276: H7-H80. [ Links ]
14. Wambolt RB, Henning SL, English DR, Dyachkova Y, Lopaschuk GD, Allard MF: Glucose utilization and glycogen turnover accelerated in hypertrophied rat hearts during severe low-flow ischemia. J Moll Cell Cardiol 1999; 31: 493-502. [ Links ]
15. Renstrom B, Liedtke AJ, Nellis SH: Mechanism of substrate preference for oxidative metabolism during early myocardial reperfusion. Am J Physiol 1990; 259: H317-H323. [ Links ]
16. Vanoverschelde JL, Janier MF, Bakke JE, Marshall DR, Bergmann SR: Rate of glycolisis during ischemia determines extent of ischemic injury and functional recovery after reperfusion. Am J Physiol 1994; 267: H1785-H1794. [ Links ]
17. Lamers JMJ: Amphiphilic interactions of long-chain fatty acylcarnitines with membranes: potential involvement in ischemic injury. En: DeJong JW, Ferrari R (eds): The Carnitine System. Kluwer Acad Publishers, Dordrecht, The Netherlands, pp 83-100. [ Links ]
18. Kudo N, Barr AJ, Barr RL, Desai S, Lopaschuk GD: High rates of fatty acid oxidation during reperfusion of ischemic hearts are associated with a decrease in malonyl-CoA levels due to an increase in 5'-AMP-activated protein kinase inhibition of acetyl-CoA carboxylase. J Biol Chem 1995; 270: 17513-20. [ Links ]
19. Sambandam N, Lopaschuk GD: AMP-activated protein kinase (AMPK) control of fatty acid and glucose metabolism in the ischemic heart. Prog Lipid Res 2003; 42: 238-56. [ Links ]
20. Lopaschuk GD: Regulation of carbohydrate metabolism in ischemia and reperfusion. Am Heart J 2000; 139: S115-9. [ Links ]
21. Lopaschuk GD: Advantages and limitations of experimental techniques used to measure cardiac energy metabolism. J Nucl Cardiol 1997; 4: 316-28. [ Links ]
22. Visser FC: Imaging of cardiac metabolism using radiolabelled glucose, fatty acids and acetate. Coron Artery Dis 2001; 12 (Suppl 1): S12-8. [ Links ]
23. Klein LJ, Visser FC, Knaapen P, Peters JH, Teule GJ, Visser CA, Lammertsma AA: Carbon-11 acetate as a tracer of myocardial oxygen consumption. Eur J Nucl Med 2001; 28: 651-8. [ Links ]
24. Czernin J, Porenta G, Brunken RC, Krivokapich J, Chen K, Bennett R, et al: Regional blood flow, oxidative metabolism, and glucose utilization in patients with recent myocardial infarction. Circulation 1993; 88: 884-95. [ Links ]
25. Katoh C, Ruotsalainen U, Laine H, Alenius S, Iida H, Nuutila P, et al: Iterative reconstruction based on median root prior in quantification of myocardial blood flow and oxygen metabolism. J Nucl Med 1999; 40: 862-7. [ Links ]
26. Armbrecht JJ, Buxton DB, Brunken RC, Phelps ME, Schelbert HR: Regional myocardial oxygen consumption determined noninvasively in humans with [1-11C] acetate and dynamic positron emission tomography. Circulation 1989; 80: 863-72. [ Links ]
27. Vanoverschelde JL, Melin JA , Bol A, Vanbutsele R, Cogneau M, Labar D, et al: Regional oxidative metabolism in patients after recovery from reperfused anterior infarction. Relation to regional blood flow an glucose uptake. Circulation 1992; 82: 9-21. [ Links ]
28. Bengel FM, Permanetter B, Ungerer M, Nekolla S, Schwaiger M: Non-invasive estimation of myocardial efficiency using positron emission tomography and carbon -11 acetate: comparison between the normal and failing human heart. Eur J Nucl Med 2000;27:319-26. [ Links ]
29. Maki MT, Haaparanta M, Nuutila P, Oikonen V, Luotolahti M, Eskola O, et al: Free fatty acid uptake in the myocardium and skeletal muscle using fluorine-18 fluoro-6-thia-heptadecanoic acid. J Nucl Med 1998; 39: 1320-7. [ Links ]
30. Schelbert HR, Henze E, Schon HR, Keen R, Hansen H, Selin C, et al: Carbon -11 palmitate for the noninvasive evaluation of regional myocardial fatty acid metabolism with positron computed tomography. III. In vivo demonstration of the effects of substrate availability on myocardial metabolism. Am Heart J 1983;105:492-504. [ Links ]
31. Chan SY, Brunken RC, Phelps ME, Schelbert HR: Use of the metabolic tracer carbon-11-acetate for evaluation of regional myocardial perfusion. J Nucl Med 1991; 32: 665-72. [ Links ]
32. Brown M, Marshall DR, Sobel BE, Bergmann SR: Delineation of myocardial oxygen utilization with carbon-11-labelled acetate. Circulation 1987; 3: 687-96. [ Links ]
33. Yazaki Y, Isobe M, Takahashi W, Kitabayashi H, Nishiyama O, Sekiguchi M, Takemura T: Assessment of myocardial fatty acid metabolic abnormalities in patients with idiopathic dilated cardiomyopathy using 1231BMIPP SPECT: correlation with clinicopathological findings and clinical course. Heart 1999; 81:153-9. [ Links ]














