Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.74 n.3 Ciudad de México Jul./Sep. 2004
INVESTIGACIÓN BÁSICA
Densidad vascular disminuida en la pared de la aorta. Característica morfológica y funcional de la aterosclerosis
Diminished vascular density in the aortic wall. Morphological and functional characteristics of atherosclerosis
Cuauhtémoc Acoltzin Vidal,* Irma Maldonado Villaseñor,** Leonardo Rodríguez Cisneros,*** J Jesús Muñiz Murguía*
* Centro de Investigaciones Biomédicas, Universidad de Colima.
** Hospital General de Zona con Medicina Familiar No. 1, IMSS, Colima.
*** Servicios Periciales, Procuraduría de Justicia del Estado de Colima.
Correspondencia
Cuauhtémoc Acoltzin Vidal. Calzada del Campesino No. 99, El Moralete, Colima, Colima, México. C.P. 28060. Tel Fax: (312) 3 14 53 54. E-mail: jose_rafael_c_acoltzin@yahoo.com
Recibido: 20 de diciembre 2002
Aceptado: 27 de agosto 2003
Resumen
Antecedente: Por distribución irregular de aterosclerosis en paredes arteriales se buscó desproporción entre grosor de la pared vascular y vasa vasorum en ocho fragmentos de aorta humana. Método: Se midió longitud y grosor de pared y de sus capas y se contó vasa vasorum, se calculó densidad vascular como número de vasos por milímetro cuadrado en áreas sanas y enfermas, valor medio, varianza, desviación estándar e intervalo de confianza para valores y para hipótesis nula, se analizaron varianzas y se aplicó prueba "t" comparativa y pareada. Resultado: Hay diferencias de grosor entre íntima sana (27 micras) y enferma (120.5 micras), P < 0.001; y entre media sana (125.2 micras) y enferma (102.3 micras), P < 0.001. La densidad vascular es mayor en fragmentos sanos (media ± IC 99% = 4.4 ± 1.4 vs 2.2 ± 0.8, P < 0.001 para Ha; 0 ± 1.0775 para Ho; "t" pareada 2.1 ± 1.1, P < 0.01). Mayor ante íntima sana (31.6 vs 5.1, P < 0.01). No varía ante capa media. La relación entre número de vasos y longitud del segmento vascular es mayor en el fragmento sano (media ± IC 95% = 4.9 ± 1.02 vs 3.5 ± 0.68, diferencia 1.4, P < 0.05). Conclusión: La densidad vascular es menor en la pared de aorta aterosclerosa que en aorta sana lo que pudiera iniciar el proceso patógeno.
Palabras clave: Hipovascularidad aórtica, Aterosclerosis, Paredes arteriales.
Summary
Purpose: To determine disproportion in thicknesses of the vascular wall and vasa vasorum in eight fragments of human aorta because of the irregular distribution of atherosclerosis in arterial walls. Method: The length and thickness of the wall and its layers were measured and the vasa vasorum were conted. Vascular density, considered as the number of vessels per square millimeter in healthy and diseased areas, was calculated along with mean value, variance, standard deviation and the confidence interval for values and null hypotesis. Variances were analyzed, and the comparative and paired "t" test was applied. Results: There were differences in thicknesses of the healthy (27 :m) and diseased (120.5 :m) intima (p < 0.001) and between the healthy (125.2 :m) and diseased (102.3 :m) media (P < 0.001). Vascular density was higher in healthy fragments (mean ± CI 99% = 4.40 ± 1.4 vs 2.20 ± 0.8, = < 0.001 for Ha; 0 ± 1.0775 for Ho; paired "t" 2.1 ± 1.1, P < 0.01), and higher compared to the healthy intima area (31.6 vs 5.1, P < 0.01). There were no differences compared to the media layer area. The relation between the number of vessels and the length of the vascular segments was greater in the healthy fragments (mean ± CI 95% = 4.9 ± 1.02 vs 3.5 ± 0.68; 1.4 difference, P < 0.05). Conclusion: Vascular density is lower in the atherosclerotic aortic wall than in the healthy aorta and this could initiate the pathologic process.
Key words: Aortic hypovascularity, Atherosclerosis, Arterial walls.
Introducción
Hay varias explicaciones hipotéticas del proceso fisiopatógeno de la aterosclerosis1-12 pero ninguna aclara la distribución irregular de las lesiones arteriales en zonas aledañas.
Es conocido que las paredes arteriales aumentan su grosor de manera directamente proporcional a la edad del individuo y que su vascularidad nutricia -vasa vasorum- aumenta de la misma manera,13 pero no se conoce si tales aumentos ocurren igual en arterias sanas que afectadas por aterosclerosis, ni si una desproporción en el desarrollo de ambas participa en la génesis de las lesiones ateromatosas al comprometer la nutrición muscular y favorecer el daño celular propio de esta enfermedad. Cabe preguntarse: ¿Existe desproporción de la pared arterial y el desarrollo de vasa vasorum en arterias de conductancia afectadas por aterosclerosis? Se pretende demostrar que las arterias centrales como la aorta de personas afectadas por aterosclerosis tienen menor desarrollo de vasa vasorum que el esperado para el grosor de la pared, y con ello que la desproporción representa un elemento en la génesis de la enfermedad.
Material y métodos
Se estudiaron aortas torácicas de cadáveres humanos, de sexo masculino, entre quinta y séptima décadas de vida, escogiendo fragmentos con lesiones ateromatosas y porciones sanas aledañas. La lesión ateromatosa se diagnosticó desde el punto de vista macroscópico por zonas de engrosamiento, endurecimiento, calcificación y ulceración; desde el punto de vista microscópico por proliferación y migración de células musculares hacia la íntima, presencia de células espumosas y, en ocasiones, por depósito de colágena o de calcio y hemorragia en la capa íntima.
Los fragmentos se fijaron con formol al 10%, se incluyeron en parafina, se cortaron a tres micras, se tiñeron con técnica de Verhoeff para fibras elásticas y se examinaron con microscopio de luz usando aumentos de 10X y 36X en el objetivo y 10X en el ocular.
Se compararon los grosores de las capas media e íntima de fragmentos sano y enfermo en cada caso. Se midió la densidad vascular, es decir la relación entre el número de vasa vasorum en la adventicia, y el área del segmento arterial estudiado (N/G); el primero por cuenta simple de estructuras identificadas en la adventicia por su forma circular o elíptica, pared vascular y contenido de eritrocitos, o por depósito de eritrocitos en estructuras de forma elíptica sin pared, en el extremo más externo de la capa media;14 no se diferenciaron arteriolas, vénulas o capilares.13
Para cuantificar el área se utilizó micrómetro ocular: se midieron la longitud de los bordes de la íntima y la adventicia y se sumaron, se dividió entre dos, luego se multiplicó el resultado por el promedio de medidas de grosor de la pared en varios puntos de cada fragmento.13
De manera adicional, con semejante método, se buscó la relación correspondiente a número de vasa vasorum en la adventicia y el área de corte en las capas íntima (N/GI) y media (N/GM), así como la relación entre número de vasos y la longitud de todo el segmento arterial estudiado (N/L).
Estadística: El tamaño de la muestra se calculó para comparar proporciones con d = 1.8, alfa = 0.01, beta = 0.99.
Los resultados se expresan como: número de vasos por milímetro cuadrado en cuanto a N/ G, N/Gi y N/GM; número de vasos por milímetro lineal en N/L.
Con el promedio de cada caso en dos grupos llamados sano y enfermo se calculó valor medio, varianza, desviación estándar de cada grupo y se compararon las varianzas. Con varianzas iguales se aplicó prueba "t" para dos muestras, intervalo de confianza de 95% para valores distribuidos en dos colas (Ha) e intervalo de confianza correspondiente a hipótesis nula (Ho) de que no hay diferencia entre medias. Se aplicó también prueba "t" pareada. Ante varianzas distintas U de Mann-Whitney con alfa 0.05.
Ética: Tratándose de productos obtenidos de necropsias autorizadas legalmente no existe implicación alguna, sólo se ha mantenido el anonimato de las personas incluidas.
Resultado
Se estudiaron ocho fragmentos de aorta sanos y ocho enfermos.
Se encontró diferencia estadísticamente significativa entre el grosor de la capa íntima sana y la enferma, y entre el de la capa media sana y enferma. La íntima se ha engrosado y la media se ha adelgazado (Tabla I).

La densidad vascular es mayor en fragmentos de aorta sana, en especial en relación con el área de la capa íntima, pero no difiere en relación con el área de la media sana o enferma. Se confirma el hallazgo porque también es mayor la relación lineal, es decir el número de vasos comparada con la longitud del segmento estudiado. Excepto al comparar la capa media, en los demás la diferencia es estadísticamente significativa (Tabla II). Hay menor número de vasos nutricios en la adventicia de segmentos arteriales enfermos.
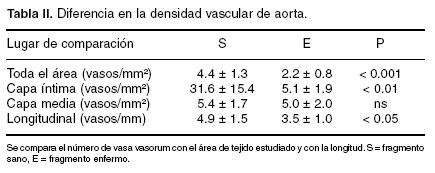
Existe disminución en la densidad vascular en el segmento aórtico afectado por aterosclerosis, respecto al sano (Fig. 1) lo que pone en entredicho la cantidad de circulación nutricia de la arteria en la zona enferma.

Discusión
El resultado obtenido muestra disminución de la densidad vascular de la pared de aorta enferma de aterosclerosis comparada con la de porciones sanas aledañas. Hay menor cantidad de vasa vasorum en donde la capa íntima se ha engrosado y la media se ha adelgazado por separación y migración de células musculares. Esta disminución de la cantidad de vasa vasorum es real porque se confirma al comparar número de vasos con longitud de los segmentos arteriales estudiados.
La disminución de la densidad vascular es importante pues se conoce que la circulación nutricia de las arterias procede en parte del flujo sanguíneo que contienen, pero también de vasa vasorum en las porciones externas de la capa media y en la adventicia y depende del número de vasos, de su estado de dilatación o constricción y, en algunos casos, de estructuras neoformadas -en condiciones patológicas- en la capa íntima.14
Partiendo de las observaciones de que la aterosclerosis es una enfermedad que -salvo en situaciones especiales- aparece tardíamente en la vida del hombre y que está relacionada con el metabolismo del colesterol -el cual cambia de manera notable a partir de la cuarta década de vida-15 se puede entender que el problema surge del agotamiento de un proceso metabólico, y el sustrato puede ser la desproporción entre el engrosamiento de la pared arterial y su dotación de vasos nutricios procedentes de la adventicia, por comprometer la nutrición vascular y exponer al endotelio, a la capa íntima y a porciones internas de la muscular a funcionar de manera inadecuada.
Scotland y sus colaboradores afirman que aunque no se conoce bien el papel de vasa vasorum en la nutrición de las paredes arteriales se han implicado en la patogenia de enfermedades como la aterosclerosis.16 Baker y sus colaboradores17 han propuesto que la formación de la lesión puede ser iniciada por hipoxia de la pared arterial, secundaria a oclusión o escisión de vasa vasorum de la adventicia. Santilli y colaboradores han demostrado un gradiente de oxígeno en la pared arterial sometida a injerto plástico.18 Kai y sus colaboradores han mostrado cómo en la hipertensión arterial experimental ocurre engrosamiento de la pared arterial y aumenta la densidad vascular, quizá para compensar la hipoxia resultante; pero también han mostrado, de manera experimental, que la coexistencia de hipercolesterolemia impide este aumento compensatorio de vasa vasorum.19
El trastorno metabólico ocurre en el transporte reverso de colesterol y es por carencia de apolipoproteína A1 y consecuentes: producción inadecuada de lipoproteína de alta densidad, dificultad para extracción de colesterol de la célula manteniéndolo esterificado. Las células que han retenido colesterol esterificado se vuelven presas de monocitos y forman células espumosas.20
Brown y Goldstein han demostrado que la acumulación de colesterol intracelular pone en marcha un mecanismo de inhibición que lleva a la célula a detener la síntesis de receptores de LDL hasta en 90%20 con lo que se genera hiperlipoproteinemia. También se conoce que concentraciones elevadas de colesterol en la membrana inhiben la bomba de calcio ATPasa e inducen acumulación anormal de calcio dentro de la célula, activación de proteasa y fosfolipasa, destrucción de la membrana e interrupción de la producción de ATP mitocondrial con desequilibrio energético y muerte celular.21
¿Por qué la aterosclerosis afecta selectivamente algunas áreas de pared arterial mientras que otras, aledañas, permanecen indemnes?
Actualmente se acepta que hay engrosamiento localizado de la capa íntima desde el nacimiento, y se cree que pudieran ser de adaptación en sitios en donde la fricción de la sangre erosiona al endotelio vascular iniciando el proceso de ateroma, lo que no se explica es ¿por qué las lesiones características de la enfermedad aparecen treinta o cuarenta años después?22
Otra explicación es el concepto de "mosaico fluido de la membrana basal" que dice: El determinante del intercambio de lípidos es su estado físico y aunque en una porción de la membrana se puede llevar a cabo difusión rápida, la mayoría puede ser inmovilizada en zonas específicas con tiempo de difusión mucho más largo; el solo incremento de la relación colesterol/fosfolípido en la membrana permite agregación en regiones específicas aumentando el umbral de temperatura para promover la difusión de los lípidos lo que forma regiones ricas en colesterol llamadas "cuasicristalinas" en la membrana plasmática.
Como tal concepto no explica totalmente la existencia de estas zonas se ha propuesto una modificación denominada "modelo de placas" en la cual el punto de partida es la rotura de la membrana; las regiones ricas y pobres en colesterol reflejan la existencia de esas placas.21
Por fin, Santilli demostró que la inhalación de oxígeno al 40% reduce el gradiente a través de la pared.18 Baskerville y sus colaboradores han diseñado un método para restaurar la capa adventicia removida, la que resulta altamente vascularizada al forrar con material de polivinilo los vasos denudados.23 Además, Pisco encontró neoformación lenta y tardía de vasa vasorum, en la capa media, 18 meses después de angioplastía y colocación de férula endarterial, lo que sugiere que el proceso es reversible.24
Conclusiones
Demostramos aquí que hay disminución de la densidad vascular de la pared de aorta enferma de aterosclerosis comparada con aorta sana, especialmente relacionada con engrosamiento de la capa íntima y adelgazamiento de la muscular, pero por disminución del número de vasa vasorum en el fragmento afectado por la lesión. Este hallazgo apoya la ocurrencia de un proceso isquémico y concilia las vertientes de explicación del daño celular y la distribución de las lesiones.
Agradecimiento. A la Sra. Gusti Gould Pineda y a los médicos: Benjamín Villarán, Joseph Cadet y Narciso Guillén por su ayuda en la elaboración y revisión del resumen en inglés; a Joseph Cadet, Carlos Cardozo y Marie Bénédicte por la revisión del resumen en francés.
Referencias
1. Corday E: Why some physicians have concerns about cholesterol. A warenes program. Am J Cardiol 1989; 63: 497-502. [ Links ]
2. Ross R: Teorías que explican el proceso aterógeno. Factores que influyen en la aterogénesis. En: Hurst W: El Corazón. 6a ed. México. Interamericana Mc Graw-Hill, 1988: 885-902. [ Links ]
3. Wood P: Diseases of the Heart and Circulation. Philadelphia. J.B. Lippincott Company, 1968: 813. [ Links ]
4. Harrison TR: Enfermedades isquémicas del corazón. México. Salvat, 1970: 21-43. [ Links ]
5. Goldstein J: Genetic aspects of hyperlipidaemia in coronary Heart disease. En: Braunwald E: The Heart. Failure and Infarction. New York. H.P. Publishing Co Inc, 1973: 205-218. [ Links ]
6. Goldstein J, Brown M: Nobel Lecture. Dec 9, 1985. [ Links ]
7. Livshits G: Multivariate analysis of twenty year follow up of the Donolo-Tel Aviv prospective coronary artery disease study and usefulness of High Density Lipoprotein Cholesterol percentage. Am J Cardiol 1989; 63: 676-681. [ Links ]
8. Maciejko J: Apolipoprotein A1 as a marker of angiographically assessed coronary artery disease. New Engl J Med 1983; 309: 385-389. [ Links ]
9. Kottke BA: Assessment of Apolipoprotein A1 as a discriminator of coronary artery disease. Am J Cardiol 1986; 57: 11C-17C. [ Links ]
10. Tasaki H: Comparison of serum lipid values in variant angina pectoris and fixed coronary artery disease with normal subjects. Am J Cardiol 1989; 63: 1441-1445. [ Links ]
11. Acoltzin C, Lezama Y: Lack of Apoprotein A1 in patients recovering from myocardial infarction. Am J Cardiol 1990; 66: 124. [ Links ]
12. Kashyap M: Basic considerations in the reversal of atherosclerosis: significance of high density lipoprotein in stimulating reverse cholesterol transport. Am J Cardiol 63: 56H-59H. [ Links ]
13. Okuyama K, Yaegashi H, Takahashi T, Sasaki H, Mori Sh: The development of vasa vasorum of the human aorta in various conditions. Arch Patol Lab Med 1988; 112: 721-725. [ Links ]
14. Williams JK, Heistad DD: The vasa vasorum of the arteries. J Mal Vasc 1996; 21(Suppl C): 266-269. [ Links ]
15. The expert panel: Report of the national cholesterol education program. Expert panel on detection, evaluation and treatment of high blood cholesterol in adults. Arch Intern Med 1988; 148: 36-39. [ Links ]
16. Scotland RS, Vallance PJ, Ahluwalia A: Endogenous factors involved in regulation of tone of arterial vasa vasorum: implications for conduit vessel physiology. Cardiovasc Res 2000; 46(3): 403-11. [ Links ]
17. Baker SG, Talbert A, Cottom S, Baskerville RA, Martin JF: Arterial intimal hyperplasia after occlusion of the adventitial vasa vasorum in the pig. Atheroscler-Thromb 1993; 13(1): 70-77. [ Links ]
18. Santilli SM, Wernsing SE, Lee ES: The effect of supplemental oxygen on the transarterial wall oxygen gradients at a prosthetic vascular graft to artery anastomosis in the rabbit. Ann Vasc Surg 2001; 15: 435-442. [ Links ]
19. Kai H, Kawahara F, Tokuda K, Shibata R, Kusaba K, Miiyama H, et al: Coexistence of hipercholesterolemia and hypertension impairs adventitial vascularization. Hypertension 2002; 39: 455-459. [ Links ]
20. Aburatani H, Matsumoto A, Kodama T, Fukazawa EH, Itakura H: Increased levels of messenger ribonucleic acid for apolipoprotein E in the spleen of Probucol-treated rabbits. Am J Cardiol 1988; 62: 60B-65B. [ Links ]
21. Mas-Oliva J: Modulación de la función de membrana celular por colesterol y su relación con enfermedad. Gac Med Méx 1994: 130(6): 438-445. [ Links ]
22. Stary HC, Chandler AB, Dinsmore RE, Fuster V, Glagov S, Insull W jr: A definition of advances types of atherosclerotic lesions and a histological classification of atherosclerosis: A report from committee on vascular lesions of the council on atherosclerosis. American Heart Association. Circulation 1995; 92(5): 1355-74. http://www.amhrt.org/Scientific/statement/1995/17950005.html [ Links ]
23. Baskerville PA, Martin JF: The adventitia and atherogenesis: removal initiates intimal proliferation in the rabbit wich regress on generation of "neoadventitia". Atherosclerosis 1994; 105: 131-144. [ Links ]
24. Pisco JM, Correia M, Esperança Pina JA, De Sousa LA: Vasa vasorum changes following stent placement in experimental arterial stenosis. J Vasc Radiol 1993; 4: 269-273. [ Links ]














