Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.74 n.2 Ciudad de México Apr./Jun. 2004
Investigación básica
Estudio de los extractos de Magnolia grandiflora sobre el músculo cardíaco de cobayo
Study of Magnolia Grandiflora extracts in guinea pigs cardiac muscle
Leonardo del Valle Mondragón*, Fermín Alejandro Tenorio López*, Juan Carlos Torres Narváez*, Gabriela Zarco Olvera*, Gustavo Pastelín Hernández*
* Departamento de Farmacología. Instituto Nacional de Cardiología "Ignacio Chávez".
Correspondencia:
Leonardo del Valle Mondragón.
Departamento de Farmacología.
Instituto Nacional de Cardiología "Ignacio Chávez".
(INCICH, Juan Badiano No. 1, Col. Sección XVI, Tlalpan 14080, México D.F.).
Tel.: 55-73-29-11 Exts. 1317 ó 1344
Fax.: 55-73-09-26.
Email: leonardodvm65@hotmail.com. leonardodvm65@correo.unam.mx
Recibido: 25 de noviembre de 2003
Aceptado: 23 de marzo de 2004
Resumen
Se evaluó farmacológicamente los extractos de diversas variedades de Magnolia grandiflora sobre el músculo cardíaco. Se recolectó en el período de marzo a julio hojas y flores de Magnolia grandiflora nativa del Instituto Nacional de Cardiología "Ignacio Chávez", de la zona norte, poniente y oriente del Distrito Federal, de los estados de Puebla, Colima y Chiapas. Éstas se procesaron por separado y los extractos se obtuvieron por maceración con una mezcla de etanol-agua (1:3 v/v) a 4°C durante dos semanas. El análisis cualitativo se realizó por cromatografía en capa fina, columna y de líquidos de alta resolución (CLAR). El análisis funcional y molecular se efectuó por reactividad química específica y resonancia magnética protónica (RMN 1H). La evaluación farmacológica se realizó en corazones aislados de cobayo macho. Los extractos, fracciones y compuestos se administraron en bolos seriados bajo un estudio de curvas dosis-respuesta gradual en donde se midió la presión intraventricular izquierda y la presión de perfusión coronaria, evaluando así el efecto inotrópico positivo y vasodilatador de los extractos de Magnolia grandiflora. Se identificó y aisló vulgarenol y 2-p-hidroxifenil-2-OH-etilamina, por lo que los resultados sugieren que su efecto vasodilatador e inotrópico positivo, se deben a la presencia de estas sustancias, las cuales se complementan con magnograndiólido y tiramina.
Palabras clave: Magnolia grandiflora, Inotropismo, Vasodilatación, Vulgarenol, Tiramina.
Abstract
Several extracts from diverse Magnolia grandiflora varieties were pharmacological evaluated in the cardiac muscle. From March to July, flowers and leaves from Magnolia grandiflora, native from the National Institute of Cardiology "Ignacio Chávez", from north, west, and orient zones from Mexico City, and from Puebla, Colima and Chiapas states were collected. They were separately processed and the extracts were obtained by maceration with ethanol-water (1:3 v/v) at 4°C during two weeks. Qualitative analysis was accomplished with thin-layer, column and high-performance liquid chromatographies (HPLC). Functional and molecular analysis was made by specific chemical reactivity and by protonic magnetic resonance (RMN 1H). Pharmacological evaluation was completed in isolated and perfused male guinea pigs hearts. Extracts, fractions, and compounds were administrated by serial bolus in a gradual dose-response curves study in which left intraventricular pressure and coronary perfusion pressure were recorded, evaluating by such the positive inotropic and vasodilator effects of Magnolia grandifloraextracts. Vulgarenol and 2-p-hydroxyphenyl-2-hydroxy-ethylamine were isolated and identified, and the obtained results suggest that its positive inotropic and vasodilator effects are owed to these substances, being complemented by magnograndiolide and tyramine.
Key words: Magnolia grandiflora, Inotropism, Vasodilation, Vulgarenol, Tyramine.
Introducción
La Magnolia grandiflora fue tipificada por Linneo1 en 1759. El género Magnolia fue otorgado por Linneo en honor a Pierre Magnol, profesor de botánica en Montpellier entre los siglos XVII y XVIII. La especie grandiflora alude a sus flores de gran tamaño. Las hojas son alternas, dispuestas en manojos terminales, de 10-20 cm de longitud y unos 7-10 cm de anchura. Son elípticas u oblongo-ovadas, con la punta aguda y la base cuneada, coriácea, de color verde brillante en el haz y ferrugíneo-pubescentes en el envés. Las flores se encuentran situadas sobre pedicelos tomentosos, erguidas, solitarias, de gran tamaño, de hasta 20 cm de diámetro. Poseen de 6-12 pétalos estrechados en la base, de color blanco, y 3 sépalos de aspecto petaloide. El fruto tiene forma de piña ovalada de unos 10 cm de longitud. Las semillas son aplanadas, de color rojo, de aproximadamente 1.0 a 1.3 cm de longitud, sujetas al folículo por un funículo filiforme. El fruto realmente es un conjunto de folículos agrupados en una estructura leñosa.2,3
Por otra parte, investigaciones histórico-botánicas realizadas en México,3,4 refieren, desde tiempos prehispánicos, que las magnoliáceas, fueron utilizadas para el tratamiento de padecimientos cardíacos que se acompañaban de palpitaciones y problemas respiratorios, Las culturas Maya, Azteca y Tolteca elaboraban infusiones de hojas, flores y corteza de Talauma mexicana y Persea americana entre otras magnoliáceas como la grandiflora (esta última introducida en América por los españoles en tiempos de la Colonia),4 ya sea ingeridas o en apósitos, para aliviar los problemas cardíacos hasta hoy en día.
Por tal razón, grupos de investigadores a nivel mundial, se han dedicado al estudio químico y farmacológico sobre diversas magnoliáceas, centrando su atención en la actividad cardiotónica sin olvidar el efecto vasodilatador.5 Estudios realizados por Pérez Cirera6,7 en 1937 y 1938, contribuyeron con la evaluación farmacológica de la Yolloxóchitl, reportando la acción de sus extractos sobre el corazón y la circulación coronaria en el modelo cardiopulmonar de perro.
La Magnolia grandiflora contiene: tiramina,8 flavonoides,9 terpenos,10 alcaloides,11 alcoholes fenólicos,12 glicósidos13 y magnograndiólido14 que pueden originar disminución variable del tono muscular en tráquea, vejiga e intestino en especies tales como cobayo, rata y conejo, mientras que en la musculatura vascular aórtica, el efecto de relajación no es evidente, más no así en el músculo liso vascular coronario.5,15-18 Se ha reportado conjuntamente, el efecto inotrópico positivo que ejercen los extractos sobre el músculo cardíaco, tanto in vitro como in vivo, en especies tales como perro, cobayo, conejo y tortuga a nivel de corazón aislado y de animal íntegro.17-19 Se han llevado a cabo estudios sobre el efecto termorregulador en pichones.17
La colecta, la limpieza, el secado y la preservación adecuada, son fundamentales para tener disponible la cantidad de material vegetal, durante el tiempo de estudio, sin que pierda su efecto o acción determinada, así como el mantener un número y cantidad presente de componentes químicos.20-22
El empleo de métodos cromatográficos en capa fina, en columna y de cromatografía de líquidos de alta resolución (CLAR), son herramientas que permiten aislar, purificar e identificar los componentes bioactivos en una gran diversidad de plantas.23-25 Asimismo, pruebas de revelado cromatográfico selectivo26 y pruebas de reactividad funcional27 efectuadas a los extractos aislados, permiten obtener en algunos casos una identificación precisa del compuesto, mientras que en otras ocasiones, sólo se puede efectuar una tipificación del grupo de sustancias químicas a la cual pertenece un cierto componente de interés. Para dilucidar la estructura química, estas pruebas cromatográficas se contrastan con un estudio espectroscópico de resonancia magnética protónica (RMN 1H),28-30 lo cual permite delimitar qué moléculas se encuentran presentes en un determinado extracto de un producto natural de interés. En casos en los cuales es difícil identificar una molécula, se pueden utilizar las espectroscopías de infrarrojo, de masas, o bien, puede emplearse la cristalografía por difracción de rayos-X, o la resonancia magnética nuclear tridimensional.28-31 En algunos casos, y como prueba complementaria, puede utilizarse el análisis de tipo funcional a nivel de reactividad química 27,32,33.
Así, se estudiaron los extractos de Magnolia grandiflora sobre el músculo cardíaco, evaluando la actividad inotrópica positiva y vasodilatación coronaria, con la finalidad de aportar nuevas expectativas alentadoras en la terapéutica cardiovascular.
Material y métodos
Colecta y preservación del material vegetal
Se colectaron, de marzo a julio, hojas y flores frescas de Magnolia grandiflora nativa del Instituto Nacional de Cardiología "Ignacio Chávez", de las zonas norte, oriente y poniente del Distrito Federal y de los estados de Puebla, Colima y Chiapas. Las hojas y los pétalos fueron lavados primeramente con abundante agua corriente, seguido de un lavado con una solución 1.0 mM de sulfato de cobre pentahidratado (JT Baker, grado ACS) en solución salina isotónica (Pisa), para finalmente lavarse con agua desionizada. Posteriormente fueron secadas a la sombra a temperatura ambiente bajo papel secante (Glossmman). Por separado, las hojas y los pétalos se preservaron en bolsas de papel encerado (Cera-Pel), a las cuales se les incorporó un sobre de fibra de vidrio (Vitrix) que contenía una mezcla de cloruro de calcio granular (JT Baker, grado ACS) y sílica gel 60 (Merck, para cromatografía en capa fina) como agentes secantes. Una vez obtenido el material de estudio, éste se almacenó en un lugar fresco y seco, protegido de la luz, hasta su uso.
Preparación de los extractos
Hojas y pétalos se trituraron finamente y por separado en un mortero de porcelana (Coors). Se colocaron, en cada caso, 250 g del material triturado en 1,000 mL de una mezcla de etanol (Sigma, grado analítico)-agua (1:3 v/v), macerándose a una temperatura de 4 a 8°C durante una semana, monitoreando el avance de la extracción mediante cromatografía en capa fina. Las mezclas se filtraron primeramente a través de gasa muy fina y posteriormente a vacío con membranas de nitrocelulosa de 0.45 μm (Millipore). Los filtrados de hojas y pétalos se preservaron en frascos de vidrio color ámbar (Pyrex) con tapón de rosca de polivinilpirrolidona a temperatura de 4°c ± 1°c
Evaluación farmacológica
La actividad biodinámica de los extractos y fracciones de hojas y pétalos, se evaluó mediante la preparación de Langendorff18 en corazón aislado de cobayo macho (450 a 500 g de peso), previa autorización del Comité de Ética para el uso y cuidado de animales de experimentación de esta Institución. Se empleó solución de Krebs como líquido de perfusión a un flujo de 10 mL/ min a 37oC, con saturación de carbógeno al 5% (Aga). Los extractos y compuestos se administraron en bolos seriados (5 a 40 μL) mediante un dosificador (Hamilton) adyacente a la cánula de perfusión, referidos ambos en la aorta ascendente segúnLangendorff.18 Bajo estas condiciones, se midió la contracción, por inserción de un balón de látex (Rubber) en el ventrículo izquierdo, conectado a un transductor hidroneumático (Statham Instruments, Inc. 7320). La presión de perfusión coronaria, fue medida con un transductor de presión (Glixo R25), referido en la aorta ascendente a nivel de los ostium derecho e izquierdo. Los registros de presión respectivos, se realizaron en un polígrafo (Grass-79D). La frecuencia cardíaca se mantuvo constante a 1 Hz mediante estimulación con un marcapaso epicárdico ventricular (Grass-SIU5). Se registró en forma continua un electrograma aurículo-ventricular, para lo cual se utilizó un osciloscopio (Tektronix 7904). El efecto y la potencia de los extractos y fracciones aisladas de hojas y pétalos, fueron medidos bajo un estudio de curvas dosis-respuesta gradual. El análisis estadístico empleado consistió en Análisis de Varianza de una vía, seguido de una prueba de t de Student para datos pareados34 con una n = 10 por grupo y una P < 0.05.
Estudio cromatográfico
Para el estudio cromatográfico cualitativo, se emplearon placas de aluminio recubiertas con sílica gel GF254 (Merck, para cromatografía en capa fina) con revelador para luz ultravioleta, de 25 mm de ancho por 60 mm de alto y 0.25 mm de espesor. También, se empleó una columna confeccionada en vidrio borosilicato de alta resistencia (Pyrex), de 12 mm de diámetro por 600 mm de alto, empacada con sílica gel para columna 60F (Merck, para cromatografía en columna), con un tamaño de partícula de 250-300 μm, disolventes grado analítico (Merck) ,tales como acetato de etilo, éter etílico, n-butanol, isopropanol, etanol, metanol y acetonitrilo, además de agua bidestilada. Se emplearon técnicas de revelado cromatográfico bajo luz ultravioleta, vapores de yodo y reacciones químicas específicas de tipo óxido-reducción y complejométricas coloridas, bajo un análisis tanto en capa fina como a la gota según Feigl.33
El fraccionamiento, la purificación y el estudio cromatográfico cuantitativo de los extractos acuosos de hojas y pétalos, se realizó en un cromatógrafo de líquidos (Gold System de Beckman), bajo las siguientes condiciones cromatográficas: columna de 25 cm de largo por 0.4 cm de diámetro interno, empacada con Lichrosorb C-18 con un tamaño de partícula de 5 μm (Phenomenex), una fase móvil de agua, metanol (Mallinckrodt, grado HPLC) y acetonitrilo (Mallinckrodt, grado HPLC) (5:3:1 v/v), pH de 6.5 ± 0.1, una velocidad de flujo de 1.2 mL/min a temperatura ambiente, detector de arreglo de diodos (Gold System de Beckman, RP168) y longitud de onda de 254 nm. El volumen de muestra por análisis fue de 100 μL. Para la prueba de identificación y cuantitatividad de los compuestos en las fracciones, se emplearon el estándar puro y el estándar interno. Las fracciones aisladas obtenidas, fueron concentradas in vacuo en un evaporador rotatorio (Evapotec), hasta sequedad de la muestra, para obtener un producto sólido y seco.
Estudio espectroscópico
El producto sólido obtenido fue secado a temperatura ambiente bajo corriente de nitrógeno gaseoso (Aga). Posteriormente, se solubilizó en una mezcla de etanol (Fluka, grado spectrum) y agua deuterados (Fluka, grado spectrum) (1:1 v/v) y se realizó el estudio de resonancia magnética protónica monofásica de interfase directa (W1:1H), a una frecuencia de 43 Hz con derivación simple (W½ de 1.00 a 0.65 Hz) con el equipo de espectroscopía de resonancia magnética protónica (SLM-Aminco RS16, SLM Instruments, Urbana IL).
Resultados
Todas las plantas recolectadas en el estudio fueron identificadas y clasificadas como Magnolia grandiflora L por la Unidad de Ecología Vegetal de la Facultad de Estudios Superiores Zaragoza de la Universidad Nacional Autónoma de México.
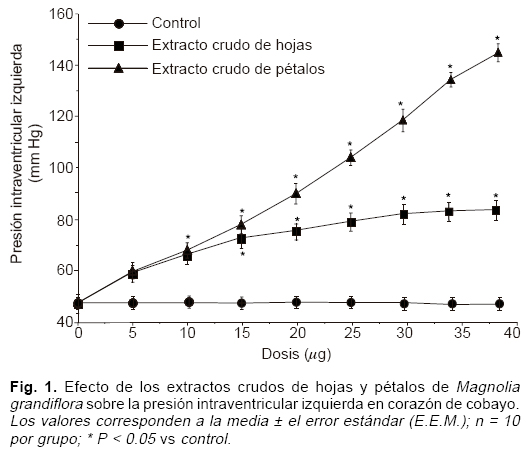
Los extractos crudos de las hojas y de los pétalos de las muestras preservadas de Magnolia grandiflora, muestran una acción inotrópica positiva en relación dosis-efecto (Fig. 1), al incrementarse, respecto al grupo control, la presión intraventricular izquierda en el corazón de cobayo, siendo más evidente el efecto con el extracto crudodepétalos. Con respecto a la presión de perfusión coronaria, se observó que los extractos crudos de hojas y pétalos la reducen considerablemente (Fig. 2) en 34 mm Hg y en 21 mm Hg, respectivamente, obteniendo mayor efecto vasodilatador provocado por la administración del extracto crudo de pétalos de Magnolia grandiflora. Cabe hacer notar que los semejantes resultados, tanto del efecto inotrópico positivo como del efecto vasodilatador, fueron observados en igual magnitud en las siete muestras de Magnolia grandiflora que fueron colectadas para este estudio.

Se estudiaron por cromatografía en capa fina, columna y CLAR a todos los extractos crudos de pétalos de Magnolia grandiflora, para analizar, fraccionar y purificar los componentes de cada extracto. Las pruebas cualitativas en cromatografía de capa fina bajo reactividad funcional presuntiva, demostraron la presencia de glicósidos tipo cromona (flavonoides glicosilados), adicionalmente, se identificó la presencia de flavonoides, sesquiterpenos, terpenos, polifenoles y tiramina (Tabla I).
Por otra parte, en el estudio por CLAR efectuado al grupo de extractos de las magnolias recolectadas en el Distrito Federal, se observaron cromatogramas muy semejantes con un mismo número y resolución de componentes (Fig. 3A). Al analizar los extractos de los pétalos de las magnolias recolectadas en los estados de Puebla, Colima y Chiapas se observó similitud entre ellos con relación a la composición y resolución de los cromatogramas (Fig. 3B). Al contrastar ambos cromatogramas (3A y 3B), se observó que éstos difieren en el número de componentes. En el cromatograma correspondiente a los extractos de las magnolias recolectadas en el Distrito Federal (grupo A), se observan 24 fracciones, mientras que el cromatograma de los extractos correspondientes a las magnolias recolectadas en Puebla, Colima y Chiapas (grupo B) se observaron 21 fracciones.
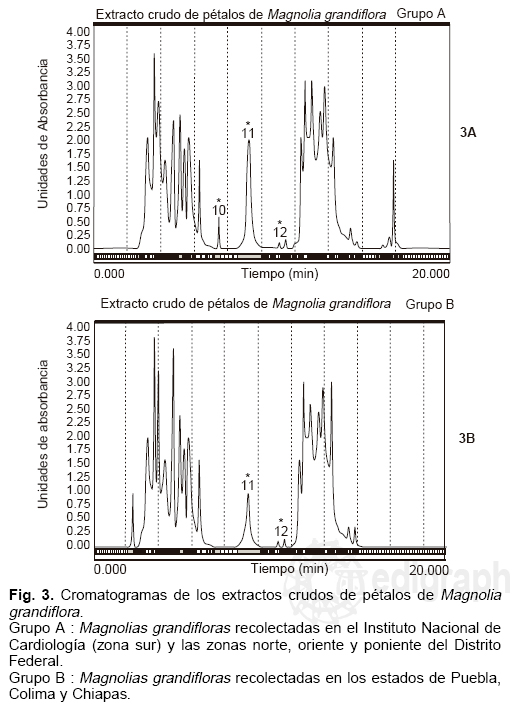
Se aislaron y purificaron por CLAR las fracciones 10, 11 y 12 correspondientes al grupo A y las fracciones 11 y 12 del grupo B, las cuales fueron sometidas a un estudio de resonancia magnética protónica monofásica, el cual indicó que la fracción 10 de los extractos del grupo A corresponde a un derivado hidroxilado de la tiramina, la 2-p-hidroxifenil-2-OH-etilamina, mientras que las fracciones 11 y 12 en los extractos de ambos grupos (A y B) resultaron ser tiramina y vulgarenol, respectivamente (Fig. 4). Posteriormente, se analizaron las fracciones restantes de los extractos crudos del grupo B tratando de identificar la 2-p-hidroxifenil-2-OH-etilamina sin éxito alguno, lo cual indica que esta sustancia sólo se encuentra presente en la Magnolia grandiflora originaria del Distrito Federal.
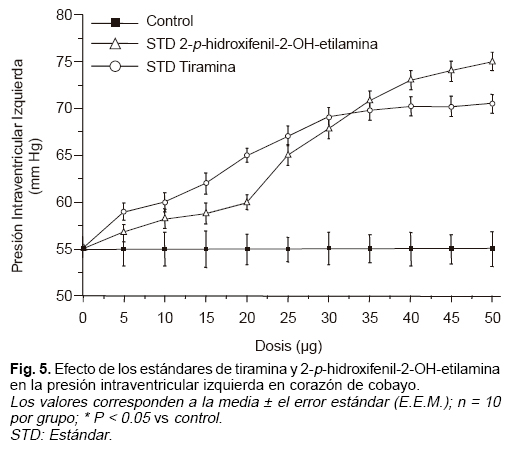
Se evaluaron estándares primarios (2-p-hi-droxifenil-2-OH-etilamina y tiramina) en un estudio por separado de curvas dosis-respuesta gradual en el modelo de corazón aislado de Langendorff,18 para evaluar su efecto sobre la contracción ventricular, observándose un efecto inotrópico positivo (Fig. 5), al incrementar la presión intraventricular izquierda a medida que se aumenta la dosis. Al comparar los estándares con sus respectivas fracciones 10 y 11 aisladas directamente de los extractos crudos de pétalos de Magnolia grandiflora (Figs. 6 y 7), se observó un comportamiento muy similar al que generan los estándares respectivos sobre el efecto inotrópico positivo en el músculo cardíaco.


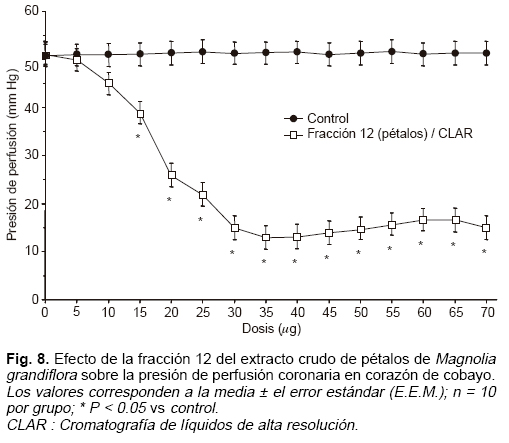
Con respecto a la fracción 12, la cual corresponde al vulgarenol, tras ser evaluada bajo el modelo de corazón aislado de Langendorff,18 observamos que ésta reduce de manera muy significativa la presión de perfusión coronaria hasta casi en 38 mm Hg en comparación con el control, lo cual evidencia un marcado efecto vasodilatador, según se puede inferir de la curva de decremento de presión (Fig. 8).
Discusión
Con el presente estudio, los resultados sugieren que los extractos de Magnolia grandiflora ejercen efecto inotrópico positivo en el corazón, así como también una vasodilatación coronaria, lo cual ya se había descrito para esta magnoliácea.5 Se identificó la presencia de tiramina, la cual aporta una acción inotrópica positiva en el músculo cardíaco mediada por una estimulación beta-adrenérgica, que tiene como resultado un flujo endógeno de noradrenalina, estimulando la acción simpática, lo que desencadena un incremento en la contracción, como lo sugieren los estudios reportados por Takauchi,35 Scott,36 Schafer,37 Kobayashi38 y Dzimiri.39 Se logró identificar un derivado de tiramina(2-p-hidroxifenil-2-OH-tiramina) que hasta hoy no estaba descrito para Magnolia grandiflora, y cuya acción es homóloga a la tiramina; cabe señalar que esta sustancia sólo fue detectada en las magnolias recolectadas en el Instituto Nacional de Cardiología "Ignacio Chávez" y en las zonas norte, oriente y poniente del Distrito Federal, más no así en las magnolias recolectadas en los estados de Puebla, Colima y Chiapas, lo cual puede deberse a factores ambientales, ya que en el Distrito Federal predomina una atmósfera altamente oxidante,40-47 lo cual pudiera haber propiciado reacciones químicas en la planta que favorecieran la presencia de esta sustancia derivada de tiramina.
Por otra parte, con la investigación realizada, cabe resaltar que se identificó el sesquiterpeno vulgarenol, que no ha sido descrito para Magnolia grandiflora, y se encuentra presente en todas las variedades estudiadas. Al parecer, el vulgarenol es capaz de generar una vasodilatación coronaria según se infiere de los resultados obtenidos al evaluar la presión de perfusión coronaria en el corazón aislado, observando un decremento en un mecanismo dosis dependiente. Tal efecto pudiera estar mediado por una vasodilatación vía óxido nítrico/guanosín monofosfato cíclico, como lo sugieren los estudios en sesquiterpenos reportados por el-Feraly,48Andersson,49 Koo,50 y Carvajal.51
Por lo anterior, nuevos estudios serán necesarios para estudiar la vía de acción tanto del 2-p-hidroxifenil-2-OH-etilamina como del vulgarenol, ya que ambas sustancias presentan acción farmacológica atribuida a los extractos de la Magnolia grandiflora dentro de la medicina tradicional.
Conclusión
Los extractos crudos de hojas y pétalos de Magnolia grandiflora contienen los compuestos: 2-p-hidroxifenil-2-OH-etilamina, tiramina y vulgarenol, los cuales inducen sobre el músculo cardíaco de cobayo un efecto inotrópico positivo y una acción vasodilatadora a nivel coronario.
Referencias
1. Linneo C: Systema naturae. 10th ed. Londres. Vol. 2, 1759. p 1082-1090. [ Links ]
2. de Micheli-Serra A: Acerca de la terapéutica digitálica. Bosquejo histórico. Gac Méd Méx 2000; 136(5): 511-518. [ Links ]
3. Krieger L: Indigenous folk botany. Nederland. Time-Life International, 1965. p 45-62. [ Links ]
4. Kelly I: Folk practices in North Mexico. In: Latin American Monographs. No. 2, Institute of Latin American Studies. The University of Texas, Texas.1965. p 84-90. [ Links ]
5. Mellado V, Chavez SMA, Lozoya X: Pharmacological screening of the aqueous extracts of Magnolia grandiflora L. Arch Invest Med 1980; 11: 335-346. [ Links ]
6. Pérez CR, Roca J: Contribución al estudio de la Farmacología del Yolloxóchitl (Talauma mexicana). Arch Latinamer Cardiol Hematol 1937; VII: 87-92. [ Links ]
7. Pérez CR, Roca J: Acción sobre el trabajo del corazón y sobre la circulación coronaria de los extractos acuosos de hojas de Yolloxóchitl (Talauma mexicana). Arch Latinamer Cardiol Hematol 1938; VIII: 109-115. [ Links ]
8. Matsutani H, Shiba T: Tyramine from magnolia species. Phytochemistry 1975; 14: 1132-1140. [ Links ]
9. Vourinen H, Määttä K, Törrönen R: Content of the flavonols myricetin, quercetin, and kaempherol in Magnolia grandiflora. J Agric Food Med 2000; 48: 2675-2680. [ Links ]
10. Poliam A, Lara M, Rodhanny G: Actividad estimulante de la fracción de saponósidos terpénicos de las Magnoliáceas. Rev Cubana Plant Med 1996; 1(4): 11-15. [ Links ]
11. Tatsuhiko N: Studies of the alkaloids of magnoliaceous plants. XII. Alkaloids of Magnolia grandiflora L. Pharm Bull 1954; 2: 31-328. [ Links ]
12. Gora J, Kalemba D, Kurowska A: Chemical substances of Magnoliaceas and Calendulaceas. Herba Hungarica 1980; 19: 151-171. [ Links ]
13. Juneau RI: A new glycoside from the bark of Magnolia grandiflora. Dis Abst Int 1973; 33: 3013-3015. [ Links ]
14. Luo XD, Wu SH, Ma YB, Wu DG, Zhou J: Sesquiterpenoids from Magnolia grandiflora. Planta Med 2001; 67: 354-357. [ Links ]
15. Middleton E, Kandaswami C, Theoharides TC: The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer. Pharmacol Rev 2000; 52: 673-751. [ Links ]
16. Nady WT: Medical Experimental. 3rd Ed., New York, Oxford University Press,1990.p 34-99. [ Links ]
17. Hissa R, George C, Stevens ED, Saarela S: Thermoregulatory response to tyramine in the pigeon. Acta Physiol Scand 1980; 110: 175-180. [ Links ]
18. Döring H, Dehnert H: The isolated perfused heart according to Langendorff. Friburgo de Brisgovia, Biomesstechnik-Verlag, 1988. p 1-70. [ Links ]
19. Wulf EW: The world resources ofthe useful animals. Moscú, Nauka, 1972. p 21-96. [ Links ]
20. Ramstad E: Pharmacognosy. New York, McGraw-Hill Book Company, 1956. p 419-449. [ Links ]
21. Abderhalden E: Handbuch der biologischen arbeitsmethoden. Berlin, Urban & Schwarzenberg, 1957. p 1-156. [ Links ]
22. Albers CC, Chambers MA: Laboratory Study Guide: General Pharmacognosy. Austin, Hemphill's Bookstores, 1951. p 22-79. [ Links ]
23. Block RJ, Durrum EL, Zweig G: Paper chromatography and Electrophoresis. 3rd Ed., New York, Academic Press, 1985. p 50-98. [ Links ]
24. Linskens HF, Jackson JF: Liquid chromatography in plant sciences. Berlin, Springer, 1987. p 25-35, 56-90, 121-200. [ Links ]
25. Golomm H, Feddor G: Practical HPL-Chromatography in Medicinal Plants. 3rd Ed., London, J. & A. Churchill, 1970. p 125-156. [ Links ]
26. Touchstone JC, Sherma J: Techniques and applications of thin layer chromatography. New York, Wiley-Interscience, 1985. p 20-54. [ Links ]
27. Siggia S: Quantitative Organic Analysis via Functional Groups. 4th Ed., New York, John Wiley and Sons, 1979. p 883. [ Links ]
28. Zweig G, Sherma J: Spectroscopic Methods of Analysis. New York, Academic Press, 1977. p 297. [ Links ]
29. Lemmedt T, Klauss W: The Nuclear Magnetic Resonance in Pharmacology. Philadelphia, Sonth-Hill, 1980. p 1-89, 160-201. [ Links ]
30. Kiwalth R, Kimari O: Start ofthe Nuclear Magnetic Resonance. New York, D'Evan Nostrand, 1988. pp 324. [ Links ]
31. Tatsime-Ohi K, Hiyamoto Y: Functional Analysis. New York, Shendo, 1989. p 7-51, 90-102. [ Links ]
32. Shriner R, Fuson R, Curtin D, Morrill T: The Systematic Identification of Organic Compounds. 6th Ed., Toronto, John Wiley & Sons, 1980. pp 604. [ Links ]
33. Feigl F, Anger V: Pruebas a la gota en análisis orgánico. México, El Manual Moderno, 1978. pp 772. [ Links ]
34. Box G, Hunter W: Estadística para Investigadores: Introducción al Diseño de Experimentos, Análisis de Datos y Construcción de Modelos. 3ª Ed., México, Reverté, 1999. p 345-580. [ Links ]
35. Takauchi Y, Yamazaki T, Akiyama T: Tyramine-induced endogenous noradrenaline efflux from in situ cardiac sympathetic nerve ending in cats. Acta Physiol Scand 2000; 168: 287-293. [ Links ]
36. Scott HJ, Donald PG, Fuller WR: In vivo cardiovascular responses to isoproterenol, dopamine and tyramine after prolonged infusion of isoproterenol. J Pharm Exp Ther 1984; 231(3): 633-639. [ Links ]
37. Schäfer RF, Poller K, Geissler M, Daul AE, Michel MC, Brodle OE: Influence or adrenoceptor and receptor blockade on the cardiovascular effects of exogenous noradrenaline and of endogenous noradrenaline released by infused tyramine. Naunyn-Schmiedeberg's Arch Pharmacol 1997; 355: 239-249. [ Links ]
38. Kobayashi M, Shimotori M, Chiba S: Direct effects of catecholamines and tyramine on sinoatrial conduction in isolated and blood-perfused dog atria. Jpn Heart J 1984; 25(2): 195-205. [ Links ]
39. Dzimiri N: Regulation of β-adrenoceptor signaling in cardiac function and disease. Pharm Rev 1999; 51(3): 465-501 [ Links ]
40. Romieu I, Borja-Aburto VH: Particulate airpollution and daily mortality: Can results be generalized to Latin American countries? Salud Publica Mex 1997; 39: 403-411. [ Links ]
41. Calderón-Garcidueñas L, Valencia-Salazar G, Rodríguez-Alcaraz A, Gambling TM, García R, Osnaya N, et al : Ultrastructural Nasal Pathology in Children Chronically and Sequentially Exposed to Air Pollutants. Am J Respir Cell Mol Biol 2001; 24: 132-138. [ Links ]
42. Romieu I, Meneses F, Ramírez M, Ruiz S, Pérez-Padilla R, Sienra JJ, et al: Antioxidant Supplementation and Respiratory Functions among Workers Exposed to High Levels of Ozone. Am J Respir Crit Care Med 1998; 158: 226-232. [ Links ]
43. Calderón-Garciduenas L, Osnaya-Brizuela N, Ramírez-Martínez L, Villarreal-Calderón A: DNA strand breaks in human nasal respiratory epithelium are induced upon exposure to urban pollution. Environ Health Perspect 1996; 104(2): 160-8. [ Links ]
44. Calderón-Garciduenas L, Roy-Ocotla G: Nasal cytology in southwest metropolitan Mexico City inhabitants: a pilot intervention study. Environ Health Perspect 1993; 101(2): 138-44. [ Links ]
45. Jaimes L, Sandoval J: Propane and butane emission sources to ambient air of Mexico City metropolitan area. Sci Total Environ 2002; 289(1-3): 243-247. [ Links ]
46. Sánchez-Carrillo CI, Cerón-Mireles P, Rojas-Martínez MR, Mendoza-Alvarado L, Olaiz-Fernández G, Borja-Aburto VH: Surveillance of acute health effects of air pollution in Mexico City. Epidemiology 2003; 14(5): 536-44. [ Links ]
47. Tellez-Rojo MM, Romieu I, Ruiz-Velasco S, Lezana MA, Hernandez-Avila MM: Daily respiratory mortality and PM10pollution in Mexico City: importance of considering place of death. Eur Respir J 2000; 16(3): 391-6. [ Links ]
48. el-Feraly FS, Chan YM: Isolation and characterization of the sesquiterpene lactone costunolide, parthenolide, costunolide diepoxide, santamarine, and reynosin from Magnolia grandiflora L. J Pharm Sci 1978; 67(3): 347-350. [ Links ]
49. Andersson M, Bergendorff O, Shan R, Zygmunt P, Sterner O: Minor components with muscle relaxing properties from scented myrrh. Planta Medica 1997; 63: 251-254. [ Links ]
50. Koo TH, Lee JH, Park YJ, Hong YS, Kim HS, Kim KE, et al: A sesquiterpene lactone, costunolide, from Magnolia grandiflora inhibits HF-kB by targeting IkB phosphorylation. Planta Med 2001; 67(2): 103-107. [ Links ]
51. Carvajal JA, Germain AM, Huidobro-Toro JP, Weiner CP: Molecular mechanism of cGMP-mediated smooth muscle relaxation. J Cell Physiol 2000; 184: 409-420. [ Links ]














