Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.73 no.1 Ciudad de México ene./mar. 2003
Investigación básica
Estudio de la relación entre las características electromoleculares de los digitálicos y su acción farmacológica
Relationship between the electromolecular properties of digitalis compounds and their pharmacological properties
Leonardo del Valle Mondragón,* Juan Carlos Torres Narváez,* Gabriela Zarco Olvera,* Fermín Alejandro Tenorio López* y Gustavo Pastelín Hernández*
* Departamento de Farmacología. Instituto Nacional de Cardiología "Ignacio Chávez".
Correspondencia:
Leonardo del Valle Mondragón,
Departamento de Farmacología.
Instituto Nacional de Cardiología "Ignacio Chávez"
(INCICH, Juan Badiano No. 1, Col. Sección XVI,
Tlalpan, 14080 México, D. F.).
Tel.: 55-73-29-11 Exts. 1317 ó 1344. Fax.: 55-73-09-26
E-mail: leonardodvm65@hotmail.com, leonardodvm65@correo.unam.mx
Recibido: 10 de junio de 2002
Aceptado: 7 de octubre de 2002
Resumen
Pese a su reducido margen de seguridad, los digitálicos siguen utilizándose en el tratamiento de la insuficiencia cardiaca congestiva y la fibrilación auricular crónica. Con el descubrimiento de su estructura, se han realizado remodelaciones para disminuir su toxicidad. Investigaciones recientes reportan que la eficacia digitálica radica en la electronegatividad del anillo "D" esteroideo, generada por la lactona e hidroxilo que poseen estos compuestos. En el presente trabajo, damos cuenta de la importancia que tiene esta propiedad molecular, que aunada a la conformación estructural, dan lugar a cambios significativos en las propiedades farmacológicas como el inotropismo y el margen de seguridad. Así, evaluamos una serie de once compuestos derivados de digitoxigenina, con grupos que sustituyen sobre el anillo "D" al hidroxilo y/o la lactona, los cuales denominamos -OH, -Lac, D-01, D-02, D-03, D-07, D-14, D-15, D-20, D-21 y D-22. La electronegatividad y la energía conformacional de cada compuesto se determinaron por el método Duhamm. El estudio farmacológico se realizó en corazones aislados de cobayo con base en el modelo de Langendorff y, en corazón de perro conforme al modelo cardiopulmonar de Starling. Los resultados permiten observar que la modulación de la acción digitálica está centrada, estructuralmente, en los sustituyentes de la fracción "D". El efecto inotrópico positivo y el margen de seguridad, medido como el cociente de la dosis tóxica sobre la dosis inotrópica, están relacionados con el aumento de electronegatividad y con una disminución de las energías rotacional y translacional que definen la conformación molecular; en consecuencia, estas propiedades son imprescindibles en la eficacia digitálica.
Palabras clave: Efecto inotrópico, Digitálicos, Electronegatividad, Energía conformacional.
Abstract
In spite their reduced therapeutic index, digitalis-type drugs continue being used for treating diseases such as congestive heart failure and chronic atrial fibrillation. Thanks to the development of several methods, their structural determination has been feasible, so, structural modifications have been worked out to modulate their toxicity. Several reports realizes that efficacy for these digitalis-type drugs lies on the electronegativity centered on the steroidal moiety (D-ring) generated by either lactone and hydroxyl sub-stituents attached to the steroidal moiety. In this work, we report how electronegativity, and so structural conformation, does modify their pharmacological properties, e.g., inotropism and safety margin. Thus, we evaluated a series of eleven drugs derived from digitoxigenin, named -OH, -Lac, D-01, D-02, D-03, D-07, D-14, D-15, D-20, D-21 and D-22, with groups that substitute both lactone and hydroxyl groups on the steroidal D-ring. Electronegativity and conformational energy were determined by Duhamm's method. The pharmacological evaluation for these drugs was accomplished in guinea pigs isolated hearts (according to the model proposed by Langendorff) and dog's isolated heart (as established by Starling's in vivo model). The results may suggest that digitalis-like action lies on the substituents attached to the D-ring. Positive inotropic effect and therapeutic index are related with increases in electronegativity as well with decreases in rotational and traslational energies; therefore, these molecular properties have such importance for the digitalis efficacy. (Arch Cardiol Mex 2003; 73:11-17).
Key words: Inotropism, Digitalis, Electronegativity, Conformational energy.
Introducción
Entre los fármacos que ejercen una acción inotrópica positiva sobre el corazón, los digitálicos, han sido la base del tratamiento en la insuficiencia cardiaca congestiva y en la fibrilación auricular crónica.15 Los digitálicos en su porción genina o aglicona, están conformados por una base estructural esteroidea de tipo alcohólico constituida principalmente por hidroxilos en el carbono-3 (C3) y en el carbono-14 (C14), metilos en los carbonos-10 (C10) y 13 (C13) además de un anillo de lactona, insaturado, anclado en el carbono-17 (C17) de la molécula esteroidea.4-9 Estudios de relación estructura-actividad,8-10 han permitido establecer que la electronegatividad sobre el anillo "D" esteroideo de los digitálicos, es una propiedad electromolecular indispensable, para que este tipo de compuestos, generen una acción inotrópica positiva sobre el músculo cardiaco. Así, el anillo lactónico en el carbono-17 y el hidroxilo del carbono-14, son las estructuras que por excelencia propician de manera satisfactoria la electronegatividad del anillo «D» y la actividad inotrópica positiva. por otra parte, se sabe que las moléculas no sólo necesitan de la electronegatividad de los sustituyentes para generar interacciones fármaco-receptor, y así, generar una respuesta farmacológica óptima, sino que también necesitan de otra propiedad molecular que es la conformación estructural. Esta propiedad depende de las energías vibracionales, rotacionales y traslacionales de los sustituyentes que componen la estructura química, siendo estas dos últimas las que modulan la unión al receptor.6,8-11 Las moléculas no son rígidas y se encuentran en constante movimiento, desplazamiento y torsión sobre sus propios enlaces, generando disposiciones conformacionales que les confieren especificidad a la unión fármaco-receptor.7-9 Dentro de la estereoquímica de los esteroides, existen dos únicas conformaciones estructurales, la alfa y la beta, esta última permite que un esteroide de tipo digitálico produzca una acción inotrópica positiva sobre el corazón, ya que se ha observado que los confórmeros alfa, en su totalidad, son inactivos.7,8 Esto se debe a que los sustituyentes de la base esteroidea, principalmente los constitutivos del anillo "A" y "D" se encuentran por debajo del plano molecular, lo que da lugar a un impedimento estérico in situ, evitando con ello que los sustituyentes del anillo "A" y "D" se unan al receptor. Así, los confórmeros beta, que se ubican por encima del plano esteroideo, carecen de impedimento estérico y, por ende, se encuentran orientados y dispuestos para interactuar directamente sobre el receptor.7-9 En el presente trabajo, decidimos introducir cambios en la densidad electrónica negativa y en la estabilidad de la conformación estructural de los sustituyentes en la fracción "D" esteroidea de la molécula digitálica, orientados en analizar posibles cambios en la actividad inotrópica y en el margen de seguridad de este grupo de fármacos.
Material y métodos
Síntesis y análisis molecular
Se diseñaron los prototipos con base a los estudios cualitativos de relación estructura-actividad reportados por Deghenghi,12 Pastelín,13 Wiesner14 y García-Domenech.15 La digitoxigenina fue seleccionada como precursor estructural digitálico, debido a la factibilidad que presenta para realizar directamente en la molécula, modificaciones estructurales a nivel de reactividad química selectiva. Así, se sintetizaron once compuestos los cuales denominamos -OH, -Lac, D-01, D-02, D-03, D-07, D-14, D-15, D-20, D-21 y D-22. Su estructura química se verificó mediante reactividad química específica, con base a las metodologías funcionales de Feigl,16 Tatsime-Ohi,17 Shriner,18 Castellanos19 y Siggia.20 Los acoplamientos se ratificaron por resonancia magnética nuclear.21-23 La electronegatividad y los potenciales de energía rotacional y de energía translacional de enlace, fueron evaluados por el método Duhamm bajo radiación infrarroja.11,21,24
Evaluación farmacológica
El efecto inotrópico se evaluó mediante la preparación de Langendorff25 en corazón aislado de cobayo macho (400 a 450 g de peso). Se empleó solución de Krebs como líquido de perfusión a un flujo de 10 mL/min a 37 °C, con saturación de carbógeno al 5%. Los compuestos se administraron en disoluciones de etanol-agua (1:20) mediante un dosificador adyacente a la cánula de perfusión, referidos ambos en la arteria coronaria ascendente según Langendorff.25 Bajo estas condiciones, se midió la contracción como efecto del desarrollo de la presión intraventricular izquierda, por inserción de un balón de látex en dicha cavidad, el cual se conectó a un transductor hidroneumático Stalham 7320. Los registros respectivos se realizaron en un polígrafo Grass-79D. La frecuencia cardiaca se mantuvo constante a 1 Hz mediante estimulación con un marcapaso epicárdico ventricular Grass-SIU5. Se registró en forma continua un electrograma aurículo-ventricular, para lo cual se utilizó un osciloscopio Tektronix 7904. El efecto y la potencia de los derivados sintéticos, fueron medidos bajo un estudio de curvas dosis-respuesta gradual en comparación con su precursor estructural, la digitoxigenina. La estadística aplicada para el manejo de datos, en el caso de curvas dosis-respuesta gradual,26 fue la prueba t de Student para datos pareados con una n = 10 por grupo y una P < 0.05. El margen de seguridad de los digitálicos sintéticos se midió en un modelo de insuficiencia cardiaca experimental, en el preparado cardiopulmonar de Starling27 en perros machos (12 a 15 kg de peso), en comparación con la digitoxigenina. La insuficiencia cardiaca fue inducida por una dosis controlada de pentobarbital sódico (100 a 200 mg en dosis única) la cual se administró a través de la cánula referida en la vena cava superior. Los fármacos se administraron, también por dicha vía, en infusión continua a una dosis de 0.2 μmoles/kg de corazón/min hasta producir la muerte del corazón por fibrilación ventricular o por paro ventricular, en aproximadamente 3 horas. En el curso de la acción e intoxicación digitálicas, fue posible cuantificar las dosis que, acumulándose, producen: el inicio de la reversión de la insuficiencia cardiaca o dosis mínima terapéutica (DMT) a juzgar por el principio del descenso de la presión venosa central; la presencia de bloqueo A-V completo o de disociación A-V o dosis de intoxicación (DI); y la dosis letal (DL). En estudios de infusión continua de digitálicos, la DMT, la DI y la DL dependen de la duración total del experimento y se miden secuencialmente según se va dando la acumulación del digitálico en el corazón; por tal motivo, resulta imposible elaborar curvas dosis-respuesta para la obtención de las dosis medias respectivas. Así, el margen de seguridad se calculó como los cocientes DI/DMT, DL/DMT y DL/DI. La estadística para el análisis de los datos resultantes, consistió de un análisis de varianza con una significancia de n = 5 por grupo y una P < 0.05.
Resultados
Las pruebas de reactividad química específica y resonancia magnética nuclear, comprobaron las características estructurales de los compuestos diseñados (Fig. 1) para efectos del estudio.
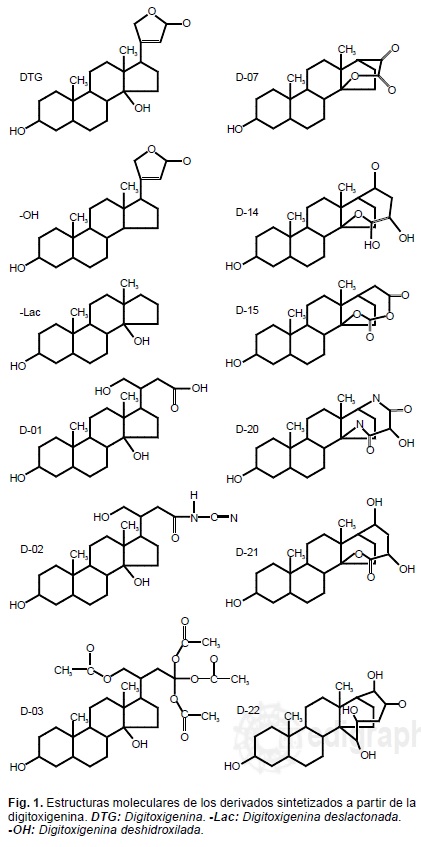
Al evaluar individualmente la electronegatividad y el potencial de energías rotacional y translacional por el método de Duhamm, bajo radiación infrarroja, se obtuvieron los resultados que se muestran en la Tabla I.

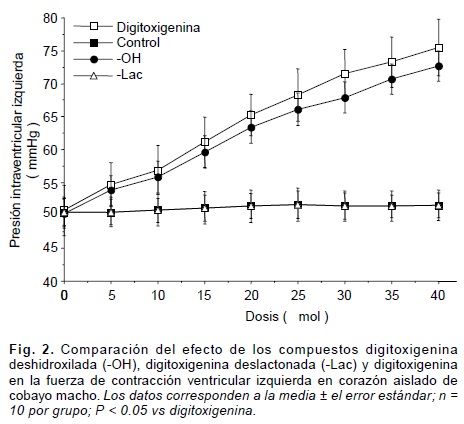
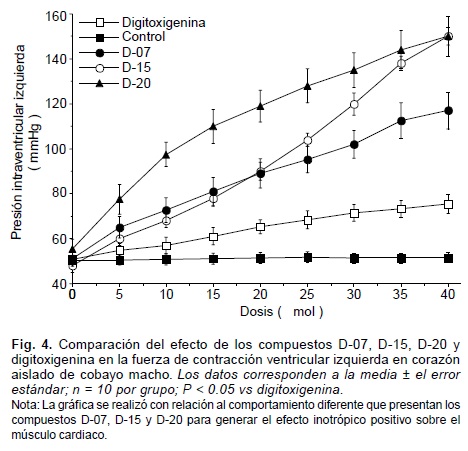
En la preparación de Langendorff, los derivados sintéticos -OH (digitoxigenina deshidroxilada por sustitución de un átomo de hidrógeno en la posición 14), -Lac (digitoxigenina deslactonada por sustitución de un átomo de hidrógeno en la posición 17), D-01, D-02 y D-03, presentaron, en comparación con la digitoxigenina, un menor efecto inotrópico positivo (Figs. 2 y 3). En contraste, los compuestos D-07, D-14, D-15, D-20, D-21 y D-22, denotaron un efecto inotrópico positivo mayor que el de la digitoxigenina (Figs. 4 y 5).


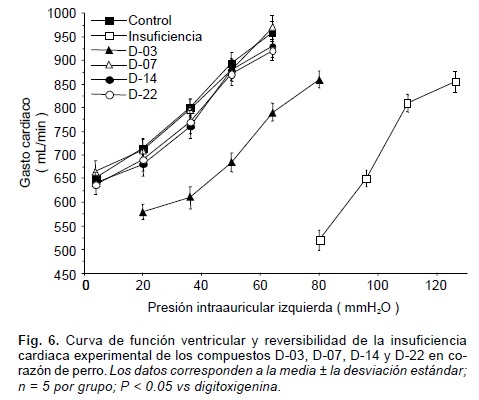
Hasta el momento, en el modelo cardiopulmonar de Starling, los compuestos D-07, D-14 y D-22, revirtieron por completo la insuficiencia cardiaca experimental, mientras que el derivado D-03, resultó poco activo para revertir la insuficiencia (Fig. 6). El margen de seguridad de los compuestos D-07, D-14 y D-22, a juzgar por los cocientes DL/DMT y DI/DMT, fue más amplio que el de la digitoxigenina, en tanto que para el D-03, resultó mucho menor que el observado para el precursor (Tabla II). El índice toxicológico de los compuestos D-07, D-14 y D-22 no mostraron diferencias significativas con respecto al de la digitoxigenina; pero el compuesto D-03, resultó de mayor toxicidad.

Discusión
Para efectos del estudio, se emplearon dos especies diferentes que fueron el cobayo y el perro, que a saber, presentan una respuesta favorable y reproducible a la acción digitálica. En ambos casos se trabajó con machos para evitar la variabilidad biológica debida al efecto estrogénico. Para la evaluación del efecto inotrópico, se seleccionó la preparación de Langendorff pues permite la elaboración de curvas dosis-respuesta en corazones perfundidos que reciben estimulación a una frecuencia constante. Al no producir un gasto cardiaco, no permite la valoración de un estado de insuficiencia cardiaca. En cambio, la preparación cardiopulmonar de Starling es un modelo de insuficiencia cardiaca en el que se pueden medir acciones terapéuticas y tóxicas.
Con la experimentación realizada, se confirmó que la acción digitálica depende, en parte, de los sustituyentes electronegativos de la fracción "D" esteroidea, ya que al sustituir por átomos de hidrógeno, por separado, al hidroxilo (-OH) y la lactona (-Lac) de la digitoxigenina, se observó una disminución en el inotropismo positivo sobre el músculo cardiaco, siendo mayor el decremento cuando se elimina el grupo lactona (Fig. 2). Para investigar el grado con que la electronegatividad determina la acción digitálica, se sintetizaron los compuestos D-01, D-02 y D-03 con mayor electronegatividad sobre el anillo "D" estructural, que la propia digitoxigenina (Tabla I). Al ser evaluados estos compuestos en el corazón aislado de cobayo bajo el método de Langendorff, se observó que no incrementó su acción inotrópica, con respecto a la digitoxigenina (Fig. 3). Por consiguiente, investigamos a nivel molecular la participación de los potenciales de energías rotacional y translacional de enlace (PERTE) de la digitoxigenina y de los derivados D-01, D-02 y D-03; en donde observamos que el PERTE de estos tres compuestos es mayor que el de la digitoxigenina (Tabla I), por lo que a mayor deformación del enlace y de la conformación de los grupos funcionales sustituyentes sobre el anillo "D" de la molécula digitálica, tiene lugar un menor efecto inotrópico positivo. Para eliminar el incremento del PERTE a medida que se incrementa la electronegatividad, desarrollamos compuestos con ciclaciones entre las posiciones 14 y 17 de la fracción "D" este-roidea en conformación beta. De esta manera, aumentó la electronegatividad sobre el anillo "D" sin que se incrementara el PERTE. Así los compuestos D-07, D-14, D-15, D-20, D-21 y D-22, poseen una electronegatividad superior y un PERTE inferior, en comparación con la digitoxigenina (Tabla I). Al ser evaluados estos compuestos en corazón aislado bajo el modelo de Langendorff, produjeron, en todos los casos, un efecto inotrópico positivo significativamente mayor al que genera la digitoxigenina. Comprobándose de esta manera, que la acción inotrópica positiva de los digitálicos sobre el músculo cardiaco depende tanto de la electronegatividad como de la conformación molecular de los sustituyentes sobre la fracción "D" esteroidea.
Por otra parte, el margen de seguridad del producto D-03 (compuesto con electronegatividad y PERTE superiores a la digitoxigenina), resultó menor que el de la digitoxigenina. En cambio los compuestos D-07, D-14 y D-22 (compuestos con electronegatividad superior y PERTE inferior a la digitoxigenina), mostraron un margen de seguridad superior al propio precursor (Tabla II). Estos resultados, según lo observado, representan una incompatibilidad con la hipótesis de la acción digitálica, la cual se manifiesta a través de un solo receptor (ATPasa-Na+,K+), lo que impediría explicar cambios obtenidos en el margen de seguridad. Lo anterior nos permite abundar en la posibilidad de la existencia de un receptor que genera la actividad inotrópica y, un segundo receptor responsable del efecto tóxico, esto apoyados en los estudios respectivos reportados por Gálvez,28-30 Tokuyama,31 Jahr32 y Wasserstrom.33 En ambos casos (efecto inotrópico positivo y margen de seguridad) se encuentra implicada la electronegatividad misma del compuesto, pero la toxicidad, al parecer, se ve favorecida cuando a la electronegatividad molecular se le aúna el libre desplazamiento angular y rotacional de los sustituyentes de las posiciones 14 y 17 de la fracción "D" esteroidea. Esto permite una libre disposición conformacional para unirse al receptor que genera el efecto tóxico, que hasta hoy en día se ha establecido que es la ATPasa dependiente de Na+ y K+. Por otra parte, al estar involucrada la electronegatividad molecular con una restricción del desplazamiento angular y rotacional de los sustituyentes por una ciclación entre dichas posiciones, se favorece la eficacia digitálica, tanto en el aumento del inotropismo, como en el incremento del margen de seguridad.
Conclusión
Con la experimentación realizada hasta el momento, podemos inferir que la acción digitálica generada por la porción genina de los glicósidos, radica principalmente en la fracción «D» esteroidea y que son los sustituyentes electromoleculares de esta región, los que modulan la eficacia del efecto farmacológico, por lo que la disminución en cantidad, o bien, la pérdida de éstos, altera significativamente dicha acción, la cual está estrechamente relacionada tanto con la electronegatividad de los sustituyentes de las posiciones 17 y 14 de la fracción "D" esteroidea, como de la disposición conformacional de los mismos en torno a la unión al receptor para generar la digitalización en el músculo cardiaco.
Referencias
1. Méndez R: Doscientos años de digital. Arch Inst Cardiol Mex 1986; 56: 339-348. [ Links ]
2. Tischler M, Smith T: Digitalis: its current place in the treatment of heart failure. Modern Conc Cardiovasc Dis 1990; 59: 67-72. [ Links ]
3. Hoffman B, Bigger J: Digital y otros glucósidos cardiacos relacionados. En: Goodman A, Rall T, Nies A, Taylor P. editores. Goodman y Gilman: Las Bases Farmacológicas de la Terapéutica. 8ª Ed. México. Editorial Médica Panamericana, 1991, p 794-818. [ Links ]
4. Pastelín G, Méndez R: Glucósidos cardiacos y otros fármacos inotrópicos positivos. En: Velasco A, Lorenzo P, Serrano J S, Andres-Trelles F. editores. Velázquez: Farmacología. 16ª Ed. Barcelona. Editorial Interamericana, McGraw-Hill, 1993. p 530-544. [ Links ]
5. The digitalis investigation group: The effect of digoxin on mortality and morbidity in patients with heart failure. New Engl J Med 1997; 336: 525-533. [ Links ]
6. Fieser L, Fieser M: Steroids. New York. Reinhold Publishing Co., 1959. p 24-35, 67-79. [ Links ]
7. Ramshar M, Volkar J: Biomedical Pharmacology. London. Harper & Row, Publishers, 1989. p 388-441, 510, 571-579. [ Links ]
8. Wiesner K, Tsai T: Some recent progress in the synthetic and medicinal chemistry of cardioactive steroid glycosides. Pure Appl Chem 1986; 58: 799-810. [ Links ]
9. O'Maller R, Potter S: Molecular structure and pharmacology. 2ª Ed. Ottawa. Jowhelleth Co., 1983. p 30-46, 80-110, 256-279, 435-437, 450. [ Links ]
10. Bevan J: Essentials of pharmacology. Introduction to the principles of drugs action. 3ª Ed. London. Harper & Row Publishers, 1986. p 60-75, 90-93. [ Links ]
11. Helm H, Backenfeld T, Muller B, Waaler T: Electroverneinend aufbave bei steroiden. Helv Chim Acta 1985; 68: 300-314. p 24-26, 68-71, 114-116, 135-137, 245, 268, 381-390. [ Links ]
12. Deghenghi Romano: Synthetic Cardenolides and Related Products. Pure Appl Chem 1970; 21: 153-165. [ Links ]
13. Pastelin G, Méndez R: The Influence of a Methyl Group in the Cardiac Activity of the Semisynthetic Glicoside Glucodigitoxigenin. Arch Pharm Tox 1984; X: 135-141. [ Links ]
14. Wiesner K and Tsai T: Some Recent Progress in the Synthetic and Medicinal Chemistry of Cardioactive Steroid Glycosides. Pure Appl Chem 1986; 58(5): 799-810. [ Links ]
15. Garcia-Domenech R, Galvez J: Molecular Topology: Its Role in the Design of New Drugs. Invest Sci (Sci Am, Spanish Edition) 1993; 2(2): 86-87. [ Links ]
16. Feigl F, Anger V: Pruebas a la gota en análisis orgánico. México. El Manual Moderno, 1978. p 75, 78, 92, 103-107, 200-211, 222, 243-245. [ Links ]
17. Tatsime-Ohi K, Hiyamoto Y: Functional analysis. New York. Shendo, 1989. p 7-51, 90-102. [ Links ]
18. Shriner R, Fuson R, Curtin D, Morrill T: The systematic identification of organic compounds. 6ª Ed. Toronto. John Wiley and Sons, 1979. p 4242, 46-49, 78-91, 133-140, 248-260. [ Links ]
19. Castellanos J: Avances en análisis de esteroides. 2ª Ed. Lisboa. Editorial Científica-Médica, 1973. p 1-155, 289-301. [ Links ]
20. Siggia S: Quantitative Organic Analysis via Functional Groups. 4ª Ed. New York. John Wiley and Sons, 1996. p 45-77, 90-121. [ Links ]
21. Simmans Co: Spectrophotometric assay. 2ª Ed. New Jersey. Simmans Public, 1980. p 71-92. [ Links ]
22. Lemmedt T, Klauss W: The nuclear magnetic resonance in the pharmacology. Philadelphia. Sonth-Hill, 1980. p 1-89, 160-201. [ Links ]
23. Kiwalth R, Kimari O: Start of the Nuclear Magnetic Resonance. New York. D'Evan Nostrand, 1988. p 34-45, 57, 78, 109, 200-203. [ Links ]
24. Ciurczak EW, Drennen JK: Pharmaceutical and Medical Applications of Near-Infrared Spectroscopy. 2ª Ed. New York. Marcel Dekker, 2002. P 56-78, 100-139, 165-170. [ Links ]
25. Döring H, Dehnert H: The isolated perfused heart according to Langendorff. Friburgo de Brisgovia, Biomesstechnik-Verlag, 1988. p 1-70. [ Links ]
26. Box G, Hunter W: Estadística para Investigadores: Introducción al Diseño de Experimentos, Análisis de Datos y Construcción de Modelos. 3ª Ed. México. Reverté, 1999. p 345-580. [ Links ]
27. Méndez R, Pastelín G, Kabela E: The influence of the position of attachment of the lactone ring to the steroid nucleus on the action of the cardiac glycosides. J Pharmacol Exp Ther 1974; 188: 189-197. [ Links ]
28. Galvez J, Garcia-Domenech R, Julian-Ortiz JV, Soler R: Topological Approach to Drug Design. J Chem Inf Comput Sci 1995; 35: 272-284. [ Links ]
29. Galvez J: On a topological interpretation of electronic and vibrational molecular energies. J Mol Struc (Theochem) 1998; 429: 255-264. [ Links ]
30. Galvez J, Garcia-Domenech R, de Julian-Ortiz JV: Some Relationships between Molecular Energy-Topology and Symmetry. En: Carbo-Dorca A. eds. Kuwer Academic: Fundamentals of Molecular Similarity, New York. Plenum Publishers, 2001, p 11-31. [ Links ]
31. Tokuyama TJ, ET AL: The Structure of Batrachotoxin A, a Noves Steroidal Alkaloid from the Colombian Arrow Poison Frog. J Am Chem Soc 1968; 90: 917-918. [ Links ]
32. Jahr EAK, ET AL: Ueber die Herzwirkung Einfacher Bisguanylhydrazone, Arzneimittel-Forsch. Arch Exp Pathol Pharm 1964; 14: 273-277. [ Links ]
33. Wasserstrom JA, Farkas D, Norell M, Vereault DV: Effects of Different Cardiac Steroids on Intracellular Sodium Inotropy and Toxicity in Sheep Purkinje Fibers. J Pharmacol Exp Ther 1991; 258: 918-925. [ Links ]














