Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.72 n.3 Ciudad de México Jul./Sep. 2002
Revisión de temas cardilógicos
Vasopresina: usos en la práctica cardiovascular
Vasopressin: uses in cardiovascular practice
Octavio González Chon,* Sandra María del Carmen García López,**
* Jefe de la Unidad Coronaria y Terapia Postquirúrgica Cardiovascular. Hospital Médica Sur.
** Médico Adscrito a la Unidad Coronaria y Terapia Postquirúrgica Cardiovascular. Hospital Médica Sur.
Correspondencia:
Octavio González Chon.
Hospital Médica Sur.
Puente de Piedra No. 150,
Tlalpan. C.P. 14050. México, D.F.
E-mail: ogchon@.medicasur.org.mx.
Recepción: 12 de octubre de 2001
Aceptado: 24 de enero de 2002
Resumen
La vasopresina, es secretada a nivel de la neurohipófisis siendo influida por un gran número de variables, entre ellas, las más importantes y conocida es la presión osmótica del agua corporal. Otros factores que modifican la liberación de esta hormona, lo constituyen los cambios en el volumen sanguíneo y presión arterial, contribuyendo de manera importante a la recuperación hemodinámica. Los receptores de vasopresina tienen diferentes localizaciones y son divididos en V1 y V2, cuya estimulación resulta en diferentes respuestas fisiológicas. Con base en las antes mencionadas, el uso de la vasopresina de manera exógena ha sido probado en diferentes situaciones clínicas, como lo son: el paro cardíaco refractario a tratamiento, choque séptico, choque vasodilatador, choque postcardiotomía y síndrome vasopléjico con resultados promisorios. Actualmente existe el sustento científico suficiente para la utilización de esta hormona en la práctica clínica.
Palabras clave: Vasopresina. Hormona antidiurética. Paro cardíaco. Choque séptico. Choque postcardiotomía. Síndrome vasopléjico.
Summary
Vasopressin is secreted by the neurohypophysis influenced by many variables; among them the most important and known is the osmotic pressure (osmotic regulation) of body fluid. Other factors that modify this hormone's secretion are changes in blood volume and blood pressure, which contribute significantly to hemodynamic recovery. Vasopressin receptors are located in different sites, and their stimulation generate also generates different physiological responses. The receptors are of two types, V1 and V2. The usefulness of exogenous vasopressin has been proven in many clinical situations, refractory cardiac arrest, septic shock, vasodilator shock, postcardiotomy shock, and vasoplegic shock, with promising results. At present, enough scientific support exists for the use of this antidiuretic hormone (vasopressin) in clinical practice.
Key words: Vasopressin. Antidiuretic hormone. Cardiac arrest. Septic shock. Postcardiotomy shock. Vasoplegic shock.
Introducción
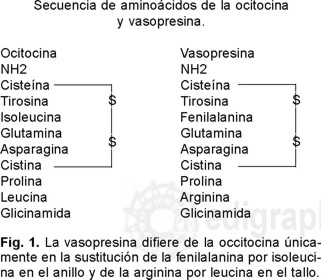
La neurohipófisis es una prolongación elongada del hipotálamo ventral que se fija a la superficie dorsal y caudal de la adenohipófisis. Las dos únicas hormonas conocidas que secretan la neurohipófisis del adulto humano son la vasopresina y la ocitocina. Cada una es un nonapétido compuesto por un anillo disulfuro de seis miembros y un tallo de tres miembros al que se une el grupo carboxilo terminal. La vasopresina difiere de la ocitocina únicamente en la sustitución de la fenilalanina por isoleucina en el anillo y de la arginina por leucina en el tallo (Fig. 1).
La síntesis de ambas hormonas se realiza en los cuerpos celulares de los núcleos supraópticos y paraventricular para posteriormente ser liberadas mediante la estimulación de diferentes estímulos.1 Tanto la vasopresina como la ocitocina, son almacenadas en la neurohipófisis como complejos insolubles con proteínas transportadoras conocidas como neurofisinas. La secreción de la hormona y su neurofisina asociada parece obtenerse por medio de un proceso exocitótico dependiente del calcio. De acuerdo con ello, la secreción se desencadena por la propagación de un impulso eléctrico a lo largo de la neurona que produce despolarización de la membrana celular, entrada de calcio, fusión con las membranas de los gránulos secretores y expulsión de su contenido.
Vasopresina
Se sabe que la secreción de vasopresina es influida por un número de diferentes variables. En condiciones fisiológicas, la más importante es, la presión osmótica del agua corporal. El efecto de esta variable sobre la secreción de vasopresina está mediado por un osmorreceptor situado en el hipotálamo anterior, cercano pero separado de los núcleos supraópticos y paraventricular. Con osmolaridades plasmáticas por debajo de un nivel mínimo o valor umbral, la vasopresina plasmática es suprimida uniformemente hasta niveles bajos o no detectables. Por encima de este punto, la vasopresina plasmática aumenta en proporción directa a la osmolaridad plasmática.2 La secreción de vasopresina, asimismo, puede estar afectada por cambios en el volumen sanguíneo o de la presión arterial. Estas influencias hemodinámicas están mediadas principalmente por aferentes neurogénicas que se originan en receptores sensibles a presión, localizados en las aurículas del corazón y en el cayado aórtico y que alcanzan el tallo cerebral por medio de los nervios vagos e hipoglosos.
Regulación hemodinámica
Diversos factores hemodinámicos pueden afectar la secreción de vasopresina. Tanto la hipotensión como la hipovolemia (sin hipotensión) pueden, si son lo suficientemente severas, producir marcadas elevaciones plasmáticas de vasopresina. La presión arterial umbral para la secreción de vasopresina ha sido determinada en humanos mediante la disminución farmacológica de la misma, demostrándose incremento en las concentraciones plasmáticas de vasopresina con cambios tan pequeños como una disminución del 5% de la presión arterial media. Sin embargo, esta respuesta no es consistente hasta que la presión arterial haya disminuido en aproximadamente 15%. Posteriores reducciones en la presión arterial producen niveles de vasopresina mucho mayores a los observados con los estímulos osmóticos importantes.3
La relación entre estímulo-respuesta para la liberación de vasopresina generada por la hipovolemia en humanos, ha sido más difícil de cuantificar. Diferentes estudios han demostrado que la reducción en el 10% del volumen sanguíneo produce un aumento significativo en la actividad antidiurética.4 Los resultados fueron compatibles con la hipótesis de que cambios ordinarios en el volumen sanguíneo pueden contribuir significativamente a la regulación fisiológica de los niveles circulantes de vasopresina. Estudios más detallados indican que pequeños cambios en el volumen sanguíneo no deben ser tan importantes en la regulación de vasopresina como se consideraba anteriormente. Es importante señalar que los niveles de vasopresina se incrementan de manera exponencial al mismo tiempo que se depleta el volumen sanguíneo. La hipovolemia severa, inducida por la combinación de ortostatismo y flebotomía, generalmente resulta en un incremento muy marcado de la hormona (vasopresina).5
La vasopresina posee dos efectos principales que dependerán de los niveles plasmáticos circulantes. El efecto antidiurético se obtiene a niveles plasmáticos bajos (5 pg/mL) y el efecto vasopresor al momento de exceder las concentraciones plasmáticas de 30 pg/mL.6 De esta forma, los niveles muy altos de vasopresina que se observan durante la hipotensión severa, muestran claramente, la contribución de la recuperación hemodinámica y su papel probable en la fisiología.7
El sistema responsable para el inicio de los efectos presores apropiados de la vasopresina, no necesita ser regulado por la secreción de la misma a bajos niveles, pero cuando un estímulo hemodinámico suficiente se presenta, debe de estar preparado para un incremento en grandes cantidades de hormona. Basado en estos factores, el sistema de osmorreceptores y el sistema de barorreceptores parecen encontrarse bien situados en el control de la secreción de vasopresina, con el propósito ya sea de balance hídrico o si fuese necesario, para mantener presión arterial, respectivamente en grados de hipovolemia y/o hipotensión leve-moderada. Con incrementos pequeños de vasopresina plasmática, el control corporal de agua puede ser mantenido sin alteraciones importantes en la osmolaridad plasmática. Cuando el estímulo hemodinámico es mucho más severo, el sistema de osmorregulación se encuentra muy comprometido, mientras tanto, los niveles de vasopresina se siguen incrementando para lograr un efecto antidiurético máximo. Bajo estas condiciones, la capacidad de regular la osmoralidad se encuentra prácticamente perdida. El análisis de la interacción entre el control en los sistemas osmótico y hemodinámico, provee una visión de cómo se encuentra organizado la unidad neurohipofisial.
De todo esto, se debe tomar en cuenta, que si la hipotonicidad es lo suficientemente grande en magnitud, suprimirá completamente los efectos estimuladores que pueda generar la hipotensión y/o hipovolemia moderada.8,9 Esto indica, que los dos tipos de estímulo, deben interactuar de alguna forma para las células neurosecretoras. Se han encontrado neuronas simples en los núcleos supraópticos que responden a estímulos tanto osmóticos como hemodinámicos.10
Neuroanatomía de la barorregulación de vasopresina
Desde que varios estudios demostraron que los estímulos hemodinámicos generan secreción de vasopresina, los esfuerzos se han orientado para tratar de identificar las vías anatómicas responsables de este efecto.
Los receptores y las vías neurales aferentes aparecen como parte del arco reflejo que participa en el control hemodinámico de numerosos sistemas neuroendócrinos.11 Cambios hemodinámicos son detectados por receptores de estiramiento que se encuentran en la pared de la aurícula izquierda y barorreceptores en el arco aórtico y seno carotídeo. Los receptores auriculares están capacitados para detectar cambios de pequeños a moderados en el volumen sanguíneo, pero la simplicidad en este concepto, está en contraposición de la verdadera complejidad del sistema. Los impulsos desde estos receptores presosensitivos, son llevados al Sistema Nervioso Central (SNC), por la vía vagal y el nervio glosofaríngeo.12 La primera sinapsis ocurre en el núcleo del tracto solitario, que es un centro barorregulador muy importante. Se ha observado, que otro sistema de vía ascendente, es por medio de células noradrenérgicas que parten de este tracto solitario a la médula ventral y al Locus Cerúleos, proyectándose hacia el núcleo paraventricular y supraóptico.13 Estas vías, probablemente regulan las señales hemodinámicas ascendentes para la secreción de vasopresina por medio de una influencia tónica inhibitoria.
Receptores de vasopresina
Los receptores de vasopresina se dividen en V1 y V2. Los receptores V1 tienen subtipos los cuales se encuentran denominados según su localización, V1a (vasculares/hepáticos) y V1b (hipófisis anterior). Estos al igual que los receptores AT1 de angiotensina, y los alfa adrenérgicos se acoplan con la vía de la Gαs, el cual es un subtipo de proteínas G que activan a la fosfolipasa C (vía fosfatilinositol)14 en las membranas plasmáticas de las células del músculo liso, en las paredes de los vasos sanguíneos y de otros tejidos. Los receptores V1b, son también denominados V3, en donde el calcio, se comporta como segundo mensajero.15
La estimulación de los receptores V1 provoca vasoconstricción, activación plaquetaria, glicogenólisis y aumento de la hormona adrenocorticotrópica. De igual forma se ha visto que provoca estimulación en los factores de trascripción c-fos, y en el c-jun, los cuales últimamente se les ha relacionado con crecimiento celular.
En contraste, los receptores V2 son encontrados en segmentos distales de la nefrona (asa ascendente de Henle),16 que también por la vía de la proteína Gαs provoca estimulación a la adenilciclasa, incrementando la producción de un segundo mensajero que es el amp-cíclico y la activación de la proteín-kinasa A. Mediante la interrupción de esta cascada de fosforilación, antagonistas de los receptores V2, inhiben los canales de agua, acuaporin-CD,17 canales de Na amilorida sensitivos, y transportadores de urea dentro de las membranas apicales de los conductos colectores; de esta forma, la habilidad para reabsorber agua por el conducto colector, está reducida.18
Existe evidencia reciente que indica la presencia de receptores V2 extrarrenales en las células endoteliales que están relacionadas con la secreción del factor de von Willebrand19 (Tabla I).
Un número análogo estructurales de la vasopresina han sido sintetizados y han sido evaluados tanto en su potencia antidiurética como en sus efectos hemostáticos. De entre ellos se encuentra la deamino-8D-arginina-vasopresina, mejor conocida como Desmopresina, considerada como un agonista selectivo V2 con una insignificante actividad vasopresora, la cual ha sido demostrada en diferentes estudios tanto en humanos como en animales.20
Diferentes factores que afectan la secreción de vasopresina
Existen diversos factores los cuales causan un incremento significativo en la producción de vasopresina, independientemente de los cambios en la osmolaridad, entre ellos encontramos a la nausea, ya que la liberación de esta hormona parecer ser mediada a través del centro del vómito.21 La hipoglucemia inducida por insulina, también incrementa los niveles de vasopresina, al igual que la hipoxia y los estímulos relacionados al estrés y al dolor.
Usos clínicos de la vasopresina
A. Reanimación cardiopulmonar
Durante el paro cardíaco y la reanimación cardiopulmonar, la activación del sistema nervioso simpático causa un gran incremento en las concentraciones de catecolaminas plasmáticas.22,23 Cuando la hipotensión arterial estimula el reflejo barorreceptor, otras vías vasopresoras tales como la liberación de vasopresina y el sistema renina angiotensina,24,25 son activadas. En situaciones de estrés en donde se incluye la isquemia miocárdica, insuficiencia cardiaca, sepsis y hemorragia subaracnoidea, las concentraciones circulantes de endotelina (un vasoconstrictor arterial y venoso derivado de las células endoteliales), se incrementan,26 con el objetivo de producir una vasoconstricción periférica y desviar de esa manera el flujo sanguíneo a órganos vitales,27 Lindner y cols.28 mediante un estudio prospectivo, midió las concentraciones plasmáticas de endotelina, adrenalina, noradrenalina, vasopresina, hormona adrenocorticotrópica y cortisol en pacientes durante la reanimación cardiopulmonar, tanto en quienes había sido exitosa como en quienes no. Los resultados demostraron que a pesar de una gran respuesta adrenosimpática observada en ambos grupos, las concentraciones de vasopresina y de hormona adrenocorticotrópica fueron bajas en el grupo donde la reanimación fue fallida, en comparación con el otro grupo, concluyendo que ambas hormonas, pueden influenciar el éxito de la reanimación cardiopulmonar por medio de la perfusión a órganos vitales. Los niveles significativamente bajos en las concentraciones plasmáticas de vasopresina pueden ser debidos a una insuficiente liberación de la misma por la hipófisis, sin embargo, la razón de ello se encuentra desconocida.29 En modelos experimentales con animales durante la reanimación cardiopulmonar convencional, se observó que la administración de vasopresina, mejoraba la perfusión a órganos vitales aún con mejores resultados que con la propia epinefrina.30,31
Los primeros estudios aplicados en humanos con base en los resultados anteriores, se refieren a la aplicación de vasopresina en el paro cardíaco refractario, con el objeto de valorar la administración exógena de la misma. En este estudio, se incluyeron a 8 pacientes adultos con paro cardíaco dentro del hospital, en donde después de la aplicación de epinefrina (dosis de acuerdo a las guías de AHA) y desfibrilación, no hubo respuesta; en ese momento, recibieron 40 U IV y posteriormente se defibrilaron. La circulación espontánea fue rápidamente restaurada en todos los pacientes. Tres pacientes fueron dados de alta del hospital con estado neurológico intacto; los otros cinco, se mantuvieron vivos entre 30 minutos y 82 horas.32
Diferentes estudios controlados, han demostrado que la epinefrina tanto a dosis estándar como a dosis altas, no modificó la sobrevida de los pacientes en paro cardíaco, cuando se compara ron con placebo.33 En ese estudio, el rango de sobrevida inmediata fue del 8.8%, pero sólo el 0.9% sobrevivió a la alta hospitalaria.
Como potenciales alternativas a la epinefrina, la vasopresina se mantuvo como una expectativa. Cuando los niveles de vasopresina son medidos en pacientes que se encuentran bajo reanimación cardiopulmonar, existe un alto grado de correlación entre los niveles altos de vasopresina endógena y el potencial de regresar a una circulación espontánea. Sorpresivamente, altos niveles de catecolaminas se relacionan a una baja probabilidad de sobrevida después de la reanimación cardiopulmonar.28 Otras evidencias a favor de la vasopresina, es que se observaron menos arritmias después de la cardioversión y un rango mayor de éxito en la reanimación. Estos resultados pueden ser relacionados en parte, a observaciones previas en el que la vasopresina mostró ser más efectiva que la epinefrina bajo condiciones de pH bajo e hipoxia.34
El mecanismo de acción de la vasopresina, a pesar de los resultados reportados en estudios previos aún está mal entendido. Las mediciones hemodinámicas sugieren que causa corto circuito sanguíneo del corazón y cerebro, lejos del músculo, piel y lecho esplácnico. Esto puede estar mediado en parte por el aumento de óxido nítrico.35,36 En el cerebro, la vasopresina provee mayor perfusión durante la reanimación cardiopulmonar que la epinefrina, a pesar del aumento en el óxido nítrico. Contrario a la epinefrina, la vasopresina continúa causando intensa vasoconstricción en presencia de acidosis severa que acompaña al paro cardiorrespiratorio, con una duración de acción prolongada.
La epinefrina, aumenta el consumo de oxígeno miocárdico por la vía de estimulación del receptor β1 adrenérgico, sin embargo, la vasopresina facilita la entrega del oxígeno al miocardio, incrementa la contractilidad cardíaca sin aumentar el consumo de oxígeno miocárdico de manera exagerada como lo hacen las catecolaminas.30,31,37 La tendencia sugerida en ese momento era la de realizar, estudios aleatorios, doble ciego, en los cuales se administrará de manera endovenosa epinefrina 1 mg o vasopresina 40 U después de que la primera dosis de epinefrina fallara para restablecer la circulación espontánea.38 Si, la vasopresina tiene un efecto positivo en la sobrevida, una comparación directa entre las dos drogas deberá de realizarse, para definir cuál será el vasopresor de primera línea, tanto en la reanimación intrahospitalaria como fuera de ella.
La vida media de la vasopresina en modelos animales con circulación intacta, es de 10-20 minutos, lo cual es más larga que la de la epinefrina en la reanimación cardiopulmonar. Los niveles de vasopresina endógena en pacientes bajo reanimación cardiovascular son significativamente más altos en aquellos que sobreviven que en los que nunca recuperan circulación espontánea.28,39 Estos hallazgos sugieren que la vasopresina exógena puede ser benéfica durante el paro cardíaco. Después de un período corto de fibrilación ventricular, la vasopresina administrada durante las maniobras de reanimación, incrementó la presión de perfusión coronaria,40 el flujo sanguíneo a órganos vitales,41 al igual que el aporte de oxígeno cerebral.42 Resultados similares fueron encontrados con paro cardíaco prolongado y actividad eléctrica sin pulso. En cambio, la vasopresina no tuvo ningún resultado, en pacientes con bradicardia después de la reanimación.41 La interacción de la vasopresina con los receptores V1 durante la reanimación cardiopulmonar (RCP), produce una intensa vasoconstricción de la piel, músculo esquelético, intestino y grasa con relativamente menos constricción de los lechos vasculares coronarios y renales.43 Dosis repetidas de vasopresina fueron más efectivas que la epinefrina para mantener la presión de perfusión coronaria, por arriba del umbral crítico que correlaciona con una RCP exitosa.44 Un pequeño estudio piloto (n = 40) comparó pacientes en paro cardíaco refractario, utilizando vasopresina 40 U IV o epinefrina 1 mg IV, encontrando, una mejoría de 24 horas de sobrevida, pero, no existió diferencia en el alta hospitalaria en el grupo de vasopresina.45
Por lo tanto, la American Heart Association (AHA) durante la Conferencia 2000 de revisión de Guías o Lineamientos de Reanimación Cardiopulmonar,46 dictamina, que la vasopresina puede ser utilizada como una alternativa a la epinefrina para el tratamiento del choque refractario a fibrilación ventricular (Clase II b: aceptable; sustentado en evidencia clara).47 También parece ser efectiva en pacientes con asistolia y actividad eléctrica sin pulso. A pesar de ello, recientemente Stiell y cols48 fallaron en demostrar alguna ventaja en la sobrevida con vasopresina, versus epinefrina, en el paro cardíaco intrahospitalario.
La vasopresina, al parecer, puede ser administrada por vías diferentes a la endovenosa como son la endobronqueal e intraósea.49,50
B. Choque séptico
El choque séptico, es la forma de choque distributivo más común que es causado por infección de bacterias gram negativas.51,52 La principal característica hemodinámica, consiste, en una marcada vasodilatación arteriolar periférica, la cual tiene como resultado una resistencia vascular sistémica baja, gasto cardíaco bajo, hipotensión severa y una inadecuada perfusión tisular.
El mecanismo de vasodilatación en el choque séptico, se encuentra aún parcialmente entendido, sin embargo, existe evidencia considerable, la cual implica diversas anormalidades en los mecanismos vasodilatadores. Mucha atención han tenido los lipopolisacáridos o endotoxinas bacterianas, en donde la administración de ellas producen algunas de las anormalidades cardiovasculares que se presentan en el choque séptico.53 Las endotoxinas estimulan la síntesis del factor de necrosis tumoral, interleucina 1 y otras citokinas; estas sustancias incrementan la generación del óxido nítrico que es un vasodilatador. Por lo tanto, la inhibición de la óxido nítrico sintetasa, revierte la hipotensión inducida por el complejo endotoxina-citokina,54 incrementando la resistencia vascular y presión arterial en pacientes con choque séptico que no respondieron a la terapia convencional.55 Además de la generación del óxido nítrico, existe activación del canal de K sensible a ATP a nivel vascular. La apertura de este canal, hiperpolariza el músculo liso vascular y reduce la entrada de calcio, induciendo de esa manera la vasodilatación.56
También han sido descritas diversas anormalidades en los sistemas de vasoconstricción en choque séptico.57 La deficiencia de vasopresina contribuye a la hipotensión del choque séptico.58 Existen hallazgos que sugieren que los niveles de vasopresina se encuentran bajos en el estado de choque séptico. Los niveles plasmáticos inapropiadamente bajos de vasopresina, pueden ser debidos a que la secreción de vasopresina es baja o que la depuración de la vasopresina se encuentre incrementada. La última posibilidad ha sido excluida mostrando que durante la infusión de vasopresina exógena, se encuentran niveles plasmáticos incrementados, por lo que se concluye, que en los estados de choque séptico, la secreción está disminuida. Una probable causa de esta disminución, es un reflejo barorreceptor alterado, más que una alteración secundaria a osmolaridad.
La infusión exógena de vasopresina en una dosis de 0.4 U/min no incrementa la presión arterial en pacientes normales, sin embargo, lo hace de manera importante, de aproximadamente 50 mmHg en los pacientes sépticos, esto, asociado a un incremento en la resistencia vascular sistémica. En algunos pacientes en choque séptico, la vasopresina ha sido utilizada como único agente para mantener la presión arterial, sin necesitar agentes del tipo de las catecolaminas; al suspender la infusión de la hormona, la presión disminuye rápidamente.57 La insuficiencia autonómica presente en los enfermos con choque séptico, es la causante de otorgar la sensibilidad vasopresora a esta hormona (vasopresina).
Es importante señalar que la deficiencia de vasopresina contribuye a la vasodilatación en el choque séptico, pero la deficiencia per se de vasopresina, no es la causa de vasodilatación. El bloqueo de los receptores V1, no disminuye las resistencias vasculares sistémicas, ni la presión sanguínea, cuando los niveles de vasopresina no son significativamente elevados.
Recientes estudios, fuertemente sugieren que bajas dosis de vasopresina, pueden ser utilizadas como alternativa a la terapia tradicional con altas dosis de vasopresores del tipo de las catecolaminas en pacientes sépticos con hiporreactividad vascular, además de disminuir las concentraciones de lactato, aunque esto no sea un cambio significativo. Lo más llamativo es que hasta el momento, la sobrevida es similar con vasopresina y la reportada con la terapia convencional.59,60
C. Choque vasodilatador
El llamado choque vasodilatador, está caracterizado no sólo por hipotensión arterial debido a vasodilatación periférica, sino también, por una pobre respuesta a la terapia con drogas vasopresoras. Si bien es cierto que la sepsis es la causa más común, existen otras causas las cuales no son infrecuentes (Tabla II).

En todas las formas de choque vasodilatador, las concentraciones de catecolaminas plasmáticas se encuentran marcadamente incrementadas y el sistema renina-angiotensina activado. Por lo tanto, esa aparente vasodilatación e hipotensión es secundaria a una falla del músculo liso vascular para constreñirse. Varios mecanismos han sido propuestos, entre ellos se incluye la muerte de las células vasculares debido a hipotensión prolongada,62 inadecuada extracción de oxígeno por los tejidos63 y un aumento en la actividad de las prostaglandinas con actividad vasodilatadora.64 Tres mecanismos65 han sido implicados en la génesis de este síndrome: la activación de los canales de potasio sensibles a ATP (K ATP), en la membrana plasmática del músculo liso vascular, la activación de la óxido nítrico sintetasa inducible y deficiencia de vasopresina, mecanismos, los cuales ya fueron descritos al hablar del choque séptico.
Con relación a la vasopresina, se ha observado, que durante los estado de choque, existe de manera inicial un aumento muy importante de vasopresina, la cual posteriormente disminuye.66 En el choque hemorrágico, las concentraciones plasmáticas promedio de vasopresina fueron mayores a 300 pg/mL (normal < 5 pg/mL) durante la fase aguda de la hipotensión con la hemorragia; estas disminuyeron a < 30 pg/mL después de aproximadamente 1 horas de hipotensión sostenida. Hallazgos similares fueron descritos para pacientes en choque séptico,58 fase tardía de choque hemorrágico, choque vasodilatador posterior a la circulación extracorpórea (CEC) y colocación de asistencia ventricular izquierda.67
La corrección de las concentraciones plasmáticas bajas de vasopresina mediante la administración exógena de la misma, con el objeto de alcanzar concentraciones similares a las encontradas en la hipotensión aguda, tuvo como resultado, el incremento de la presión arterial en rangos que oscilan entre los 25-50 mmHg.
Para poder explicar el efecto vasoconstrictor de la hormona exógena en estos casos, se han propuesto algunos conceptos: 1. Debido a que las concentraciones plasmáticas son relativamente bajas, los receptores vasculares se encuentran disponibles para ser ocupados por la hormona exógena. 2. La acción vasopresora se encuentra incrementada en animales con denervación barorreceptora,68 pacientes con falla autonómica y pacientes con choque vasodilatador sedados o comatosos. Por lo tanto, si la sepsis está presente, la función del sistema nervioso simpático en tales pacientes se encuentra alterada. 3. La vasopresina potencializa el efecto vasoconstrictor de la norepinefrina,69 en donde, las concentraciones de esta última, se encuentran marcadamente elevadas en el choque vasodilatador. 4. La vasopresina directamente inactiva los canales (K ATP), en el músculo liso vascular, con la consiguiente vasoconstricción. 5. La vasopresina inhibe el incremento del GMPcíclico que es inducido por el óxido nítrico y el péptido atrial natriurético, además de la disminución de la óxido nítrico sintetasa inducible que es estimulada por los lipopolisacáridos.65
D. Choque postcardiotomía
El choque vasodilatador después de CEC ha sido asociado a una relativa deficiencia de vasopresina e hipersensibilidad a la administración exógena de la hormona. Además, dentro de la propia cirugía cardíaca, aquellos pacientes a los cuales se les colocó un dispositivo de asistencia ventricular y se le administró vasopresina, demostraron una marcada respuesta presora y una significativa reducción en la necesidad de catecolaminas exógenas.67,70
Los resultados y estudios hasta el momento sólo se habían reportado en adultos, hasta que Rosenzweing y cols.71 describieron la experiencia en 11 pacientes pediátricos severamente enfermos, los cuales cursaban con hipotensión después de cirugía cardíaca y a quienes se les administró vasopresina. Todos los pacientes recibieron múltiples agentes inotrópicos y vasopresores. Cinco de ellos, recibieron vasopresina inmediatamente después de CEC, 5 en la unidad de terapia intensiva dentro de las primeras 12 horas de la cirugía y uno de ellos 2 días posterior a la cirugía por sepsis. La dosis de vasopresina fue ajustada dependiendo del peso del paciente con rangos de 0.0003 a 0.002 U/kg/min. Durante la primera hora de tratamiento la presión sistólica aumentó de 65 ± 14 a 87 ± 17 mmHg (p < 0.0001; n = 11), la administración de epinefrina disminuyó en 5 de 8 pacientes y se incrementó en 1. Los niveles plasmáticos de vasopresina antes del tratamiento sólo fueron medidos en 3 pacientes y estuvieron depletados (4.4 pg/mL; n = 3). Nueve pacientes sobrevivieron y 2 fallecieron a pesar de mejoría transitoria en la presión arterial.71
Dentro del manejo los síndromes de gasto cardíaco bajo postcardiotomía, una de las drogas más efectivas que incrementan el gasto cardíaco lo constituye el grupo de los inhibidores de la fosfodiesterasa tipo III,72 sin embargo, la utilización de las mismas, puede estar asociada a vasodilatación e hipotensión.73 Cuando este grupo de drogas es esencial en el manejo de la falla cardíaca, la administración concomitante con un vasopresor de origen catecolamínico puede ser requerido para prevenir una vasodilatación excesiva.
Gold y cols,74 utilizaron vasopresina (0.03-0.07 U/min) en tres pacientes con falla cardíaca severa incrementando la presión arterial sistémica de 90 ± 47 a 130 ± 2.3 mmHg, con disminución de los vasopresores adrenérgicos. Estos casos sugieren que la vasopresina a dosis bajas, puede ser un tratamiento efectivo para la vaso dilatación e hipotensión secundaria a la utilización de los inhibidores de fosfodiesterasa tipo III.
Una de las grandes ventajas de la utilización de la vasopresina con relación a los vasopresores catacolamínicos, es que la hormona exógena (vasopresina) tiene efecto constrictor en la arteriola glomerular eferente y por lo tanto tiende a mantener la tasa de filtración glomerular a pesar de disminución en el flujo sanguíneo renal.75 Por lo tanto, la vasopresina parece ser superior a la norepinefrina para mantener la función renal. El incremento paradójico del gasto urinario en respuesta a un agente antidiurético, puede ser debido a la mejoría en la perfusión renal al aumentar la presión arterial, o a la capacidad de la vasopresina de constreñir específicamente sólo la arteriola glomerular eferente,76 manteniendo de esa forma, el grado de filtración glomerular.
Los efectos de la vasopresina a nivel cardíaco son complejos. Bajo condiciones normales y en falla cardíaca moderada, inducida de esta de manera experimental, la vasopresina disminuye el gasto cardíaco.77 En corazones aislados, la vasopresina se comporta como un agente inotrópico78 a bajas dosis, sin embargo, a dosis altas disminuye el gasto cardíaco debido a constricción de las arterias coronarias.79 El efecto de vasopresina a nivel de la circulación regional en pacientes con insuficiencia cardíaca, aún no es conocido, sin embargo a bajas dosis, no ha existido evidencia de isquemia coronaria, mesentérica y de las extremidades; a nivel renal, se incrementan los flujos urinarios.77 Los efectos adversos a nivel de la perfusión gastrointestinal y coagulación, hasta el momento, no han podido ser excluido a pesar de los efectos benéficos de la administración de la hormona.80
La hipotensión arterial (presión arterial media < 60 mmHg) posterior a la circulación extracorpórea (CEC), se encuentra típicamente asociada con un marcado incremento en las concentraciones plasmáticas de vasopresina entre 100 a 200 pg/mL.67 Sin embargo, niveles inapropiadamente bajos de vasopresina (8-34 pg/mL) se encuentran en pacientes hipotensos a quienes se les coloca un dispositivo de asistencia ventricular izquierda. Cuando esta deficiencia es corregida mediante la administración de vasopresina exógena, los pacientes (n = 50) mejoraron en su estado hemodinámico. La dosis de 0.09 U/min en promedio, tuvo como resultado un incremento significativo en las resistencias vasculares sistémicas causando un aumento en la presión arterial media (75 mmHg), mientras que el flujo del dispositivo de asistencia ventricular y el apoyo inotrópico no sufrían grandes modificaciones, excepto por una importante disminución de la dosis de norepinefrina; las presiones pulmonares se mantuvieron sin cambios, manifestando mejoría clínica posterior a las seis horas de la administración de la droga.70 No existió evidencia electrocardiográfica de isquemia durante la administración de vasopresina.
De manera reciente ha sido publicado el término de síndrome vasoplejico,81 el cual ha sido definido, como aquel que se presenta en el período postoperatorio temprano posterior a cirugía cardíaca y donde se halla utilizado la CEC;82 éste se caracteriza por una hipotensión severa, disminución de las resistencias vasculares sistémicas, disminución de la reactividad arteriolar, incremento en los volúmenes de llenado y agentes vasopresores, a pesar de un adecuado gasto cardíaco.81 Este síndrome ha sido estrechamente asociado con una baja fracción de eyección83 e insuficiencia cardíaca, sin embargo, este evento mórbido, también ocurre en presencia de función ventricular normal. Mekontso y cols.,81 trataron de identificar qué factores predisponentes, tanto preoperatorios como intraoperatorios, estaban relacionados en la cirugía de revascularización coronaria y la presencia de este síndrome. Treinta y seis pacientes (n = 108) desarrollaron síndrome vasopléjico, identificándose sólo como factores predictores preoperatorios, el uso de inhibidores de enzima convertidora de angiotensina (IECA's) y la heparina intravenosa con un riesgo relativo de 2.26 y 2.78 respectivamente.
Ha sido observado, que el uso preoperatorio de los IECA's, se encuentra asociado con hipotensión y disminución de la vasorreactividad después de la separación de la CEC;84 esto es secundario a una disminución en la angiotensina II y a un incremento en los niveles plasmáticos de bradikininas (vasodilatador); los niveles aumentan, debido a que, durante la CEC, los pulmones son excluidos y es ahí, donde se realiza el catabolismo de las mismas. La utilización crónica de los IECA's, en especial, aquellos agentes de duración prolongada, sufren acumulación en los tejidos, teniendo como consecuencia, niveles elevados posterior a CEC que condicionan una disminución en las resistencias vasculares sistémicas en el período postoperatorio. Sin embargo, aún se necesitan estudios posteriores que determinen el mecanismo preciso de este síndrome con especial énfasis en el sistema renina-angiotensina y la reactividad arteriolar antes de la CEC.
Conclusiones
La administración exógena de vasopresina, progresivamente ha incrementado su utilización en la práctica clínica, sustentado ello, en los numerosos reportes de mejoría con relación al incremento de la presión arterial. Estos estudios, de manera inicial, fueron desarrollados en animales, para posteriormente demostrar su utilización en humanos, de hecho, el cambio de mayor trascendencia para la hormona exógena, es la inclusión aunque en clase IIb dentro de los lineamientos de la AHA para la reanimación cardiopulmonar.46 Dentro del choque séptico, indudablemente la administración de vasopresina ha mejorado las variables hemodinámicas en especial, lo concerniente a las resistencias vasculares sistémicas y utilización de vasopresores,57 sin embrago, debemos de señalar, que hasta el momento, la mortalidad no ha sido aún modificada.59,60 En los pacientes sometidos a cirugía cardíaca, la CEC, juega un papel fundamental, mediante la génesis y liberación de sustancias vasoactivas, mismas que pueden ser la causa del síndrome vasopléjico, causa de mortalidad en el postoperatorio inmediato.81
La experiencia inicial de los autores en el uso de la vasopresina exógena sugiere que esta se puede utilizar de manera segura en rangos que oscilan entre 2-8 Unidades/hora. Actualmente existe la evidencia científica que la administración de la hormona de manera exógena es segura, pero, consideramos falta aún mayor sustento para que la vasopresina tome un papel de primera elección dentro de las patologías antes mencionadas.
Referencias
1. GAITAN E, COBO E, MIZRACHI M: Evidence for the differential secretion of oxytocin and vasopressin in man. J Clin Invest 1964; 43: 2310-2313. [ Links ]
2. ROBERTSON GL, ATAR S, SHELTON RL: Osmotic control of vasopressin function: disturbances in body fluid osmolality. Bethesda, American Physiological Society: 1997: 125-130. [ Links ]
3. ROBERTSON GL, ATAR S: The interaction of blood osmolality and blood volume in regulating plasma vasopressin in man. J Clin Endocrinol Metab 1976; 42: 613-619. [ Links ]
4. JONSON JA: Effects of separate and concurrent osmotic and volume stimuli on plasma ADH in sheep. Am J Physiol 1970; 128: 1273-1276. [ Links ]
5. ROBERTSON GL: Development and clinical application of a new method for the radioimmunoassay of arginin vasopressin in human plasma. J Clin Invest 1973; 52: 2340-2345. [ Links ]
6. MALAYAN S: Effects of increases in plasma vasopressin concentration on plasma renin activity, blood pressure, heart rate and plasma corticosteroid concentration in dogs. Endocrinology, 1980; 107: 1899-1904. [ Links ]
7. ZERBE RL: Vasopressin: an essential pressor factor for blood pressure recovery following hemorrhage. Peptides 1982; 3: 509-511. [ Links ]
8. DUNN FL: The role of blood osmolality and volume in regulating vasopressin secretion in the rat. J Clin Invest 1973; 52: 3212-3216. [ Links ]
9. ROBERTSON GL: The role of osmotic and hemodynamic variables in regulation vasopressin, in James VHT. Proceeding of the fifth International Congress of Endocrinology, Hamburg, July 1976, Excerpta Medic Congress Series no. 402. Amsterdam, 1977: 126-136. [ Links ]
10. KANNAN H, YAGI R: Supraoptic neurosecretory neurons: evidence for the existence of converging inputs both from carotid baroreceptors and osmoreceptors. Brain Res 1978; 145: 385-392. [ Links ]
11. JUN ER: Cholinergic and adrenergic release mechanism for vasopressin in the male rat: a study with injection of neurotransmitters and blocking agents into the third ventricle. Neuroendocrinology 1974; 16: 255-260. [ Links ]
12. SHARE L: Extracellular fluid volume and vasopressin secretion. In: Ganong WF, Martini L. Frontiers in neuroendocrinology. New York, Oxford University Press. 1969: 183-189. [ Links ]
13. SAWCHENKO PE, SWANSON LW: Central noradrenergic pathways for the integration of hypothalamic neuroendocrine and autonomic responses. Science 1981; 214: 685-689. [ Links ]
14. THIBONNIER M, CONARTY DM, PRESSTON JA: Molecular pharmacology of human vasopressin receptors. Adv Exp Med Biol 1998; 449: 251-276. [ Links ]
15. THIBONNIER M, BERTIMATTERA LN, DULIN N, MATERRA R: Signal transduction pathways of the human V1 vascular, V2 renal, V3 pituitary vasopressin and oxytocin receptors. Prog Brain Res 1998; 119: 147-161. [ Links ]
16. MOREL F: Sites of hormone action in the mammalian nephron. Am J Physiol 1981; 240: F159-F164. [ Links ]
17. NIELSEN S, MARPLES D, FROKIAER J: The aquaporin family of water channels in kidney: an update on physiology and pathophysiology of aquaporin 2. Kidney Int 1996; 49: 1718-1723. [ Links ]
18. BANKIR L: Antidiuretic action of vasopressin: quantitative aspects and interaction between V1 and V2 receptor-mediated effects. Cardiovascular Research 2001; 51: 372-390. [ Links ]
19. KAUFMANN JE, OKSCHE A, WOLLHEIM CB: Vasopressin-induced von Willebrand factor secretion from endothelial cells involves V2 receptors and camp. J Clin Invest 2000; 106: 107-116. [ Links ]
20. RICHARDSON DW, ROBINSON AG: Desmopressin. Ann Internal Med 1985; 103: 228-239. [ Links ]
21. ROWE JW: Influence of the emetic reflex on vasopressin release in man. Kidney Int 1979; 16: 729-733. [ Links ]
22. LINDNER KH, STROHMENGER IU, PRENGEL AW, ENSINGER H, GOERTZ A, WEICHEL T: Hemodynamic and metabolic effects of epinephrine during cardiopulmonary resuscitation in a pig model. Crit Care Med 1992; 20: 1020-1026. [ Links ]
23. PRENGEL AW, LINDNER KH, ENSINGER H, GRUNERT A: Plasma catecholamine concentrations after successful resuscitation in patients. Crit Care Med 1992; 20: 609-614. [ Links ]
24. SHEN YT, COWLEY AW, VATNER SF: Relative roles of cardiac and arterial baroreceptors in vasopressin regulation during hemorrhage in conscious dogs. Cir Res 1991; 68: 1422-1423. [ Links ]
25. WILSON MF, BRACKETT DJ: Release of vasoactive hormones and circulatory changes in shock. Cir Shock 1983; 11: 225-234. [ Links ]
26. MILLER RC, PELTON JT, HUGGINS JP: Endothelins from receptors to medicine. Trends Pharmacol Sci 1993; 14: 54-60. [ Links ]
27. OTA K, KIMURA T, SHOJI M, INOUE M, SATO K, OHTA M: Interaction of ANP with endothelium on cardiovascular, renal, endocrine function. Am J Physiol 1992; 262: EI 135-141. [ Links ]
28. LINDNER KH, HAAK T, KÉLLER A, BOTHNER U, LURIE KG: Release of endogenous vasopressors during and after cardiopulmonary resuscitation. Heart 1996; 75(2): 145-150. [ Links ]
29. SCHULTZ CH, RIVERS EP, FWLDKAMO CS, GOAD EG, SMITHLINE HA, MARTÍN GB: A characterization of hypothalamic-pituitary-adrenal axis function during and after human cardiac arrest. Crit Care Med 1993; 21: 1339-1347. [ Links ]
30. LINDNER KH, BRINKMANN A, PFENNINGER EG, LURIE KG, GOERTZ A, LINDNER MI: Effect of vasopressin on hemodynamic variables, organ blood flow, and acid-base status in a pig model of cardiopulmonary resuscitation. Anesth Analg 1993; 77: 427-435. [ Links ]
31. LINDNER KH, PRENGEL AW, PFENNIGER EG, LINDNER MI, STROHMENGER H-U, GEORGIEFF M: Vasopressin improves vital organ blood flow during closed-chest cardiopulmonary resuscitation in pigs. Circulation 1995; 91: 215-221. [ Links ]
32. LINDNER KH, PRENGEL AW, BRINKMANN A, STROHMENGER HU, LINDNER IM, LURIE KG: Vasopressin administration in refractory cardiac arrest. Ann Inter Med 1996; 124(12): 1061-1064. [ Links ]
33. BROWN CG, MARTÍN DR, PEPE PE, STUEVEN H, CUMMINS RO, GONZÁLEZ E, JASTREMSKI MA: A comparison of standard-dose and high-dose in cardiac arrest outside the hospital. N Engl J Med 1992; 327: 1051-1055. [ Links ]
34. EICHINGER MR, WALKER BR: Enhanced pulmonary arterial dilatation to arginine vasopressin in the chronically hypoxic rat. Am J Physiol 1994; 267: H2413-H2429. [ Links ]
35. RUSS RD, WALKER BR: Role of nitric oxide in vasopressinergic pulmonary vasodilatation. Am J Physiol 1992; 263: H743-H747. [ Links ]
36. EVORA PR, PEARSON PJ, SCAF HB: Arginin vasopressin induces endothelium-dependent vasodilatation in the pulmonary artery: V1 receptor mediated production of nitric oxide. Chest 1995; 103: 1241-1243. [ Links ]
37. CHANDRASHEKHAR Y, ANAND I, GOLDSMITH S: Arginine vasopressin V1-a receptor mediates positives inotropic effects in normal isolated rat cardiac myocytes. Circulation 1994; 90: (suppl 1): 1-174. [ Links ]
38. CHUNG S, LURIE K, LINDNER K: Pressor with promise: using vasopressin in cardiopulmonary arrest. Circulation 1997; 96(7): 2453-2454. [ Links ]
39. LINDNER KH, STROHMEENGER UH, ENDINGER H: Stress hormone response during and after cardiopulmonary resuscitation. Anesthesiology 1992; 77: 662-668. [ Links ]
40. BABAR SI, BERG RA, HILWING RW, KERN KB, EWY GA: Vasopressin versus epinephrine during cardiopulmonary resuscitation: a randomized swine out-come study. Resuscitation 1999; 41: 185-192. [ Links ]
41. WENZEL V, LINDNER KH, PRENGEL AW, MAIER C, VOELCKEL W, LURIE KG, STROHMENGER HU: Vasopressin improves vital organ blood flow after prolonged cardiac arrest with postcounter shock pulseless electrical activity in pigs. Crit Care Med 1999; 27: 486-492. [ Links ]
42. PRENGEL AW, LINDNER KH, SÉLLER A, LURIE KG: Cardiovascular function during the postresuscitation phase after cardiac arrest in pigs: a comparison of epinephrine versus vasopressin. Crit Care Med 1996; 24: 2014-2019. [ Links ]
43. FOX AW, MAY RE, MITCH WE: Comparison of peptide and nonpeptide receptor-mediated responses in rat-tail artery. J Cardiovasc Pharmacol 1992; 20: 282-289. [ Links ]
44. WENZEL V, LINDNER KH, BAUBIN MA: Vasopressin decrease endogenous catecholamine plasma levels during cardiopulmonary resuscitation in pigs. Crit Care Med 2000; 28: 1096-1100. [ Links ]
45. LINDNER KH, DIRKS B, STROHMENGER HU: Randomized comparison of epinephrine and vasopressin in patients with out-of-hospital ventricular fibrillation. Lancet 1997; 349: 535-537. [ Links ]
46. Guidelines 2000 for cardiopulmonary resuscitation end emergency cardiovascular care. Circulation 2000; 102(suppl I): I-129-135. [ Links ]
47. KERN KB, HALPERIN HR, FCIELD J: New guidelines for cardiopulmonary resuscitation and emergency cardiac care: changes in the management of cardiac arrest. JAMA 2001; 285(10): 1267-1269. [ Links ]
48. STIELL IG, HEBERT PC, WELLS WA, VANDEMHEEN KL, TANG AS, HIGGINSON LA: Vasopressin versus epinephrine for intrahospital cardiac arrest: a randomized controlled trial. LANCET 2001; 358: 105-109. [ Links ]
49. WENZEL V, LINDNER KH, PRENGEL AW: Endobronchial vasopressin improves survival during cardiopulmonary resuscitation in pigs. Anesthesiology 1997; 86: 1375-1381. [ Links ]
50. WENZEL V, LINDNER KH, AUGENSTEIN S: Intraosseus vasopressin improves coronary perfusion pressure rapidly during cardiopulmonary resuscitation in pigs. Crit Care Med 1999; 27: 1565-1569. [ Links ]
51. PARRILLO JE, PARKER MM, NATANSON C, SUFFREDINI AF, CUNNION RE, OGNIBENE FP: Septic Shock in humans: advances in the understanding of pathogenesis, cardiovascular dysfunction and therapy. Ann Intern Med 1990; 13: 227-242. [ Links ]
52. GLAUSER MP, ZANETTI G, BAUMGARTHENER JD, COHEEN J: Septic shock: pathogenesis. Lancet 1991; 338: 732-736. [ Links ]
53. SUFFRENDINI AF, FROME WL, PARKER NM, BREENNEEER M, KOVASCS JA, WESLEY RA, PARRILLO JE: The cardiovascular response of normal humans to administration of endotoxin. N Engl J Med 1989; 321: 280-287. [ Links ]
54. LOSCALZO J, WELCH G: Nitric oxide and its role in the cardiovascular system. Prog Cardiovasc Dis 1995; 38: 87-104. [ Links ]
55. PETROS A, BENNET D, VAALLANCEE P: Effect of nitric oxide synthase inhibitors on hypotension in patients with septic shock. Lancet 1991; 338: 1557-1558. [ Links ]
56. LANDRY DW, OLIVER JA: The ATP-sensitive K sup channel mediates hypotension in endotoxemia and hypoxic lactic acidosis in dog. J Clin Invest 1992; 89: 2071-2074. [ Links ]
57. REID IA: Role of vasopressinin deficiency in the vasodilation of septic shock. Circulation 1997; 95: (5): 1108-1110. [ Links ]
58. LANDRY DW, LEVIN HR, GALLANT EM, ASHTON RC, SEO S, D'ALESANDRO D, ET AL: Vasopressin deficiency contributes to the vasodilatation of septic shock. Circulation 1997; 95: 1122-1125. [ Links ]
59. TSUNEYOSHI I, YAMADA H, KAKIHANA Y, MASATAKA N, NAKANO Y, BOYLE WA: Hemodynamic and metabolic effects of low-dose vasopressin infusions in vasodilatory septic shock. Crit Care Med 2001; 29(3): 487-493. [ Links ]
60. ABID O, AKCA S, HAJI-MICHAEL P: Strong vasopressor support may be futile in the intensive care unit patient with multiple organ failure. Crit Care Med 2000; 28: 947-949. [ Links ]
61. BENEDICT CR, ROSE JA: Arterial norepinephrine changes in patients with shock septic. Circ Shock 1992; 38: 165-167. [ Links ]
62. BYRNE JJ: Shock. N Engl J Med 1996; 275: 543-546. [ Links ]
63. PARRILLO JE: Pathogenetic mechanisms of septic shock. N Engl J Med 1993; 328: 1471-1477. [ Links ]
64. BERNARD GR, WHEELER AP, RUSSELL JA: The effects of ibuprofen on the physiology and survival of patients with sepsis. N Engl J Med 1997; 336: 912-918. [ Links ]
65. LANDRY DW, OLIVER JA: The pathogenesis of vasodilatory shock. N Engl J Med 2001; 345: 588-595. [ Links ]
66. MORALES D, MADIAGAN J, CULLINACE S: Reversal by vasopressin of intractable hypotension in the late phase of hemorrhagic shock. Circulation 1999; 100: 226-229. [ Links ]
67. ARGENZIANO M, CHOUDHRI F, OZ MC, ROSE EA, SMITH CR, LANDRY DW: A prospective randomized trial of arginine vasopressin in the treatment of vasodilatory shock after left ventricular assist device placement. Circulation 1997; 96: (Suppl II): 286-290. [ Links ]
68. COWLEY AW JR, MONOS E, GUYTON AC: Interaction of vasopressin and baroreceptor reflex system in the regulation of arterial blood pressure in the dog. Circ Res 1974; 34: 505-514. [ Links ]
69. BARTELSTONE HJ, NASMYTH PA: Vasopressin potentiation of catecholamine actions in dogs, rat, cat and rat aortic strip. Am J Physiol 1965; 208: 754-762. [ Links ]
70. MORALES DL, GREGG D, HELMAN DN, WILLIAMS MR, NAKA Y, LANDRY DW, OZ MC: Arginine vasopressin in the treatment of 50 patients with post-cardiotomy vasodilatory shock. Ann Thorac Surg 2000; 69: 102-106. [ Links ]
71. ROSENZWEIG EB, STARC TJ, CHEN JM, CULLINANE S, TIMCHAK DM, GERSONY WM, ET AL: Intravenous arginine-vasopressin in children with vasodilatory shock after cardiac surgery. Circulation 1999; 100: (II): 182-186. [ Links ]
72. MAGER G, KLOCKE R: Phosphodiesterase III inhibition or adrenoreceptor stimulation: milrinone as analternative to dobutamine in the treatment of severe heart failure. Am Heart J 1991; 121: 1974-1983. [ Links ]
73. SEINO Y, MOMOMURA S, TENAKO T: Multicenter double blind study of intravenous milrinone for patients with acute heart failure in Japan. Crit Care Med 1996; 24: 1490-1497. [ Links ]
74. GOLD JA, CULLINANE S, CHEN J, OZ MC, OLIVER JA, LANDRY DW: Vasopressin as an alternative to norepinephrine in the treatment of milrinone induced hypotension. Crit Care Med 2000; 28: 249-252. [ Links ]
75. EDWARDS RM, TRIZNA W, KINTER LB: Renal microvascular effects of vasopressin and vasopressin antagonist. Am J Physiol 1989Z; 256: F274-278. [ Links ]
76. WAGNER HN, BRAUNWALD E: The pressor effects of the antidiuretic principle of the posterior pituitary in orthostatic hypotension. J Clin Invest 1956; 35: 1412-1418. [ Links ]
77. GOLDSMITH SR, FRANCIS GS, COWLEY AW, GOLDENBERG IF, COHN JN: Hemodynamic effects of infused arginine vasopressin in congestive heart failure. J Am Coll Cardiol 1986; 8: 779-783. [ Links ]
78. WALKERK BR, CHILDS ME, ADAMS EM: Direct cardiac effects of vasopressin: role of V1 and V2 vasopressinergic receptors. Am J Physiol 1988; 255: H261 H 265. [ Links ]
79. BOYLE QA III, SEGEL LD: Direct cardiac effects of vasopressin and their reversal by vascular antagonist. Am J Physiol 1986; 251: H734-H741. [ Links ]
80. DUNSER MW, MAYR AJ, ULMER H, RITSCH, KNOTZER H, PALK W, ET AL: The effects of vasopressin on systemic hemodynamics in catecholamine-resistant septic and postcardiotomy shock: a retrospective analysis. Anesth Analg 2001; 93: 7-13. [ Links ]
81. MEKONTSO-DESSAP A, HOUËL R, SOUSTELLE C, KIRSCH M, THEBERT D, LOISANCE DY: Risk factors for post-cardiopulmonary bypass vasoplegia in patients with preserved left ventricular function. Ann Thorac Surg 2001; 71: 1428-1432. [ Links ]
82. KIRKLIN JK: Prospects for understanding and eliminating the deleterious effects of cardiopulmonary bypass. Ann Thorac Surg 1991; 51: 529-531. [ Links ]
83. ARGENZIANO M, CHEN JM, CHOUDHRI AF: Management of vasodilatory shock after cardiac surgery: the systemic inflammatory response. Ann Thorac Surg 1997; 63: 277-284. [ Links ]














