Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.72 n.1 Ciudad de México Jan./Mar. 2002
Investigación Clínica
Reflexión arterial precoz y extrasistolia ventricular. Un mecanismo novel detectado por esfigmoquinetocardiografía
Reflexive arterial waves and ventricular premature beats studied by sphygmokynetocardiography
Gustavo Sánchez Torres,* Oscar Infante Vázquez,** Raúl Martínez Memije,** Pedro Flores Chávez,** Genaro Rodríguez Rossini**
Instituto Nacional de Cardiología "Ignacio Chávez".
* Depto. de Farmacología.
** Depto. de Instrumentación Electromecánica.
Correspondencia:
Gustavo Sánchez Torres,
Depto. de Farmacología
Instituto Nacional de Cardiología "Ignacio Chávez".
(INCICH. Juan Badiano No. 1,
Col. Sección XVI, 14080 México, D.F.).
E-mail: infante@ssa.gob.mx
infante@cardiologia.org.mx
Recepción: 25 de abril 2001
Aceptado: 24 de octubre 2001
Resumen
Antecedentes: El desarrollo de la esfigmoquinetocardiografía (EQCG), método exploratorio que registra: una señal electrocardiográfica, un oscilo-pulso carotídeo (OPC) y dos vibriogramas del ventrículo izquierdo (quinetocardiogramas, QCG) obtenido en el hemitórax y en la región subcostal izquierdos (QCGant y QCGpost, respectivamente) permitió la observación anecdótica de una onda de reflexión arterial precoz detectada en el OPC y una prolongación del periodo expulsivo (PE) medido en el QCGant o en el QCGpost en el latido sinusal pre-extrasistólico (LPE) versus un latido control (LC), en casos con extrasistolia ventricular (EV).
Objetivo: Cotejar si la arritmia ventricular está vinculada a cambios en los intervalos señalados.
Método: En sesenta casos; 30 con y 30 sin EV, se hizo EQCG; se midió el índice de reflexión arterial (IRA): duración del periodo expulsivo (PE) entre el intervalo aorta-frente de la onda de reflexión arterial.
Resultados: Los datos demográficos fueron semejantes en casos con o sin EV. Un PE más largo (291 ± 41 ms vs 279 ± 39, p < 0.01) y un IRA más corto (0.36 ± 0.17 vs 0.58 ± 0.21, p < 0.001) en el LPE vs el LC se encontró en casos con EV.
Conclusión: La combinación de PE más largo e IRA más corto en el LPE se asocia con la EV. La onda de reflexión arterial precoz probablemente distiende el VI y origina la EV quizás por el mecanismo de realimentación electromecánica, lo que tiene implicaciones clínicas.
Palabras clave: Extrasistolia ventricular. Ondas de reflexión arterial. Realimentación mecano-eléctrica.
Summary
Antecedent: Through sphygmokynetocardiography (SKCG) an exploratory method that records an electrocardiographic signal, a carotid pulse (CP), and two vibriograms (kinetocardiograms) of the left ventricle (LV) recorded in the left hemithorax (anterior kinetocardiogram, AKC) and the subcostal region of left abdomen (posterior kinetocardiogram of PKC, vibrations transmitted through the hemidiaphragm) we observed a systolic precocious reflection wave (Rw) in the CP and prolongation of LV ejection time (LVET) measured in AKC or in PKC of the previous sinusal preextrasystolic beat (PEB) vs control beats (CB) in cases with ventricular extrasystoles (VEs).
Objective: To demonstrate whether the intervals just mentioned are associated with ventricular extrasystoles.
Method: Sixty cases: 30 with VEs, group A, and 30 without arrhythmia, group B, were studied through SKCG. The LVET and the arterial reflection index or ARI = Ta-rw/LEVT, Ta-rw = time between initial ventricular impulse to reflexive wave, were measured.
Results: Demography was similar in both groups. PEB had a longer LVET than the CB (291 ± 41 vs 279 ± 39, p < 0.01) and ARI was shorter (0.36 ± 0.17 vs 0.58 ± 0.21, p < 0.001).
Conclusions: 1) Distention of the LV due to Rw, possibly through the well-known experimental mechanism of electromechanic feedback, is believed to underlie the arrhythmia. 2) The observation has important clinical implications.
Key words: Reflexive arterial waves. Ventricular extrasystole. Electromechanic feedback.
Introducción
La esfigmoquinetocardiografía (EQCG) digitalizada registra simultáneamente señales electrocardiográficas,1 fotopletismográficas dedo-mano, oscilaciones pulsátiles de la arteria carótida2 y vibraciones del ventrículo izquierdo3 mediante la colocación respectiva de detectores neumáticos en las regiones anterolateral y subcostal del hemitórax izquierdo. El aparato implicado en estas adquisiciones (esfigmoquinetocardiógrafo) conjunta una serie de sistemas previamente desarrollados y validados en nuestra Institución (Tabla I), cuyos circuitos de adecuación se anotan en la Tabla II. La esfigmoquinetocardiografía aplicada al estudio de las extrasístoles ventriculares mostró una onda de reflexión arterial (ORA) precoz (o sea, que llega a la raíz de la aorta en la tele o en la mesosístole) y una prolongación del periodo expulsivo (PE) del ventrículo izquierdo; ambos fenómenos observados en el ciclo cardiocirculatorio que precede a la extrasístole ventricular, lo que sugiere que la onda de reflexión distiende la cavidad ventricular izquierda y origina la arritmia, quizás mediante el fenómeno de la realimentación mecanoeléctrica también denominado retroalimentación contracción-excitación.4 Estos términos son utilizados para referir cambios electrofisiológicos4 producidos por estímulos miocárdicos mecánicos como son el estiramiento o las sobrecargas de volumen.5 La alteración ha sido descrita en células, en preparaciones multicelulares y en corazones intactos en donde elongaciones bruscas o sostenidas originan extrasístoles aisladas o repetitivas,6-8 especialmente en corazones desfallecientes.9 En humanos algunas situaciones clínicas que distienden el miocardio (sobrecargas de volumen espontáneas,10 farmacológicas11 o experimentales12), parecen asociarse a la aparición de arritmias.
En este trabajo se explora la hipótesis de que las ondas de reflexión precoz contribuyen a la aparición de extrasístoles ventriculares estudiando un índice que relaciona el tiempo aorta-frente de onda de reflexión del pulso carotídeo entre el periodo expulsivo y que se denomina índice de reflexión arterial (IRA),13 en casos con o sin esta arritmia. Además, se resalta la importancia de un desarrollo instrumental para identificar un substrato arritmogénico arterioventricular humano, hasta ahora no descrito en la literatura médica.
Metodología
Población. Se estudiaron 60 enfermos asistentes a la clínica cardiológica de adultos divididos en 2 grupos: grupo A (GA) formado por 30 enfermos con registro electrocardiográfico de cuando menos una extrasístole ventricular y grupo B (GB) constituido por 30 sujetos sin extrasistolia ventricular en cuando menos 500 latidos explorados mediante esfigmoquinecardiografía (visualización de las señales digitalizadas electrocardiográficas y del pulso de un dedo de la mano). Todos los casos contaron con estudios diagnósticos clínicos, de laboratorio y de gabinete obtenidos previamente. Criterios de inclusión: se aceptaron casos mayores de 30 años de edad sin manifestación de complicaciones cardiovasculares agudas o situaciones clínicas depauperantes y que podían tolerar la suspensión, cuando menos de 48 horas, de medicación anti o proarrítmica.
Aparato utilizado. Se trata de un instrumento diseñado por nosotros que hemos denominado esfigmoquinetocardiógrafo1-3 el cual brevemente se describe y consta de una computadora personal a la que se agrega una tarjeta convertidora de analógico a digital para registrar: la derivación DII del electrocardiograma, el pulso fotopletismográfico del dedo índice y dos señales recogidas en detectores neumáticos para obtener mediante transductores piezorresistivos (Tabla II) el oscilopulso carotídeo (OPC) y señales vibratorias (quinetocardiograma, QCG), producidas por el actuar de las paredes anterior y posterior del ventrículo izquierdo recogidas respectivamente en la cara anterolateral del hemitórax izquierdo (QCGant) o en la región subcostal izquierda QCGpost VI (vibraciones contráctiles de la pared posterior del ventrículo izquierdo transmitidas a través del diafragma). La captura se realiza a 350 muestras por segundo con 10 bits de resolución en amplitud por cada señal.
Procedimiento. El día del estudio se tomó la presión arterial auscultatoria y se efectuó el registro de las señales esfigmoquinetocardio-gráficas. Se colocaron los siguientes detectores: electrodos para la toma de DII, fotodetector del pulso en el dedo índice de la mano, 3 detectores neumáticos (DN1, DN2 y DN3) (bolsas de hule de 4 x 8 cm con dos salidas de conexión: una al transductor de presión y la otra a la perilla de insuflación) sostenidos por cinchos de tela inextensible de 6 cm de ancho para encircular transversalmente y en forma ceñida el cuello, el tórax y la parte superior del abdomen. Los detectores se situaron: el DN1 desde la línea media a la región anterolateral izquierda del cuello, el DN2 en la cara anterolateral del tórax desde la línea medioclavicular hacia la región anterior de la axila y cubriendo los espacios intercostales izquierdos 4º y 5º, y el DN3 en la región subcostal izquierda, en la parte alta del abdomen, alineado con el detector torácico DN1. Todos estos elementos se conectaron al adecuador de señales de las características señaladas en la Tabla II y a la computadora personal. En inspiración sostenida, en posición sedente y con los detectores neumáticos inflados a 50 mmHg se registró, en cuando menos 10 tramos de 6-10 latidos, la señal DII, el pulso en el dedo índice de la mano, el oscilopulso carotídeo (OPC) y el QCGant VI con el DN2 o el QCGpost VI con el DN3.13 En todos los tramos se registraron simultáneamente las señales DII y del pulso del dedo índice y las combinaciones OPC + QCGant VI u OPC + QCGpost VI.
Mediciones y criterios. Las señales se imprimieron en papel milimétrico y asistidos por la temporalidad del registro del electrocardiograma, del fotopulso del dedo índice y del oscilopulso carotídeo, se efectuaron las siguientes mediciones: a) intervalo R-R (DII) (tiempo de onda R a onda R del ECG), b) periodo expulsivo (PE): inicio del periodo expulsivo (IPE) hasta el cierre sigmoideo aórtico (CSA) determinado por la muesca en la rama ascendente de la deflexión ventricular (Fig. 1),13 c) tiempo aorta-rebote (ta-r) o sea, el intervalo inicio del periodo expulsivo ventricular-frente de onda de la reflexión en el oscilopulso carotídeo (Fig. 1) y d) índice de reflexión arterial (IRA): ta-r/PE.14

Estas mediciones se realizaron en los ciclos cardiocirculatorios clasificados en la siguiente forma, Grupo A: latido pre-extrasistólico que es el ciclo sinusal que precede a la extrasístole ventricular y que sigue a un latido también sinusal registrado en el QCGant VI o en el QCGpost VI; latido sinusal control: ciclo sinusal registrado antes o después de la extrasístole y no influido por la secuencia arrítmica. Grupo B: latido sinusal testigo, promedio de 3 ciclos consecutivos. Substrato arritmogénico carotídeo (SAC): variabilidad de > 40 ms en el tiempo aorto-rebote en 3 de 6 o más latidos consecutivos, y substrato arritmogénico ventricular (SAV): variabilidad de más 40 ms en el periodo expulsivo en 3 o más de 6 latidos consecutivos medidos en el QCGant VI o en el QCGpost VI.
Estadística. Se utilizó la prueba de (t) de Student (discriminación de 0.05) contrastada a 2 colas para variables continuas (las que se presentan como promedio ± desviación estándar), mientras que para contrastar proporciones se utilizó la prueba de χ2.
Resultados
En la Figura 1 se muestra un quinetocardiograma posterior del VI en un caso del GB y se señalan las mediciones realizadas en este trabajo y en la Figura 2 se señala un ejemplo de extrasístole ventricular precipitada por un rebote carotídeo precoz.
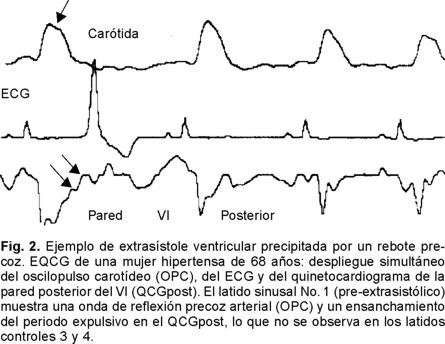
Las características demográficas del GA y del GB se ven en la Tabla III. No se encontraron diferencias en: edad, peso, talla, sexo y presión arterial. En la Tabla IV se mencionan los tipo de extrasistolia del GA. Los factores arritmogénicos en los dos grupos no fueron diferentes (Tabla V) con excepción de la ingestión de alcohol de carácter moderado (≥ 60 c.c. de licor > 40%ºL diario) y la cual prevaleció en el GA. Esfigmoquinetocardiografía (Tabla VI): el intervalo R-R, y el índice de reflexión arterial entre los grupos A y B medidos en los latidos control vs el promedio de 3 latidos testigo respectivamente, no mostraron variantes estadísticamente significativas con excepción de un periodo expulsivo menor en el GA. Siete casos del grupo A no tuvieron rebotes carotídeos precoces: en 6 de ellos se encontró un factor arritmogénico tradicional (4 casos con alcoholismo y 2 con miocarditis). En 3 casos con rebote carotídeo precoz no se encontró HA ni datos de arteriopatía. En el grupo A el latido sinusal pre-extrasistólico (Tabla VII) tuvo un PE (en ms) más largo (291 ± 41 vs 279 ± 39, p = 0.01) y un índice de reflexión arterial menor (0.36 ± 0.17 vs 0.58 ± 0.24, p = 0.0015) que el latido sinusal control. El substrato arritmogénico de tipo ventricular fue más frecuente en el GA (60%) que en el GB (33.3%), aunque el dato no fue significativo (p > 0.43). El substrato carotídeo fue marginalmente significativo entre ambos grupos: GA = 70% y GB = 46.6, p < 0.07.




Discusión
Aunque en 1628 Harvey observó las ondas de reflexión circulatoria. La importancia clínica de ellas se ha puesto en evidencia en las últimas 3 décadas y ahora se sabe que cuando son precoces y llegan a la raíz de la aorta en el periodo sistólico, interfieren con la expulsión ventricular izquierda alterando la relación presión-volumen, además de disminuir la fase diastólica del flujo coronario, lo que favorece estados isquémicos.3,4 En general las ondas de reflexión se originan en lugares donde se reduce el calibre de los vasos y sus efectos centrales dependen del momento de su formación en el ciclo cardiaco, del nivel de la presión, del estado de vasoconstricción-vasodilatación y de las propiedades viscoelásticas del árbol arterial. En la hipertensión arterial y en la edad avanzada la rigidez dinámica y estructural de las arterias está alterada;15 por ello, la formación de ondas de rebote es muy común.16 En esta observación se pone en evidencia que la precocidad de las ondas de reflexión arteriales (o sea, el frente de onda de las reflexiones que llegan a la aorta en la sístole) constatada por la medición del IRA se relacionan con la prolongación del periodo expulsivo del latido pre-extrasistólico por lo que se puede inferir que el suceso mecánico arterial actúa como un elemento disparador del episodio arrítmico, probablemente originado por una distensión del ventrículo izquierdo. Experimentalmente, en el perro, la implantación de una aorta rígida artificial altera las curvas de presión-volumen y forma un pico telesistólico debido a un aumento de la presión intraventricular que retarda la regresión volúmica por interferir con la expulsión del flujo,17 lo que distiende la cavidad cardiaca, esta observación apoya el hallazgo clínico aquí relatado, ya que la metodología utilizada estudia simultáneamente los rebotes o reflexiones arteriales, el periodo expulsivo del ventrículo izquierdo16 y la señal electrocardiográfica permitiendo constatar la relación entre los 3 elementos. El índice de reflexión arterial vincula el periodo expulsivo del VI con el tiempo aorto-rebote, lo que expresado en otra forma constata el porcentaje de interferencia sobre la expulsión ventricular que acarrea el fenómeno reflexivo (por ejemplo: un índice de reflexión arterial de 0.27 señala que en el 73% de la duración del periodo expulsivo existe una influencia de la onda de reflexión, un índice de reflexión arterial mayor de 1 significa que la reflexión llega a la raíz de la aorta en la diástole). En nuestra observación la modificación del índice de reflexión arterial en el latido pre-extrasistólico vs latidos no seguidos por la arritmia sucede por una disminución del tiempo aorta-onda de reflexión y por un alargamiento del periodo expulsivo, resaltando la influencia que el primero tiene sobre el segundo y sugiriendo que la onda de reflexión en la telesístole dificulta el vaciamiento del ventrículo izquierdo. La mayoría de las extrasístoles observadas ocurrieron en el periodo del llenado rápido ventricular por lo que muy probablemente la irrupción de este flujo contribuye al proceso distensivo.
No todos los latidos con un IRA acortado son seguidos por extrasistolia ni todos los latidos ectópicos van precedidos de un rebote conspicuo; sin embargo, en la mayoría de los latidos extrasistólicos se observó la secuencia relatada. Debe establecerse que en nuestro estudio la alteración mecánica se analiza en la oscilación carotídea, por lo que el tiempo real de llegada de la reflexión a la raíz de la aorta es más tardío y esto constituye una limitación del estudio. No obstante, el esfigmograma del pulso carotídeo se puede equiparar al del pulso aórtico18 y por ello la limitación no parece interferir significativamente con la valoración del índice. A nuestro juicio, las alteraciones arteriales constituyen un substrato arritmogénico favorecedor de arritmias; empero, para que la disritmia ocurra debe haber un substrato ventricular coexistente que desencadena el efecto mecano-eléctrico. No cuesta trabajo entender que la hipertrofia miocárdica de la enfermedad hipertensiva y el daño estructural del miocardio vinculado a la edad avanzada constituyan la base anatómica del substrato ventricular de la mayoría de nuestros casos, lo que aunado a los rebotes generan extrasistolia.
La ausencia de rebotes carotídeos precoces en 7 individuos del grupo A merecen comentario aparte; 4 de ellos tuvieron el antecedente de un daño miocárdico posiblemente alcohólico, en otros 2 casos una miocarditis aguda infecciosa constituyó el substrato ventricular aislado y en una mujer no se encontró elemento etiológico "primario". Por otro lado, en 3 casos con rebotes arteriales conspicuos y precoces no se encontró HA ni datos de otras arteriopatías; en ellos se planteó la posibilidad de que una alteración del tejido viscoelástico arterial de tipo primario o una anatomía particular del árbol arterial pudiesen tener importancia patogénica, asunto que deberá estudiarse en un futuro.
Como ya se mencionó, experimentalmente la realimentación mecano-eléctrica produce cambios electrofisiológicos y arritmias ventriculares cuyo mecanismo subyacente está vinculado al efecto de canales activados por estiramiento que desencadenan actividades disparadas19 o bien a alteraciones del ciclo cálcico intracelular,20 ambos procesos originan despolarizaciones postpotenciales que interrumpen la repolarización y provocan la extrasistolia.4 Es muy probable que este fenómeno constituya el vínculo electromecánico de nuestra observación.
En este trabajo, se resalta la importancia de detectar substratos arritmogénicos en poblaciones predispuestas a desarrollar arritmias, lo que le brinda al clínico la oportunidad de realizar medidas preventivas (vg. tratamiento intensivo de la hipertensión arterial cuando existe substrato carótido-ventricular) y, por otro lado, la ausencia de alteraciones arteriales mecánicas puede enfocar el estudio o la búsqueda de substratos vinculados a otras etiologías, como daño alcohólico, miocarditis, insuficiencia cardiaca, isquemia coronaria, etc. La esfigmoquinetocardiografía permite el estudio simultáneo de señales cardioarteriales y dota al clínico de un invaluable procedimiento para prevenir y tratar la extrasistolia que con frecuencia evoluciona a taquicardia o fibrilación ventricular y a muerte súbita.
Conclusiones
1) En casos con extrasistolia se encontró una disminución del índice de reflexión arterial y aumento del periodo expulsivo en el latido sinusal pre-extrasistólico, ambos datos con significancia estadística vs los latidos sinusales no relacionados con la arritmia. 2) El substrato arritmogénico ventricular fue más frecuente en el GA que en el GB lo cual sugiere que el substrato carotídeo actúa sobre una alteración peculiar del ventrículo izquierdo para provocar la disritmia. 3) El substrato carótido-ventricular constituye un marcador de un estado arrítmico o prearrítmico que abre posibilidades terapéuticas interesantes. 4) La esfigmoquinetocadiografía es un método útil en el estudio de éstas y seguramente de otras disritmias.
Referencias
1. INFANTE O, RODRÍGUEZ G, PÉREZ J, ESPINOSA L, VALENZUELA F: Terminal electrocardiográfica. Rev Mex Ing Biomed 1988; 9: 87-95. [ Links ]
2. INFANTE O, SÁNCHEZ G, MARTÍNEZ R, CHÁVEZ P, SÁNCHEZ G: Sistema para la medición no invasiva de la velocidad del pulso arterial. Arch Inst Cardiol Mex 1999; 69: 330-337. [ Links ]
3. SÁNCHEZ G, INFANTE O, MARTÍNEZ R, SÁNCHEZ G, FLORES P: Provocación y medición de 1a velocidad de la onda pulsátil retrógrada en sujetos normales e hipertensos. Arch Ins Cardiol Mex 1999; 69: 47-54. [ Links ]
4. TAGGART P, SUTTON PMI: Cardiac mechano-electric feedback in man: clinical revelance-progress in biophysic. Molecular Biology 1999; 71: 139-154. [ Links ]
5. REITER MJ: Contraction-excitation feedback. In: Zippes DP, Jalife J: Cardiac Electrophysiology. From cell to bedside, 3th, London, Toronto. Ed. Saunders Philadelphia Company, 2000: 249-255. [ Links ]
6. LAB MJ: Mechanically dependent changes in action potentials recorder from the intact frog ventricle. Circ Res 1978; 42: 519-528. [ Links ]
7. TAGGART P: Mechano-electric feedback in the human heart. Cardiovasc Res 1996; 32: 3-43. [ Links ]
8. SASAKI N, MITSUIWE T, NOMA A: Effect of mechanical stretch on membranes currents on single ventricular myocites of guinea-pig hearts. Jpn J Phisiol 1992; 42: 957-970. [ Links ]
9. WANG Z, TAYLOR LK, DENNEY WD, HANSEN DE: Initiation of ventricular extrasystoles by myocardial stretch in chronically dilated and failing canine left ventricle. Circulation 1994; 90: 2022-2031. [ Links ]
10. TAGGART P, SUTTON P, JOHN R, LAB M, SWANTON H: Monophasic action potential recordings during acute changes in ventricular loading induced by the Valsalva manoeuore. Br Heart J 1992; 67: 221-229. [ Links ]
11. BASHIR-SHEDDON JF, O'LLUNAIN-SELAL L: Comparative electrophysiological effects of captopril or hydralazine combined with nitrate in patients with left ventricular tachycardia. Br Heart J 1992; 67: 355-360. [ Links ]
12. TAGGART P, SUTTON P, LAB M, RUNNALS M, O'BRIEN, TREASURE T: Effect of abrupt changes in ventricular loading on repolarization induced by transient aortic occlusion in human. Am J Physiol 1992; 263: H1816-H823. [ Links ]
13. SÁNCHEZ TG, INFANTE O, MARTÍNEZ-MEMIJE R, FLORES P, RODRÍGUEZ G, URRIETA J, SÁNCHEZ-MIRANDA G: Sistema de registro de la velocidad de la onda del pulso con ayuda del quinetocardiograma anterolateral. Estudios en sujetos normales e hipertensos. 1er. Congreso Latinoamericano de Ingeniería Biomédica. Rev Mex Ing Biomed 1998; 1: 651-654. [ Links ]
14. SÁNCHEZ MG, SÁNCHEZ TG, INFANTE O, MARTÍNEZ-MEMIJE R, FLORES P, RODRÍGUEZ G: Reflexión sistólica del pulso. Un índice de sobrecarga sistólica en la hipertensión arterial. Memorias del 6º. Congreso Nacional de la Sociedad de Hipertensión Arterial de México A.C. 1998. resumen 41. [ Links ]
15. SÁNCHEZ TG, INFANTE O: La mecánica en la patología cardiovascular. Arch Inst Cardiol Mex 1996; 66: 301-305. [ Links ]
16. O'ROURKE M, KELLY RP: Wave reflection in the systemic circulation and its implications in ventricular function. J Hipertension 1993; 11: 327-337. [ Links ]
17. BERGER DS, ROBINSON KA, SHROFF SG: Wave propagation in copple left ventricle-arterial system implications for aortic pressure. Hypertension 1996; 27: 1079-1089. [ Links ]
18. SHARIR T, MARMOR A, TING CT, CHEN JW, LUIC P, CHANG MS: Validation of a method for noninvasive measurement of central arterial pressure. Hypertension 1993; 21: 74-87. [ Links ]
19. HANSEN DE, BORGANELL M, STACY G, TAYLOR LK: Dose-dependent inhibition of stretch-induce arrhythmia's by gadolinium in isolated canine ventricles. Evidence for a unique mode of antiarrhytmic action. Cir Res 1997; 69: 820-831. [ Links ]
20. JANSE MJ: The premature beat. Cardiovasc Res 1992; 26: 89-100. [ Links ]














