Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.71 no.4 Ciudad de México oct./dic. 2001
Revisión de temas cardiológicos
El magnesio en el tratamiento del infarto agudo del miocardio. Revisión y controversias
Magnesium in the treatment of acute myocardial infarction
Ursulo Juárez H,* Elliot M Antman**
* Adscrito a la Unidad Coronaria del Instituto Nacional de Cardiología "Ignacio Chávez". México, D.F.
** Profesor Asociado de Medicina. Director de la Unidad Coronaria "Samuel A. Levine", Brigham and Women's Hospital, Harvard Medical School, Boston Massachusetts, EUA.
Correspondencia
Ursulo Juárez Herrera.
Instituto Nacional de Cardiología "Ignacio Chávez"
(INCICH. Juan Badiano No. 1 Col. Secc. XVI, 14080, México, D.F.)
Tel. 5 573 29 11 Ext 1158 Fax 5 57324 79. E-mail: ujuarez@mail.medinet.net.mx
Recepción: 3 de julio de 2001
Aceptado: 13 de septiembre de 2001
Resumen
La utilización del magnesio en el tratamiento del infarto agudo del miocardio es motivo de controversia, pues su aplicación rutinaria no es una práctica establecida. Hay bases fisiológicas que atribuyen al magnesio propiedades de protección miocárdica sobre todo en relación con la terapia de reperfusión. En este trabajo se analizan los aspectos básicos del metabolismo del magnesio y sus efectos en el sistema cardiovascular, así como los efectos benéficos de este catión: en la prevención de arritmias, efectos antiplaquetarios, vasodilatación coronaria y prevención del daño por reperfusión, así mismo los riesgos de su aplicación en la cardiopatía isquémica. Ya que los resultados en los principales estudios han originado debate, se señalan las principales diferencias entre estos estudios y cuales son las posibles explicaciones al respecto y que dan como consecuencia diferencia en la interpretación de los hallazgos.
Palabras clave: Magnesio. Infarto agudo del miocardio. Daño por reperfusión.
Abstract
The use of magnesium in the current therapeutics of acute myocardial infarction is controversial. There are theoretical bases on possible benefit mechanisms of action, whereby the magnesium have unique properties of myocardial cyto-protection, mainly reperfusion injury. The fundamental aspects about metabolic vias of magnesium, and the pathophysiologic explanations for the beneficial effect of magnesium included prevention of arrhythmia, antiplatelet effect, prevention of reperfusion injury, coronary vasodilation. Deleterious effects are out-lined. The results of the main trials have originated considerable discussions in the world cardiology community. The principal differences between these trials and the possible explanations in order to interpret the results are explained.
Key words: Magnesium. Acute Myocardial infarction. Reperfusion injury.
Introducción
El magnesio (Mg2+) en la terapéutica cardiológica médica se ha empleado para el tratamiento de las crisis de hipertensión arterial y en los episodios convulsivos de la eclampsia. Su principal indicación es el tratamiento de las arritmias cardiacas post-infarto como las ventriculares tipo torsades de pointes . Además en los últimos años, la utilización de este catión ha tenido participación como: 1. Protector de isquemia cerebral en sobredosis de cocaína.1. 2. Protector de las terminaciones espinales sensitivas afectadas por compresión crónica, ya que el Mg2+ inhibe la utilización de glucosa en la médula.2 3. Broncodilatador en asma bronquial.3 Al Mg2+ no se le había dado la oportunidad de tener una participación protagónica en el tratamiento del infarto agudo del miocardio (IAM), sino hasta fechas recientes.
Ubicación del problema
En los últimos años, el tratamiento del IAM se ha definido en ofrecer terapia de reperfusión (trombólisis y/o angioplastía), por el indudable beneficio que implica restablecer el flujo anterógrado en la arteria responsable. Esta terapia de reperfusión requiere de un tratamiento denominado "conjunto" por acompañarse con heparina no fraccionada. El tratamiento "adjunto", incluye: beta bloqueadores, inhibidores de la enzima convertidora de angiotensina y aspirina, los que han demostrado reducir la mortalidad y aumentar la sobrevida en el IAM.4 En años recientes otros medicamentos tales como los antagonistas del calcio, los antiarrítmicos de clase I y el Mg2+ han tratado de ocupar un lugar en el tratamiento adjunto, sin haber demostrado un beneficio sólidamente documentado en términos de reducción de la mortalidad.
¿Qué se sabe del magnesio?
Los efectos cardiovasculares del Mg2+ reflejan un proceso de antagonismo para el Calcio (Ca2+), razón por la cual se le ha llamado el "bloqueador fisiológico del calcio".5 Estudios experimentales atribuyen al Mg2+ propiedades benéficas de agente protector del miocardio, en lo que se refiere al daño por reperfusión6 y que pueden indicar la participación del calcio en el daño por reperfusión y por tanto la importancia del Mg2+ como antagonista de calcio.
Sin embargo los resultados de algunos de estos estudios como el LIMIT 26 y otros multicéntricos como el ISIS-4,7 han originado controversias al respecto. Principalmente en lo que se refiere al momento de su aplicación, y a la interpretación de los resultados, por lo que el papel del Mg2+ en el tratamiento del IAM no se ha establecido, haciendo necesario nuevos estudios que evalúen su eficacia.
Aspectos generales del magnesio
La concentración total en el suero humano es de 0.89 mM, en parte unido a la albúmina y otros componentes, por lo que la concentración de Mg2+ libre extracelular es de 0.5 mM.8 La mayor parte del Mg2+ intracelular se encuentra en los microsomas del retículo endoplásmico rugoso y en mitocondrias.8 Este catión se encuentra principalmente en células de músculo estriado, hepatocitos, y osteocitos, menos del 1% del Mg2+ total se encuentra en el espacio extracelular.9 Su concentración sérica normal es de 1.8-2.2 mEq/L.9 Como se mencionó, el Mg2+ circulante está parcialmente unido a las proteínas, así que sólo el 70-80% es filtrado a través del glomérulo, y el 3% del Mg2+ filtrado escapa de la reabsorción tubular y es excretado. Hay 4 hormonas que estimulan la reabsorción del Mg2+ en el asa de Henle: la antidiurética, la paratiroidea, el glucagon, la calcitonina, y los fármacos con acción beta adrenérgica.9
Las concentraciones séricas del Mg+2 reflejan el Mg+2 libre o ionizado (55%), otro tanto es el Mg2+ quelado (12%), y las fracciones unidas a proteínas (33%). La forma libre es la forma activa del Mg2+. La reducción de albúmina abate los niveles séricos del Mg+2 sin afectar el total del Mg2+ ionizado. La alcalosis aumenta su unión a proteínas y en condiciones de acidosis ocurre lo opuesto. Algunos estados de deficiencia de Mg2+ tisular pueden existir con niveles de Mg2+ sérico normales.10
La necrosis miocárdica y el daño por reperfusión. Un problema no resuelto.
En 1985 Braunwald y Kloner11 señalaron que había un efecto adverso al reperfundir las células miocárdicas circundantes del sitio donde ha ocurrido necrosis. Los mecanismos de daño miocárdico por reperfusión se han clasificado en diferentes tipos: 1. Letal. Se refiere a la muerte celular inducida por la reperfusión, aunque algunas células permanecen viables cuando el flujo sanguíneo es restaurado 2. Vascular progresivo. Este se presenta como resultado de una zona que ha tenido fenómeno de no-reflujo, y que se expande a áreas contiguas con pérdida de la reserva vasodilatadora. 3. Aturdimiento miocárdico y disfunción contráctil. Es la forma que se observa mas frecuentemente en los síndromes coronarios agudos ocasionados por isquemia prolongada. 4. Arritmias por reperfusión. Taquicardia o fibrilación ventricular, que ocurren en segundos o minutos de haberse restaurado el flujo coronario . De estos diferentes tipos de daño por reperfusión, el daño letal es controversial en el hombre.
Estudios experimentales han demostrado que la pérdida de Mg2+ ocurre después de un episodio de reperfusión súbita, a través de un fenómeno conocido como transición de la permeabilidad de la mambrana interna mitocondrial. Así, se da lugar a un proceso que resulta dañino para el miocardio. La sobrecarga de Ca2+ y la generación de radicales de oxígeno libres,11 afectan la integridad del sarcolema durante la reperfusión, estas observaciones se han relacionado con reducción de los niveles intracelulares de Mg2+ y con un incremento en los niveles de Ca2+. Otros efectos adversos que ocurren con la sobrecarga de Ca2+ intracelular son la activación de proteasas degradativas, que afectan irreversiblemente la función mitocondrial.12 Estudios experimentales y clínicos sugieren que el Mg2+ puede ser eficaz y utilizarse para reducir el daño por reperfusión al disminuir la sobrecarga de Ca2+. El papel del Mg2+ durante la isquemia-reperfusión parece multifactorial. En la Tabla I se mencionan los posibles mecanismos benéficos del Mg2+ durante el proceso de reperfusión, algunos están documentados experimentalmente y otros son hipotéticos.13

Efectos del magnesio en la cardiopatía isquémica
Anti-isquémico
Los mecanismos por los cuales el Mg2+ ofrece protección celular se deben a los siguientes efectos: Reducción tanto del influjo intracelular,14 y de la sobrecarga de Ca+2,15 así como una conservación de niveles de ATP mitocondrial16 y menor generación de radicales de oxígeno libres durante la reperfusión.17
Antiarrítmico
Prolonga el intervalo PR, retrasa el tiempo de conducción sino-atrial y atrio-ventricular, e incrementa el periodo refractario en el nodo AV. Estudios experimentales realizados por de Micheli, Medrano y cols.18,19 muestran que la acción del sulfato de Mg2+ es responsable de la reducción de voltaje de los potenciales de los tejidos específicos y, por ende de la conducción aurículo-ventricular, esencialmente a nivel del nodo A.V. En estos experimentos, el sulfato de Mg2+ ha causado siempre lentitud de la conducción A.V. y depresión importante del automatismo cardiaco. Esta llevaba generalmente al paro ventricular en diástole, seguido pronto de una buena recuperación funcional. En conclusión el sulfato de Mg2+ deprime considerablemente el automatismo cardíaco hasta provocar paros auriculares y ventriculares transitorios, seguidos de una excelente recuperación funcional. El Mg2+ vuelve lenta la conducción A.V. esencialmente a nivel del nodo de Asschoff-Tawara.18-20 No afecta significativamente el periodo refractario ni la conducción a nivel atrial o ventricular.21 Las arritmias que responden favorablemente a la infusión de Mg2+ son la taquicardia ventricular helicoidal; Torsades de Pointes; en otras arritmias la respuesta es menos efectiva (taquicardia ventricular monomórfica, arritmias supraventriculares por re-entrada, y taquicardia atrial multifocal).22
Hemodinámicos y sobre la circulación coronaria
A)En sujetos sanos
El Mg2+ reduce la presión sistólica y las resistencias vasculares sistémicas,23 lo que conlleva una disminución de la post-carga y ligero incremento en la frecuencia cardiaca, secundario a hipotensión. Los efectos del Mg2+ sobre las arterias coronarias se caracterizan por reducción en la resistencia vascular.24 El resultado es un significativo incremento en el flujo coronario.
La vasodilatación coronaria, inducida por el Mg2+, puede estar directamente relacionada con su efecto calcio-antagonista sobre las células del músculo liso vascular, o bien por la liberación de prostaciclinas y óxido nítrico dependiente de Ca2+ en la pared vascular,25 pero no se conoce con exactitud este último mecanismo.
B) En enfermedad coronaria
Existe un incremento en la concentración sérica de catecolaminas, al ocurrir isquemia aguda, debido a la activación del sistema simpático como un mecanismo compensatorio para incrementar la contractilidad miocárdica y perfundir órganos vitales.26 El incremento de las catecolaminas circulantes requiere de aporte adicional de Mg2+ para mantener los procesos metabólicos dependientes de energía. En los enfermos que sufren IAM ocurre una reducción progresiva en los niveles extracelulares de Mg2+,27 influenciada en parte por la sobre-estimulación adrenérgica, de manera que se establece un círculo vicioso donde las catecolaminas por un lado provocan desplazamiento del Mg2+ del compartimento intra al extracelular, provocando inestabilidad, y por otro lado incrementan la permeabilidad de la membrana, con mayor pérdida adicional de potasio.28 La pérdida de Mg2+ inducida por las catecolaminas se asocia a una mayor captación de calcio con la consecuente acumulación intracelular y daño por sobrecarga.29
Efectos vasculares del magnesio
Incrementa la perfusión miocárdica tras abatir la postcarga, reduce el tono arterial coronario, estabiliza las membranas, inhibe la agregación plaquetaria y disminuye las arritmias cardiacas.22-23 Se ha descrito que la hipomagnesemia se asocia a aterosclerosis, cardiomiopatías, insuficiencia cardiaca, arritmias e IAM.30 Algunos estudios han mostrado que la disminución aguda y crónica de Mg2+ es deletérea para el miocardio isquémico.27 Estudios epidemiológicos señalan que los enfermos con IAM tienen reducción crónica de Mg2+ sérico,28 e inclusive se ha propuesto que existe una relación entre dietas bajas en Mg2+ y mayor mortalidad por cardiopatía isquémica. Más importante resulta el hecho que los principales factores de riesgo para la cardiopatía isquémica: Hipertensión Arterial Sistémica, Hiperlipidemia, y Diabetes Mellitus, se asocian a una deficiencia crónica de Mg2+.30
Así que tanto en el marco teórico como en el experimental, con relación al Mg2+ e IAM , se han propuesto los siguientes mecanismos: en el IAM se puede inducir una deficiencia relativa funcional de Mg2+ aún en sujetos normo-magnesémicos. La deficiencia de Mg2+ se acompaña de hipokalemia, la cual no puede ser totalmente corregida mientras exista hipomagnesemia, lo que predispone a arritmias letales que se presentan frecuentemente en las primeras 48 hrs del IAM, mismas que deben ser tratadas con potasio y Mg2+ por vía endovenosa. En algunos estudios controlados el Mg2+ ha demostrado reducir el riesgo de arritmias post-IAM tanto ventriculares como supraventriculares, particularmente las del tipo torsades de pointes, la toxicidad por digital, y la taquicardia ventricular.27
Por otro lado, se ha encontrado cierta relación positiva entre los niveles séricos de Mg2+ y los niveles de lipoproteínas de alta densidad en la enfermedad coronaria, lo cual pudiera tener cierto efecto protector.27
Relación magnesio-plaquetas-trombosis
Al Mg2+ se le han atribuido propiedades que inhiben la agregación plaquetaria tanto in vivo como in vitro.31 La agregación plaquetaria es inducida por varios agonistas como epinefrina, colágena, fibronectina , vitronectina y es inhibida por el Mg+2.32 Dichos efectos se explican por reducción del ingreso de Ca2+, y reducción en la síntesis, liberación de eicosanoides pro-agregatorios como es el tromboxano A2, y el ácido 12-hidroxieicosatetraenoico. El Mg2+ estimula la síntesis endotelial de prostaciclinas, mediadoras de la vasodilatación coronaria e inhibidoras de la agregación plaquetaria en humanos.33 La activación plaquetaria puede ser estimulada por muchos mecanismos, a través de receptores de membrana plaquetarios y mensajeros secundarios que estimulan tanto el ingreso intracelular de Ca2+, como la degranulación plaquetaria. Los efectos antiplaquetarios del Mg2+ parecen estar relacionados con un bloqueo en la disponibilidad intracelular de Ca2+, el cual es esencial en la transducción de señales en las plaquetas y su activación. Esto además de la posible liberación de óxido nítrico en la pared vascular el cual tiene efecto antitrombótico.25 Las propiedades antiplaquetarias del Mg2+ se señalan en la Tabla II.

Efectos adversos en el sistema cardiovascular
Los efectos tóxicos atribuidos a incremento de Mg2+ sérico se presentan cuando sobrepasan de 5 a 20 veces los valores extracelulares. Estas concentraciones tienen efecto sobre la contractilidad miocárdica34 y el sistema de conducción. Se manifiestan por prolongación del intervalo PR, ensanchamiento del QRS, e incremento en la amplitud de la onda T. Se ha descrito paro cardiaco cuando los niveles sobrepasan los 35 mg/dL. Son contraindicaciones para recibir terapia con Mg2+: El bloqueo AV completo, bradicardia sinusal sintomática, hipotensión sistólica sostenida, choque cardiogénico, e insuficiencia renal con creatinina sérica > 3.0 mg/dL. Debe señalarse que las dosis a las cuales se utiliza el Mg2+ en el contexto del IAM no alcanzan ni con mucho las concentraciones señaladas.
Estudios clínicos con la aplicación de magnesio en el IAM con y sin tratamiento trombolítico
Estudios aleatorios, doble ciego, que compararon el Mg2+ contra placebo, y que mostraron beneficio en su mayoría, fueron realizados en la era pre-trombolítica. Los meta-análisis con Mg2+ en el IAM,35 coinciden en mostrar mejores resultados, sobre todo cuando coexiste un tratamiento de reperfusión simultáneo. La dosis administrada de Mg2+ fue de 30-90 mmol por paciente, infundidos durante 24-96 hr. El efecto de esta infusión, en términos de mortalidad, en dichos estudios, se muestra en la Tabla III. Las evidencias sugieren que la administración de Mg2+, antes de que ocurra la reperfusión, reduce el daño miocárdico y la mortalidad, aun en el grupo de enfermos considerados como no-candidatos a recibir terapia trombolítica. Se ha reportado que hasta un 50% de los individuos con IAM, quienes no reciben terapia trombolítica por diversas razones, muestran una mortalidad hospitalaria más alta (14-20%), especialmente en pacientes de edad avanzada.36 El riesgo de muerte luego de un IAM aumenta conforme a la edad, de un 3% en pacientes menores de 65 años a un 14.2% en pacientes de 65 a 74 años, y en un 29.2% en sujetos de 75 años o mayores. Actualmente, el número de enfermos mayores de 75 años que presentan IAM va en aumento, donde la edad per se no es contraindicación para trombólisis.
Morton37 publicó que el Mg2+ no sólo reduce la mortalidad hospitalaria en los enfermos con IAM, sino también el tamaño del mismo en un 20% en sujetos con clasificación Killip I. Como se puede ver en la Tabla III, los primeros estudios incluían pocos casos. En cambio, el estudio LIMIT-26 incluyó 2,316 enfermos y fue diseñado para probar la hipótesis que la concentración doble de Mg2+ reduciría la mortalidad en los enfermos con IAM. En dicho estudio, el 36% de la población recibió terapia trombolítica. Se aplicó un bolo de Mg2+ antes de la trombólisis, y su infusión fue concomitante con esta última. De manera que los enfermos trombolizados deberían tener niveles séricos de Mg2+ elevados al ocurrir la reperfusión. En aquellos que no recibieron trombólisis, la pronta administración de Mg2+ también aseguró una elevada concentración sérica al momento de ocurrir la reperfusión espontánea. En el grupo que recibió trombólisis, la mortalidad total se redujo 24% a 28 días (de 10.3% a 7.8%). Hubo 25% menos disfunción ventricular izquierda hospitalaria y menor mortalidad por causas isquémicas durante el seguimiento a 2.7 años. En el grupo que no recibió trombólisis, pero sí Mg2+, la mortalidad fue menor tanto por arritmias, como por disfunción ventricular izquierda. La conclusión de este estudio6 concuerda con pequeños estudios clínicos, pues muestra una reducción en la mortalidad con la aplicación de Mg2+.
Un estudio aleatorio doble ciego, comparado con placebo que demostró los beneficios del Mg2+ en el IAM, es el de Shechter y cols.38 En éste, se administró el Mg2+ en 194 enfermos con IAM no candidatos a trombólisis. Noventa y seis de ellos recibieron 22 gm (92 mmol) de sulfato de Mg2+ en solución glucosada durante las primeras 48 horas, (6 gm en las primeras 3 horas, 10 gramos en las siguientes 21 horas y 6 gm en las siguientes 24 horas); los restantes 98 pacientes recibieron placebo. Los resultados se muestran en la Tabla IV y dejan ver el beneficio en los que recibieron Mg2+. El grupo tratado con Mg2+ mostró reducción de arritmias, insuficiencia cardiaca, y trastornos de la conducción, comparado con el grupo placebo. La mortalidad hospitalaria también fue menor en el grupo que recibió Mg2+ (4% vs 17%, p < 0.01) (Tabla IV). En este estudio, 77 enfermos (38%) eran mayores de 70 años. Se observó que la mortalidad hospitalaria, en este grupo de alto riesgo, fue reducida importantemente respecto al grupo control . El choque cardiogénico fue la principal causa de muerte en el grupo que recibió placebo (11 de 17 pacientes) y sólo uno en el grupo que recibió Mg2+ lo presentó. La fracción de expulsión evaluada a las 72 hr y a los 2 meses, fue mayor en el grupo con Mg2+ que en el grupo con placebo.

No obstante estos resultados, otros estudios muestran lo contrario, creando controversia que se deriva de los resultados que mostró el estudio ISIS-4,7 con 58,050 pacientes en el cual el Mg+2 no mostró ningún beneficio en mortalidad a los 35 días (Fig. 1). El grupo control tuvo una mortalidad de 7.24% y el grupo tratado con Mg2+ 7.64%. En este estudio la terapia trombolítica fue administrada antes que la infusión de Mg2+, por lo que el Mg2+ tenía una amplia ventana de administración (hasta 24 hr). Sin embargo, no se informa el tiempo transcurrido desde el inicio de los síntomas, ni el tiempo de aplicación de la trombólisis, tampoco el tiempo en el cual se aleatorizaron para recibir la infusión de Mg2+. Esta estrategia fue llevada a cabo en el 70% de los pacientes; en el resto que no recibió trombólisis (30%), se aleatorizaron a las 12 hr, tiempo suficiente para que un número considerable de ellos hubiese tenido reperfusión espontánea. De acuerdo a los estudios angiográficos, se ha demostrado que la reperfusión espontánea ocurre al menos en el 30% de los pacientes dentro de un periodo de 12 hs39 que no reciben trombólisis. Episodios espontáneos de oclusión-reperfusión ocurren en una proporción significativa de enfermos.40 Un punto importante en este estudio es que resultaría muy difícil para cualquier protocolo abatir la mortalidad que se reporta en el ISIS-4,7 especialmente en el grupo que no recibió trombólisis (7.24% a 35 días). De esta manera es posible suponer que la mayoría de los pacientes incluidos en el ISIS-47 fueran una población de bajo riesgo, y que no tuvieron niveles séricos de Mg2+ elevados al momento de ocurrir la reperfusión. Además, el Mg2+ ha mostrado una estrecha ventana terapéutica por lo tanto su aplicación debe ser temprana para ofrecer sus beneficios, como: reducir el tamaño del infarto, o prevenir el daño por reperfusión en el tiempo. De manera que los hallazgos de estos estudios sugieren que una de las siguientes posibilidades puede ser la correcta:

1. Los resultados del ISIS-4 son verdaderos y el Mg2+ es inefectivo, o
2. Los ensayos experimentales y los pequeños estudios clínicos, son verdaderos y el Mg2+ sí puede reducir la mortalidad en el IAM.
Análisis de los resultados disponibles
Hay dos diferentes modelos estadísticos donde se ha usado Mg2+ intravenoso: a) El modelo de los efectos fijos, el cual asume que la población a estudiar es homogénea, y la única diferencia es el medicamento que se prueba, y b) el que analiza los efectos de aleatorización. Este último supone de antemano que la población en los estudios clínicos es heterogénea, ya sea por factores como: poblaciones diferentes, protocolos alternos, tratamientos concomitantes, etc. Si la heterogeneidad de la población es mínima en diferentes estudios, ambos modelos tendrán hallazgos similares. Pero si la heterogeneidad es significativa, la mayoría de las autoridades están a favor del modelo de los efectos de aleatorización para probar una hipótesis 41. En la Figura 2 se mues tra el resultado del meta-análisis de los estudios con Mg2+. El beneficio en reducción de la mortalidad, con estas 2 técnicas de análisis estadístico, muestra un beneficio con el modelo de efectos de aleatorización, y no lo hay con el modelo de efectos fijos. El beneficio en razón de momios (OR), estimado para mortalidad es: 0.44 (0.27-0.71) con el modelo de los efectos fijos, y de 0.45 (0.23-0.87) con el modelo de efectos de aleatorización de acuerdo al meta-análisis de los 7 estudios clínicos con Mg2+ intravenoso publicados entre 1984 y 1991.42 Independientemente de la forma de analizar grandes estudios vs pequeños estudios acerca del papel del Mg2+ en el IAM el estudio LIMIT-26 mostró una significativa reducción de la mortalidad gracias al Mg2+.
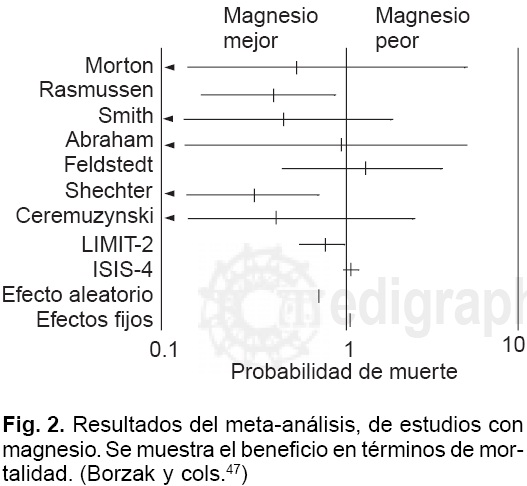
¿En qué radica esta diferencia de resultados?
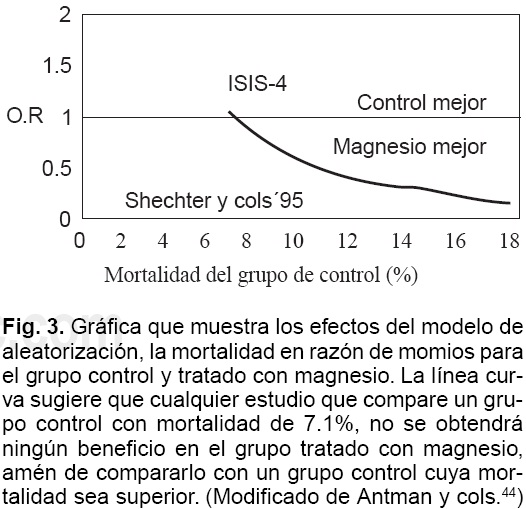
Los investigadores de la escuela de Salud Publica y del Departamento de Estadística de la Universidad de Harvard publicaron un análisis de meta-regresión43 de todos los estudios donde se ha usado el Mg2+ en el IAM. Dicho análisis demuestra que existe una progresiva reducción del beneficio en el grupo tratado con Mg2+ a medida que disminuye la mortalidad en el grupo control (Fig. 3); una relación curvilínea que cruza el OR a nivel de 1.0 significa que cualquier estudio realizado previamente o futuro donde se compare un grupo control con una mortalidad de 7.1%, no se obtendrá ningún beneficio en el grupo tratado con Mg2+ (como es el ISIS-4), por lo contrario, en un estudio que compare a un grupo control con mayor mortalidad (edad avanzada, reperfusión tardía, disfunción ventricular), cuyo valor evidentemente es mayor de 7.1%, probablemente se demostrará beneficio en el grupo tratado con Mg2+.
Como consecuencia de los resultados del ISIS-4,7 donde no se demostró beneficio en términos de mortalidad, y sí se mostraron efectos deletéreos, se abandonaron en la práctica clínica estudios en marcha y protocolos con Mg2+.
Diferencias entre los estudios ISIS-4 y LIMIT-2
La primera se encuentra en el tiempo de aleatorización. En el LIMIT-2,6 el 74% de la población se aleatorizó dentro de las primeras 6 hr y en el ISIS-47 sólo el 40%. De manera que la reperfusión, en la mayoría de los pacientes del ISIS-4,7 ocurrió sin la influencia del Mg2+. En el ISIS-47 la trombólisis se administró antes que se administraran los medicamentos a probar (captopril, isosorbide, y Mg2+). Además, el tiempo de aleatorización fue de 12 hr. En los pacientes que no recibieron trombólisis, por lo tanto, es posible que por el tiempo transcurrido, ya hubiera ocurrido reperfusión espontánea, antes de que se encontraran elevados los niveles séricos de Mg2+, y por ende no hubo prevención del daño por reperfusión. El tiempo preciso en el cual fue administrado el Mg2+ en el estudio ISIS-47 no se conoce.44 Sólo se reporta que en el 50% de los enfermos que recibieron Mg2+, lo recibieron dentro de las 2 hr siguientes a la trombólisis. De acuerdo con lo establecido en este estudio, el medicamento a probar debería iniciarse inmediatamente después de la trombólisis. Entonces más del 50% de la población estudiada, puede considerarse fuera de protocolo.
Consideraciones finales
Los resultados del ISIS-47 orientan a pensar que no hay beneficio en términos de mortalidad aplicando el Mg2+ después de la trombólisis. El LIMIT-26 muestra evidencia que la aplicación del Mg2+ antes de la trombólisis protege el miocardio y prolonga la sobrevida. El aumentar los niveles séricos de Mg2+ en el IAM, previamente o concomitantemente con la reperfusión, limita el daño ocasionado por ésta y favorece los efectos antiplaquetarios. Sin embargo, estos beneficios del Mg2+ operan en un rango estrecho de tiempo con relación a la reperfusión. No hay evidencia que sugiera que las dosis de Mg2+ utilizadas en los estudios presentados sean peligrosas, además es un tratamiento no oneroso y simple de proporcionar.45 Las controversias relacionadas con este tema continúan, ya que recientes observaciones del Segundo Registro Nacional del Infarto del Miocardio,46,47 informan que el uso del Mg2+ fue asociado a un incremento en la mortalidad en enfermos que no recibieron terapia de reperfusión (20.2% vs 13.2%, p < 0.0001) pero no en enfermos que sí recibieron terapia trombolítica (6.2% vs 5.9%, p = NS). Si en realidad la reducción de la mortalidad es de un 4.5% a 3 años, como lo mostró el estudio LIMIT-2,6 el Mg2+ tiene un verdadero lugar en el tratamiento del IAM. Debe señalarse que los resultados del ISIS-47 justifican nuevos estudios y que hoy día no hay un criterio uniforme en relación con el papel terapéutico del Mg+2 en el IAM, a pesar del continuo debate en la interpretación de los resultados.
¿Qué es lo que se propone hacer ahora?
En el estudio MAGIC48 (Magnesium in Coronaries) actualmente en curso, se aplica el Mg2+ antes y/o concomitantemente con la reperfusión (trombólisis o angioplastía primaria), el cual incluye pacientes de alto riesgo mayores de 65 años, cuyo objetivo primario es la mortalidad a 30 días. Nosotros creemos que este diseño de estudio permite que se pongan a prueba las hipótesis que favorecen el uso del Mg2+ para comprobar dichos resultados. La respuesta para conocer cuál es el papel del Mg2+ en el tratamiento del IAM es importante por sí misma y tiene amplias implicaciones en la investigación futura.
Agradecimientos
Los autores agradecen al Dr. Eulo Lupi Herrera Jefe de la Unidad Coronaria del Instituto Nacional de Cardiología "Ignacio Chávez" la revisión de este trabajo.
Referencias
1. GOLDMAN RS, FINKBEINER SM: Therapeutic use of magnesium sulfate in selected cases of cerebral ischemia and seizure. N Engl J Med 1988; 319: 1224-25. [ Links ]
2. SZABO MD, CROSBY G: Central Nervous Sistem effects of magnesium. Anesth Analg 1989; 69: 691-692. [ Links ]
3. OKAYAMA H, AIKAWA T, OKAYAMA M: Bronchodilating effect of intravenous magnesium sulfate in bronchial asthma. J Am Med Assoc 1987; 257: 1076-78. [ Links ]
4. FREEK WA: Acute Coronary Syndromes: Drug Treatments. Lancet 1999: 353(Suppl II) 20-23 [ Links ]
5. ISERI LT, FRENCH JH: Magnesium: Nature's physiologic calcium blocker. Am Heart J 1984; 108 (1): 188-193. [ Links ]
6. WOODS KL, FLETCHER S, ROFFE C, HAIDER Y: Intravenous Magnesium sulphate in suspected acute myocardial infarction: Results of the second Leicester Intravenous Magnesium Intervention Trial (LIMIT-2) Lancet.1992; 339: 1553-1558. [ Links ]
7. ISIS-4 Collaborative Group: A Randomized factorial trial assessing early oral captopril,oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet. 1995; 345: 669-685. [ Links ]
8. RODRÍGUEZ-ZAVALA JS: Bioquímica y Fisiología del Mg2+ en el corazón y en otros órganos. Arch Inst Cardiol Méx 1998; 68: 262-272. [ Links ]
9. GUYTON C, HALL E: Textbook of Medical Physiology. Integration of renal mechanisms for control of blood volume and extracelular fluid volume; and renal regulation of potasium, calcium and magnesium. 9a Edition, Philadelphia, Pennsylvania; W.B. Saunders Company 1996; 382. [ Links ]
10. ZALOGA GP: Interpretation of seric level of magnesium. Chest 1989; 95: 257-258. [ Links ]
11. BRAUNWALD E, KLONER RA: Myocardial Reperfusion: a double-edged sword? J Clin Invest. 1985; 76: 1713-1719. [ Links ]
12. BOLLI R: Oxygen-derived free radicals and postischemic myocardial disfunction ("Stunned myocardium"). J Am Coll Cordiol 1988; 12: 239-249. [ Links ]
13. STEENBERGEN C, MURPHY E, LEVY L, LONDON RE: Elevation in cytosolic concentration early in myocardial ischemia in perfused rat heart. Circ Res 1987; 60: 700-707. [ Links ]
14. WOODS KL: Possible pharmacological actions of magnesium in acute myocardial infarction. Br J Clin Pharmacol 1991; 32: 3-10. [ Links ]
15. WHITE RE, HARTZELL HC: Effects of intracellular free magnesium on calcium current in isolated cardiac myocites. Science 1988; 239: 778-780 [ Links ]
16. FERRARI R, CURELLO AS, CECCONI C: Myocardial recovery during post-ischaemic reperfusion: Effects of nifedipine, calcium,and magnesium. J Mol Cell Cardiol 1986; 18: 487-498. [ Links ]
17. HERASE DJ, STEWART DA, BRADIMBIRDGE MV: Cellular protection during myocardial ischemia. Circulation 1976; 54: 193-202. [ Links ]
18. DE MICHELI A, MEDRANO GA, TESTELLI M, SODI PALLARES D: L'action de certaines substances chimiques sur l'électrogramme et la courbe de tensión artérielle chez le chien. Mal Cardiovasc 1963; 4(2): 607-649. [ Links ]
19. DE MICHELI A, MEDRANO GA, SODI PALLARES D: Efectos de algunas soluciones electrolíticas sobre la evolución electrocardiográfica del infarto experimental agudo del miocardio. Arch Inst Cardiol Mex 1963; 33: 567-580. [ Links ]
20. MEDRANO GA, DE MICHELI A, SODI PALLARES D: Les potentiels des structures spécifiques du coeur et leurs relations chronologiques avec l'électrocardiogramme périphérique chez le chien. Acta Cardiol 1962; 17: 731-760. [ Links ]
21. DICARLO LA, MORADY F, DE BUITLEIR M: Effects of magnesium sulfate on cardiac conduction and refractoriness in humans. J Am Coll Cardiol 1986; 7(6): 1356-1362. [ Links ]
22. RODEN DM: Magnesium treatment of ventricular arrhythmias. Am J Cardiol 1989; 63: 43G-46G. [ Links ]
23. VIGORITO C, GIORDANO A, FERRANO P: Haemodinamics effects of magnesium sulphate on the normal human heart. Am J Cardiol 1991; 67: 1435-1437. [ Links ]
24. KUGIYAMA K, YASUE H, OKUMURA K: Suppression of exercise-induced angina by magnesium sulphate in patients with variant angina. J Am Coll Cardiol 1988; 12(5): 177-183. [ Links ]
25. KEMP PA, GARDINER SM, MARCH JE: Hindquarters vasodilator effect of MgSo4 in conscious rats: Possible involvement of nitric oxide . Br J Pharmacol 1992; 107: 403P. [ Links ]
26. SMETANA R, BRICHTA, GLOGAR D, GOTTSAUNER-WOLF M, WEINDLMAYR-GOETTL M, MEISINGER V, SPONA J: Stress and magnesium metabolism in coronary artery disease. Magnesium Bull 1991; 13: 125-127. [ Links ]
27. CASSCELLS W: Magnesium in myocardial infarction. Lancet 1994; 343: 807-809. [ Links ]
28. JOHNSON CJ, PETERSON PR, SMITH EK: Myocardial tissue concentrations of magnesium and potassium in men dying suddenly from ischemic heart disease. Am J Clin Nutr 1979; 32: 967-970. [ Links ]
29. BOLLI R: Myocardial Stunning in man. Circulation 1992; 86: 1671-1691. [ Links ]
30. RESNICK LM: Cellular ions in hypertension, insulin resistence, obesity,and diabetes: A unifying theme. J Am Soc Nephrol 1992; 3: S78-S85. [ Links ]
31. ADAMS JH, MITCHELL JRA: The effect of agents which modify platelet behaviour and of magnesium ions on thrombus formation in vivo. Thromb Haemostas 1979; 42: 603-610 [ Links ]
32. HWANG DL, YEN CF, NADLER JL: Effect of extra-cellular magnesium on platelet activation and intracellular calcium mobilization. Am J Hypertens 1992; 5: 700-706. [ Links ]
33. NADLER JL, GOODSON S, RUDE R: Evidence that prostacycline mediates the vascular action of magnesium in humans. Hypertension 1987; 9: 379-383. [ Links ]
34. PADDLE BM,HAUGAARD N: Role of magnesium in effects of epinephrine on heart concentration and metabolism. Am J Physiol 1971; 221: 1178-1184. [ Links ]
35. TEO KK, YUSUF S, COLLINS R: Effects of intravenous magnesium in suspected acute myocardial infarction: An overview of the randomized trials. Br Med J 1991; 303: 1499-1503. [ Links ]
36. Grupo Italiano per lo Studio della Streptochinasi nell'infarto miocardico (GISSI): Long-term effects of intravenous thrombolysis in acute myocardial infarction: final report of the GISSI study. Lancet 1987; 2: 871-874. [ Links ]
37. MORTON BC, NAIR RC, SMITH FM, MCKIBBON TG, POZNANZKY WJ: Magnesium therapy in acute myocardial infarction: a double blind study. Magnesium 1984; 3: 346-352. [ Links ]
38. SHECHTER M, HOD H, CHOURAQUI P, KAPLINSKY E, RABINOWITS B: Magnesium therapy in acute myocardial infarction when patients are not candidates for thrombolytic therapy. Am J Cardiol 1995; 75: 321-323. [ Links ]
39. WOODS KL: Megatrials in management in acute myocardial infarction. Lancet 1995; 346611-614. [ Links ]
40. DEWOOD MA, SPORES J, NOTSKE RN, SIMPSON JS, EUGSTER GS, JUDGE TP, HINNEN ML: Prevalence of total coronary occlusion during the early hours of transmural myocardial infarction. N Engl J Med 1980; 333: 897-902. [ Links ]
41. National Research Council. Combining information: Statistical issues and opportunities for research. Washington National Academy Press; 1992. [ Links ]
42. ANTMAN EM, LAU J, BERKEY C, MCINTOSH M, CHALMERS TC, MOSTELLER F: Large versus small trials of magnesium for acute myocardial infarction: big numbers do not tell the whole story. Circulation 1994; 90(Suppl I): 325. [ Links ]
43. BERKEY CS, HOAGLIN DC, MOSTELLER F, COLDITZ GA: A random-effects regression model for meta-analisis. Stat Med 1995; 14: 395-411. [ Links ]
44. ANTMAN EM: Magnesium in acute myocardial infarction: overview of available evidence. Am Heart J 1996; 132 (2) (Suppl-II): 487-495. [ Links ]
45. YUSUF S, TEO KK, WOODS KL: Intravenous magnesium in acute myocardial infarction. Circulation 1993; 87(6); 2043-2046. [ Links ]
46. BORZAK S, RIDKER PM: Discordance between meta-analyses and large-scale randomized, controlled trials. Examples from the management of acute myocardial infarction. Ann Intern Med 1995; 123: 873-877. [ Links ]
47. ZIEGELSTEIN R, HILBE JM, FRENCH WJ, ANTMAN EM, CHANDRA-STROBOS N: Magnesium Use in the Treatment of Acute Myocardial Infarction in the United States (Observations from the Second National Registry of Myocardial Infarction ) Am J Cardiol 2001; 87: 7-10. [ Links ]
48. MAGIC Study (Magnesium in Coronaries): A clinical Trial to reevaluate the efficacy of early administration of magnesium in acute myocardial infarction. Am Heart J 2000; 139: 10-24 [ Links ]














