Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.71 n.2 Ciudad de México Apr./Jun. 2001
Revisión de temas cardiológicos
El centenario del electrocardiógrafo de Einthoven. Parte I
On the centennial of Einthoven's electrocardiograph
Alfredo de Micheli*
* Del Instituto Nacional de Cardiología "Ignacio Chávez". México. (INCICH. Juan Badiano No. 1, 14080 México, D.F.).
Aceptado: 18 septiembre de 2000
Resumen
Se recuerdan los estudios iniciales acerca de la "irritabilidad" de los tejidos animales por científicos iatrofísicos o iatromecánicos, que llevaron al descubrimiento de la llamada electricidad animal, vislumbrada por Luigi Galvani en el siglo XVIII y demostrada por Carlo Matteucci y sus continuadores en el siglo XIX.
A partir de la rana "reoscópica", que permitía valorar la corriente eléctrica en sentido cualitativo, se llegó a principios del siglo XX al electrocardiógrafo de cuerda, presentado por Willem Einthoven en 1901. De ahí arrancó el camino que llevó a la construcción de aparatos siempre más perfeccionados hasta los sistemas actuales de mapeo endocárdico con tecnología magnética o con catéteres multipolares, que permiten identificar rápidamente el sitio de origen o las vías de propagación de una arritmia para su ablación con radiofrecuencia. Ahora se utiliza también la ecocardiografía intracardiaca para definir la anatomía de la aurícula derecha, durante la realización de la cartografía intracardiaca, con el fin de establecer los sitios más adecuados para dicha ablación. Por otra parte, se ha desarrollado un método lógico, i.e. racional, de la exploración eléctrica del corazón, introducido por Frank N. Wilson en Ann Arbor y aplicado con acierto por Sodi Pallares en México, del que son derivados importantes adelantos diagnósticos y notables implicaciones terapéuticas.
Palabras clave: Electrocardiógrafo de cuerda. Electrocardiografía clásica, Electrocardiografía de alta fidelidad.
Abstract
The initial studies about the "irritability" of animal tissues by iatrophysic or iatromechanic scientists are reviewed. These studies led to discover the so called animal electricity envisaged by Luigi Galvani in the XVIII century and demonstrated by Carlo Matteucci and his followers in the XIX. Beginning with the Galvani's "reoscopic" frog, which allowed to assess the electrical current in a qualitative sense, it was possible to arrive, at the beginnings of the XX century, to the string electrocardiograph developed by Willem Einthoven in 1901. This opened the way that led to fabrication of ever more sophisticated instruments until the present systems of endocardial mapping by magnetic technology or by multipolar catheters, which permit to quickly identify the site of origin or the spreading ways of a tachycardia for their ablation with radiofrequency. Intracardiac echocardiography is also employed to define the anatomy of right atrium, during intracardiac cartography, in order to establish the most adequate sites for ablation. On the other hand, a logic, i.e. rational, method for the interpretation of results from the electrical exploration of the heart has been developed. This one was introduced by Frank N. Wilson in Ann Arbor and has been fittingly applied by Demetrio Sodi Pallares in Mexico. Important diagnostic advances and notable therapeutic inferences have been derived from these latter developments.
Key words: String electrocardiograph. Classic electrocardiography. High fidelity electrocardiography.
Introducción
Los antecedentes del registro de los fenómenos eléctricos del miocardio se han descrito en una publicación previa.1 Pero parecería oportuno recordar que el físico berlinés Emil Du Bois-Reymond logró, en 1849, la construcción de un aparato capaz de medir las corrientes bioeléctricas con la mayor sensibilidad posible en aquel tiempo. Se trata del reótomo o interruptor de corriente, que permitía determinar la magnitud de la misma durante cortos lapsos. El reótomo fue modificado por varios físicos y fisiólogos, en particular por el físico ruso Emilii Lenz. Concibió éste, en 1854, un método para calcular una curva -en función del tiempo- de las variaciones de la corriente eléctrica durante un ciclo de inducción aislado. De este modo resultó posible registrar, por vez primera, el desarrollo temporal de la variación de intensidad de la corriente alterna.
Julius Bernstein, discípulo de Du Bois-Reymond, estudió la evolución temporal de la variación negativa del potencial eléctrico (corriente de acción). Por eso modificó el reótomo de manera que el intervalo entre la estimulación y la medida pudiese variarse: reótomo diferencial (1868). Con éste registró Marchand, en 1877, la evolución temporal de las variaciones de la corriente de acción en el miocardio de la rana. Dicho investigador dispuso sus resultados en tablas, que indicaban la intensidad de la corriente eléctrica en diferentes momentos del ciclo cardiaco. El fisiólogo Theodor Engelmann fue el primero en representar gráficamente la evolución temporal de las variaciones de la corriente de acción del músculo cardiaco (1878). Las curvas por él obtenidas muestran claramente la naturaleza difásica de la corriente mencionada.
Un instrumento más satisfactorio para medir las corrientes bioeléctricas fue inventado en 1872 por el fisiólogo francés Gabriel Lippmann. Tal aparato, denominado electrómetro capilar, tenía mayor sensibilidad que el reótomo diferencial. Etienne-Jules Marey elaboró a su vez, en 1876, un sistema para fotografiar las variaciones de corriente registradas con un electrómetro capilar. Desde entonces se contó pues con un aparato sensible, que podía proporcionar registros gráficos de los fenómenos bioeléctricos. Sir John Burdon-Sanderson2 lo empleó para registrar las variaciones de corriente en el corazón de la tortuga y en el de la rana. Las curvas obtenidas con dicho método fotográfico le permitieron analizar las características de la onda de repolarización ventricular, ya identificada por los alemanes Kölliker y Müller en 1856.3 Estos últimos habían notado que la variación negativa del potencial, en un corazón puesto en contacto con la rana reoscópica de Galvani,4 era seguida ocasionalmente de una pequeña deflexión positiva.
Potenciales eléctricos del miocardio fueron obtenidos en corazones expuestos de varios animales.5 Pero fue Alexandre Muirhead, al parecer, el primero en obtener registros electrocardiográficos humanos en el hospital londinense de San Bartolomé (1869 ó 1870). Esto, mediante el dispositivo diseñado por sir William Thomson.6 Por su lado, el fisiólogo Augusto Desiré Waller registró, con el electrómetro capilar, potenciales eléctricos del miocardio en animales intactos vivos y, después, en seres humanos.7 Cabe mencionar que el electrómetro capilar de Lippmann era un instrumento mucho mejor que el "sifón" de Thomson para detectar la actividad eléctrica cardiaca.8 Así pudo Waller captar los fenómenos eléctricos cardiacos en el hombre utilizando electrodos torácicos9 y, más tarde, con un electrodo colocado en la boca del enfermo.10 En su publicación original, llamó "electrograma" el registro obtenido. Sin embargo, en la lección inaugural del año académico 1888-1889 de la Escuela de Medicina del Hospital de Santa María en Paddington, denominó "cardiogramas" los trazos registrados.11 La expresión "electrocardiograma" se debe a Einthoven.12
Pese a la sensibilidad relativamente grande del electrómetro capilar, su respuesta era lenta. Por eso, la atención de los fisiólogos se volvió hacia los galvanómetros de bobina móvil. Éstos comprendían un alambre enrollado y suspendido en el campo magnético de un imán. Las variaciones de la corriente, que pasaba a través de la bobina, la hacían moverse y tales movimientos se registraban por medio de espejos y otros dispositivos. El más aceptado de dichos galvanómetros fue el construido por Jacques Arsène d'Arsonval en 1889: un galvanómetro de mediano poder.
Nace el galvanómetro de cuerda
El fisiólogo holandés Willem Einthoven (Fig. 1), insatisfecho de los registros obtenidos con el electrómetro capilar, utilizó inicialmente el galvanómetro de d'Arsonval, que halló poco sensible. Diseñó y construyó, por ende, su propio galvanómetro de cuerda. Debe mencionarse que, cuando él comenzó a trabajar en su electrocardiógrafo (1900), ignoraba probablemente la existencia de un aparato semejante construido en 1897 por el ingeniero francés Clement Ader con otros fines.13 De todos modos, el aparato de Ader tenía una sensibilidad muy baja y no hubiera podido emplearse nunca para la electrocardiografía clínica. El maestro de Leiden presentó su nuevo galvanómetro, en una comunicación preliminar, el año 1901.14 Dos años después (1903), pudo publicar una descripción detallada de tal electrocardiógrafo y una comparación entre los trazos obtenidos con éste y los tomados con el electrómetro capilar.15 Reproducía en su artículo los electrocardiogramas de 6 personas y establecía los parámetros de amplitud y de tiempo de las deflexiones registradas. Debe mencionarse que el propio Einthoven había propuesto, en 1895,16 las letras PQRST para denominar las deflexiones de los trazos por él obtenidos con un electrómetro capilar perfeccionado. Mantuvo tal denominación en los trazos que registró más tarde con el galvanómetro de cuerda, tal vez con base en la nomenclatura adoptada por Descartes para identificar los puntos sucesivos en una curva y porque el orden de estas letras le ofrecía la posibilidad de agregar otras, correspondientes a deflexiones registradas antes de la onda P y después de la T.17 Así, poco después, pudo agregar la onda U.18

El excelente galvanómetro de cuerda, fiel y resistente, hizo accesible la electrocardiografía clínica y queda aún como la piedra angular de la exploración electrocardiográfica. El aparato original, que constituía una máquina monumental e intrasportable, sufrió muchos perfeccionamientos a partir de 1911. El electrocardiógrafo, que había sido introducido en inglaterra por Thomas Lewis en 1909, fue perfeccionado y fabricado en serie por la compañía inglesa "Cambridge & Paul Scientific Instrument Co". Una mejora importante fue la reducción del tamaño del electroimán. Se le agregaron el motor rotante de tiempo (Rayleigh, 1915), la sustitución de la lámpara de arco por una de filamento incandescente y el empleo de los electrodos de contacto (Barron en Inglaterra, Cohn en los Estados Unidos de Norteamérica). Antes de 1920, el aparato no era transportable. En ese año, se inventaron los tubos de vacío, que podían amplificar mucho las corrientes eléctricas cardiacas. Dichos tubos, conectados con el galvanómetro de d'Arsonval, permitieron utilizarlo en lugar del galvanómetro de cuerda, menos resistente aunque más sensible. Debido a su gran resistencia, los galvanómetros con amplificadores se emplearon en la construcción de aparatos portátiles. Los primeros electrocardiógrafos de este tipo se fabricaron en Alemania, en 1934; más tarde se comenzó a fabricarlos también en Inglaterra y en los Estados Unidos de América del Norte. De este modo se llegó rápidamente a la obtención de instrumentos de inscripción directa. El primero fue diseñado en Suiza por Duchosal y Luthi en 1932 y pronto se obtuvo en serie. Tales aparatos se popularizaron después de la segunda guerra mundial. Deben proporcionar fuerza suficiente para mover una pluma inscriptora o un estilete, con velocidad adecuada, e incluir un galvanómetro de bobina del tipo d'Arsonval con amplificadores de válvulas termoiónicas. En estos aparatos, se necesitan alrededor de 10-1vatios para obtener una deflexión de 1 cm. La respuesta deficiente de los primeros modelos a las frecuencias elevadas ha sido mejorada considerablemente. Así los electrocardiogramas registrados con los aparatos más recientes son semejantes a los tomados con sistemas de registro fotográfico y, por tanto, se consideran muy satisfactorios.
Sin embargo, la amplitud y las relaciones cronológicas de los componentes más rápidos del complejo QRS, sobre todo en las derivaciones precordiales e intracardiacas así como en los trazos de animales pequeños, se captan de manera más fidedigna mediante el osciloscopio de rayos catódicos. Gracias a los adelantos de la técnica, este último pudo aplicarse a la exploración eléctrica del corazón. La mayor ventaja de los osciloscopios consiste en la ausencia de inercia del rayo, lo que permite registrar -teóricamente de manera fiel- aun los componentes del trazo que tienen las frecuencias más elevadas. El rendimiento real del aparato depende del sistema amplificador. Los osciloscopios muestran una neta mejora en las características físicas de los instrumentos de registro y, por su amplia aplicación, han abierto nuevos derroteros para la exploración de la actividad eléctrica del miocardio: la vectocardiografía espacial, la electrocardiografía de alta fidelidad y la radiotelemetría desde el espacio exterior. Ha sido posible realizar así la "telecardiografía", auspiciada por Einthoven.19 Por otro lado, en la práctica clínica tienen gran utilidad los registros continuos de 24 horas, grabados en cintas magnéticas (sistema Holter).20
Derivaciones utilizadas
Las derivaciones más antiguas son las tres estándar: bipolares alejadas o diferenciales, que corresponden a los lados del triángulo de Einthoven.21 Exploran éstas el campo eléctrico cardiaco en el plano frontal y registran la diferencia de potencial entre dos puntos de dicho campo, proporcionando una curva difásica que constituye la primera derivada de la curva del potencial de acción monofásico.
Las derivaciones unipolares alejadas, o de los miembros, fueron introducidas por Wilson y cols.22 Los electrodos correspondientes (vR, VL y VF) se encuentran en los vértices del triángulo de Einthoven y exploran el campo eléctrico cardiaco en el plano frontal. El electrodo explorador registra la variación de potencial,23 a saber los cambios del potencial en sentido físico o gaussiano, en un punto determinado del campo eléctrico cardiaco relativamente lejos de la fuente de corriente. El electrodo indiferente está situado en otro punto muy alejado del corazón, en donde el potencial es prácticamente cero respecto al campo eléctrico cardiaco. Tal electrodo representa la llamada central terminal (VR + VL + VF) con resistencias de 5,000 ohmios para cada uno de ellos. La sensibilidad de dichas derivaciones se aumenta al formar la central terminal, en cada registro, solamente con dos electrodos (menos el que actúa como electrodo explorador).
Alguna que otra derivación unipolar torácica (p. ej. la IV o torácica posterior) fue utilizada por Wolferth y Wood en 1932.24 Derivaciones precordiales múltiples fueron propuestas por Wilson en 1934 y sistematizadas por Kossmann y Johnston25 en 1935: V1 a V5 y VE con polaridad opuesta a la que tienen ahora. Sucesivamente la derivación V6 reemplazó a la VE y la "American Heart Association" recomendó el uso de derivaciones unipolares torácicas suplementarias, derechas e izquierdas.26 Todas ellas exploran el campo eléctrico cardiaco esencialmente en el plano horizontal. Registran la variación de potencial en un punto determinado del campo y están influidas más por los fenómenos eléctricos originados en estructuras miocárdicas cercanas, que por los que se originan en estructuras alejadas.27 El potencial de cualquier punto del campo eléctrico cardiaco puede determinarse en relación a las cargas eléctricas situadas dentro del mismo corazón, considerado como una esfera (análisis por el ángulo sólido o teorema de la equivalencia)28 o bien respecto a la distribución de las cargas eléctricas que se hallan en la superficie de la esfera (análisis por la integral de Poisson, Fig. 2). En la fórmula correspondiente, Vp es el potencial en el punto p del medio conductor; f es la distancia de dicho punto al centro de la superficie de la esfera; a es el radio de tal superficie; F es el potencial en un punto del segmento ds de la superficie de la esfera, definido por los ángulos 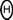 y Φ R es la distancia de p respecto al segmento considerado. Este procedimiento, basado en el principio de la superficie electromotriz de Helmholtz, permite demostrar que el potencial de cada área pequeña de la superficie de una esfera determina, en un punto dado del medio conductor extracardiaco, un potencial gaussiano.29
y Φ R es la distancia de p respecto al segmento considerado. Este procedimiento, basado en el principio de la superficie electromotriz de Helmholtz, permite demostrar que el potencial de cada área pequeña de la superficie de una esfera determina, en un punto dado del medio conductor extracardiaco, un potencial gaussiano.29

Su amplitud es inversamente proporcional al cubo de la distancia entre los dos sitios. Para la exploración del fenómeno eléctrico del miocardio, lo más conveniente es seguir ambos procedimientos descritos mediante una integración electrovectocardiográfica.
Los registros unipolares torácicos se obtienen con los electrodos de contacto o con los de succión, propuestos por Burger en 1932 y modificados por Welsh. La semejanza entre las morfologías unipolares epicárdicas (directas) y las obtenidas en las derivaciones precordiales (semidirectas) ha sido demostrada por Wilson y cols. en el perro.30 Las segundas son parecidas a las primeras, pero no son idénticas por muchas razones. De hecho, un registro precordial corresponde a la suma de las variaciones de potencial, que se producen en un área miocárdica extensa. La curva eléctrica registrada por una derivación unipolar en el medio conductor es muy semejante a la de la corriente de membrana, estudiada por Cole y Curtis.31 Constituye la primera derivada de la curva del potencial difásico y la segunda derivada de la curva del potencial monofásico. Parece oportuno mencionar que los potenciales celulares se obtuvieron, en 1949, por Ling y Gerard mediante microelectrodos de pipeta.32
Con apego a sugerencias de la "American Heart Association",26 se registra en nuestro Instituto un "círculo torácico",33 que comprende derivaciones unipolares torácicas derechas e izquierdas, y se le agregan tres unipolares abdominales altas: MD, en el hipocondrio derecho; MI, en el hipocondrio izquierdo; ME, en el centro del epigastrio. MD y ME captan las variaciones de potencial de la pared libre del ventrículo derecho en los corazones horizontales y semihorizontales, mientras que registran variaciones de potencial del ventrículo izquierdo en los corazones intermedios, semiverticales y verticales. Cabe hacer hincapié en el hecho de que, para poder analizar correctamente un trazado electrocardiográfico, es preciso conocer qué estructuras cardiacas exploran las diferentes derivaciones. Esto, en función de la posición y la rotación cardiacas. Con cierta frecuencia, se necesita ratificar la posición del corazón en la radiografía torácica correspondiente.
Cremer,34 a su vez, fue el primero en obtener, en 1906, un trazo electrocardiográfico por medio de un electrodo de acero introducido en el esófago de un enfermo, bajo control radiológico. Lieberson y Lieberson35 adoptaron tal procedimiento en 1934 y Hurst Brown36 describió en 1935 las características del "electrocardiograma esofágico", subrayando la utilidad del método en el análisis de la onda auricular y de sus relaciones cronológicas con el complejo ventricular. Desde la década de 1960 contamos con los electrogramas hisianos y las cartografías intracavitarias.
Electrocardiografía de alta fidelidad
Hace 40 años señaló Langer37 la posible identificación, en electrocardiogramas de alta fidelidad, de alteraciones miocárdicas que no pueden apreciarse en los trazos convencionales. En efecto, la señal eléctrica que se obtiene en un electrocardiograma de superficie es la resultante de la suma global de todos los vectores que se originan durante la propagación de los frentes de onda, debidos a la activación eléctrica del miocardio, y del procesamiento de dicha señal. Para registrar el trazado electrocardiográfico convencional, se emplean constantemente una amplificación estándar, una velocidad del papel de 45 mm/seg y un dispositivo de inscripción directa. Tal electrocardiograma es de gran utilidad práctica pero permite detectar sólo alteraciones eléctricas originadas en una región extensa del miocardio ventricular (> 7%, aproximadamente) o bien trastornos acentuados de la conducción intraventricular. Las posibles lesiones en zonas pequeñas, capaces de producir un retardo local del proceso de activación, pueden pasar inadvertidas o estar enmascaradas por el tipo de filtración que se utiliza. Se ha destacado, por ende, la importancia de fragmentar el complejo QRS para detectar señales de alta frecuencia y baja amplitud, denominadas potenciales tardíos por Boineau y Coix.38 Por otra parte los registros de alta fidelidad obtenidos mediante un sistema fotográfico, con filtros de amplia banda de frecuencias, amplificaciones de 1 mV = 10 ó 20 mm y velocidades del papel de 100 ó 200 mm/ seg, permiten diagnosticar aun los bloqueos periféricos de tipo fascicular o parietal.39
En la década de 1990, Abboud40 ha señalado la utilidad de los registros electrocardiográficos de alta frecuencia en la detección de isquemia miocárdica. Ciertas limitaciones de los resultados por él obtenidos se deben al hecho de que utilizó una sola derivación precordial. Otros autores41 han sugerido la conveniencia de investigar los cambios en la amplitud pico a pico del electrocardiograma de alta frecuencia. Se ha propuesto recientemente, en nuestro Instituto, el procedimiento de la espectrocardiografía de alta fidelidad para el diagnóstico de la cardiopatía isquémica.42 Consiste en obtener un electrocardiograma de promediación de señales, tomado con el aparato comercial computarizado de Mar Avionics, Model-183 CEWS. El registro así obtenido permite analizar el grado de "turbulencia espectral". Debe tenerse presente asimismo que el método utilizado para el análisis de la señal eléctrica en el dominio del tiempo fue descrito hace años por Simson y cols.43,44 y ahora se emplea comúnmente para el estudio de los potenciales tardíos.45,46
Por su lado, conviene recordar que los primeros libros de electrocardiografía se publicaron a principios del siglo XX: p. ej. el texto del fisiólogo ruso Alejandro Samojloff,47 discípulo de Einthoven, y el de Sir Thomas Lewis.48 Se publican actualmente libros de subespecialidades de la electrocardiografía p. ej. las arritmias cardiacas.49,50
En conclusión, parece muy certera la aseveración de Charles Fisch:51 "He who maintains that new knowledge of electrocardiography is no longer possible or contributive, ignores history".
Referencias
1. de Micheli A: Del De viribus electricitatis ... de Galvani a la moderna electrovectocardiografía. Arch Inst Cardiol Mex 1991; 61: 7-19. [ Links ]
2. Burdon-Sanderson JS, Page FJM: On the electrical phenomena of the excitatory process in the heart of the frog and of the tortoise, as investigated photographically. J Physiol (Lond) 1883; 4: 327-338. [ Links ]
3. Kölliker A, Müller M: Nachweiss der negativen Schwankung des Muskelsstrom am nàturlich sich contrahirenden Muskel. Verh Phys Med Ges 1856; 5: 528-533. [ Links ]
4. de Micheli A: El bicentenario de la muerte de Luigi Galvani, iniciador de los estudios electrofisiológicos. Arch Inst Cardiol Mex 1998; 68: 453-456. [ Links ]
5. Burch GE, De Pasquale NP: A history of electrocardiography. Chicago. Year Book Medical Publishers Inc., 1964. [ Links ]
6. Burnett J: The origins of the electrocardiograph as a clinical instrument. Med Hist 1985; Suppl. 5: 53-76. [ Links ]
7. Waller AD: A demonstration on man of electromotive changes accompanying the heart beat. J Physiol (Lond) 1887; 8: 229-233. [ Links ]
8. Acierno LJ: Augustus Desiré Waller. Clin Cardiol 2000; 23: 307-309. [ Links ]
9. Burchell HB: A centennial note on Waller and the first human electrocardiogram. Am J Cardiol 1987; 59: 979-983. [ Links ]
10. Waller AD: On the electromotive changes connected with the beat of the mammalian heart, and of the human heart in particular. Philos Trans R Soc Lond (Biol) 1889; 180: 169-194. [ Links ]
11. Cope Z: Augustus Desiré Waller. Med Hist 1973; 17: 380-385. [ Links ]
12. Sykes AH: A D Waller and the electrocardiogram. Br Med J 1987; 294: 1396-1398. [ Links ]
13. Ader C: Sur un nouvel appareil enregistreur pour cables sous-marins. CR Acad Sci (Paris) 1897; 124: 1440-1442. [ Links ]
14. Einthoven W: Un nouveau galvanomètre. Arch Neerl Sci Exactes Nat 1901; 6: 525-633. [ Links ]
15. Einthoven W: Die GalvanometrischeRegistrierung des menschlichen Elektrokardiogramms, zugleich eine Beurtheilung der Anwendung des kapillar-Elektrometers in der Physiologie. Pfüger Arch Ges Physiol 1903; 99: 472-480. [ Links ]
16. Einthoven W: Ueber die Form des menschlichen Elektrokardiogramms. Pflüger Arch Ges Physiol 1895; 60: 101-123. [ Links ]
17. Hurst JW: Naming of the waves in the ECG, with a brief account of their genesis. Circulation 1998; 98: 1937-1942. [ Links ]
18. Snellen HA: Willem Einthoven (1860-1927): Father of Electrocardiography. Dordrecht, Netherlands. Kluwer Academic Publishers, 1995. [ Links ]
19. Einthoven W: Le télécardiogramme. Arch Int Physiol 1906; 4: 132-164. [ Links ]
20. Holter NJ: New method for heart study. Science 1961; 134: 1214-1220. [ Links ]
21. Einthoven W: Weiteres über das Elektrokardiogramm. Pfüger Arch Ges Physiol 1908; 122: 517-584. [ Links ]
22. Wilson FN, Macleod AG, Barker PS: The potential variations produced by the heart beat at the apices of Einthoven's triangle. Am Heart J 1931; 7: 207-211. [ Links ]
23. Wilson FN, Johnston FD, Macleod AG, Barker PS: Electrocardiograms that represent the potential variations of a single electrode. Am Heart J 1934; 9: 447-458. [ Links ]
24. Wolferth CC, Wood FC: The electrocardiographic diagnosis of coronary occlusion by use of chest leads. Am J Med Sci 1932; 183: 30-35. [ Links ]
25. Kossmann CE, Johnston FD: The precordial electrocardiogram. I. The potential variations of the precordium and of the extremities in normal subjects. Am Heart J 1935; 10: 925-941. [ Links ]
26. Committee on electrocardiography presided by F.N. Wilson. American Heart Association: Recommendations for standardization of electrocardiographic and vectorcardiographic leads. Circulation 1954; 10: 564-573. [ Links ]
27. Wilson FN, Johnston FD, Rosenbaum FF, Erlanger H, Kossmann CE, Hecht HH, et al: The precordial electrocardiogram. Am Heart J 1944; 27: 19-85. [ Links ]
28. Holland RP, Arnsdorf MF: Solid angle theory and the electrocardiogram: Physiologic and quantitative interpretation. Prog Cardiovasc Dis 1977; 19: 431-457. [ Links ]
29. Sodi Pallares D: The influence of the investigations of Helmholtz on electrocardiography. Am Heart J 1956; 51: 647-653. [ Links ]
30. Wilson FN: On the choice of a reference point for the study of the electrical field of a tissue immersed in a volume conductor. En Libro homenaje para el Dr. Ignacio Chávez. México. UNAM, 1945: 503-516. [ Links ]
31. Cole KS: Membrane, ions and impulses. Berkeley, Cal. University of California Press, 1968. [ Links ]
32. Ling G, Gerard RW: The normal membrane potential of frog sartorius fibres. J Cell Comp Physiol 1949; 34: 383-396. [ Links ]
33. de Micheli A, Medrano GA, Iturralde P: El círculo torácico en la exploración eléctrica del corazón. Arch Inst Cardiol Mex 2000; 70: 187-196. [ Links ]
34. Cremer M: Über die direkte Ableitung der Aktionsstrome des menschlichen Herzens vom Oesophagus und über Elektrokardiogramm des Fótus. Münch Med Wochenschr 1906; 53: 811-813. [ Links ]
35. Lieberson A, Lieberson F: An internal electrocardiographic lead. Proc Soc Exp Biol Med 1934; 31: 441-442. [ Links ]
36. Brown HW: Observations upon electrocardiographic tracings obtained by the use of esophageal leads in the human subject. (Abstract). Am Heart J 1935; 10: 1101. [ Links ]
37. Langer PH jr, Geselawitz DS, Mansure FT: High frequency components in the electrocardiograms of normal subjects and of patients with coronary heart disease. Am Heart J 1961; 62: 746-755. [ Links ]
38. Boineau JP, Coix JL: Slow ventricular activation in acute myocardial infarction. Circulation 1973; 48: 702-713. [ Links ]
39. de Micheli A, Medrano GA, Martínez Ríos MA: Bloqueos derechos en la comunicación interauricular. Arch Inst Cardiol Mex 1978; 48: 1091-1113. [ Links ]
40. Abboud S: High-frequency electrocardiogram analysis of the entire QRS in the diagnosis and assessment of coronary artery disease. Prog Cardiovasc Dis 1993; 35(5): 311-327. [ Links ]
41. Goldberger AL, Shargava V, Froelicher V, Cavell J, Mortara D: Effect of myocardial infarction on the peak amplitude of high frequency QRS potentials. J Electrocardiol 1980; 13: 367-372. [ Links ]
42. Rosas Peralta M: Espectrocardiografía de alta fidelidad para el diagnóstico de cardiopatía isquémica. Valoración de una nueva prueba diagnóstica. (Tesis doctoral). México. Facultad de Medicina, UNAM, noviembre de 1999. [ Links ]
43. Simson WE, Scher AM: Mechanism of ST segment alteration during acute myocardial injury. Circ Res 1960; 8: 780-788. [ Links ]
44. Simson MS, Untereker WJ, Spielman SR, Horowitz LN, Markus NH, Falcone RA, et al: Relations between late potentials on body surface and directly fragmented electrocardiograms in patients with ventricular tachycardia. Am J Cardiol 1983; 51: 105-112. [ Links ]
45. Dumbar D, Denes P: Operational aspects ofsignal average electrocardiography. Prog Cardiovasc Dis 1993; 35; 329-348. [ Links ]
46. Hnatkova K, Kulakowski P, Staunton A, Keeling P, Yi G, Camm AJ, et al: Influence of filtering technique on the time domain analysis, diagnosis, and clinical use of signal-average electrocardiogram. PACE 1994; 17(6): 1107-1117. [ Links ]
47. Samojloff A: Elektrokardiogramm. Salmml Anat Physiol Vorträge Aufaätze. Jena, Gaupp & Nagel, 1909. [ Links ]
48. Lewis T: Clinical electrocardiography. Londres. Shaw & Sons, 1913. [ Links ]
49. Cárdenas Loaeza M: La clínica de las arritmias. México. La Prensa Médica Mexicana, 1976 y 1987. [ Links ]
50. Iturralde P: Arritmias cardiacas. México. McGraw-Hill Interamericana Ed. S.A, 1997. [ Links ]
51. Fisch C: The clinical electrocardiogram: a classic. Circulation 1980; 62 (Suppl III): 1-4. [ Links ]














