Introducción
Al conjunto de microorganismos que habita en el intestino e interactúa con el huésped humano se le llama microbiota intestinal (MI). La MI tiene una gran influencia en la salud humana, por lo que existe interés por encontrar compuestos que modulen su composición (Thursby & Juge, 2017; Davani-Davari et al., 2019). Desde la década de los años 50, se conocen nutrientes con la capacidad de promover el crecimiento de la MI en beneficio a la salud, llamados prebióticos (Varzakas et al., 2018). Ejemplos de ellos son la inulina, la oligofructosa, los fructooligosacáridos (FOS), los galactooligosacáridos (GOS), los xilooligosacáridos (XOS) (Glenn et al., 2010), los ácidos grasos, las proteínas y los fitoquímicos (Whelan, 2013).
El síndrome metabólico (SMet) es uno de los principales problemas de salud mundial (Saklayen, 2018), derivado de un desbalance en la MI (He & Shi, 2017). El objetivo de este artículo fue revisar la literatura existente sobre el papel de los prebióticos en la modificación de la microbiota para el tratamiento y prevención del SMet.
Síndrome metabólico
El SMet es de persistencia mundial, propagación silenciosa, con una alta tasa de morbilidad y mortalidad, y en aumento permanente (Saklayen, 2018). Las enfermedades asociadas son considerados como uno de los factores de riesgo para presentar formas graves de COVID-19 (Marhl, Grubelnik, Magdič & Markovič, 2020; Singh et al., 2020).
Quienes padecen el SMet, este se caracteriza por presentar la combinación de tres o más anormalidades metabólicas y por el aumento del riesgo de padecer otras enfermedades. Por ejemplo, dos veces más riesgo de enfermedades cardiovasculares e incremento de cinco veces de desarrollar diabetes mellitus (Aguilar-Salinas & Viveros-Ruiz, 2019; Bridgeman et al., 2020).
Las principales manifestaciones del SMet son la resistencia a la insulina, obesidad abdominal, hipertensión, dislipidemia aterogénica (niveles sanguíneos elevados de triglicéridos y de LDL-colesterol, y bajos niveles de HDL-colesterol), altas concentraciones séricas de glucosa en ayuno, disfunción endotelial y un estado de hipercoagulación (Kaur, 2014; Grundy, 2016). En la Tabla I se muestran los parámetros de diagnóstico del SMet.
Tabla I Integración de criterios de diagnóstico del síndrome metabólico.
| Factores de riesgo | Nivel |
|---|---|
| Obesidad abdominal (circunferencia de cintura) | |
| Hombres | > 102 cm ó *94 cm |
| Mujeres | > 88 cm |
| Triglicéridos | ≥ 150 mg/dL |
| HDL colesterol | |
| Hombres | < 40 mg/dL |
| Mujeres | < 50 mg/dL |
| Presión arterial | ≥130/ ≥ 85 mm Hg |
| Glucosa en ayuno | ≥ 110 mg/dL |
| Microalbuminuria | > 20 μg / min |
HDL: lipoproteínas de alta densidad; * para la población de Latinoamérica según la ALAD. El diagnóstico de SMet se determina cuando se presentan 3 de estos factores de riesgo.
Fuente: Modificada de Aguilar-Salinas & Viveros-Ruiz, 2019.
La prevalencia del SMet varía de acuerdo con la región geográfica, el lugar de residencia, la composición de la población y el tipo de definición del SMet que se utilice, pero se calcula que a nivel mundial es de 10 al 84%, con un promedio del 20-25% en la población adulta (Sherling, Perumareddi & Hennekens, 2017). En México, alrededor del 43% de las muertes de enero a agosto del 2020 se debieron a enfermedades relacionadas con el síndrome: 14.6% por diabetes mellitus, 20.8% enfermedades del corazón, 4.1% enfermedades del hígado y 3.64% por enfermedades cerebrovasculares (INEGI, 2021). Según la ENSANUT, 2018, 18.4% de la población presenta hipertensión arterial, 19.5% tiene niveles séricos elevados de colesterol y triglicéridos, 10.3% sufre de diabetes, y más del 70% tiene sobrepeso u obesidad (Shamah-Levy et al., 2018; Romero-Martínez et al., 2019).
La patogénesis del SMet involucra tanto factores genéticos como los relacionados con el estilo de vida, es decir, una alta ingesta calórica y la falta de actividad física son considerados los principales factores etiológicos. Se sabe que sólo el 17.9% de la población mexicana realiza una hora de ejercicio diaria y el 85% consume a diario bebidas endulzadas, como los refrescos (Shamah-Levy et al., 2018; Romero-Martínez et al., 2019). Entre los mecanismos que explican la patofisiología del SMet, el más importante está relacionado con la presencia de resistencia a la insulina (RI). La RI se encuentra fuertemente interconectada con la obesidad visceral, la inflamación y el estrés oxidativo. Por lo tanto, el tejido adiposo tiene un papel preponderante en el desarrollo del síndrome, ya que además de funcionar como un depósito de energía es un tejido fisiológicamente activo que secreta hormonas que controlan el apetito, la saciedad y regulan el metabolismo energético, como la leptina y la adiponectina (Saklayen, 2018). Además, la grasa visceral promueve la RI y la liberación de ácidos grasos en el tejido adiposo, por lo que los lípidos se acumulan en otros órganos, como el hígado y el músculo, predisponiendo aún más a la RI, a la dislipidemia y al estrés oxidativo. El tejido adiposo produce también adipocinas pro-inflamatorias, como las interleucinas IL-1β, e IL-6, y el factor de necrosis tumoral alfa (TNF-α), que generan un estado de inflamación crónica de bajo grado en los tejidos (Zand, Morshedzadeh & Naghashian, 2017; Chen & Devaraj, 2018). La inflamación también afecta la vasodilatación causando hipertensión arterial, que desemboca en problemas cardiovasculares graves (Kaur, 2014).
Microbiota
Los seres humanos están colonizados por microorganismos, denominados microbiota que habitan en diferentes partes del cuerpo, como la boca, la piel y el tracto intestinal, y está compuesta de bacterias, arqueas y eucariotas (protozoos, hongos y nematodos) e incluso virus, denominados viroma (Virgin, 2014). El microbioma se define como la colección de genomas de los microorganismos, y hace referencia al hábitat completo, incluyendo las condiciones ambientales; se diferencian en comensales, mutualistas y patógenos, dependiendo del tipo de relación que establezcan con su huésped (Schwiertz & Rusch, 2016). Se ha estimado que el número total de bacterias en un humano con un peso corporal de 70 kg es de 3.8 x 1013, una masa total de 0.2 Kg, y su relación con las células es de 1:1. La mayoría de los microorganismos que componen la microbiota humana se encuentran en el colon, seguido de la piel, la saliva, la mucosa bucal y la conjuntiva (Sender, Fuchs & Milo, 2016).
Microbiota intestinal
Composición
El intestino tiene una superficie de 200 a 400 m2, y representa la interfase más larga entre el hospedero, los factores ambientales y los antígenos (Rinninella et al., 2019); se estima que, en una vida media, pasan por él 60 toneladas de alimentos (Thursby & Juge, 2017). La MI incluye especies nativas, que se adquieren al nacer y durante el primer año de vida, y especies temporales, que transitan por el tubo digestivo y se ingieren continuamente en la dieta (Pereira & Berry, 2017). La población microbiana promedio total incluye unos 100 billones de bacterias que pertenecen a entre 500 a 1,000 especies distintas, que a su vez contienen alrededor de 3 millones de genes (Shetty, Hugenholtz, Lahti, Smidt & de Vos, 2017; He & Shi, 2017; Rinninella et al., 2019). En la Tabla II se muestra que, tanto la cantidad como la diversidad taxonómica de la MI, aumentan conforme se avanza por el tubo digestivo, de manera que la zona con el mayor número de bacterias y de especies diferentes es el colon (Donaldson, Lee & Mazmanian, 2016).
Tabla II Heterogeneidad de la microbiota intestinal
| Compartimento | Cantidad (UFC/gr) | Grupos taxonómicos identificados | |
|---|---|---|---|
| Phyla | Géneros/especies | ||
| Estómago | 104 | Proteobacteria | Helicobacter pylori, Lactobacillus |
| Firmicutes | Streptococcus | ||
| Duodeno | 103- 104 | Proteobacteria | Helicobacter pylori |
| Firmicutes | Lactobacillus | ||
| Streptococcus, Staphylococcus | |||
| Yeyuno | 105- 107 | Proteobacteria | Helicobacter pylori |
| Firmicutes | Lactobacillus | ||
| Streptococcus | |||
| Bacillus | |||
| Íleon | 107- 108 | Bacteroidetes | Bacteroides |
| Proteobacteria | Enterobacteriaceae, Clostridium | ||
| Firmicutes | Enterococcus, Lactobacillus, Veillonella | ||
| Colon | 1010-1011 | Bacteroidetes | Bacteroides |
| Actinobacteria | Bifidobacterium, Bacillus | ||
| Firmicutes | Clostridium, Enterococcus, Eubacterium | ||
| Fusobacteria | Peptostreptococcus, Ruminococcus | ||
| Streptococcus, Fusobacterium | |||
* Fuente: Eckburg, 2005; Rajilić-Stojanović, 2014; Mitev & Taleski, 2019.
En la Figura 1 se muestra la heterogeneidad espacial de la microbiota a lo largo del tracto digestivo; en el estómago y el duodeno, las secreciones ácidas, biliares y pancreáticas destruyen la mayor parte de los microorganismos ingeridos y la actividad motora propulsiva impide una colonización estable en el lumen intestinal por lo que las bacterias se adhieren a la superficie mucosa o se encuentran en tránsito. El número de bacterias aumenta progresivamente desde 104 en el yeyuno hasta 107 UFC/ g de contenido en el extremo ileal, con un predominio de aerobios gram negativos y algunos anaerobios obligados, donde principalmente dominan dos Phyla, Actinobacteria y Firmicutes (Sekirov, Russell & Antunes, 2010; Kastl, Terry, Wu & Albenberg, 2020; Villmones et al., 2021). El intestino grueso está densamente poblado de organismos anaerobios y las bacterias alcanzan densidades de alrededor de 1011 UFC/g de contenido luminal, con dominancia de Bacteroidales y Clostridiales (Schloissnig et al., 2013; Pickard, Zeng, Caruso & Núñez, 2017). En el colon, el tiempo de tránsito es lento, lo que permite la proliferación de los microorganismos que fermentan los sustratos disponibles de la dieta o de secreciones endógenas, alcanzando una carga microbiana de 1012 UFC/g (Donaldson et al., 2016).

(Modificado de Pereira & Berry, 2017)
Figura 1 Microorganismos predominantes en el intestino humano, y sus condiciones óptimas de crecimiento.
Los Phyla que son predominantes en la materia fecal son los Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria y Verrucomicrobia, donde los Firmicutes y los Bacteroidetes constituyen el 90% de la MI (Rinninella et al., 2019). Actualmente, con el uso de las técnicas de biología molecular, se reportó que las tres familias más frecuentes son Coriobacteriaceae, Ruminococcaceae y Peptostreptococcaceae, mientras que los principales géneros son Collinsella, Clostridium y Prevotella. También se encontraron un gran número de nuevas familias y géneros por describir (Almeida et al., 2019).
Funciones de la microbiota intestinal
La microbiota intestinal tiene tres funciones principales: de nutrición y metabólicas, de protección, y tróficas (Lin & Zhang, 2017).
Funciones de nutrición y metabólicas. La MI tiene un papel fundamental en el metabolismo y la salud humana, su diversidad de enzimas y vías bioquímicas permiten metabolizar sustratos o residuos dietéticos no digeribles, el moco endógeno y los detritus celulares (Thursby & Juge, 2017). La fermentación de los carbohidratos no digeribles produce ácidos grasos de cadena corta (acetato, propionato y butirato) que son absorbidos por el intestino y favorecen el crecimiento de la microbiota y la absorción de iones (Ca2+, Mg2+, Fe2+) (Rowland et al., 2018). Las funciones metabólicas también incluyen la producción de vitaminas (K, B12, biotina, ácido fólico y pantoténico) y la síntesis de aminoácidos a partir del amonio o la urea. El metabolismo anaeróbico de los péptidos y proteínas (putrefacción) también es fuente de ácidos grasos de cadena corta, y genera sustancias potencialmente tóxicas incluyendo amoníaco, aminas, fenoles, tioles e indoles (Ma, Tian, Wu & Ma, 2017). También el metabolismo de las sales biliares y de los polifenoles, modifican su bioactividad (Rowland et al., 2018).
Funciones de protección. La MI resiste la invasión de bacterias no autóctonas y la expansión de bacterias patógenas; este fenómeno se conoce como “resistencia a la colonización” y puede ser mediado por mecanismos directos, como el efecto barrera por el que impiden la implantación de bacterias extrañas, compitiendo por nutrientes o espacio (Pickard et al., 2017) y por la producción de sustancias antimicrobianas o inhibidoras del crecimiento, como las bacteriocinas (Thursby & Juge, 2017) o ácidos grasos de cadena corta y sales biliares desconjugadas (Pickard et al., 2017); e indirectos, como la estimulación del sistema inmunitario innato o adaptativo, y de la mucosa intestinal en el intestino delgado, el ciego y el colon (Johansson et al., 2008; Johansson, Jakobsson & Holmen-Larsson, 2015). El principal componente del moco del intestino grueso es la glicoproteína secretora Mucina-2 (MUC2), pero también contiene otras proteínas que pueden inmovilizar o eliminar a las bacterias (Bergstrom et al., 2016; Vaishnava et al., 2011).
Adicionalmente, un aspecto importante para la eliminación de competidores que se ha estudiado recientemente es la presencia de bacteriófagos (De Sordi, Lourenço & Debarbieux, 2019).
Funciones tróficas. Las bacterias intestinales pueden controlar la proliferación y diferenciación de las células epiteliales intestinales (CEI) que, además de formar una barrera, pueden detectar una gran cantidad de señales de la microbiota, lo que permite ajustar la proliferación de las CEI y sus funciones homeostáticas (Rescigno, 2014; Soderholm & Pedicord, 2019).
La MI desempeña un papel esencial en la estimulación de la respuesta inmune, se ha visto que animales criados en condiciones de asepsia estricta muestran baja concentración de células linfoides en la mucosa del intestino delgado, la estructura de los folículos linfoides está atrofiada y la concentración de inmunoglobulinas circulantes es anormalmente baja (Lin & Zhang, 2017; Rescigno, 2014). Las CEI median la interrelación entre la MI y las células intraepiteliales y subepiteliales, respondiendo a metabolitos microbianos y coordinando las respuestas inmunitarias mediante la secreción de quimiocinas, de otras citocinas y moléculas inmunomoduladoras, así como por el transporte de antígenos y metabolitos microbianos a las células inmunitarias subyacentes en la lámina propia. Entre las moléculas inmunomoduladoras que producen las células epiteliales está la linfopoyetina del estroma tímico, el factor de crecimiento transformador (TGF)-b, el ácido retinoico y la IL-10, que afectan a una amplia gama de células inmunitarias (Soderholm & Pedicord, 2019).
Importancia de la microbiota en la salud
La composición y funcionamiento de la MI tiene un rol fundamental para la salud humana; al cambio cuantitativo o cualitativo de la composición, funcionamiento, distribución o actividades metabólicas de la MI se le llama disbiosis (Heintz-Buschart & Wilmes, 2018). En la disbiosis puede haber tanto reducción en la diversidad de especies como alteraciones en la proporción relativa de géneros, lo que puede motivar a la manifestación de características patogénicas de los microorganismos minoritarios (Carding, Verbeke, Vipond, Corfe & Owen, 2015). La naturaleza de la disbiosis varía según el individuo y su condición patológica, pero frecuentemente se observa una reducción de la proporción relativa de anaerobios obligados y el aumento de los anaerobios facultativos, que incluyen Proteobacterias patógenas como Escherichia coli, Salmonella, Proteus, Klebsiella y Shigella; es importante mencionar que la disbiosis no siempre involucra la presencia de bacterias patógenas, ya que también la ausencia de comensales importantes puede ser perjudicial (Weiss & Hennet, 2017).
Diversos factores exógenos y endógenos afectan a la composición microbiana del intestino, como la dieta, fármacos, la mucosa intestinal, el sistema inmunitario y la propia MI (Weiss & Hennet, 2017; Lin & Zhang, 2017). Además, el estrés oxidativo, los bacteriófagos y las bacteriocinas son factores que exacerban los cambios de la MI (Weiss & Hennet, 2017).
Se ha establecido una relación entre la disbiosis y diversas enfermedades, síndromes y alteraciones funcionales, como las gastrointestinales crónicas (síndrome del intestino irritable y la enfermedad inflamatoria intestinal), enfermedades metabólicas sistémicas (diabetes tipo 1 y 2), la obesidad, el síndrome metabólico, padecimientos cardiovasculares y neurológicos, y algunos tipos de cáncer (Michel, Izeta & Torres, 2017).
En los últimos años se ha documentado que la disbiosis de la MI juega un papel central en el desarrollo de la obesidad y en la aparición de resistencia a la insulina e inflamación, que subyacen en el SMet. En este sentido, en personas y modelos animales de obesidad y SMet se han encontrado cambios en la proporción relativa de algunos Phyla, principalmente una disminución de Bacteriodetes y un aumento en Firmicutes, como en ratones obesos ob/ob (Chen, 2018). Un estudio comparativo en mujeres mexicanas sanas, con obesidad y SMet se encontró que si bien los Phyla dominantes de la MI en los tres grupos eran Firmicutes > Bacteroidetes > Proteobacteria > Actinobacteria, la abundancia de Firmicutes era del 72.9 % en mujeres con obesidad y del 73.3% en mujeres con obesidad y SMet, mientras que en las sanas, la abundancia era del 56.9%, con una abundancia relativa de Firmicutes/Bacteroidetes alrededor de 3 en las mujeres con obesidad y con SMet, y de 1.57 en las sanas. En particular, en las mujeres con obesidad y con SMet, en el filo Bacteroidetes se observó una disminución en la abundancia relativa del género Bacteroides y de la familia Bacteroidaceae, y en el filo Firmicutes se encontró un aumento de la abundancia relativa del género Faecalibacterium y de la familia Lachnospiraceae, y una disminución de la familia Erysipelotrichaceae (Chávez-Carvajal et al., 2019).
Se ha sugerido que la disbiosis promueve de diversas formas la aparición del SMet: causa inflamación sistémica crónica de bajo grado a través del incremento de la permeabiidad intestinal y la traslocación de lipopolisacáridos bacterianos, proceso denominado endotoxemia (Org et al., 2017); se incrementa la síntesis de ciertos ácidos grasos de cadena corta (SCFAs), como el acetato, que afecta la producción de colesterol y ácidos grasos en el hígado, y modulan la expresión de genes asociados con el metabolismo lipídico (Murugesan et al., 2015; Ussar et al., 2015; Willson & Situ, 2017). Se ha reportado también que la MI produce metabolitos de colina, betaina, y N-óxido de trimetilamina a partir de fosfatidilcolinas dietarias, que participan en el desarrollo de la aterosclerosis (Nguyen, Jin, Chung & Hong, 2017).
Como se mencionó anteriormente, la composición y abundancia relativa de la MI puede ser modificada a través de la dieta y de la ingesta de diversos compuestos conocidos como prebióticos.
Prebióticos
Los prebióticos son compuestos no digeribles que, a través de su utilización por microorganismos en el intestino, modulan la composición y/o actividad de la MI, lo que confiere un efecto fisiológico beneficioso sobre el anfitrión (Bindels, Delzenne, Cani & Walter, 2015). La mayoría de los prebióticos son carbohidratos presentes en la dieta humana y animal, principalmente en las frutas, verduras, cereales y otras plantas comestibles como tomates, alcachofas, plátanos, espárragos, bayas, ajo, cebollas, achicoria, vegetales verdes, legumbres, avena, la linaza, la cebada y el trigo.
Los prebióticos incluyen a la lactulosa, galactooligosacáridos (GOS), maltooligosacáridos, ciclodextrinas, lactosacarosa, fructanos, como la inulina, los fructo-oligosacáridos (FOS), la oligofructosa, oligosacáridos de leche humana (HMO), almidón resistente, pectina, arabinoxilano, granos enteros (no refinados), varias fibras dietéticas, y moléculas como ácidos grasos, aminoácidos, y fitoquímicos (curcumina, resveratrol, extractos ricos en polifenoles) (Krumbeck, Maldonado-Gomez, Ramer-Tait & Hutkins, 2016; Yoo & Kim, 2016).
Tipos y composición
Carbohidratos. Los carbohidratos no digeribles se clasifican en dos tipos: colónicos (fibra alimentaria) y prebióticos. Los primeros llegan al colon y sirven como sustrato para los microorganismos que lo habitan, así como fuente energética y nutriente para el hospedador. Dentro de este grupo se incluyen los polisacáridos estructurales de plantas, como las pectinas, las hemicelulosas o la celulosa, las gomas o algunos oligosacáridos derivados de la soya, glucooligosacáridos, y arabinooligosacáridos. Los segundos realizan todas las actividades mencionadas y además estimulan el crecimiento selectivo de determinadas especies de la MI beneficiosas para el hospedador como las bifidobacterias y los lactobacilos (Corzo et al., 2015).
En el mercado a nivel mundial, se comercializan como prebióticos un gran número de carbohidratos; los más comunes se mencionarán a continuación:
Beta-glucanos: Son compuestos solubles de las paredes celulares del endospermo de granos de cereales, compuestos de unidades lineales de D-glucopiranosil o con una mezcla de enlaces glucosídicos β- (1,3) y β- (1,4). La avena y la cebada son las dos fuentes más comunes (Cloetens, Ulmius, Johansson, Akesson & Onning, 2012). Dada su ramificación y longitud variable, tienen diversos impactos en la salud intestinal del huésped (Lam & Chi, 2013).
Fructo-oligosacáridos (FOS), oligofructosa e inulina: Son compuestos de fructosa (β [2,1] -fructanos) que se encuentran en una amplia gama de estructuras y de alimentos. La inulina tiene un grado de polimerización (DP) de 3 a 60 monómeros de fructanos y la oligofructosa, de 2-20. Los FOS son producidos por la transfructosilación de la sacarosa y contienen de 2 a 4 unidades de fructosilo con enlaces β (2,1) (Van, Boon, Possemiers, Jacobs & Verstraete, 2007).
Galacto-oligosacáridos (GOSs): Son compuestos obtenidos industrialmente a partir del permeado de suero de quesería, mediante la transglicosilación de la lactosa catalizada por β-galactosidasas (lactasas). Contienen de 2-10 moléculas de galactosa unidas a una glucosa terminal y se diferencian entre sí en la longitud de la cadena y en el tipo de enlace (Marín et al., 2013).
Oligosacáridos de la leche materna (HMO): La leche humana contiene hasta un 10% de carbohidratos, siendo la lactosa el mayoritario (55-70 g/L). Los HMO se encuentran en concentraciones entre 12-14 g/L, y en el calostro, de 22-24 g/L: son responsables del alto número de bifidobacterias en heces de lactantes (Barile & Rastall, 2013).
Debido a la amplia gama de especies que componen a la MI, existen otras biomoléculas que también pueden ser consideradas como prebióticos (Diether & Willing, 2019), como:
Ácidos grasos (AG): Los ácidos grasos presentes en los alimentos pueden modificar la MI de diversas formas. Una dieta alta en AG saturados se ha asociado con una reducción en la diversidad de la MI (Sonnenburg, Tremaroli, Kovatcheva, Cani & Backhed, 2016) con aumento de bacterias patógenas (Fava et al., 2013), desarrollo de inflamación intestinal (Devkota et al., 2012), resistencia a la insulina e inflamación sistémica de bajo grado (Cani & Delzenne, 2009). Por otro lado, los efectos de los ácidos grasos poliinsaturados (AGPI) dependen del tipo de AGPI, ya que los AGPI ω-6 pueden provocar disbiosis asociada con inflamación intestinal (Prossomariti et al., 2017) y obesidad (Kaliannan, Wang, Li, Kim & Kang, 2015), mientras que los AGPI ω-3 pueden revertir la disbiosis y promover una microbota saludable (Santoru et al., 2017), además de servir como precursores de sustancias antiinflamatorias capaces de mantener la integridad del epitelio, por lo que están asociados con la prevención o tratamiento de ciertas enfermedades (Li et al., 2008).
Aminoácidos: Las proteínas y péptidos de la dieta pueden ser metabolizados a SCFA por la MI (Lin & Zhang, 2017) . Se ha observado que una dieta baja en fibra dietética puede dar lugar a un aumento en la fermentación proteolítica debido a la baja cantidad de carbohidratos fermentables en el colon, lo que puede alterar la abundancia relativa de especies microbianas en el intestino (Davila et al., 2013; Neis, Dejong & Rensen, 2015).
Fitoquímicos: Los fitoquímicos que están presentes en plantas o extractos de éstas pueden alcanzar el colon y ser utilizados por la MI, por lo que se proponen como moduladores de la misma (Feng, Ao & Peng, 2018). Un ejemplo es el resveratrol, que está presente en más de 70 tipos de plantas, como en la piel y semilla de la uva, en la semilla de acacia, maracuyá, té blanco, ciruelas, maní, entre otros (Chastang et al., 2018). Estudios recientes han demostrado que el resveratrol induce cambios en la MI que podrían conducir a la disminución del peso y grasa corporal, junto con la mejora en la homeostasis de la glucosa (Chaplin, Carpéné & Mercader, 2018; Chih, You, Hong & Li, 2019).
Estrategias terapéuticas para el tratamiento del SMet
Una adecuada estrategia para el manejo del SMet debe incluir la prevención, el diagnóstico temprano, y el abordaje médico multifactorial. Para el tratamiento del SMet se han aplicado estrategias farmacológicas y no farmacológicas, siendo la utilización de tratamientos combinados la mejor opción (Kuete, 2017).
Las estrategias no farmacológicas abordan el problema de forma integral al promover cambios en el estilo de vida, como modificaciones de la dieta para la reducción y mantenimiento del peso; la inclusión de compuestos bioactivos y nutracéuticos, como polifenoles, vitaminas, ω-3 PUFA, con actividades como antioxidantes, vasodilatadores, antiaterogénicos, antitrombóticos, y antiinflamatorios; y el incremento de la actividad física con rutinas de ejercicio (De la Iglesia et al., 2016; Rochlani, Pothineni, Kovelamudi & Mehta, 2017). Debido al importante papel que la MI juega en la patogénesis del SMet que provoca la aparición de enfermedades como la diabetes mellitus tipo 2 y las enfermedades cardiovasculares (Kellow, Coughlan & Reid, 2014); en años recientes se ha estudiado la manipulación de la MI como una estrategia prometedora para la prevención y manejo del SMet, lo que puede llevarse a cabo a través de cambios específicos de la dieta, y/o con la administración de probióticos y de prebióticos, como parte de los alimentos o en suplementos, de forma individual o combinada (simbióticos) (Chen & Devaraj, 2018; He & Shi, 2017). Los prebióticos son utilizados en el intestino para el crecimiento y actividad metabólica de ciertas especies bacterianas, por lo que la composición específica y la estabilidad de la MI dependerá del tipo de prebiótico administrado, además de factores inmunológicos, nutricionales, del consumo de antibióticos y otros fármacos, y de la presencia de enfermedades en el hospedero (He & Shi, 2017).
Uso de prebióticos para el manejo del SMet
Diversos estudios han demostrado beneficios de la administración de prebióticos en aspectos clave del SMet aunque los resultados obtenidos han sido en ocasiones contradictorios, posiblemente debido al tipo de modelo animal utilizado, a la cantidad de individuos estudiados, al estado de salud/enfermedad de los participantes, a la composición de la dieta, al tipo y presentación del prebiótico administrado, así como a las dosis y duración de las intervenciones.
Los efectos observados han sido relacionados con cambios en la composición y actividad de la MI, en la homeostasis energética, mejoramiento de la sensibilidad a la insulina, en el metabolismo lipídico, y en la modulación de la inflamación (Louis, Flint & Michel, 2016). En la Tabla III se muestran ejemplos de estos estudios en relación con la modificación de la MI.
Tabla III Efectos benéficos de los prebióticos sobre los parámetros del Síndrome metabólico en humanos y animales.
| Prebiótico | Modelo de estudio | Beneficios | Modificación en la microbiota | Referencias |
|---|---|---|---|---|
| FOS | Ratones - Dieta alta en grasa |
|
|
Cani et al., 2007 |
| Ratones C57b16/J obesos |
|
|
Cani et al., 2009 | |
| Ratones obesos resistentes a la leptina- Dieta alta en grasa |
|
|
Everard et al., 2011 | |
| FOS de cadena corta | Ratones obesos |
|
|
Respondeck et al., 2013 |
| Ratones obesos |
|
|
Márquez et al., 2013 | |
| Fructanos tipo inulina (ITF) | Adultos con obesidad y sobrepeso |
|
|
Reimer et al., 2017 |
| Mujeres obesas |
|
|
Dewulf et al., 2013 | |
| Ratones C57b16/J - Dieta alta en grasa |
|
|
Dewulf et al., 2011 | |
| GOS | Adultos SMet/ obesidad |
|
|
Vulevic et al., 2013 |
| Ratas con MI humana |
|
|
Djouzi & Andrieux, 1997 | |
| GOS de garbanzo | Ratones - Dieta alta en grasa |
|
|
Dai et al., 2017 |
| Inulina | Ratas - Dieta alta en grasa |
|
|
Han et al., 2013 |
| FOS + inulina | Infantes con obesidad y sobrepeso |
|
|
Nicolucci et al., 2017 |
| Ratas JCR:La-cp obesas |
|
|
Parnell & Reimer, 2012 | |
| XOS+inulina | Adultos sanos |
|
|
Lecerf et al., 2012 |
| XOS | Adultos prediabéticos |
|
|
Yang et al., 2015 |
| Ratones C57BL/6NTac |
|
|
Hansen et al., 2013 | |
| Arabinoxilano | Ratones obesos - Dieta alta en grasa |
|
|
Neyrinck et al., 2011 |
| a-ciclodextrinas | Ratones obesos - Dieta alta en grasa |
|
|
Nihei et al., 2018 |
FOS: fructooligosacáridos; GOS: glucooligosacáridos; XOS: xilooligosacáridos; CC: circunferencia de cintura; CD36: transportador de ácidos grasos; GLP-1: péptido similar al glucagón tipo 1; GLP-2: péptido similar al glucagón tipo 2; GPR43: receptor 43 acoplado a proteínas G; HDL: lipoproteínas de alta densidad; HOMA-IR: índice de resistencia a la insulina; IgA: inmunoglubulina A; IL-: interleucinas; LDL: lipoproteínas de baja densidad; LPS: lipopolisacáridos; PPARγ: receptor activado por proliferadores de peroxisomas gamma; TG: triglicéridos; TNFα: factor de necrosis tumoral alfa; aumento disminución
Obesidad y sobrepeso. - Los efectos benéficos de la administración de prebióticos sobre la obesidad se han demostrado en ratas y ratones utilizando modelos genéticos de obesidad y SMet o inducidos a través de la ingesta de dietas altas en grasas o carbohidratos. En estos trabajos se ha reportado la disminución del peso, de la grasa corporal, de la ganancia de peso, del tamaño de adipocitos, y de la ingesta calórica, al suplementar la dieta de los roedores con diversos prebióticos (Daubioul, Taper, Wispelaere & Delzenne, 2000; Brusserolles et al., 2003; Cani, Neyrinck, Maton & Delzenne, 2005 y Cani et al., 2009; Delmée et al., 2006; Sugatani, Wada & Osabe, 2006; Yang et al., 2007; Reimer & Rusell, 2008; Dewulf, 2011; Everard et al., 2011; Neyrinck et al., 2011; Parnell & Reimer, 2012; Márquez et al., 2013; Nihei et al., 2018).
En humanos se han observado también efectos positivos en la disminución del peso, del índice de masa corporal, de la circunferencia de cintura, de la grasa corporal, de la ingesta calórica, de la sensación de hambre, y el aumento de la saciedad, en infantes y personas adultas sanas, con sobrepeso y obesidad, después de la administración de prebióticos (Cani et al. , 2006; Cani et al., 2009; Whelan, Efthymiou & Judd, 2006; Genta et al., 2009; Parnell & Reimer, 2009; Hume, Nicolucci & Reimer, 2017; Nicolucci et al., 2017; Reimer et al., 2017; Edrisi et al., 2018).
Resistencia a la insulina.- La administración de diversos prebióticos en roedores con SMet ha demostrado efectos benéficos en el mejoramiento de la sensibilidad a la insulina y la tolerancia a la glucosa, con disminuciones significativas en los niveles séricos de insulina, glucosa, y del índice de resistencia a la insulina HOMA-IR (Delmée et al., 2006; Cani et al., 2007; Yang et al., 2007;Dewulf et al., 2011; Everard et al., 2011; Neyrinck et al., 2011; Respondeck et al., 2013, Márquez et al., 2016; Dai et al., 2017).
El mejoramiento de la sensibilidad a la insulina se ha observado también en humanos con SMet obesos, con sobrepeso o normopeso, por la reducción significativa de los niveles postprandiales de glucosa y de insulina, la restauración de la sensibilidad a la insulina, el mejoramiento en el control glicémico, y la disminución de aminotrasnferasas en individuos con esteatosis hepática, después del consumo de prebióticos (Daubioul et al., 2000; Giacco et al., 2004; García, Otto & Reich, 2007; Genta et al., 2009; Parnell & Reimer, 2009; Dewulf et al., 2013; Vulevic, Juric, Tzortzis & Gibson, 2013; Dehghan, Gargari, Jafar-Abadi & Aliasgharzadeh, 2014; Yang et al., 2015; Márquez et al., 2016; ver también revisión en Kellow, Coughlan & Reid, 2014).
Dislipidemia. - En lo que respecta a los lípidos, diversos reportes demuestran efectos benéficos de los prebióticos en la modulación de los niveles de lípidos circulantes y hepáticos en modelos con SMet inducido por la dieta o genéticamente determinados en roedores y en humanos.
En ratas y ratones, se ha observado la disminución de los niveles circulantes de colesterol total, triglicéridos, LDL-colesterol, VLDL, relación LDL/HDL, triglicéridos y fosfolípidos hepáticos, la actividad del ácido graso sintasa, la esteatosis hepática, y el aumento de HDL-colesterol (Kok, Robert & Delzenne, 1996 y Kok, Taper & Delzenne, 1998; Djouzi & Andrieux, 1997; Agheli et al., 1998; Kim & Shim, 1998; Daubioul et al., 2000; Brusserolles et al., 2003; Cani et al., 2005; Rault-Nania et al., 2006; Yang et al., 2007; Reimer & Russell, 2008; Everard et al., 2011; Neyrinck et al., 2011; Han et al., 2013; Respondeck et al., 2013; Márquez et al., 2013; Dai et al., 2017).
El efecto benéfico en infantes y personas adultas con sobrepeso, obesidad, dislipidemia, hipercolesterolemia, o con intolerancia a la glucosa, ha sido también demostrado al disminuir los niveles de lípidos séricos y hepáticos, la lipogénesis y la esteatosis hepática después del consumo de prebióticos (Brighenti, Casiraghi, Canzi & Ferrari, 1999; Causey, 2000; Alliet et al., 2007; Genta et al., 2009; Russo et al., 2010; Tovar, Caamano, Garcia-Padilla, Duarte & Rosado, 2012; Vulevic, Juric, Tzortzis & Gibson, 2013).
Inflamación. - La administración de diversos prebióticos en modelos genéticos e inducidos a SMet en ratas y ratones y en humanos con alteraciones relacionadas con el SMet ha demostrado efectos benéficos en los marcadores inflamatorios, con disminuciones significativas de citocinas pro-inflamatorias (IL-1β, IL- 6, TNFα, Interferón Ifnƴ), de edotoxemia, de marcadores de estrés oxidativo, proteína C-reactiva, y el aumento de citocinas anti-inflamatorias (IL-13 e IL-10) (Schiffrin et al., 2007; Cani et al., 2007 y 2009; Everard et al., 2011; Neyrinck et al., 2011; Lecerf et al., 2012; Hansen et al., 2013; Vulevic et al., 2013; Dehghan et al., 2014; Edrisi et al., 2018; Saville & Saville, 2018).
Mecanismos de acción de los prebióticos
Los mecanismos fisiológicos responsables de los efectos del consumo de prebióticos en el SMet son numerosos, se encuentran íntimamente relacionados, y varían de acuerdo con el estado fisiológico del individuo, el tipo de dieta, y el prebiótico administrado. Los efectos están relacionados principalmente con la mejora o normalización de la disbiosis intestinal asociada con el SMet, ya que los prebióticos estimulan el crecimiento y actividad de determinados grupos bacterianos considerados benéficos, como las Bifidobacterias, los Lactobacillus y los Bacteroidetes, e inhiben el crecimiento de los patógenos, como Clostridium difficile (Clarke et al., 2014) [Figura 2 (a)]. La MI es metabólicamente muy activa, y sus principales productos, los ácidos grasos de cadena corta (SCFAs) (ácidos acético, butírico y propiónico) [Figura 2 (b)], tienen efectos a nivel local (intestino) y sistémico (hígado, páncreas y tejido adiposo) (Parnell & Reimer, 2012; Louis et al., 2016; He & Shi, 2017).
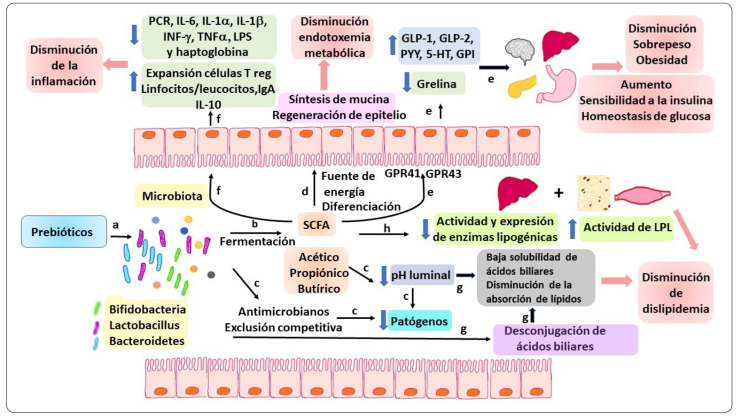
Elaboración propia
Figura 2 Mecanismos de acción de los prebióticos en relación con el SMet. Estos mecanismos incluyen la estimulación del crecimiento de grupos microbianos benéficos (a), la producción de ácidos grasos de cadena corta (SCFA) (b), la disminución de los patógenos por exclusión competitiva y la disminución del pH luminal (c) y su impacto en la regeneración del epitelio y la síntesis de mucina (d); la producción de hormonas saciogénicas, insulinotrópicas y reguladoras de la sensibilidad a la insulina (e); la disminución de citocinas proinflamatorias y la expansión de células T reguladoras, linfocitos/leucocitos, la producción de IgA y de IL-10 (f); la modificación de ácidos biliares (g); y la regulación de enzimas lipogénicas en hígado, músculo y tejido adiposo (h).
En el intestino, la MI actúa como una barrera contra los patógenos a través de mecanismos llamados antagónicos, como la disminución del pH del lumen por los SCFAs, la producción de antimicrobianos, y la exclusión competitiva (competencia por nutrientes y por adhesión al epitelio) [Figura 2 (c)]. Además, los SCFAs son absorbidos en el colon y proveen de energía para la división celular; en particular el butirato estimula la síntesis de mucina, lo que resulta en la regeneración y reparación de la mucosa intestinal, y promueve la diferenciación de las células enteroendócrinas L (He & Shi, 2017; Clarke et al., 2014) [Figura 2 (d)]. Los SCFAs tienen la capacidad de regular la expresión de los genes en el colon al inhibir a la histona desacetilasa, y de modular rutas de señalización a través de su unión a los receptores acoplados a proteínas G, GPR41 (también llamado FFAR3) y GPR43 (FFAR2) localizados en el epitelio intestinal, en las células enteroendócrinas e inmunes, así como en otros tejidos como el adiposo, hepático y el páncreas, regulando la secreción de las hormonas GLP-1 (glucagón-like peptide-1), GLP-2, PYY (péptido YY), 5-hydroxitriptamina (5-HT), el polipéptido gástrico inhibitorio (GPI) y la hormona estimuladora del apetito grelina (Cani et al., 2009; Dai et al., 2017; Cerdó, García-Santos, Bermúdez & Campoy, 2019) [Figura 2 (e)]. La GLP-1 es una hormona anorexigénica, que suprime el apetito, reduce el tránsito intestinal y el vaciamiento gástrico, disminuyendo así la ingesta de alimentos y el peso corporal; además, junto con el GPI, estimula la secreción postprandial de insulina por el páncreas, aumenta la masa de células β del páncreas, inhibe la liberación del glucagón, disminuye la gluconeogénesis y mejora la sensibilidad a la insulina en el hígado, con efectos hipoglucemiantes (Ahren & Schmitz, 2004; Cani et al., 2006; Louis et al., 2016; He & Shi, 2017). La comunicación continua entre el intestino y el páncreas es llamada el eje entero-insular, y es imprescindible para mantener la homeostasis de la glucosa (Fernández, Redondo, Gutiérrez, Miguélez, Villar & Lombó, 2016). Además, el ácido propiónico estimula la glucólisis e inhibe la gluconeogénesis, y se ha observado una reversión de la resistencia a la insulina hepática por el incremento en la fosforilación de las proteínas intracelulares Akt y IRS2 (Reis et al., 2015) [Figura 2 (e)].
La GLP-2 y el PYY son también reguladores de la ingesta de alimentos a través de la inhibición de la secreción de ácidos y del vaciamiento gástrico, con lo que participan también en la disminución de la obesidad y el sobrepeso. El GLP-2 mejora la sensibilidad a la insulina en el hígado, y juega un papel central en el control de la homeostasis de la glucosa. El PYY actúa a nivel cerebral en la regulación del apetito, y el 5-HT es un neurotransmisor que regula la motilidad gastrointestinal y sus funciones secretoras, por lo que promueve la peristalsis intestinal y reduce la absorción de la energía de los alimentos (Parnell & Reimer, 2012; Reis et al., 2015; Fernández, Redondo, Gutiérrez, Miguélez, Villar & Lombó, 2016; He & Shi, 2017) [Figura 2 (e)].
EL GLP-2 contribuye también a reducir la inflamación sistémica y sus desórdenes asociados, ya que estimula la proliferación celular del epitelio intestinal y está involucrada en la promoción de las uniones estrechas que mantienen la integridad de la barrera epitelial intestinal, con lo que se disminuye la endotoxemia metabólica al reducir o eliminar la filtración de LPS a través de la pared intestinal, lo que estimula la inflitración de macrófagos y activan la síntesis de citocinas inflamatorias (Parnell & Reimer, 2012). En este sentido, se ha demostrado que los prebióticos incrementan la cuenta de linfocitos y/o leucocitos en los tejidos linfoides asociados al intestino (GALTs) y en la sangre periférica, y que el GPL-2 tiene propiedades antiinflamatorias pues promueve la expansión de células T reguladoras a través de la inhibición de la desacetilación de histonas, y la producción de IgA por las células B de la mucosa, lo que estimula la función fagocítica de los macrófagos (Dai et al., 2017; Markowiak & Śliżewska, 2017; Cerdó, García-Santos, Bermúdez & Campoy, 2019) [Figura 2 (f)].
La MI y sus metabolitos tienen efectos benéficos también en el metabolismo lipídico. La disminución del pH del lumen intestinal provoca que los ácidos biliares sean menos solubles y sean eliminados por las heces fecales, mientras que la MI los desconjuga, lo que resulta en la excreción de ácidos biliares libres que son menos eficientes en la solubilización y absorción de lípidos en el intestino. En consecuencia, se reduce la absorción intestinal de lípidos y colesterol, y, por lo tanto, sus concentraciones séricas (Reis, Conceição, Diniz, Damiana, Manoela & Peluzio, 2015; Fernández, Redondo, Gutiérrez, Miguélez, Villar & Lombó, 2016) [Figura 2 (g)].
Por otra parte, los SCFAs, en especial el ácido propiónico, regulan la síntesis de novo de lípidos y la adiposidad, ya que aumentan la lipólisis y reducen la actividad y expresión de las enzimas lipogénicas hepáticas acetil-CoA carboxilasa, ácido graso sintasa (FAS), enzima málica, ATP-citrato liasa, y glucosa-6-fosfato deshidrogenasa (Reis, Conceição, Diniz, Damiana, Manoela & Peluzio, 2015; Yoo & Kim, 2016; Markowiak & Śliżewska, 2017) [Figura 2 (h)]. Además, disminuyen la síntesis de colesterol y triglicéridos hepáticos, ya que inhiben la actividad de la enzima 3-hidroxi-metil-3-glutaril-CoA (HMG-CoA) reductasa y la expresión de la proteína 4 angiopoietina-like (ANGPTL4), que a su vez inhibe a la LPL circulante. También redistribuyen el colesterol plasmático hacia el hígado, e incrementan la síntesis y secreción de ácidos biliares, ya que estimulan la actividad de la enzima 7α-hidrolasa, e inhibe la expresión de los genes involucrados en la biosíntesis intestinal del colesterol; esto resulta en la disminución de los niveles séricos de triglicéridos, VLDL, y colesterol (Reis, Conceição, Diniz, Damiana, Manoela & Peluzio, 2015). A nivel muscular, los SCFAs Incrementan la actividad de la lipoproteína lipasa (LPL), lo que lleva a una reducción de los triglicéridos séricos y lípidos en el músculo (Reis, 2015). En el tejido adiposo, la hormona GIP estimula la actividad de las enzimas LPL y FAS, y se observa una reducción del tejido adiposo visceral (Reis, Conceição, Diniz, Damiana, Manoela & Peluzio, 2015; Fernández, Redondo, Gutiérrez, Miguélez, Villar & Lombó, 2016) [Figura 2 (h)].
Esto lleva consigo una disminución en la secreción de citocinas pro-inflamatorias y un aumento de las anti-inflamatorias, y de la disminución de la expresión del receptor GPR43 en el tejido adiposo, lo que conduce al mejoramiento de la tolerancia a la glucosa, de la sensibilidad a la insulina, y de la inflamación (Cani et al., 2006 y 2009; Whelan et al., 2006; Parnell & Reimer, 2009 y 2012; Dewulf et al., 2011; Everard et al., 2011; Neyrinck et al., 2011; Verhoef, Meyer & Westerterp, 2011; Russo et al., 2012; Reimer & Russell, 2008; Festi et al., 2014; Louis et al., 2016; Hume et al., 2017; Nihei et al., 2018).
En conjunto, los mecanismos mencionados anteriormente se reflejan en la disminución del sobrepeso u obesidad, la disminución de la dislipidemia, en el mejoramiento de la sensibilidad a la insulina y la homeostasis de la glucosa, así como en la reducción de la inflamación sistémica crónica de bajo grado y de la endotoxemia metabólica (Figura 2).
Conclusiones
El SMet y sus comorbilidades asociadas tienen un gran impacto social y económico mundial. El desarrollo del SMet es consecuencia de un desbalance energético originado por estilos de vida inadecuados en combinación con aspectos genéticos y epigenéticos de la población. El carácter multifactorial del SMet hace que su erradicación sea un reto que debe abordarse con estrategias terapéuticas diversas. La implicación de la microbiota intestinal y los prebióticos, así como sus efectos en el origen, desarrollo y reversión, los coloca como blancos terapéuticos de gran valor para la prevención y el tratamiento.
El desarrollo de las investigaciones en animales y en estudios clínicos son imprescindibles para conocer el efecto de la administración de los probióticos y/o los prebióticos, y entender a profundidad los mecanismos implicados en los beneficios que tienen en la modulación de la MI, así como en los diferentes resultados clínicos, para formular estrategias terapéuticas más precisas que involucren su utilización en el manejo de este importante padecimiento.











 nueva página del texto (beta)
nueva página del texto (beta)


