Introducción
El plomo (Pb) es un metal pesado cuya presencia ha formado parte de la historia humana. Al identificarse procesos patológicos generados por la exposición a _I este metal, las agencias gubernamentales en diversos países se encargaron de normar sus niveles en el ambiente, con la finalidad de proteger la salud de la población (Wu, Cobbina, Mao, Xu, Zhang & Yang, 2016). A pesar de esto, el Pb continúa siendo un elemento de importancia industrial en diversos países y una amenaza para los seres vivos y el ambiente (Schell, Burnitz & Lathrop, 2010; Ospina, 2015).
La frecuencia de exposición, no ocupacional, a concentraciones ambientales por encima de los límites máximos establecidos por agencias gubernamentales es mayor en países en desarrollo (Liu et al., 2017; Pelfrene & Douay, 2017; Nazarpour, Watts, Madhani & Elahi, 2019). Las fallas en el tratamiento de agua potable (Maloney, Bayon, Zaqia & Lahiri, 2018), así como el dolo en las pruebas de calidad de este líquido que enmascaran niveles peligrosos de Pb (Roy & Edwards, 2019) continúan siendo un riesgo para la población. El grado de exposición al Pb varía en cada país (Iqbal, 2012; Caravanos et al, 2014; Hobi, 2014; Oben-Gyasi, 2019), la vía más común de ingreso al organismo es a través de la ingestión por agua o alimentos contaminados (Fitamo, Itana & Olsson, 2007; Fuentes-Gandara, Pinedo-Hernández, Marrugo-Negrete & Díez, 2016; Luo, Meng, Ye, Wang & Bai, 2016; Tamayo-y-Ortiz et al., 2016; Jarvis, Quy, Macadam, Edwards & Smith, 2018; Ngole-Jeme, Ekosse & Songca, 2018) y, si bien puede ingresar por inhalación y absorción dérmica, estos últimos suelen ser menos frecuentes (Agency for Toxic Substances and Disease Registry, 2011; Bindler, 2011). Debido a que el Pb afecta la fertilidad, resulta de suma importancia ahondar en los conocimientos sobre sus mecanismos de toxicidad en el aparato reproductor femenino (Chang et al., 2006; Hsiao-Ling, Hsiao-Jui, Hsin-Yi, Kai-Wei & Ling-Chu, 2015).
La fertilidad femenina depende del ovario, que tiene un papel central en la maduración sexual a través de la producción hormonal, así como en la generación y desarrollo de los ovocitos (Hoyer, 2014). Debido a que el Pb afecta al sistema endocrino y reproductor (Doumouchtsis, Doumouchtsis, Doumouchtsis & Perrea, 2009; Sharma & Bhattacharya, 2014), impacta negativamente a la salud reproductora femenina a corto y largo plazo (Junaid, Chowdhury, Narayan, Shanke & Saxena, 2010). Se sabe que éste puede ejercer efectos y ser acumulado en el sistema óseo incluso a concentraciones traza (Bloom, Louis, Sundaram, Kostyniak & Jain, 2011) al ser liberado durante la gestación, la lactancia o la osteoporosis (Gulson, Mizon, Korsch, Palmer & Donnelly, 2003; Center for Disease Control and Prevention [CDC], 2010; Winiarska-Mieczan & Kwiecien, 2016), se convierte en un riesgo potencial para las mujeres y su descendencia, aun si ha cesado la exposición (Nampoothiri & Gupta, 2008; Matthews & Phillips, 2010). Por esta razón, en el presente trabajo se llevó a cabo una revisión de los estudios realizados acerca de los efectos del Pb sobre los ovarios.
Metodología
Se realizó una búsqueda de los términos "ovary lead exposure", "granulose cells Pb", "Pb+ovary", "lead acetate female gonads", "Lead exposure female gonads" en los buscadores PubMed, Pubchem, Elsevier, ScienceDirect, JSTOR, Mendeley, SciELO, SpringerLink y Google Scholar, para llevar a cabo una revisión bibliográfica de artículos científicos que abordan los efectos del Pb de manera aislada o en combinación con otros compuestos sobre el aparato reproductor femenino, principalmente en ratón, rata y humano, así como las técnicas in vitro en tejido ovárico; se consultaron sólo un par de trabajos en bovinos, ovejas, y un trabajo con gallinas (estos últimos por ser modelos experimentales más recientes).
El criterio empleado se basó en la selección de publicaciones posteriores al año 2000 enfocadas principalmente, pero no limitadas a los ovarios como órgano completo o a los componentes celulares del mismo. Sólo se mencionan trabajos previos al año 2000 fundamentales para entender la acción del Pb en los ovarios. El orden cronológico no demerita la naturaleza del trabajo realizado con gónadas femeninas, por esta razón se consideraron estudios de años más recientes en los que utilizan técnicas plenamente establecidas como: la histología, los marcadores moleculares y el cultivo celular. Se modificó la unidad en que se reportan los niveles de exposición de cada artículo a ppm para mantener un formato homogéneo.
El ovario y las especies reactivas de oxígeno (ERO)
El ovario es el órgano que produce los gametos y hormonas femeninos (Hoyer, 2014). Está compuesto por células germinales (ovocitos) y somáticas (células de la granulosa, de la teca y del estroma), cuyas interacciones dictan la formación y la maduración de los folículos, la ovulación, así como la formación del cuerpo lúteo (Richards & Pangas, 2010). Los procesos relacionados a la maduración folicular y a la ovulación son controlados por las hormonas folículo estimulante (FSH) y la luteinizante (LH), que son secretadas por la glándula pituitaria, que a su vez es regulada por la hormona liberadora de la gonadotropina (GnRH) (Richards & Pangas, 2010). Estas hormonas funcionan como mensajeros en el ovario, interactuando con distintos componentes celulares que permitirán el desarrollo adecuado de los gametos femeninos, así como el mantenimiento de las funciones ováricas normales (Figura 1). El éxito reproductor dependerá de estas interacciones. Los gametos femeninos son producidos cuando el organismo es un feto y no son regenerados, disminuyendo en número a lo largo de la vida (Hoyer, 2014).
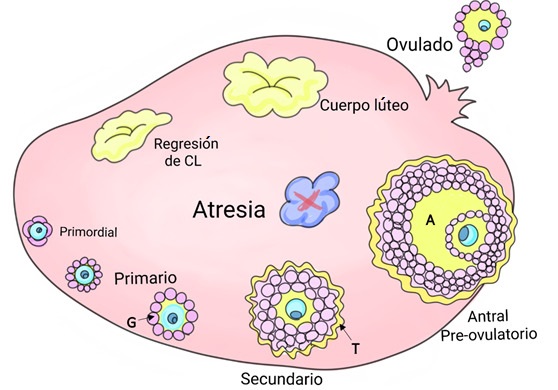
Figura1 . Representación del proceso de maduración folicular. La FSH controla el crecimiento de las células de la granulosa(G), así como la producción de estradiol, mientras que la LH regula la ovulación y la luteinización folicular (Richards & Pangas, 2010). Hoyer (2014) describe que la forma más inmadura del folículo se denomina "primordial", donde el ovocito es rodeado por una unicapa de células de la granulosa. Una vez activado, madura para volverse un folículo primario, donde se rodeará por una unicapa de células de la granulosa cuboidales. Posteriormente se convertirá en un folículo secundario, en el cual las células de la granulosa proliferan para formar una capa multicelular, mientras se genera una capa de células de la teca interna (T). Éstas interactuarán entre sí para producir la 17β-estradiol (el principal estrógeno asociado a la función ovárica). Conforme avanza el desarrollo, comienza a formarse una cavidad llena de fluido (el antro, A). El folículo más grande es denominado "Antral" o "preovulatorio". Aquellos que no ovulan mueren en un proceso conocido como atresia. En la etapa final, el ovocito es liberado y entra al oviducto rodeado por varias capas de células de la granulosa. Las células residuales en el ovario son infiltradas y comienzan a luteinizarse, formando un cuerpo lúteo maduro, el cual producirá progesterona (importante para el proceso de implantación). Al final del ciclo ovárico, si no hay fecundación, el cuerpo lúteo sufre una regresión. Elaboración personal.
En el ovario, la producción de especies reactivas de oxígeno (ERO) es un fenómeno normal durante la esteroidogénesis, la maduración folicular, la reanudación de la meiosis y la ovulación (Sugino, 2005). La generación de las ERO es contrarrestada por enzimas como la superóxido-dismutasa (SOD), catalasa (CAT), glutatión-peroxidasa (GPx), glutatión reductasa (GR), y la molécula del glutatión (Glut), entre otras, cuyo equilibrio es crucial en la salud reproductora. El Pb tiene la capacidad de aumentar los niveles de las ERO como el peróxido de hidrógeno (H2O2), anión superóxido (O2-) y radical hidroxilo (OH•) al inactivar estas enzimas antioxidantes (AOX) (Ahamed & Siddiqui, 2007), alterando el balance óxido-reducción (REDOX). Las células lúteas y las de la granulosa tanto en ratas como en humanos responden al H2O2 y al O2- con una rápida inhibición en la síntesis hormonal (Behrman, Kodaman, Preston, & Gao, 2001 ; Hayashi, Miyamoto, Konari, Ohtani & Fukui, 2003;Agarwal, Gupta & Sharma, 2016; Masudul-Hoque, Umehara, Kawai & Shimada, 2021). El radical OH• induce daño al DNA en las células lúteas e inhibe la síntesis de proteínas, interrumpiendo el desarrollo folicular y la ovulación (Agarwal et al., 2016). Esta inactivación interfiere con los procesos de reparación de daños al DNA ocasionados por las ERO, disminuyendo el número de óvulos disponibles y, a pesar de ser posible un embarazo, el daño al material genético compromete la estabilidad de los cromosomas heredados (Titus et al., 2013). Los daños inducidos han sido descritos en diversos estudios a lo largo de los años (Tabla I).
Tabla I Estudios desde el año 2000 que demuestran los efectos del plomo sobre los ovarios a nivel celular y fisiológico.
| Referencia | Modelo empleado | Hallazgos significativos |
|---|---|---|
| Aglan et al. (2020) | Cultivo celular | Aumento de las ERO, atenuación de la expresión génica Nrf2, reducción de la SOD y la CAT, el aumento de las proteínas carboniladas induce la apoptosis en las células de la granulosa |
| Bruno-Nascimento et al. (2016) | Rattus norvegicus | Acumulación del Pb en la leche de las hembras gestantes y en los ovarios de la descendencia |
| Canaz et al. (2010) | Tejidos tumorales de pacientes | Concentraciones de Pb, mayores, en tejidos de tumores limítrofes y malignos, proyecciones papilares y tejido capsular |
| Dhir & Dhand (2010) | Rattus norvegicus | Ciclo estral irregular, disminución de un 40% en la fertilidad. Atresia en los folículos en distintas fases del desarrollo. |
| Dumitrescu et al. (2015) | Rattus norvegicus | Acumulación del Pb directamente correlacionada con la concentración. Dispersión celular en los folículos, destrucción del parénquima ovárico, necrosis en las células y en las glándulas uterinas, desarrollo de quistes ováricos y folículos atrésicos. |
| Dumitrescu et al. (2014) | Rattus norvegicus | Disminución significativa de la FSH, la progesterona y el estradiol, aumento de la LH |
| Jasim-Sodani (2017) | Mus musculus | La mayoría de los folículos con corona radiata degenerada, ovocito degradado, sin zona pelúcida visible y apoptosis masiva. Reducción en el número de células de la granulosa y dispersas. Aumento en la cantidad de folículos atrésicos. |
| Junaid et al. (2010) | Mus musculus | Disminución en el número de folículos primordiales a antrales, distintos grados de atresia en los folículos secundarios a antrales. Degeneración de los ovocitos, edema en la médula ovárica y los folículos de Graaf con desarrollo incompleto. |
| Lefevre (2001) | Mus musculus | Menor cantidad de folículos primordiales, mayor cantidad de folículos atrésicos. Muchos ovocitos habían reanudado la meiosis. Folículos antrales atrésicos con células de la granulosa despegadas y cuyos ovocitos reiniciaron la meiosis. Teca hipertrófica |
| Ma et al. (2020) | Gallus domesticus | Acumulación relacionada directamente con el nivel de exposición. Disminución en la expresión de GPx y Nrf2 |
| Nampoothiri & Gupta (2008) | Rattus norvegicus | Disminución leve del estradiol y la progesterona. Disminución de la actividad esteroidogénica en las células de la granulosa. Reducción del glutatión, la catalasa y la superóxido dismutasa, aumento en los marcadores de la lipoperoxidación |
| Paksy, Gati, Naray & Rajczy (2001) | Cultivo celular (humano) | Acumulación del Pb en el fluido folicular, disminución en la producción de progesterona, los niveles de Pb en el líquido folicular fueron mayores que en el suero. Despegamiento gradual de las células de la granulosa |
| Sharma & Bhattacharya (2014) | Mus musculus | Pérdida en el peso de los ovarios dependiente de la duración del tratamiento, disminución del número de ovocitos y folículos que entraron a la fase de crecimiento. Células de la granulosa atrofiadas y reducción en el diámetro de los folículos. |
| Taupeau et al. (2003) | Cultivo celular (ratón) | Disminución en la cantidad de folículos primordiales disponibles, aumento de los folículos atrésicos, células de la teca hipertróficas. La mayoría de los ovocitos en los folículos atrésicos habían reiniciado la meiosis. Disminución de transcriptos de P450 aromatasa y ERBβ en las células de la granulosa. |
El ingreso y los efectos del Pb en las células.
El Pb puede ser absorbido a través del sistema respiratorio o por el tracto gastrointestinal. En el organismo se distribuirá a órganos como el riñón, el hígado, el cerebro, las gónadas y los huesos (Valdivia-Infantas, 2005; Beyersmann & Hartwig, 2008), siendo el último, el compartimento en el que se acumula durante las exposiciones crónicas (Patocka & Cerny, 2003; ATSDR, 2011). Se sabe que el calcio almacenado en los huesos es transferido a través de la circulación materna para ayudar a la rápida mineralización de los huesos del feto, proceso que continúa posterior al parto a través de la leche materna (Kovacs, 2001). La movilización del calcio a partir del hueso materno que ocurre durante el embarazo y la lactancia estimula también la movilización del Pb almacenado en el hueso, elevando sus niveles en la sangre materna. El plomo movilizado se convierte entonces no sólo en una fuente endógena de exposición para la madre, sino también para el feto y el niño lactante (Gulson et al, 2003; CDC, 2010; Winiarska-Mieczan & Kwiecien, 2016). La importancia de ésto radica en el hecho de que este metal puede afectar al organismo aún a bajas concentraciones, ya que el ion Pb2+ ha sido asociado a modificaciones en las rutas metabólicas y en las vías de señalización hormonal y molecular que afectan negativamente al organismo (Martínez-Riera, Sant-Yacumo & Riera de Martínez-Villa, 2001; Beyersmann & Hartwig, 2008).
El Pb ingresa a la célula por vías como el intercambio iónico, o anclado a grupos -SH (tioles o sulfhidrilo) de proteínas transmembranales (Kirberger, Wong, Jiang & Yang, 2013), canales iónicos, o transportadores del glutatión, transportadores de iones calcio o vesículas (Chiu & Yang, 2012; Gonick, 2011). Sus efectos patológicos son multifactoriales al interrumpir la actividad de las enzimas AOX, inhibir competitivamente la absorción de iones metálicos importantes, e interactuar con los compuestos - SH, alterando diversos procesos celulares (Jomova & Valko, 2011; Kirberger et al, 2013).
La enzima delta aminolevulínico deshidrogenasa (ALAD) (Godwin, 2001) y la molécula del glutatión (Mah & Jalilehvand, 2013) tienen la capacidad de formar enlaces con iones metálicos. Estos componentes del sistema REDOX se anclarán con mayor facilidad al Pb, inactivándose o modificándose en el proceso. Al poder reemplazar los iones que funcionan como cofactores importantes, las enzimas como la superóxido-dismutasa (SOD) y la catalasa (CAT) también pueden ser inactivadas por este metal (Flora, Gupta & Tiwari, 2012).
Aunque el peso molecular del Pb es mayor que el del Calcio, el Zinc y el Hierro, al tener la misma valencia química que éstos, puede mimetizarse fácilmente (Godwin, 2001; Patocka & Cerny, 2003), al ser transportado y almacenado en las células a través de las distintas rutas metabólicas dependientes de los iones metálicos anteriormente mencionados. Esto facilita la modificación de los procesos de plegamiento proteico en el retículo endoplasmático (Patocka & Cerny, 2003; Corsetti, Romano, Stacchiotti, Pasini & Dioguardi, 2016), además de incrementar la formación de los radicales libres en la cadena respiratoria de la mitocondria (Kaur, Singh, Batish & Kohli, 2012; Sousa & Soares, 2014), así como la formación de cuerpos de inclusión citosólicos y nucleares (Zuo, Qu, Cooper, Goyer, Diwan & Waalkes, 2009; Kaur et al, 2012); también provoca alteraciones en la reparación del DNA y la acetilación de las histonas en el núcleo (Gadhia, Calabro & Barile, 2012; Xu et al., 2015), lo que explica su capacidad para afectar la salud y el estado REDOX celular (Figura 2).

Figura 2 Compartimentos celulares en los que el Pb se ha encontrado anclado o afectando funciones importantes. V-vesículas, IC-canales iónicos, PT-proteínas transmembranales, TG-Transportadores del Glutatión, B-bombas y proteínas como la NaK-ATPasa, CdI-cuerpos de inclusión, Glut-Glutatión, M-mitocondria, RE-retículo endoplásmico, PM-proteínas membranales nucleares y RH-residuos aminoacídicos de histonas. Elaboración personal.
Acumulación del Pb en ovarios y sus efectos deletéreos en la salud reproductora
Taupeau, Poupon, Nome & Lefevre (2001), observaron en ratones que el Pb (10 ppm) no modifica el peso ovárico, pero sí puede acumularse en el ovario. Esto provoca la disminución en la cantidad de folículos primordiales saludables, incrementa el número de folículos atrésicos, la separación de células de la granulosa, y el reinicio de la meiosis en ovocitos degenerados, incluso a bajos niveles de Pb en la sangre. Si bien la intoxicación por el Pb no causa esterilidad total, compromete la fertilidad femenina al impedir la foliculogénesis (Lefevre, 2001), así como el desarrollo de las células germinales durante la organogénesis en la vida fetal (Taupeau et al., 2001; Lefevre, 2001; Fortune, 2003; Shah et al., 2008). Aunado a esto, en experimentos posteriores con crías de ratas expuestas in utero al Pb (0.05, 0.1 y 0.15 ppm) hasta su nacimiento, se reportó dispersión de las células foliculares, destrucción del parénquima ovárico (Dumitrescu, Trif, Argherie & Romeo-Teodor, 2009), así como una reducción en la cantidad de folículos en crecimiento (Shirota et al., 2003). Posteriormente, Ma et al. (2020), confirmaron que los efectos deletéros del Pb sobre el sistema reproductor observados en otras especies, son similares a los encontrados en gallinas expuestas a distintas concentraciones (3.2, 33.2, 63.2 y 93.2 ppm). Estos fueron tangibles desde la concentración más baja, mostrando una correlación significativa entre el aumento de la concentración administrada con la acumulación del Pb en el ovario, el incremento en la muerte celular, así como con la disminución en las actividades CAT, SOD, GR y glutatión, (Ma et al., 2020).
Bruno-Nascimento, Ezequiel-Risso & Reis-Martinez (2016) expusieron a hembras de rata adultas a 2 ppm de Pb a través del alimento, así como a las crías desde su gestación hasta la adultez. En la primera generación, el Pb fue encontrado principalmente en los huesos, seguido por el hígado y el riñón, así como en la leche materna. En la segunda generación y conforme incrementó la edad, la concentración acumulada fue mayor en el tejido óseo, además de los ovarios, provocando infertilidad. Debido a que el Pb puede atravesar la barrera placentaria, los animales estuvieron expuestos desde el útero. Posterior al nacimiento, la exposición al Pb continuó a través de la leche materna, provocando efectos deletéreos a la salud reproductora de la descendencia. Los autores enfatizan esto, ya que evidencia las graves consecuencias que sufrirán las futuras generaciones (Bruno-Nascimento et al., 2016; Dursun et al., 2016).
Por otra parte, Canaz, Kilinc, Sayar, Kiran & Osyurek (2017), compararon las concentraciones del Pb y otros metales en distintos cultivos de muestras de tejido ovárico no neoplásico, de cáncer epitelial ovárico y de tumor epitelial limítrofe de distintas pacientes. Las concentraciones del Pb fueron 8 veces mayores en tejidos de tumores malignos y limítrofes (4.93 ppm) en comparación con los de ovarios saludables (0.62 ppm), existiendo una asociación entre la acumulación del metal con la proliferación celular en la superficie del epitelio cancerígeno, impidiendo a su vez la separación de las cromátidas hermanas durante la división celular (Rabanni-Chadegani, Abdosamadi, Fani. & Mohammadian, 2009), y provocando el aumento de los radicales libres que dañan directamente al DNA (Jomova & Valko, 2011). Esto último modifica y/o inactiva a las proteínas encargadas de la reparación de daños al material genético, lo que en las gónadas promoverá finalmente el desarrollo de procesos cancerígenos (Rabanni-Chadegani et al., 2009; Gadhia et al., 2012). Por esta razón los marcadores moleculares del estrés oxidante (SOD, CAT, Glut, entre otros) son una herramienta crucial al momento de identificar, dar seguimiento y encontrar soluciones a los daños ocasionados por la exposición al Pb (Ma et al., 2020).
Efectos a nivel molecular del Pb en los ovarios
El Pb interfiere en la regulación hormonal femenina a través de la generación excesiva de los radicales libres (Ahamed & Siddiqui, 2007), al provocar estrés oxidante que afecta a lípidos, proteínas y al DNA. Estas alteraciones pueden modificar la maduración folicular, así como el desarrollo de los órganos reproductores en etapas tempranas del desarrollo del embrión al interferir en los procesos de señalización hormonal (Dennery, 2004). De acuerdo con la ATSDR (2011), la exposición a concentraciones inferiores a los valores diarios tolerables o aceptables establecidos (ADI- Acceptable Dietary Intake por sus siglas en inglés) de metales tóxicos, podría afectar la salud reproductora de las mujeres. Debido a la gran variedad de los procesos llevados a cabo en el mantenimiento de la homeostasis en el ovario, los marcadores moleculares son herramientas confiables para evaluar los efectos adversos de la exposición al Pb.
La modificación de los factores que intervienen en la modulación de los niveles hormonales afecta de manera importante la homeostasis ovárica. Por ejemplo, al cultivar células ováricas humanas con acetato de Pb (10 μM), se observó una reducción del 65% de la enzima P450 aromatasa (clave para la síntesis del estradiol en células de la granulosa) y del 25% del receptor de estrógenos (Erβ) (Taupeau et al., 2003), así como una alteración en la interacción de los receptores de la FSH y la LH (Priya, Pillai & Gupta, 2004). Este fenómeno también se ha observado en la exposición materna de las ratas al Pb (1 mL de 1,200 ppm), con una reducción del 50% de la actividad de la proteína StAR (proteína reguladora aguda esteroidogénica, clave para la esteroidogénesis gonadal) que en el ovario de las crías se relacionó directamente con la disminución del estradiol (importante en los procesos de maduración folicular) (Srivastava et al., 2004), y también con la disminución en los niveles de la FSH y la LH en suero (Krieg, 2007). La señalización hormonal juega un papel importante en el mantenimiento de la salud reproductora, por lo que el daño causado sobre los tejidos no se limita al nivel estructural, sino que también compromete distintas vías metabólicas mediadas por las hormonas, esenciales para la correcta producción de los gametos femeninos (Nampoothiri & Gupta, 2005; Nampoothiri, Agarwal & Gupta, 2007).
Como se mencionó, el estado REDOX celular necesita ser regulado constantemente. Algunos de los elementos importantes para llevar esto a cabo son las proteínas reguladoras de la respuesta antioxidante (el factor de transcripción, Nrf2 o Factor 2 relacionado con el factor nuclear eritroide 2) y de la supervivencia celular (NFkβ, factor nuclear potenciador de la cadena ligera kappa de las células B activadas). Aglan et al. (2020) observaron una disminución significativa de éstas proteínas, independientemente de la concentración del Pb a la que los cultivos de células de la granulosa bovinas fueron expuestos (1, 2, 3, 5 y 10 ppm). Por otra parte, Ma et al. (2020) reportaron una correlación directa de la concentración del Pb con la muerte celular, así como con la inhibición de las enzimas SOD, GPx, CAT, GR y de la molécula del glutatión, que son importantes en el mantenimiento del estado REDOX ovárico. Lo anterior invariablemente comprometerá a la célula, por lo que la citotoxicidad, el estrés oxidante y la inhibición de las proteínas por la exposición al Pb no son efectos excluyentes entre sí, sino distintos resultados de las alteraciones inducidas por el metal.
La detección temprana de la alteración de la expresión de estos marcadores moleculares evidencia la vulnerabilidad de la homeostasis en las gónadas femeninas. Si bien estos trabajos no son tan frecuentes como aquellos enfocados en el análisis histológico, nos ayudan a entender el origen de las alteraciones que se traducirán en muerte celular y, por lo tanto, en patologías observadas en los estudios histológicos en los ovarios de organismos expuestos al Pb.
Efectos del Pb a nivel histológico en el ovario
Las características histológicas del ovario saludable son resultado del balance de distintos procesos metabólicos que mantienen las funciones y estructuras celulares en óptimas condiciones. Durante la etapa reproductora, los ovarios presentan cambios estructurales y funcionales de manera cíclica, como el crecimiento y la maduración folicular, la ovulación, la formación y la degeneración del cuerpo lúteo. El mantenimiento adecuado de las estructuras involucradas en estos procesos influirá directamente en la capacidad reproductora femenina (Sharma, Garu & Panwar, 2012a).
Junaid et al. (2010) evaluaron las características de los folículos presentes en el ovario de ratones adultos posterior a la exposición con distintas concentraciones de Pb (0, 2, 4 y 8 ppm). El grupo expuesto a la menor dosis mostró una reducción significativa en los folículos primarios y secundarios en comparación con el grupo control (o testigo), los grupos expuestos a una dosis más alta mostraron una mayor reducción. Los folículos terciarios sufrieron un daño significativo sólo en las mayores concentraciones, sin embargo, en todos se observó atresia folicular. Sharma, Qureshi, Mogra & Panwar (2012b) también reportaron atresia en ovarios de ratas hembra expuestas crónicamente al Pb (60 y 640 ppm). Al igual que Dhir & Dhand (2010) quienes observaron el mismo fenómeno, sin embargo, no lograron esclarecer si la reducción en la cantidad de folículos observada era el resultado del daño en la reserva de los folículos primarios o del efecto directo sobre los folículos secundarios y terciarios.
Siguiendo con esta línea de investigación, Panwar, Sharma, Mogra, Qureshi & Barber (2011) observaron que la administración de Pb (1 mL con 1200 ppm diario) a ratones hembra durante la gestación redujo la cantidad de folículos primordiales observables y alteró la estructura ovárica. La exposición durante la lactancia también dio lugar a la modificación de la estructura folicular, así como a la reducción en el número de folículos en desarrollo. Las crías sufrieron daños significativamente mayores en los ovarios en función del tiempo de exposición, entre ellos: reducción del número de folículos en distintos estadios, ovocitos dañados y en algunos casos completamente destruidos, además de una mayor cantidad de folículos atrésicos (Taupeau et al., 2001); así como la alteración total en la estructura de las células de la granulosa, y disminución de sus capas (Panwar et al., 2011).
De manera similar, Sharma et al. (2012a) trabajaron con ratones expuestos al acetato de plomo (PbA) (1 mL con 640 ppm diario a hembras gestantes) desde la gestación hasta los 21 días post destete. Los ovarios de las crías sacrificadas en etapas tempranas presentaron una menor cantidad de folículos primordiales, con estructura alterada, aumento de la atresia folicular, así como algunos folículos con el ovocito completamente destruido; estos parámetros se exacerbaron después de 21 días de exposición. Debido a que el Pb puede traspasar la barrera placentaria y afectar al tejido fetal, se infiere a partir de estos trabajos que la exposición al metal en etapas de vida temprana modifica a los precursores básicos gonadales, causando una drástica reducción de la fertilidad durante la edad adulta.
Como se mencionó anteriormente, las ERO tienen la capacidad de dañar los componentes histológicos mediante la modificación de proteínas importantes para el mantenimiento de las estructuras celulares (Agarwal et al., 2016). Sharma et al. (2012b) formaron grupos de ratones hembra expuestas al acetato de Pb (50 ppm) y a las vitaminas C, E o C+E, conocidas por actuar de manera sinérgica en el sistema AOX del organismo. El grupo tratado con Pb presentó daño evidente en los folículos y en el epitelio germinal. Las hembras expuestas y tratadas con vitaminas C y vitaminas C+E tuvieron una protección leve contra el efecto del Pb. En el grupo tratado sólo con vitamina E los ovarios estuvieron mejor protegidos. En este trabajo se demostró que el Pb afecta los folículos en desarrollo y maduros, aumentando la magnitud del daño en función del tiempo de exposición. Previamente, Bedaiwy & Falcone (2003) mencionaron que las ERO juegan un papel importante en la fisiología del eje hipotálamo-pituitario-gonadal, por tanto, el desbalance en estos niveles causará no sólo un daño histológico directo, sino que también se reflejará con modificaciones a nivel fisiológico.
Sharma & Bhattacharya (2014) encontraron que en los ratones hembra expuestas al acetato de Pb (0.5 ppm) durante la lactancia (21 días posteriores al nacimiento), hubo una reducción en el diámetro y la cantidad de folículos en la fase de crecimiento, así como un incremento de los folículos antrales atrésicos, con daño progresivo conforme avanzaban los días de exposición. Bires, Maracek, Bartko, Biresova & Weissova (1995), también habían observado estos efectos en recién nacidos, aunado a una reducción en el número de células germinales en las gónadas en desarrollo de ovejas expuestas al PbA, mientras que Sharma & Bhattacharya (2014) notaron además una deformación muy marcada del ovario en las hembras que consumieron leche materna contaminada. Finalmente, Taupeau et al. (2001) y Qureshi, Sharma & Mogra (2010), plantean que las alteraciones visibles no se deben sólo a la exposición incidental, sino que el Pb acumulado en el ovario podría provocar una disfunción de la foliculogénesis.
Se ha demostrado que el Pb es uno de los tóxicos de mayor importancia a nivel reproductor, ya que incluso a bajas concentraciones, afecta la estructura y las funciones gonadales, causando alteraciones en la fertilidad (Qureshi & Sharma, 2012). Dumitrescu et al. (2015) evaluaron la acumulación del Pb, así como la vulnerabilidad de las células ováricas, de las trompas de Falopio y del útero en hembras de rata Wistar maduras sexualmente expuestas a distintas concentraciones (0.05, 0.1 y 0.15 ppm). Las ratas expuestas mostraron un incremento significativo en la concentración corporal del Pb en relación directa con el nivel de exposición (hasta 396% más que el grupo control en la concentración más alta). Los niveles séricos de FSH, estradiol y progesterona disminuyeron, mientras que los de LH y testosterona se incrementaron, esto anteriormente comprobado por Dumitrescu, Cristina & Muselin (2014). En todos los grupos, los principales cambios en los ovarios fueron edemas difusos, necrosis y reducción en el tamaño de los folículos (Shah et al., 2008). Dumitrescu et al. (2015) coinciden con estudios previos en que los efectos pueden deberse a la acción sobre la unidad estructural hipotálamo-hipofisiario o a la alteración de la síntesis esteroidea en las células de la granulosa. Estos factores, junto a la modificación de los componentes celulares por el aumento en la cantidad de radicales libres y el consecuente estrés oxidante, afectan el crecimiento y la maduración de los óvulos (Agarwal et al., 2016; Balasch & Fabregues, 2006).
En un estudio realizado por Jasim-Sodani (2017), se evaluaron los efectos del Pb (0.3 ppm) sobre la salud reproductora de las hembras maduras de ratón durante 14 días. A pesar de que la cantidad de folículos no disminuyó significativamente, todos tenían ovocitos degradados, ovocitos con zona pelúcida no visible, degeneración en las células de la corona radiata y apoptosis masiva; las células de la granulosa se redujeron en número y se dispersaron, presentando picnosis nuclear. Los daños en los componentes celulares generan la muerte fisiológica del óvulo, provocando una infertilidad inmediata (Gupta, Singh, Singh & Reddy, 2010).
Los efectos del Pb sobre el ovario anteriormente citados son de gran relevancia en temas de salud pública. Se ha comprobado que los niveles de éste son significativamente mayores en mujeres infértiles (0.028 a 0.017 ppm) en comparación con mujeres fértiles (0.012 ppm) (Cerna, Krskova, Ceichanova & Snevackova, 2012; Hsiao-Ling et al., 2015) y, a pesar de encontrarse por debajo de los valores de referencia necesarios para considerarse un riesgo para la salud humana, las afecciones pueden ser a largo plazo (ATSDR, 2011). Los estudios abordados demuestran que la exposición ambiental al Pb sí provoca alteraciones en la fisiología e histología ovárica, así como en la capacidad reproductora en más de una generación de la población femenina.
Conclusiones
A través de los trabajos revisados se concluye que las gónadas femeninas cuentan con mecanismos de protección efectivos que resguardan de la pérdida de la homeostasis causada por la exposición al Pb durante períodos cortos, mientras que, de manera crónica aumenta el daño tanto estructural, como el de los procesos clave para mantener un ovario funcional y saludable. Este tipo de exposiciones, así como la liberación del Pb del sistema óseo durante la gestación y la lactancia, plantean un riesgo latente, ya que en algunas ocasiones no es fácilmente detectable. Aunado a la probabilidad de sufrir abortos, el bajo peso al nacer y las alteraciones en el desarrollo neurológico, además del daño a los componentes celulares del ovario causado por el Pb afectará negativamente a la descendencia.
La totalidad de los mecanismos involucrados en el daño a las gónadas por exposición al Pb es aún desconocida. El hecho de que su valencia química sea similar a la del Calcio y la del Zinc, así como su interacción con los grupos sulfhidrilo de distintas enzimas, confiere al Pb diversas vías por las que afecta a los ovarios. Debido a que el balance entre las ERO y los AOX es vital para la maduración folicular, el desarrollo de los órganos reproductores en etapas tempranas del embrión, así como para mantener la calidad del material genético heredado, los trabajos revisados sugieren que el desbalance en el estado REDOX provocado por el Pb es una de las vías principales por las que ejerce sus efectos sobre la histoarquitectura ovárica, así como en los procesos fisiológicos relacionados al desarrollo y maduración folicular.
Las concentraciones del Pb empleadas en los trabajos experimentales suelen ser mucho mayores que aquellas observadas en la vida real, dado que se han enfocado principalmente en explicar los mecanismos de daño causados por el Pb, más que en simular un escenario real, que haría difícil el estudio de estos mecanismos de daño en períodos cortos a bajas concentraciones tomando en cuenta la vida media de los modelos empleados. Los estudios in vitro han ayudado a comprender el modo en que las vías de señalización son afectadas durante la exposición al Pb, y cómo ésto se evidencia a través de las alteraciones a nivel celular e histológico.
En más de una ocasión se ha demostrado que tanto las dosis como la respuesta de los estudios in vitro difieren de los estudios in vivo, en que el efecto se da en función de una respuesta sistémica. Aunado a esto, las concentraciones no siempre serán las mismas en la vida real. A pesar de estas limitantes, la posibilidad de realizar trabajos interdisciplinarios, así como revisiones más exhaustivas, podrá complementar el conocimiento que se tiene hasta ahora, mejorando la comprensión de los mecanismos de acción del Pb en el ovario, así como del riesgo que representa para la salud reproductora de la población femenina.











 nova página do texto(beta)
nova página do texto(beta)


