Introducción
Los esfingolípidos son componentes esenciales de la estructura y función de las membranas de las células eucariotas. Su metabolismo permite la formación de lípidos polares como la esfingosina1-fosfato (S1P) (Saba & Hla, 2004). En los vertebrados la S1P se encuentra en el ambiente extracelular y se une a receptores acoplados a proteínas G (GPCRs, por sus siglas en inglés) que regulan una gran variedad de respuestas celulares como la migración, diferenciación y sobrevivencia celular, angiogénesis, cardiogénesis, desarrollo de extremidades, formación del sistema linfático y nervioso, entre otras funciones (Gaengel et al., 2012; Kupperman, Osborne, Waldron & Stainier, 2000; Chae, Paik, Allende, Proia & Hla, 2004; Mizugishi et al., 2005).
Metabolismo de los esfingolípidos
Los esfingolípidos están formados por una base de cadena larga (conteniendo una doble ligadura (posición Δ12), un alcohol secundario (posición 3), un grupo amino (posición 2) y un alcohol primario, un ácido graso de longitud variable unido al grupo amino que está anclado al carbono 2 de la cadena base y diversas cabezas polares unidas al hidroxilo del carbono 1 (Figura 1). En el caso de la esfingomielina, su grupo hidrofílico es la fosfocolina. El ácido graso de 2-28 carbonos unido a la esfingosina forman la ceramida (Futerman & Hannun, 2004).

Elaboración personal.
Figura 1 A) Síntesis de S1P. La ceramida es el centro del metabolismo de la S1P. La síntesis de novo es a partir de la condensación de una serina y un palmitoil CoA por la serinpalmitoiltransferasa (SPT) que produce la esfinganina que es acilada por la ceramida sintasa (CerS) generando dihidroceramida que es desaturada para biosintetizar ceramida. La ceramida es desacilada y se obtiene esfingosina que es fosforilada por la esfingosina cinasa (SphK) para producir S1P. B) Estructura de la esfingomielina. La esfingomielina está constituida por una ceramida formada por la esfingosina como base de cadena larga y un ácido de longitud variable. La fosfocolina se considera la cabeza polar.
La producción de esfingolípidos es compleja (Figura 1). La ceramida es la base estructural de los esfingolípidos y puede ser obtenida a partir de la esfingomielina por hidrólisis a través de la esfingomielinasa, que genera ceramida y fosfocolina (Obinata & Hla, 2012). Los sustratos iniciales para la síntesis de novo de la ceramida son una molécula de serina y otra de palmitoil-coenzima A que se condensan por la catálisis de la serinpalmitoil transferasa formando una molécula de esfinganina. Posteriormente la ceramida sintasa promueve la N-acilación de la esfinganina para generar dihidroceramida que es desaturada por la dihidroceramida desaturasa, biosintetizando la ceramida. Para obtener la esfingosina, la ceramida se somete a una desacilación catalizada por la ceramidasa. La esfingosina se fosforila por la esfingosina cinasa para formar S1P y posteriormente es degradada irreversiblemente por la S1P liasa que genera etanolamina fosfato y hexadecenal. Además, la S1P puede ser desfosforilada por fosfatasas de esfingosina (SPP) y obtener esfingosina (Hla, Venkataram & Michaud, 2008) (Figura 1).
Señalización activada por la unión de la S1P a GPCRs
Dentro del enorme grupo de los GPCRs, hay un grupo especializado en reconocer a los lisofosfolípidos en el que se encuentran incluidos los diversos receptores para el ácido lisofosfatídico, la S1P, el lisofosfatidilinositol y la lisofosfatidilserina (Kihara, Mizuno & Chun, 2015). Se han identificado cinco subtipos de GPCRs que se unen específicamente a la S1P y se han denominado; S1P1, S1P2, S1P3, S1P4 y S1P5 (Chun, Hla, Lynch, Spiegel & Mololenaar, 2010). Los receptores S1P1-5 activan diferentes vías de señalización dependiendo del subtipo de proteína G con que se acoplen. La vía de transducción de señales acoplada a Gq está involucrada en la hidrólisis del fosfatidilinositol 4, 5,-bifosfato, la generación del inositol 1,4,5-trifosfato y el diacilglicerol, con un aumento de la concentración de Ca2+ intracelular. Los receptores acoplados a G12/13 activan a la GTPasa monomérica Rho que está involucrada en la regulación del citoesqueleto y la movilidad celular (Lepley, Ji-Hye, Timothy & Fernando, 2005). Los receptores acoplados a Gi activan vías de señalización involucradas en la inhibición de la adenilato cilasa, conduciendo a la proliferación y sobrevivencia celular al regular también las vías de PI3K/Akt y Ras/ERK (Takuwa, Okamoto, Yoshioka & Takuwa, 2008). La S1P también puede regular las respuestas transcripcionales de la señalización por Hippo (Yu et al., 2012) y las desacetilasas de histonas (Hait et al., 2009). Es importante señalar que algunos de los receptores de la S1P pueden acoplarse a más de un tipo de proteína G. En el caso de los receptores S1P1 el acoplamiento principal tiene lugar vía la proteína Gi (Figura 2) (Kihara et al., 2015). Los receptores de S1P están implicados en muchos procesos fisiopatológicos como el cáncer, alteraciones en la homeostasis del sistema nervioso y el progreso degenerativo de la esclerosis múltiple (Brinkmann, 2007). La caracterización de los ratones con bloqueó de la expresión (“knockout (-/-)) de los diferentes GPCRs ha proporcionado una visión muy amplia de la importancia fisiológica de los receptores de la S1P. Los ratones en que se impide la expresión del receptor S1P1 presentan defectos letales durante su desarrollo en el útero, debido a lo cual se considera un gen esencial para el desarrollo embrionario (Liu et al., 2000). El bloqueo de la expresión del receptor S1P2 favorece la presencia de ataques epilépticos (MacLennan et al., 2001) y también sordera en los animales afectados (Kono et al., 2007). Los ratones con bloqueo en la expresión del receptor S1P3 no presentan un fenotipo obvio (Ishii et al., 2001), sin embargo, el triple “knockout” de S1P1-3 permitió evidenciar el importante papel de estos receptores, en el desarrollo y función del sistema vascular durante la embriogénesis (Kono et al., 2004). El receptor S1P4 se expresa en el sistema hematopoyético y en las arterias pulmonares. Se sabe que participa en la maduración de los megacariocitos y se ha observado que el ratón “knockout” para este receptor presenta problemas para generar plaquetas en algunas condiciones experimentales y alteraciones en los procesos inflamatorios (Golfier et al., 2010). Los ratones “knockout” para el receptor S1P5 presentan una disminución en el número de células NK en la circulación; y en el sistema nervioso central el receptor S1P5 se expresa solamente en los oligodendrocitos, varía durante el desarrollo y parece participar en la retracción y sobrevivencia de estas células (Jaillard et al., 2005).

Elaboración personal.
Figura 2 Patrones de señalización activados por las diferentes proteínas G. El principal efector de la señalización de Gαs es la Adenilato Ciclasa (AC). Para Gαq es la activación de la fosfolipasa C (PLC) que genera diacilglicerol (DAG) el cual activa a la PKC e IP3 que promueve la apertura de canales dependientes de IP3 liberando calcio. Mientras que las proteínas Gα12/13 activan a Rho y Rac. La proteína Gαi inhibe a la AC a través de la subunidad α.
Regulación de la función y localización de los GPCRs
Después de ser activado un GPCR se presentan diferentes mecanismos que regulan los procesos de señalización, como la desensibilización y la resensibilización. La desensibilización es la atenuación o desaparición con el tiempo de la respuesta del GPCR al agonista (Hausdorff, Caron & Lefkowitz, 1990). Existe un proceso de desensibilización rápida, que se debe a la fosforilación del GPCR provocada por la activación del mismo (desensibilización homóloga) y otra provocada por la activación de receptores diferentes (desensibilización heteróloga) (Kelly, Bailey & Henderson, 2008). La desensibilización homóloga está asociada a la fosforilación del receptor ocupado por el agonista y por las cinasas de receptores acoplados a proteínas G (GRKs, por sus siglas en inglés); la fosforilación ocurre en residuos de aminoácidos de serina (S) y treonina (T) de la tercera asa intracelular y del carboxilo terminal (Lohse, Benovic, Codina, Charon & Lefkowitz,1990). En la desensibilización heteróloga se involucran cinasas dependientes de segundos mensajeros (por ejemplo, las proteínas cinasas A (PKA) y C (PKC)) que pueden ser activadas por estímulos producidos por diversos ligandos sobre otros receptores (Benovic et al., 1985). La fosforilación de los GPCRs por algunas de las cinasas facilita el reclutamiento y la unión de las β-arrestinas y del complejo de clatrinas-AP2, permitiendo que los GPCRs se encuentren en las vesículas cubiertas de clatrina. Posteriormente, los GPCRs incluidos en estas vesículas son internalizados en la célula donde pueden sufrir procesos como la degradación en los lisosomas (regulación a la baja) o reciclamiento a la membrana plasmática y recuperación de su función (resensibilización) (Voet & Voet, 2006).
El receptor de la esfingosina-1-fosfato tipo 1 (S1P1)
El receptor S1P1 fue descubierto en 1990 por Timothy Hla, al caracterizar un receptor huérfano que se expresaba cuando se inducía la diferenciación endotelial con forbol miristato acetato, por esta razón se le denominó Gen de Diferenciación Endotelial 1 (EDG-1, por sus siglas en inglés), Hla & Maciag,1990. Sin embargo, se desconocía el ligando que lo activaba fisiológicamente permaneciendo como receptor huérfano; después adquirió el nombre de S1P1 al descubrirse que su ligando natural es la S1P (Watterson et al., 2001). El receptor de S1P1 humano es un GPCR y tiene un tamaño de 380 residuos de aminoácidos, de los cuales 46 corresponden al extremo amino terminal y 68 al carboxilo terminal (Figura 3), presenta 7 dominios hidrofóbicos compuestos por 20-26 aminoácidos y 8 dominios hidrofílicos compuestos por 7-33 aminoácidos. Actualmente el estudio del receptor de S1P1 se encuentra enfocado en la función de diferentes modificaciones postraduccionales que regulan su función y señalización. El receptor de S1P1 ha sido ampliamente estudiado, se conoce su estructura cristalográfica (Hanson et al., 2012) y la importancia de algunos residuos de aminoácidos en las diferentes regiones del receptor. En el amino terminal encontramos los residuos de asparagina (N30 y N36) que son sustratos de N-glucosilación y las tirosinas (Y19 y Y22) que presentan sulfatación, involucradas en la afinidad por el ligando (Figura 3) (Fieger, Huang, Van Brocklyn & Goetzl, 2005). El carboxilo terminal presenta las cisteínas (C328, C329 y C331) que son susceptibles a la palmitoilación, una modificación postraduccional importante para el anclaje de las proteínas a la membrana plasmática (Figura 3) (Ohno et al., 2009); en lo que se refiere a los residuos de lisina (K330, K339, K341 y K354) son susceptibles a la poliubiquitinación en presencia de FTY720-P, un agonista sintético del receptor S1P1 utilizado como tratamiento en la esclerosis múltiple y los residuos de serina (S351, S352 y S355) que son también fosforilados en presencia de FTY720-P (Figura 3) (Oo et al., 2007); la tirosina (Y143) también se fosforila en presencia de la S1P y es necesaria para la internalización del receptor (Chavez et al., 2015); la treonina (T236) se fosforila por la proteína cinasa PKB/Akt regulando la activación de la proteína G pequeña, Rac, que está involucrada en procesos como la quimiotaxis y la angiogénesis (Figura 3) (Lee et al., 2001; Spiegel & Milstein, 2002); por último, los residuos de treonina (T371) y serina (S374 y S375) son fosforilados por GRK2 y regulan el tráfico de linfocitos al torrente sanguíneo (Arnon et al., 2011) (Figura 3).

Elaboración personal.
Figura 3 Esquema del receptor de S1P1. Se representan las modificaciones postraduccionales reportadas para el receptor de S1P1. El circulo azul ejemplifica la sulfatación, amarillo la N-glucosilación, gris la palmitoilación, naranja la ubiquitinación y verde la fosforilación.
Tráfico vesicular de GPCRs
Como se mencionó anteriormente, después de ser activado un GPCR se presentan diferentes mecanismos que regulan los procesos de desensibilización y resensibilización. Posterior a la fosforilación del GPCR se reclutan las β-arrestinas y el complejo de clatrinas-AP2 permitiendo que el GPCR se encuentre en las vesículas cubiertas de clatrina y favorecer la endocitosis. La endocitosis se caracteriza por el transporte vesicular del GPCR, el acoplamiento y fusión con la membrana destino (Rodman & Wandinger-Ness, 2000). La especificidad en la dirección del endosoma está regulado por las proteínas Rab. Las proteínas Rab son GTPasas que regulan el transporte vesicular en la endocitosis y en la exocitosis. Se han identificado aproximadamente 60 proteínas Rab en humanos, pero sólo se conoce la función de algunas de ellas (Zeng et al., 1999). De las 60 proteínas Rab, se ha reportado que la proteína Rab5 es fundamental en el direccionamiento de los GPCRs en el tráfico vesicular dirigido a los endosomas tempranos para su reciclamiento rápido hacia la membrana plasmática, además Rab5 es considerada un regulador esencial debido a que controla la formación de vesículas cubiertas de clatrina (Zhu et al., 2004) (Figura 4). La proteína Rab9 dirige a las vesículas a endosomas tardíos, reciclaje lento y el transporte hacia el aparato de Golgi (Kloer et al., 2010). Rab7 también se encuentra en los endosomas tardíos y dirige la carga a la degradación por los lisosomas (Schwartz, Canhong, Olena, Alexey & Wandinger-Ness, 2007) (Figura 4). Actualmente, se propone que las proteínas Rab se agrupan en dominios de membrana definidos. Estudios de localización por microscopía sugieren que las proteínas Rab5, Rab4 y Rab11 pueden estar localizadas en el mismo endosoma (Roberts et al., 1999). Se pueden distinguir tres poblaciones principales de endosomas que contienen: la primera principalmente Rab5, la segunda Rab5 y Rab4 y la tercera Rab4 y Rab11. Son tres las poblaciones de proteínas Rab: las dos primeras corresponden a endosomas tempranos y la tercera a endosomas de reciclaje. Por lo tanto, los endosomas pueden verse como un mosaico con diferentes proteínas Rab y aunque interaccionan dinámicamente, mantienen una relativa distribución estable en el tiempo (van der Sluijs,1992) (Figura 4).

Elaboración personal.
Figura 4 Mapa de localización intracelular de diferentes GTPasas Rab. Las flechas indican la dirección del transporte entre los compartimientos celulares. Rab5 controla la formación de las vesículas cubiertas de clatrina, la endocitosis y la fusión de vesículas con endosomas tempranos. Rab4 y Rab11 se encuentran en endosomas de reciclaje y Rab9 y Rab7 se localizan en endosomas tardíos.
Actualmente estudiar el tráfico vesicular de los GPCRs activándolos con diferentes ligandos es importante para conocer sus similitudes y diferencias en la asociación con las proteínas Rab y su destino celular. Para el receptor de S1P1 se sabe que la S1P, el forbol miristato acetato (un activador directo de la proteína cinasa C) y el agonista sintético, FTY720-P, inducen una cinética de fosforilación diferencial del receptor S1P1, la S1P induce una fosforilación más intensa en comparación con FTY720-P y el forbol miristato acetato provoca una fosforilación mayor respecto a la S1P y el FTY720-P (Martínez-Morales, Romero-Ávila, Reyes-Cruz & García-Sáinz, 2018). Se conoce que las isoformas clásicas de PKC α y β son las que regulan la fosforilación del receptor al utilizar forbol miristato acetato y la GRK2 al utilizar S1P y FTY720-P (Morquecho-León, BazúaValenti, Romero-Ávila & García-Sáinz, 2013; Martínez-Morales et al., 2018). Se observó que cuando el receptor S1P1 se activa con S1P o forbol miristato acetato, el receptor interacciona con proteínas presentes en los endosomas tempranos, como Rab5 y con marcadores de endosomas tardíos, como Rab9, pero no con Rab7. Al activar el receptor con FTY720-P, el receptor interacciona con Rab5 y con marcadores de los endosomas tardíos, como Rab7, pero no con Rab9 (Martínez-Morales et al., 2018). Diversos estudios sugieren que la regulación de los GPCRs se lleva a cabo a través de un patrón diferencial de fosforilación; a ésto se le ha denominado como “códigos de fosforilación” que determinan la función, la cascada de señalización y el tráfico vesicular del GPCR (Tobin, Butcher & Choi, 2008). Diversos códigos de fosforilación pueden presentarse en un GPCR al activarse con diferentes tipos de agonistas: parciales, inversos, sesgados y antagonistas (Rajagopal & Lefkowitz, 2010). Como se mencionó anteriormente se han reportado algunos residuos de aminoácidos fosforilados por la S1P y FTY720-P en el S1P1. En presencia de S1P la proteína Akt/PKB fosforila el residuo T236 ubicado en la tercera asa intracelular (Lee et al., 2001). La deleción de los últimos 32 residuos de aminoácidos del COOH terminal elimina la fosforilación del receptor S1P1 por la S1P y la deleción de los últimos 12 residuos de COOH terminal afectan la fosforilación por S1P (Wattherson et al., 2001). La expresión de una mutante del receptor S1P1 en la que se realizó la sustitución de una región rica en residuos de serina (351-359) por residuos de alanina afectó la fosforilación del receptor inducida por el FTY720-P (Arnon et al., 2011). Como se puede notar, se conocen algunos residuos de aminoácidos del receptor de S1P1 que se fosforilan por la S1P o el FTY720-P, ya que cada ligando fosforila de manera diferencial y es posible que este código de fosforilación regule el tráfico vesicular del receptor S1P1.
El receptor de S1P1 y la esclerosis múltiple
La esclerosis múltiple (EM) es una enfermedad autoinmune del sistema nervioso central y se caracteriza por una inflamación que provoca astrogliosis, desmielinización y pérdida de oligodendrocitos y neuronas (Compston & Coles, 2002). Se ha reportado que los receptores de S1P se expresan en diversas células del sistema nervioso central (SNC) como los oligodendrocitos, astrocitos y células de la microglía. Los resultados de varios estudios sugieren que la señalización de la S1P en el SNC se altera en la EM, los niveles de S1P son más altos en los pacientes con EM que en sujetos sanos (Quin, Berdyshev, Goya, Natarajan & Dawson, 2010) y los astrocitos reactivados sobre-expresan a los receptores S1P1 y S1P3 (Van Doorn et al., 2010). Adicionalmente, en condiciones proinflamatorias los astrocitos están activados y regulados positivamente por el S1P3 y la cinasa de la esfingosina (SPHK) (Dong-Seon et al., 2011). Por otra parte, las células dendríticas presentan antígenos y regulan la diferenciación de los linfocitos T en los ganglios linfáticos. La naturaleza del antígeno, las señales estimuladoras y las citoquinas en los ganglios linfáticos provocan la diferenciación de las células T no comprometidas a linfocitos T ayudadores 1, 2 y 17 y de los linfocitos T citotóxicos (Comabella, Montalban, Munz & Lunemann, 2010). Estás células del sistema inmune entran al torrente sanguíneo, penetran la barrera hematoencefálica e invaden el SNC, se reactivan y expanden clonalmente. La presencia de linfocitos T ayudadores 1 y 17, linfocitos T citotóxicos y células B en el SNC junto con los astrocitos y microglía anormalmente activados, conducen a un aumento de la producción de citoquinas inflamatorias, especies reactivas de oxígeno, producción de anticuerpos y la citotoxicidad directa, que están involucrados en la desmielinización, y del daño axonal y neuronal presente en los pacientes con EM (Brinkmann, 2007) (Figura 5).
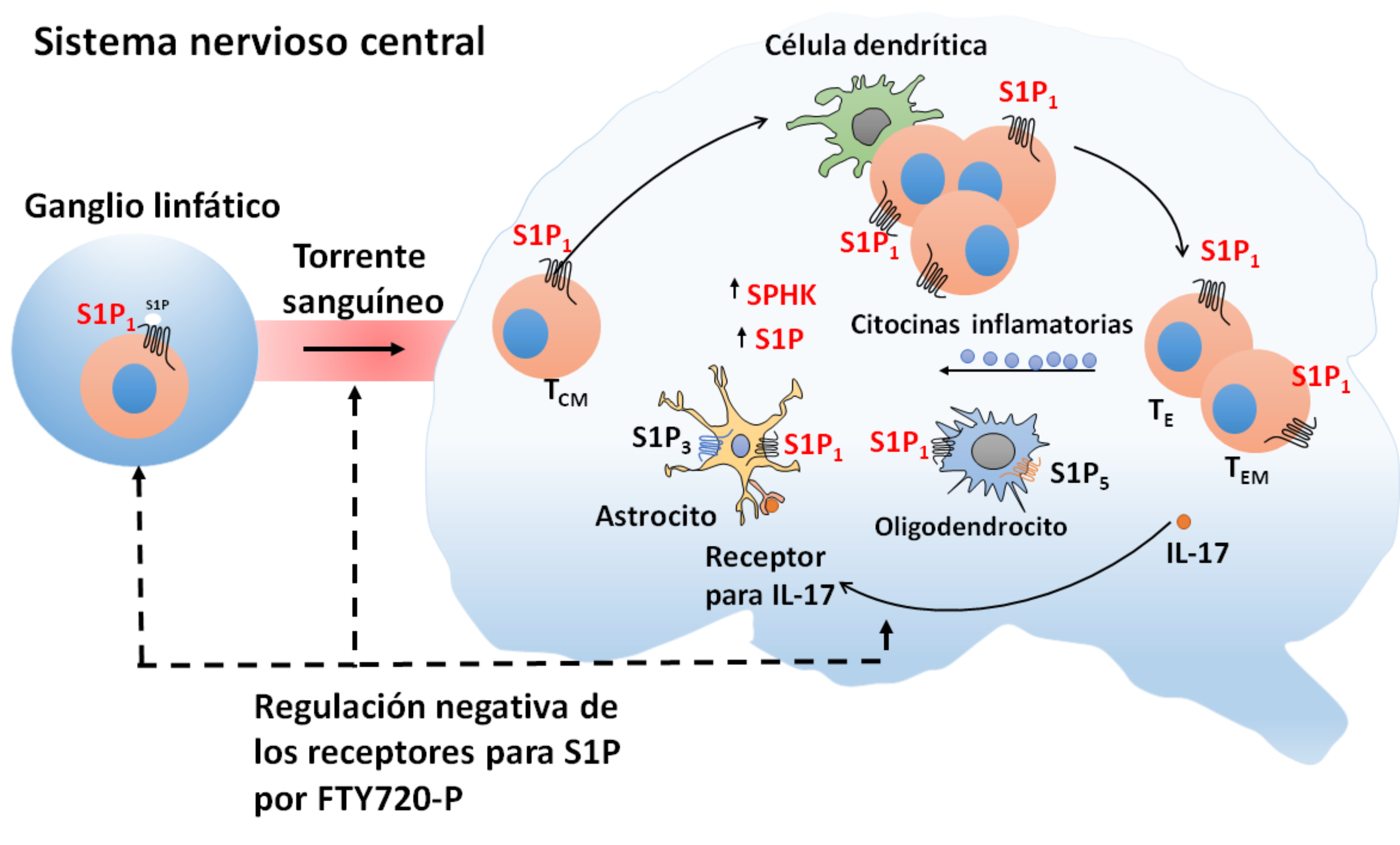
Elaboración personal.
Figura 5 Modelo propuesto para el papel del receptor de S1P1 en la esclerosis múltiple. Los linfocitos T de memoria central (TCM), salen del nodo linfático hacia el torrente sanguíneo por la expresión del S1P1 y atraviesan la barrera hematoencefálica invadiendo el sistema nervioso central (SNC). En el SNC, las TCM se reactivan por células presentadoras de antígeno como las células dendríticas causando proliferación y diferenciación local de células T efectoras (TE) y células efectoras de la memoria (TEM). Las células TE activan a los astrocitos por la interleucina 17 (IL-17) y activan a las Sphk´s aumentando la producción de la S1P favoreciendo la neuroinflamación y gliosis.
Como se mencionó anteriormente el receptor de S1P1 está distribuido en células del sistema nervioso y se ha propuesto que los linfocitos T de memoria central, salen del nodo linfático hacia el torrente sanguíneo por la expresión del receptor de S1P1 y penetran la barrera hematoencefálica invadiendo el SNC (Matloubian et al., 2004). En el SNC, las células T de memoria se reactivan por el antígeno presentado en la microglía y por las células dendríticas causando proliferación y diferenciación local de células T efectoras (Kivisakk et al., 2004). Las células T efectoras activan a los astrocitos por la interleucina-17 (IL-17) (Kang et al., 2010), destruyen células neuronales y secretan citocinas inflamatorias que activan a las esfingosinas cinasas (Chalfant & Spiegel, 2005), lo que genera un incremento en la producción de S1P y aumentan la neuroinflamación y el desarrollo de gliosis (Nayak et al., 2010). El FTY720 (Novartis, Basel, Switzerland) es un modulador de los receptores de S1P, fue la primera droga oral usada en el tratamiento de la EM, y fue aprobada por la Food and Drug Administration de los EEU en 2010 (Brinkmann, 2007) y poco después en nuestro país. In vivo, el FTY720 es una pro-droga, ya que tiene que ser fosforilada por la esfingosina cinasa 2 (Brinkmann et al., 2002) para generar el FTY720-P que es el agente biológicamente activo (Albert et al., 2005). Se considera que el FTY720-P representa un análogo estructural de la S1P y se une a los receptores de S1P1-5, excepto al S1P2 (Brinkmann et al., 2002). Aunque el FTY720-P es un agonista del receptor S1P1, también se le considera un antagonista funcional por causar ubiquitinación y degradación del receptor (Oo et al., 2007). En otras palabras, conduce a mediano y largo plazo a una falta de respuesta a la S1P por disminución en la disponibilidad de receptores en la membrana de las células. La modulación del receptor de S1P1 por el FTY720-P conduce a la retención de las células T de memoria en los nodos linfáticos y previene su invasión al SNC, su expansión clonal y diferenciación en células T de memoria y efectoras (Figura 5) (Fujino, 2003), disminuye el daño al SNC, a la desmielinización (Gasperini & Ruggieri, 2012) y a la activación de los astrocitos (Chun & Hartung, 2010) (Figura 5).
Resumiendo lo anteriormente expuesto, la S1P a través, principalmente, del receptor S1P1 regula la salida de las células del sistema inmune de los nódulos a la sangre y hacia puntos donde existe un proceso inflamatorio. El FTY720-P, es un agonista también como la S1P, pero ejerce una acción muy intensa sobre la internalización del receptor S1P1 conduciéndolo a la degradación. Es decir, es un “agonista sesgado” que reduce la disponibilidad de receptores en las células, comportándose a largo y mediano plazo como un antagonista funcional. Un efecto similar parece existir en los astrocitos, lo que significa un cambio importante en la farmacología moderna (Kenakin, 2019).
Análogos estructurales de la S1P
La mayoría de las drogas sintéticas están diseñadas para ser específicas con el receptor de S1P1 debido a que tiene una gran importancia biomédica. El fármaco que ha tenido mayor éxito es el FTY720 que fue desarrollado por la compañía farmacéutica Novartis como tratamiento para la EM. El FTY720 fue descubierto en 1992, es un derivado de la miriocina encontrado en el hongo Isaria sinclairii; el FTY720 actúa como inmunosupresor iniciando la internalización del receptor S1P1 y su posterior degradación (Oo et al., 2007; Brinkmann et al., 2002; Brinkmann et al., 2007). Desafortunadamente el FTY720 muestra varios efectos secundarios como bradicardia, dolor de cabeza, fatiga, diarrea y náuseas (Sanna et al., 2004; Fryer et al., 2012). La biodisponibilidad del FTY720-P depende de la fosforilación in vivo del FTY720 por la esfingosina cinasa 2 y la pérdida de este grupo fosfato por la fosfatasa SPP1-2 (Billich et al., 2003). Para superar ésto en 2009, se desarrollaron dos análogos del FTY720 que incorporan un fosfonato o un grupo vinil fosfato, ambos no hidrolizables (Fryer et al., 2012). Además, el FTY720 se encuentra actualmente en ensayos clínicos para el trasplante de riñón y para la esclerosis lateral amiotrófica (Rousselle et al., 2020; Berry et al., 2017).
A continuación se menciona una breve descripción de otros análogos estructurales de la S1P que se encuentran en ensayos clínicos o han sido aprobados por la Administración de Drogas de los EEUU. El Amiselimod (MT-1303) es un agonista selectivo para el S1P1, desarrollado por Biogen y está en evaluación clínica para el tratamiento de la psoriasis y la EM (https://clinicaltrials.gov/ct2/show/NCT01742052?term=MT-1303&rank=5). Se ha observado que tiene un bajo riesgo para el desarrollo de bradicardia (Xu, Gray & Henderson, 2014).
Siponimod (BAF-312, Mayzent®) elaborado por Novartis, es un agonista para los receptores S1P1 y S1P5 (Pan et al., 2013). El Siponimod causa la internalización del receptor de S1P1, reflejando una disminución de linfocitos T y linfocitos B (Gergely et al., 2012). Se ha reportado que este compuesto suprime totalmente las encefalopatías autoinmunes en modelos de rata, además de inhibir la desmielinización por lisolecitina en astrocitos y microglía (Gergely et al., 2012; O´Sullivan, Schubart, Mir & Dev, 2016; Legangneux, Gardin & Johns, 2013).
Ozanimod (RPC 1063, Zeposia®) es un agonista selectivo para los receptores S1P1 y S1P5 desarrollado por Celgene. El Ozanimod reduce los niveles de linfocitos, disminuye marcadores inflamatorios en encefalomielitis autoinmune, con evaluación clínica para la EM y la inflamación del intestino (Scott, Clemons & Brooks, 2016). Este compuesto no requiere de una fosforilación para unirse al S1P1 y puede atravesar la barrera hematoencefálica favoreciendo su acción en el SNC (Scott et al., 2016).
KRP 203 es un agonista selectivo para los receptores de S1P1 y S1P4. Se ha observado que beneficia en un 10-20% los aloinjertos de piel y no se presenta rechazo en los trasplantes de corazón en roedores, al compararlo con el tratamiento con FTY720, debido a que disminuye la ateroesclerosis y fibrosis del miocardio en trasplantes (Shimizu et al., 2005; Forbes, Cernacek, Zheng, Gomersall & Guttman, 1996; Potì et al., 2013).
Etrasimod (APD-334) es un agonista selectivo para el receptor S1P1 (Buzard et al., 2014). El Etrasimod es una molécula de nueva generación desarrollada para el tratamiento de desórdenes inflamatorios como la colitis ulcerosa al disminuir la concentración de linfocitos T en el plasma (Al-Shamma et al., 2019). Ponesimod (ACT-128800) es un agonista para el receptor S1P1 y agonista parcial para el S1P4 y S1P5 (Bolli et al., 2010) este compuesto no requiere de una fosforilación para unirse al S1P1 y disminuye el egreso de los linfocitos T de los nódulos linfáticos. Una diferencia importante del Ponesimod, respecto al FTY720, es la rápida recuperación de la linfopenia después de 36 horas de interrumpir el tratamiento (D’Ambrossio, Freedman & Prinz, 2016). Actualmente se encuentra en desarrollo clínico para tratar a la EM (Wingerchuk & Weinshenker, 2016).
Es importante mencionar que todos estos compuestos deben ser utilizados con una vigilancia médica muy frecuente, por los efectos generales sobre el sistema inmune y por los efectos indeseables en otros órganos, con el fin de notificarlos a las autoridades de Salud en los países donde son empleados. Es importante mencionar la aportación de la investigación básica al conocimiento de los procesos que ocurren en el organismo y con posibles aplicaciones terapéuticas. Finalmente destacamos el desarrollo que los conceptos farmacodinámicos están evolucionando y ello obliga a la revisión frecuente de la Farmacología fundamental.











 nueva página del texto (beta)
nueva página del texto (beta)


