Introducción
La microbiología es una de las áreas más importantes de las ciencias naturales al permitir conocer a los microorganismos y sus funciones en el balance ecológico terrestre, especialmente de los que forman asociaciones entre ellos y con la mayor parte de los macroorganismos. La genómica, proteómica y metabolómica, junto con los métodos bioquímicos y microbiológicos clásicos, posibilitan un mejor estudio de las complejas redes e interacciones de los microorganismos con su ambiente (Maldonado-Carmona et al., 2019; He et al., 2020). Algunos de estos microorganismos son algas, bacterias y hongos endófitos (Suryanarayanan, 2013).
La etimología de la palabra endófito se deriva del griego endon (dentro) y phyton (planta) y se refiere a microbiomas que se alojan en el tejido interno de una planta (raíz, flor, tallo, frutos o semillas) por transmisión vertical (hacia la descendencia) u horizontal (no es por la descendencia del huésped), y que establecen una variedad de interacciones biológicas con su fitohospedero según el estado fisiológico de la planta, ya sea por factores ambientales (temperatura, pH, disponibilidad de nutrimentos) o la etapa de desarrollo de ambos; se les encuentra como patógenos latentes, mutualistas, comensales, residentes temporales o saprófitos latentes (Davis & Shaw, 2008; Suryanarayanan, 2013; Yadav, 2021). Debido al avance en los estudios moleculares, se han secuenciado una gran cantidad de endófitos que no se han podido cultivar ni aislar (Conn & Franco, 2004; Pereira, Ibáñez, Rosenblueth, Etcheverry & Martínez-Romero, 2011), por lo que se ha propuesto una definición más apropiada: los endófitos son un conjunto de genomas microbianos ubicados dentro de los órganos de las plantas (Bulgarelli et al., 2012).
Al establecerse la relación entre los simbiontes (endófito y planta), ambos organismos producen metabolitos secundarios potencialmente tóxicos. Los endófitos pueden producir factores de virulencia, como exoenzimas y metabolitos fitotóxicos, y la planta puede generar defensas mecánicas y/o bioquímicas contra estos factores. Para que los simbiontes puedan coexistir se establece un antagonismo balanceado, el cual depende de la virulencia del endófito y de las variadas defensas de la planta. Estas defensas son influenciadas por factores ambientales y del desarrollo de ambos organismos. Se establece una relación endofítica si los factores de virulencia del microorganismo y las defensas de la planta están en equilibrio; pero si el hospedero presenta senescencia o se encuentra bajo estrés, el microorganismo se expresa como patógeno y en la planta se notan síntomas de enfermedad. Todas estas interacciones se explican en la Figura 1 (Schulz & Boyle, 2006; Kusari, Hertweck & Spiteller, 2012; Sánchez-Fernández et al., 2013).
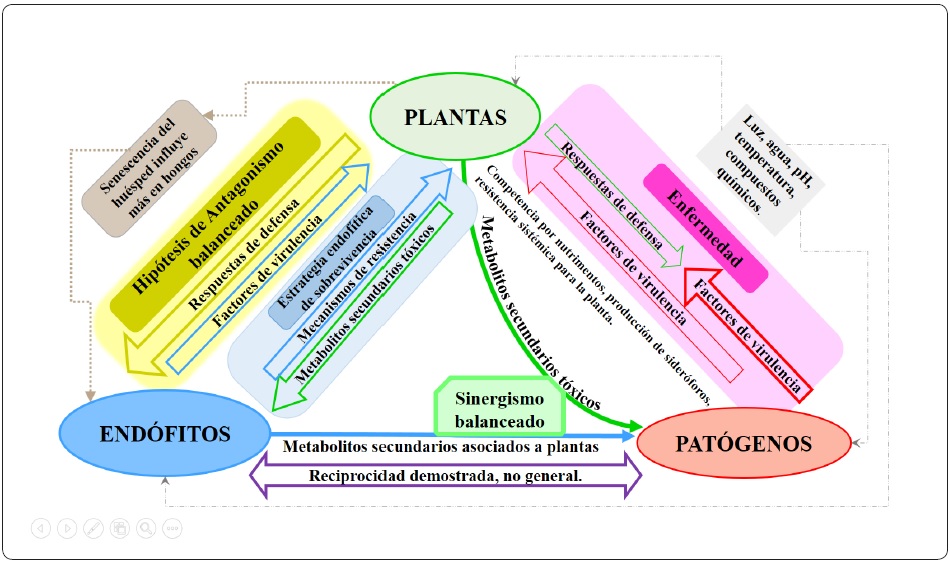
Figura 1 Diagrama de las interacciones entre un microbioma endófito y su planta hospedera. Modificado de Schulz & Boyle (2006); Puri et al. (2017) y Kusari et al. (2012).
Las bacterias y hongos endófitos (ByHE) colonizan tejidos sanos de una planta en algún estadio de su ciclo de vida, albergándose en espacios intercelulares, intracelulares y vasculares de los tejidos (Wang et al., 2006; Barrales-Cureño & De la Rosa, 2014; Pereira, Azevedo & Souza-Motta, 2017). Las ByHE más estudiados son los que pueden ser aislados de tejidos vegetales cuya superficie fue desinfectada y sus microorganismos fueron aislados. La importancia de la investigación de las ByHE ha sido tal que, se ha propuesto a la “endofitología”, como una línea de especialización en las ciencias biológicas (Schouten, 2019).
Se ha demostrado que la presencia de ByHE inducen la estimulación del crecimiento de las plantas mediante la fijación de nitrógeno (solamente bacterias), la producción de fitohormonas, el biocontrol de fitopatógenos en la raíz mediante la producción de agentes antimicrobianos, la producción de sideróforos, la inmunidad contra patógenos, herbívoros y estrés abiótico (Sessitsch, Howieson, Perret, Antoun & Martínez-Romero, 2002; Rosenblueth & Martínez-Romero, 2006; Schouten, 2019; Yan et al., 2019; Dini-Andreote, 2020). Particularmente en zonas áridas y semiáridas, algunos estudios demuestran que las ByHE son importantes para las plantas porque les ayudan a soportar el estrés causado por distintas condiciones ambientales adversas como la falta de agua y la alta salinidad, entre otras (Godínez, 2017).
La familia Cactaceae es característica de zonas secas, pues son plantas suculentas nativas de ecorregiones áridas y semiáridas como desiertos, matorrales y selvas secas (Challenger & Soberón, 2008). Es una de las familias más diversas en el mundo con aproximadamente 1,400 especies; de las que en México se han descrito 797 y el 69% son endémicas (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad-CONABIO, 2021). La sobrevivencia de los cactus en condiciones extremas de su hábitat se debe a sus adaptaciones morfológicas y fisiológicas: hojas modificadas en espinas y fotosíntesis de plantas con metabolismo ácido de las crasuláceas (CAM, por sus iniciales en inglés: Crassulacean Acid Metabolism), respectivamente (Bezerra, de Azevedo & Souza-Motta, 2017). Su éxito evolutivo y ecológico también se debe a la interacción que tienen con ByHE al formar un holobionte (a saber, el individuo y su microbiota) que les permite tolerar el bajo contenido de nutrimentos, la presencia de metales pesados y el estrés hídrico y salino; convirtiéndolas en especies dominantes y diversas en hábitats con esas características (Fonseca-García et al., 2016; Godínez, 2017). Por ejemplo, el cactus Cylindropuntia cholla (F.A.C.Weber) F.M.Knuth es colonizado en su zona radical por bacterias como Aarococcus terreus y hongos Agaricomycetes que le ayudan a crecer en estratos rocosos (Puente, Bashan, Lui & Lebsky, 2004 a). Ésta, junto con otras investigaciones se presentan en la Tabla I.
Tabla I Especies de cactáceas y sus respectivos endófitos bacterianos y fúngicos, aislados de cada una de ellas.
| Especies de cactus | Endófitos (phyla o especies) | Región de estudio |
Referencias | |
| Bacterias | Hongos | |||
|
|
|
Arizona, EUA. | Suryanarayanan, Wittlinger & Faeth, 2005 | |
| Cereus jamacaru D.C. | Rhizobium sp. | Caatinga, Brasil | Leite et al., 2015 | |
| Ferocactus acanthodes (Lem.) Britton & Rose | Micorrizas sin especies determinadas | Desierto de California, EUA. | Cui & Nobel, 1992 | |
| Mammillaria carnea Zucc. ex Pfeiff. |
|
Altiplano mexicano | Aguirre-Garrido et al., 2012 | |
| Mammillaria albicans subsp. fraileana (Britton & Rose) D. R. Hunt |
|
Desierto Sonorense, México | López et al., 2012 | |
| Melocactus zehntneri (Britton & Rose) Luetzelb. |
|
Caatinga, Brasil | Leite et al., 2015 | |
| Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console |
|
|
Guanajuato, México | Fonseca-García et al., .2016 |
| Opuntia robusta J. C. Wendl. |
|
|
Guanajuato, México | Fonseca-García et al., 2016 |
| Pachycereus pringlei (S.Watson) Britton & Rose |
|
Desierto Sonorense, México | Puente et al., 2009 | |
| Stenocereus pruinosus (Otto ex Pfeiff.) Buxb. S. stellatus (Pfeiff.) Riccob. |
Azospirillum
brasilense A. lipoferum |
Puebla, México | Mascarúa-Esparza, Villa-González & Caballero-Mellado, 1988 | |
Modificado de Fonseca-García et al. (2016) y Godínez (2017).
Los cactus cumplen la función de mantenimiento de los ambientes semiáridos y áridos a través de sus servicios ecosistémicos como la protección del suelo contra la erosión e infiltración de agua, alimento y refugio de animales (Pauca, Talavera, Villasante, Quispe & Laura, 2018) y el nodricismo, cuando la planta nodriza protege a otros organismos al aportar microambientes más favorables (Flores & Jurado, 2003). Estas características de importancia ecológica han enfocado los estudios de estas especies en su conservación, principalmente proponiendo distintas formas de propagación y cultivo in vitro. En los últimos diez años, se ha incrementado el estudio sobre la actividad biológica de algunos de los metabolitos secundarios producidos por estas plantas, así como la identificación y actividad de su microbioma (Bezerra et al., 2013; Chávez-Ambriz, Hernández-Morales, Cabrera-Luna, Luna-Martínez & Pacheco-Aguilar, 2016; Bulla et al., 2017; Eke et al., 2019; Camarena-Pozos, Flores-Núñez, López & Partida-Martínez, 2021).
Lo anterior, revela que es necesario sintetizar y analizar las publicaciones disponibles sobre endófitos en las cactáceas, para contribuir al desarrollo de esta reciente línea de investigación en México. Con esta revisión, se busca ordenar la información existente en este tema para conocer la situación actual sobre su conocimiento, destacando el uso de los organismos endófitos en la transferencia biotecnológica en áreas como la agricultura, la conservación y la salud. Para ello, se hizo la recopilación de información científica desde 1988 hasta enero 2021, sobre endófitos aislados de cactáceas, empleando las principales bases de datos en español e inglés.
Bacterias endófitas
Las bacterias endófitas son microorganismos que habitan en las plantas y se estima que existe una alta diversidad de estas (Rosenblueth & Martínez-Romero, 2006). Según la región donde se encuentre la planta hospedera y de sus propias características, puede albergar más de una especie y en diferentes cantidades ocasionando en ellas, principalmente, efectos como: a) aumento en su capacidad de absorción de nutrimentos del suelo por el incremento y desarrollo de raíces, que ayudan a la solubilización de fosfatos y a la fijación biológica de nitrógeno (Li, Wang, Chen & Chen, 2008; Schouten, 2019) y b) establecimiento de una relación mutualista que le confiere protección contra factores bióticos y abióticos adversos (Schouten, 2019).
Particularmente hay bacterias endófitas solubilizadoras de fosfato (BSF) orgánico e inorgánico (Goldstein, Lester & Brown, 2003), las cuales generalmente secretan ácidos orgánicos (Wan & Wong, 2004) como el butanoico, etanoico, metanoico y propanoico que solubilizan fosfatos minerales (Paredes-Mendoza & Espinosa-Victoria, 2010). El mecanismo básico de las BSF para transformar el fósforo insoluble a una forma soluble, es romper los enlaces de P con iones metálicos de Al, Fe y Ca (Restrepo-Correa, Pineda-Meneses & Ríos-Osorio, 2017).
Otras bacterias especializadas son las fijadoras de nitrógeno, que junto con las cianobacterias y las actinobacterias, forman un grupo único de microorganismos capaces de fijar este elemento químico además de producir metabolitos secundarios (Swarnalakshmi, Senthilkumar & Ramakrishnan, 2016). Estos microorganismos primero reducen el nitrógeno hasta una forma utilizable mediante la fijación biológica de nitrógeno (FBN), y después lo combinan o fijan en la forma de iones amonio. El proceso de FBN mediado por el complejo nitrogenasa, hace asimilable el nitrógeno atmosférico para otros organismos (Bellenger, Darnajoux, Zhang & Kraepiel, 2020). Específicamente, las bacterias fijadoras de nitrógeno pueden ser: 1) simbióticas endófitas, que producen nódulos en diferentes especies de leguminosas como las del género Rhizobium, y Frankia, asociadas con Betulaceae, Casuarinaceae y Rhamnaceae, entre otras familias de plantas y 2) de vida libre, como los géneros Azotobacter, Azospirillum, Bacillus y Clostridium (Puri, Padda & Chanway, 2017; Soumare et al., 2020).
También existen bacterias que promueven el crecimiento vegetal (PGPB por sus iniciales en inglés: Plant Growth Promoting Bacteria) mediante distintos mecanismos fisiológicos como: a) fijación de nitrógeno, b) solubilización de fósforo y c) producción de quitinasas, fitohormonas, glucanasas, sideróforos, compuestos orgánicos volátiles y antibióticos (Pitiwittayakul & Tanasupawat, 2020). Particularmente en zonas áridas y semiáridas, Kobayashi, Reedy, Bick & Oudemans (2002) demostraron que las PGPB son muy importantes para el establecimiento de muchas especies de plantas.
Bacterias endófitas de las cactáceas
A pesar de que las PGPB son esenciales para el establecimiento de plantas en zonas áridas y semiáridas, falta más investigación sobre su presencia en las cactáceas. Lima, Weber, Correia, Soares & Senabio (2015) identificaron en la cactácea columnar Cereus jamacaru DC., cepas bacterianas como Rhizobium, Burkholderia, Enterobacter, Pseudomonas y Pantoea, que no aumentaron significativamente la biomasa del cactus durante seis meses de cultivo, sin embargo, estas bacterias mostraron una posible actividad solubilizadora de fosfatos.
Por otro lado, Fonseca-García, Desgarennes, Flores-Núñez & Partida-Martínez (2018) analizaron el microbioma de plantas CAM, con una separación entre los microorganismos presentes en las siguientes zonas: a) rizosfera, b) endosfera radicular, c) endosfera del tallo y d) filosfera (partes aéreas de las plantas). Las cactáceas que estudiaron fueron Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console y Opuntia robusta J. C. Wendl. Los linajes de las bacterias y las arqueas encontrados en ambas especies fueron Actinomycetales, Bacillales, Burkholderiales, Enterobacteriales, Pseudomonadales, Rhizobiales, Sphingobacteriales y Xanthomonadales, entre otros. De acuerdo con la diversidad de estos linajes, se determinó que uno de los factores que influyen en la composición bacteriana de estas plantas es la zona de las plantas de donde provienen, ya que la diversidad microbiana fue mayor en la rizosfera, y menor en la endosfera.
Hongos endófitos
Los hongos endófitos son microorganismos que colonizan los tejidos vivos internos de las plantas y pueden contribuir a la protección de su hospedera contra factores: a) bióticos como patógenos y herbívoros, b) abióticos como el estrés salino y térmico o la presencia de metales (Ramos-Garza et al., 2016; Yan et al., 2019). También, se consideran hongos endófitos a los que en alguna etapa de su ciclo de vida, subsisten en su hospedera sin producir síntomas de enfermedad (Petrini, 1991; Porras-Alfaro & Bayman, 2011). Los espacios intercelulares y las conexiones apoplásticas son el nicho primordial de estos hongos, en donde se alimentan de los nutrimentos que circulan por los haces vasculares de las plantas que habitan (Saikkonen, Faeth, Helander & Sullivan, 1998).
Algunos estudios como el de Schulz, Römmert, Dammann, Aust & Strack (1999) demuestran que, a veces, la condición saprófita del hongo endófito que se hospeda en ciertos árboles cambia a efectos negativos cuando la planta se vuelve susceptible al presentar desórdenes nutricionales o estrés hídrico y el hongo la puede invadir. De tal forma, que existen hongos “endófitos temporales” o “patógenos latentes” (Márquez, Bills, Herrero & Zabalgogeazcoa, 2012), al considerar que la latencia se refiere a infecciones “letargadas” y asintomáticas por algún tiempo. Estos hongos pasarían de su estado quiescente a patogénico cuando las condiciones resulten propicias para el huésped y/o desfavorables para la planta. Hay ocasiones en las que bajo determinadas condiciones ambientales, un hongo endófito puede comportarse como patógeno en otra condición ambiental dentro de la misma hospedera u en otra distinta (Begoude, Slippers, Wingfield & Roux, 2011; Delaye, García-Guzmán & Heil, 2013).
La protección del hongo a su hospedera se puede realizar por medio de tres mecanismos: 1) directo, a través de enzimas y/o metabolitos secundarios con acción anti-patógena, originados en el hongo; 2) indirecto, inducen o aumentan la expresión de los mecanismos de defensa fisiológicos o químicos inherentes a su hospedera; y 3) ecológico, mediante la depredación, el hiperparasitismo y la ocupación del nicho ecológico (Sánchez-Fernández et al., 2013).
Hongos endófitos de las cactáceas
Uno de los géneros más estudiados de la familia Cactaceae, por su diversidad e importancia económica, es Opuntia. Por ejemplo, Ratnaweera, de Silva, Williams & Andersen (2015) analizaron la actividad antimicrobiana de los hongos endófitos del cactus invasivo Opuntia dillenii (Ker Gawl.) Haw. e identificaron dos especies: Aspergillus niger y Fusarium sp., la primera con mayor colonización en los cladodios del cactus y la segunda en los pistilos de sus flores. El endófito Fusarium sp. mostró mejor acción antimicrobiana que A. niger contra Bacillus subtilis y Staphylococcus aureus, lo cual se atribuye al compuesto identificado mediante cromatografía como equisetina (Ratnaweera et al., 2015).
Para otras especies de cactáceas, Bezerra et al. (2013) identificaron 59 taxa de hongos endófitos del cactus columnar Cereus jamacaru del bosque tropical seco brasileño. Las especies de hongos dominantes fueron Cladosporium cladosporioides y Fusarium oxysporum; seguidas de Acremonium implicatum, Aureobasidium pullulans, Trichoderma viride, Chrysonilia sitophila y Aspergillus flavus. Por primera vez se registraron 47 especies como hongos endófitos de una cactácea, lo cual sugiere que C. jamacaru alberga una comunidad fúngica altamente diversa. Las curvas de acumulación de especies demuestran que, según los autores, el estudio subestima la diversidad de endófitos; por lo que sugieren realizar muestreos más exhaustivos.
El mencionado trabajo de Fonseca-García et al. (2018), reporta varios linajes de hongos endófitos del cactus columnar Myrtillocactus geometrizans y el nopal Opuntia robusta, como Botryosphaeriales, Capriodiales, Chaetosphaeriales, Dothideomycetes, Hypocreales y Pleosporales, entre otros. Los distintos ensambles de estos hongos parecen estar influenciados por la biogeografía de sus hospederas, pues la diversidad fúngica varió según la ubicación de los cactus; resultando dos grupos principales: los estadounidenses y los mexicanos. Otro factor importante que podría explicar la diferencia de los ensambles de la endosfera del tallo, fue la época del año, ya que en la temporada lluviosa no se registraron los linajes que se presentaron durante la época seca, o bien fueron menos abundantes.
Usos y aplicaciones de algunos endófitos de cactáceas
La investigación sobre los endófitos de las cactáceas es escasa y más aún su efecto en otros organismos, sus hospederas o su bioactividad en general. A continuación, se describen aplicaciones potenciales basadas en estudios de endófitos hallados en estas y otras especies de plantas, cuya actividad ha sido probada experimentalmente y/o escalada a nivel productivo.
Crecimiento y desarrollo de plantas
Puente et al. (2004 a) demostraron que algunas bacterias endófitas (Bacillus chitinolyticus, Citropbaacter sp., Pseudomonas putida) de la cactácea conocida como cardón o Pachycereus pringlei (S.Watson) Britton & Rose, pueden disolver fósforo y transformarlo en formas asimilables para las plantas. Otras bacterias aisladas de la misma especie de cactus, son capaces de degradar roca (Azospirillum brasilense, Bacillus pumilus) y fijar nitrógeno atmosférico (Bacillus subtilis). Estas capacidades fisiológicas pueden estar relacionadas con el establecimiento de plantas en estratos rocosos (Puente, Li & Bashan, 2004 b).
Asimismo, López, Tinoco-Ojanguren, Bacilio, Mendoza & Bashan (2012) trabajaron con el cactus mexicano Mammillaria albicans subsp. fraileana (Britton & Rose) D. R. Hunt, aportando evidencia experimental de que la inoculación de bacterias endófitas nativas (especies que se encuentran en su área de distribución natural u original -histórica o actual- según su potencial de dispersión natural, y forman parte de las comunidades bióticas naturales del área) puede estimular el crecimiento del cactus. Esto mediante la movilización de elementos del sustrato rocoso de la planta como Na, P y Fe, lo cual puede incrementar su actividad fotosintética y la acumulación de biomasa. Los endófitos identificados por la secuenciación total del gen 16S rRNA, fueron 14 morfotipos; dentro de los que destacan Azotobacter vinelandii M2Per, Pseudomonas putida M5TSA y Bacillus megaterium M2PCa como degradadoras de rocas riodacitas. Además, los cactus inoculados con la variante de P. putida, mostraron más acumulación de nitrógeno total que los inoculados con la bacteria fijadora de nitrógeno control.
Por otro lado, Camarena-Pozos, Flores-Núñez, López, López-Bucio & Partida-Martínez (2019) aislaron de los cactus Opuntia robusta y Myrtillocactus geometrizans, bacterias endófitas de los phyla Actinobacteria, Firmicutes y Proteobacteria. Comprobaron que estas endófitas emiten compuestos orgánicos volátiles (ésteres, alcoholes, compuestos azufrados y nitrogenados) que influyen en el crecimiento y el desarrollo (longitud y número de raíces, biomasa, etc.) de algunas herbáceas como Arabidopsis thaliana (L.) Heynh. y Nicotiana benthamiana Domin. Por lo tanto, algunos de estos compuestos son moléculas prometedoras para la producción sostenible de cultivos en regiones áridas y semiáridas (Camarena-Pozos et al., 2019).
Flores-Núñez et al. (2020) realizaron un estudio metagenómico de los endófitos de cactus del centro de México, donde señalan algunos de los mecanismos por los que algunas bacterias (encima y por debajo del suelo) sobreviven y colonizan plantas de ecosistemas áridos y semiáridos. Sus resultados indican que hay una diferencia funcional en los grupos microbianos del suelo, la rizosfera y la filosfera del cactus; agrupando así los linajes en grupos funcionales específicos: productores de biofilm, bacterias fototróficas y diazotróficas. Estos grupos influyeron en la diversidad microbiana y los autores sugieren que pueden intervenir en el crecimiento, la salud y la productividad de las cactáceas producidas en invernadero.
Aunque Kavamura et al. (2013) aislaron 48 cepas bacterianas como Bacillus, Brevibacillus, Cellulosimicrobium, Enterobacter, Paenibacillus, Pantoea y Virgibacillus de la rizosfera de los cactus Cereus jamacaru, Melocactus sp. y Pilosocereus gounellei (F.A.C.Weber ex K.Schum.) Byles & G. D. Rowley, algunos de estos géneros (Bacillus, Enterobacter, Pantoea) también se han identificado como endófitos de cactáceas (Puente et al., 2004 a; López et al., 2012; Lima et al., 2015; Fonseca-García et al., 2018). El 65% de esas cepas bacterianas crecieron en un medio con reducida disponibilidad de agua y un 65% produjeron exopolisacáridos. En el mismo estudio se inocularon algunas de estas bacterias en plantas de Zea mays L. y solamente tres cepas de Bacillus sp. (LMA3, LMA42 y LMA52) y una de Pantoea sp. (LMA28), el resultado fue un aumento significativo del área foliar del maíz en comparación con las plantas no inoculadas con las bacterias. De estas, en las plantas de maíz, solo la cepa LMA3 incrementó los tres parámetros analizados (área foliar, longitud del tallo y biomasa seca de brotes). Además, la inoculación de esta cepa parecía haber protegido a la planta contra los efectos negativos de la desecación (Kavamura et al., 2013).
Kavamura et al. (2013) también cuantificaron: a) la producción de ácido indolacético en las cepas bacterianas que aislaron de la rizosfera de los cactus brasileños, con valores superiores a 51 μg mL-1 para el 4% de ellas, y b) la solubilización de Ca-P que fue alta para el 6% de estas endófitas. Al inocular estas cepas en plantas de Z. mays, la producción del ácido indolacético de las bacterias se correlacionó positivamente con la longitud del tallo y con la solubilización del fósforo en las plantas de maíz. El ácido indolacético es una fitohormona reguladora de la división celular, formación de raíces y el crecimiento. Actualmente este ácido es de las auxinas más usadas con fines agrícolas y se sintetiza químicamente, causando contaminación del entorno donde se produce y se usa, por lo que se buscan métodos responsables ambientalmente para su obtención (Ayala et al., 2020).
Recientemente, Camarena-Pozos et al. (2021) identificaron compuestos volátiles (terpenos, alcoholes, ésteres, cetonas) en hongos endófitos de O. robusta y M. geometrizans, que en su mayoría son producidos por las clases Sordariomycetes, Eurotiomycetes y Dothiomycetes. Algunos de los compuestos aislados como el canfeno y el benzoato de bencilo, tuvieron un efecto positivo en el crecimiento de las raíces y en general de la biomasa de la herbácea Arabidopsis thaliana.
Incremento en la germinación de semillas y la floración
Chávez-Ambriz et al. (2016) obtuvieron aislados bacterianos de la rizosfera de Mammillaria magnimamma Haw. y Coryphantha cornifera (DC.) Lem., pertenecientes al género Bacillus. Todas las bacterias aumentaron la germinación de las semillas hasta un 34.3% más, con respecto a las semillas no inoculadas con los bacilos. También se mostró un efecto positivo sobre la floración del cactus al inocular una de estas bacterias en plantas de Mammillaria zeilmanniana Boed.; ya que, en un par de meses dentro del período de un año, aumentó hasta un 31% el número de plantas en floración con respecto a las plantas sin bacterias inoculadas. Esto sugiere que la inoculación de estas rizobacterias podría usarse en programas de conservación de especies de cactáceas en alguna categoría de riesgo o para el mantenimiento de sus poblaciones (Chávez-Ambriz et al., 2016).
Control de plagas
Silva-Hughes et al. (2015) encontraron en el cactus Opuntia humifusa (Raf.) Raf., una especie de hongo endófito (Biscogniauxia mediterranea) que demostró tener una moderada actividad antifúngica, al menos en fase experimental, contra el patógeno Phomopsis obscurans que causa el tizón en las hojas de la fresa. Probablemente en otras cactáceas existan más hongos endófitos con estos efectos; puesto que se ha demostrado la existencia de los mismos en plantas como pastos, que pueden actuar como agentes de biocontrol de ciertos insectos (Clay, 1989). En cuanto a las bacterias, Shahid et al. (2017) aislaron cepas de Pseudomonas aurantiaca de un cactus paquistaní, en las que identificaron metabolitos secundarios como la fenazina-1-ácido carboxílico, que mostró una función antifúngica en plantas de trigo.
Tolerancia a la sequía
Recientemente, Eke et al. (2019) aislaron 18 especies de bacterias del cardón silvestre Euphorbia trigona Mill, pertenecientes a 13 géneros como Bacillus, Lysinibacillus, Enterobacter, Stenotrophomonas, Lelliottia y Pseudomonas. Al inocular estas endófitas en plantas de tomate, se produjeron cambios benéficos en las plantas en su estado oxidativo, la función estomática y del fotosistema II, la temperatura interna de la hoja y el contenido relativo de agua. Esto sugiere un efecto fisiológico positivo en el tomate por parte de las endófitas, contra el estrés por humedad. Así, en este estudio los autores proponen usar la cepa de Bacillus amyloliquefaciens como bioinoculante de bajo costo para contrarrestar los problemas de sequía y elevar la producción de ciertos cultivos, como por ejemplo el tomate donde fue probada la bacteria. En el mismo trabajo, se identificó por primera vez a Bacillus xiamenensis como endófito de una planta. A pesar de que las bacterias fueron aisladas de E. trigona, que no es una cactácea pero sí una suculenta característica de hábitats secos, podría compartir algunos endófitos con ciertos cactus. Esto tal y como lo demuestra un estudio con el hongo patógeno Fusarium oxysporum hallado por primera vez en Euphorbia mammillaris L. y que es típico de cactus como Astrophytum myriostigma Lem., Epiphyllum hookeri Haw. y Cereus repandus (L.) Mill. (Bertetti, Ortu, Gullino & Garibaldi, 2017).
Recuperación de poblaciones y restauración de ecosistemas
Varias especies de cactáceas se encuentran bajo alguna categoría de riesgo, debido principalmente a su comercio ilegal y la pérdida de su hábitat, por lo que los estudios de propagación in vitro son muy comunes para poder reintroducir las especies en su hábitat original. Por lo tanto, si se vincula este tipo de investigaciones con las de microorganismos endófitos, la probabilidad de recuperar y reestablecer poblaciones de cactáceas vulnerables a los distintos problemas ambientales, podría ser mayor. Incluso para establecer Unidades de Manejo para la conservación y aprovechamiento de la vida silvestre (UMA), debido a que estas plantas son altamente cotizadas por su importancia hortícola (Ruvalcaba-Ruiz, Rojas-Bravo & Valencia-Botín, 2010; Godínez, 2017; Rodríguez-Ruíz et al., 2018).
Los estudios de PGPB en cactáceas indican que la relación entre endófitos y plantas del desierto podría ser más común (Pereg, de-Bashan & Bashan, 2016; Enebe & Babalola, 2018). De modo que las bacterias endófitas de cactus pioneros como Mammillaria albicans subsp. fraileana, Opuntia cholla, Pachycereus pringlei y Stenocereus thurberi (Engelm.) Buxb., aportarían una ventaja ecológica sobre superficies de roca estéril porque les permitiría crecer donde otras plantas no pueden hacerlo (Bashan, Li, Lebsky, Moreno & De Bashan, 2002; López et al., 2012). Se ha demostrado que las semillas de muchas especies de plantas contienen diversidad de endófitos que les ayudan a germinar, lo que probablemente ocurra también en las cactáceas (Li, Parmar, Sharma & White, 2019). Esto es una línea de investigación actual para identificar y después usar los microorganismos para la restauración activa de los ecosistemas, a través de la colonización y establecimiento de plantas pioneras en suelos degradados o donde ya exista roca desnuda (Puente, Li & Bashan, 2009; López et al., 2012).
Biorremediación como uso potencial
En cuanto a la bioactividad de las cactáceas y sus endófitos, falta mucho por analizar. Las funciones de fitoextracción de metales pesados y fitoestabilización de residuos tóxicos, han sido estudiadas en bacterias endófitas de familias vegetales distintas a la Cactaceae. Por ejemplo, las PGPB pueden servir como componentes valiosos en la biorremediación de suelos y aguas contaminados, así como en la revegetación y reforestación de tierras degradadas. La mayor utilidad potencial de estas bacterias radica en su estrecha asociación e influencia positiva en el crecimiento de las plantas. Por ejemplo, se ha demostrado que las PGPB endófitas y de la rizosfera aumentan la biomasa de ciertas plantas, y contribuye a la degradación de contaminantes orgánicos (De Bashan, Hernández & Bashan, 2012; Li, Wei, Shen & Zhou, 2012; Puri et al., 2017).
Por otro lado, existen hongos que degradan colorantes de aguas residuales a través de exoenzimas o por bioabsorción (Cardona, Osorio & Quintero, 2009). Algunas de esas enzimas son lacasas provenientes de hongos endófitos y no endófitos, demostrándose su potencial para degradar tintes de origen industrial (Bulla et al., 2017; Bettin et al., 2019). Particularmente, Tochhawng, Mishra, Passari & Singh (2019) compilaron al menos cinco hongos endófitos con reportes de biodegradación de tintes sintéticos, como Marasmius cladophyllus, Myrothecium verrucaria y Phlebia formosus.
Muthezhilan, Vinoth, Gopi & Jaffar Hussain (2014) purificaron parcialmente lacasas de distintas cepas de hongos endófitos y encontraron que la de Fusarium sp. puede degradar los tintes textiles utilizados, más que las otras cepas analizadas. Este género de hongo endófito ya ha sido identificado en algunas cactáceas, como se mencionó en párrafos anteriores (Bezerra et al., 2013; Ratnweera et al., 2015; Bertetti et al., 2017); por lo tanto, se sugiere que sería posible aislar una enzima o compuesto similar a la lacasa en esas u otras especies de cactus. Además, la enzima usada por Muthezhilan et al. (2014) fue aislada de hongos endófitos de plantas provenientes de dunas costeras, un ecosistema donde puede haber cactus como Mammillaria gaumeri (Britton & Rose) Orcutt que es endémica de matorrales de dunas costeras y bosques caducifolios secos tropicales de Yucatán (Ferrer-Cervantes et al., 2012).
Potencial uso farmacológico
Hay evidencia de que algunas especies de cactus producen metabolitos secundarios con beneficios médicos como antiinflamatorios y anticancerígenos (Shedbalkar, Adki, Jadhav & Bapat, 2010; Salazar et al., 2011; De Castro et al., 2012; Kim, Jho, Choi & Nam, 2013; Zareisedehizadeh, Tan & Koh, 2014; Ríos-León, Fuertes-Ruiton, Arroyo & Ruiz, 2017). Asimismo, se han identificado en algunas cactáceas, bacterias endófitas como Pseudomonas, género del que ciertas especies producen metabolitos secundarios de los que se han aislado compuestos como: 1) antibióticos (Singh, Shrivastava, Yadav & Srivastava, 2020); 2) emomicinas, una familia relativamente nueva de antibióticos de naturaleza lipopeptídica con acción antifúngica (Miller et al., 1998; Samad, Antonielli, Sessitsch, Compant & Trognitz, 2017); y 3) ácido bórico y 2-amino-3quinolincarbonitrilo, cuyo efecto resultó antibacteriano (Fitriani, Ihsan & Hamdiyati, 2015). Además, se ha demostrado actividad antibiótica de ciertos compuestos de P. fluorescens aislada del algodón (Devi, 2019).
Conclusiones
Esta revisión evidencia que, hasta ahora, existen reportes de la presencia de endófitos en varias cactáceas. Algunos de esos trabajos sólo reconocen el phyllum, clase, orden o género de las bacterias u hongos endófitos encontrados en los cactus. De los 22 trabajos considerados en esta revisión, la mayoría (12 estudios) analizaron bacterias; mientras que la minoría (8 publicaciones) se refieren a hongos, y solamente 2 de ellos, identifican bacterias y hongos. El 18% de los trabajos señala la actividad biológica de los endófitos en las mismas especies de cactáceas de las que fueron aislados, y otro 18% se refiere al efecto de los endófitos en algunas herbáceas o en un hongo patógeno del cultivo de la fresa. Dado que la mayoría de las publicaciones (13 trabajos) solamente registran la presencia de hongos y/o bacterias endófitas, es evidente la importancia de investigar su bioactividad e identificar los compuestos activos. Por otro lado, desde principios de este siglo se producen nuevos fármacos con compuestos activos producidos por microorganismos endófitos (Martínez-Klimova, Rodríguez-Peña & Sánchez, 2017). Así, existe la posibilidad de que alguna bacteria u hongo endófito de los cactus, generen compuestos químicos con propiedades medicinales. Incentivar la investigación en este sentido, contribuirá a lograr uno de los Objetivos de Desarrollo Sustentable de la Organización de las Naciones Unidas que es generar buena salud y bienestar, mediante la búsqueda de nuevos medicamentos de origen microbiano para combatir la resistencia a antibióticos y generar fármacos amigables con el ambiente (Akinsemolu, 2018).
Finalmente, este trabajo revela la necesidad de continuar investigando a las cactáceas y sus endófitos no sólo para encontrar nuevas especies, sino tmabién usos con potencial aplicación para la conservación y el desarrollo sustentable. Asimismo, es necesario vincular los sectores académicos, empresariales y gubernamentales para que existan políticas públicas que fomenten la investigación y la transferencia biotecnológica.











 nova página do texto(beta)
nova página do texto(beta)


