Introducción
La minería es una de las fuentes económicas más importantes en México, generadora de riqueza, pero a la vez causa de afectaciones importantes al ambiente, su operación provoca desmonte, destrucción de hábitats, contaminación de cuerpos de agua superficiales y generación de grandes cantidades de residuos (Higueras & Oyarzun, 2002). Estos últimos representan una fuente de contaminación y un problema de salud pública, ya que contienen sulfuros metálicos, altas concentraciones de metales pesados, carecen de las propiedades físicas, químicas y biológicas necesarias para el desarrollo de la vegetación y al ser materiales de partículas finas e inestables se dispersan al ambiente por arrastre hídrico y eólico, éste último es causa de erosión (He, Yanga & Soffellab, 2005).
El grado de contaminación con metales pesados en suelos, regularmente se mide a partir de la concentración total (Rieuwerts, Thornton, Farago & Ashmore 1998). Sin embargo, ese parámetro no provee información completa del riesgo ecológico, distribución geoquímica, movilidad o biodisponibilidad (Davutluoglu, Seckin, Ersu, Yilmaz & Sari, 2011). Para conocer el riesgo que representa la contaminación con metales pesados se recomienda cuantificar la concentración biodisponible, definida como la cantidad de metal pesado disuelto en la solución del suelo o presente en los sitios de intercambio (Zeien & Bruemmer, 1989). Las formas solubles e intercambiables son consideradas las más móviles y biodisponibles, mientras que las que están incorporadas a otros componentes actúan como reservorio, manteniéndose retenidas con la materia orgánica (MO), unidas con carbonatos y ocluidas con los óxidos de Fe y Mn o inactivas dentro de las estructuras cristalinas de las arcillas (Ahumada, Mendoza & Ascar, 1999).
La concentración móvil de los metales pesados se determina a partir de extracciones simples con: sales neutras como CaCl2 0.001-0.01 M, NaNO3 0.1 M o NH4NO3 1.0 M, y quelatos orgánicos como EDTA y DTPA 0.05 M (Rog-Young et al., 2015); o bien, se realizan extracciones secuenciales para cuantificar la fracción lábil de los contaminantes y su distribución con los componentes del suelo (Vega, Covelo & Andrade, 2006). Las extracciones secuenciales son procedimientos que se aplican para evaluar la movilidad de los metales pesados en sedimentos, suelos y materiales de desecho, y disolver las distintas fracciones de los minerales que retienen la mayor parte de los oligoelementos, utilizando una serie de reactivos selectivos (Gleyzes, Tellier & Astruc, 2002).
En la actualidad, la aplicación de enmiendas orgánicas no sólo es una alternativa para mejorar las condiciones físicas, químicas y nutrimentales del suelo, sino una opción para inmovilizar los metales pesados solubles (Clemente & Bernal, 2006). Entre los materiales orgánicos empleados con esa finalidad se encuentran las compostas (Farrel, Perkins, Hobbs, Griffith & Jones 2010), los biosólidos (Campos Chaer, Leles, Silva & Santos, 2019) y estiércoles de animales (Sungur, Soylak, Yilmaz & Ozca, 2016: Duarte, Carrillo-González, Lozano & Carrasco, 2019), entre otros. La cantidad, composición y dinámica de la materia orgánica del suelo (MOS) influyen en la movilidad de los metales pesados (Zhou, Wu, Luo & Christie, 2018), así como otros factores abióticos como el pH, Eh, capacidad de intercambio catiónico, contenido y tipo de arcillas, contenido de sales, oxi-hidróxidos de Fe y Mn, etc. (Rieuwerts et al., 1998). De manera general, se ha establecido que la MOS humificada forma complejos más estables con los metales pesados, mientras que la MO fresca o fracción ligera de la MOS, puede incrementar la movilidad y biodisponibilidad de los metales (Wiatrowska & Komisarek, 2019).
El presente trabajo tuvo como objetivo, evaluar el efecto de la aplicación del estiércol de vaca y de cerdo composteados en la movilidad de las fracciones químicas del Cu en un suelo contaminado con los residuos mineros, considerando como variable de análisis, la proporción de estiércol aplicado en la retención y tipo de estiércol en los cambios de las fracciones móviles o biodisponibles del Cu. Como hipótesis de trabajo se planteó que en los tratamientos con mayor proporción de estiércol aplicado, así como en el estiércol con mayor capacidad de intercambio catiónico se registra una menor concentración de Cu en la fracción con mayor movilidad (Soluble-intercambiable).
Materiales y métodos
Muestreo y preparación de las muestras
El muestreo de los residuos mineros se llevó a cabo en los taludes y parte alta del depósito Santa María, en Zimapán, Hidalgo, localizado en las coordenadas geográficas 0°44’17.6”N 99°24’03.1” W, y de donde se tomó una muestra que representa la concentración del Cu del lugar, compuesta a su vez de 10 submuestras colectadas en 10 puntos distintos utilizando una barrena de 30 cm de largo y 7 cm de diámetro, con la que se extrajeron 0,5 kg de residuos por submuestra. El suelo se colectó a 10 km al oeste del depósito de residuos muestreado a 20° 42’ 10.764 N ‘’99° 20’ 5.848’’ W. El estiércol de vaca y de cerdo fueron composteados por cuatro meses en el área del traspatio del Tecnológico de Estudios Superiores del Oriente del Estado de México y las muestras fueron secadas al aire y a la sombra a temperatura ambiente.
Diseño experimental
El experimento se realizó en un invernadero, a partir de la preparación de distintos tratamientos utilizando estiércol de vaca y de cerdo aplicados en distintas proporciones en el suelo contaminado artificialmente con los residuos mineros (25% p/p). Las proporciones de estiércol fueron de 0, 3, 6, 12 y 24% (p/p). El diseño experimental se hizo completamente al azar con cinco tratamientos y tres repeticiones para cada tipo de estiércol. El experimento se mantuvo durante dos meses a una temperatura media de 30 °C, la humedad se mantuvo al 5% de peso y se revisó por gravimetría cada tercer día. El peso total de cada unidad experimental fue de 1 kg de peso, elaboradas a partir de tubos de PVC de 35 cm de altura y 2.5” de diámetro. Los cambios en la fracción móvil (F1, Soluble-Intercambiable) del Cu se determinaron a partir de un procedimiento químico secuencial.
Métodos analíticos
El pH se determinó por potenciometría (Palmer, 1979) en una relación suelo:agua de 1:4, posteriormente en la misma solución después de 20 h de equilibrio se midió la conductividad eléctrica (CE) con un puente de conductividad (Soil Survey Staff, 1975). Los siguientes análisis fueron determinados por distintos métodos: La materia orgánica (MO) y el carbón orgánico (CO) por el método Walkey & Black modificado por Nelson & Sommers (1982); el nitrógeno total (NT) por el método micro Kjeldalh (Palmer, 1979) y el análisis de Textura fue realizado por la técnica del hidrómetro de Bouyoucos (Gee & Bauder, 1986); la capacidad de intercambio catiónico (CIC) por el método del acetato de amonio 1N pH 7 (Rowel, 1994; el contenido pseudo-total de Cu se determinó por triplicado después de una digestión ácida con la mezcla de HNO3:HCIO4:H2O2 (4:1:1) por espectrofotometría de Adsorción Atómica (EAA) con el equipo Thermo Scientific ICE 3000 Series AA Spectrometer. La calibración se realizó empleando un estándar certificado de 1,000 mg/L de Cu (Perkin Elmer Pure: Part N9300183) con una curva de calibración en el rango de 0.2 - 1.6 mg/L.
Procedimiento secuencial para las fracciones químicas del Cu
El procedimiento para la determinación de las fracciones químicas del Cu de cada uno de los tratamientos consistió en el uso de distintos reactivos químicos de forma secuencial y obtener así las fracciones en el orden que se describe en la Tabla I (adaptado de Pagnanelli, Mosca, Giuliano & Toro, 2004).
Tabla I Procedimiento secuencial para la determinación de las Fracciones Químicas del Cu.
| Paso | Fracción | Método y reactivos empleados |
|---|---|---|
| F1 | Cu-soluble intercambiable | Extracción con ácido acético 1M a pH 5 |
| F2 | Cu-unido a óxidos de Fe y Mn | Extracción con hidrocloruro de hidroxilamina 0.1 M y ácido acético al 25%. |
| F3 | Cu-unido débilmente con la MO | Extracción con HCl0.1 M. |
| F4 | Cu-unido Fuertemente con la MO | Extracción con NaOH 0.5 M y digestión con HNO3 al 65%. |
| F5 | Cu-unido a la Fase sulfida | Digestión con HNO3 8 M. |
| F6 | Cu-unido en el sólido residual | Digestión con HNO3 + HCl, + H2O2 |
Resultados y discusión
Caracterización física y química de los materiales y contenido pseudo-total del Cu
Los residuos mineros registraron una textura arenosa, con 85% de arena, 2.5% de arcilla y 12.5% de limo y bajo contenido de MO, pH de 6.64, CE de 2,100 dS/m, y CIC baja. Por otra parte, el suelo presentó una textura Franca, con 14% de arcilla, 48% de limo y 38% de arena, pH ligeramente alcalino, CE de 280 dS/m, CIC de 13 Cmol(+)/kg (Tabla II). El estiércol de cerdo tuvo un pH neutro; mientras que el de vaca registró un pH ligeramente alcalino, este último con mayor CE, menor contenido de MO y menor CIC (Tabla II). Por otra parte, la concentración pseudo-total del Cu en los residuos mineros fue de 2,417 mg/kg, mientras que en el suelo tan solo de 46 mg/kg y 76 mg/kg en el estiércol de vaca y 39 mg/kg en el de cerdo, este último registró un mayor contenido de MO y CO que el otro material.
Tabla II. Características físicas y químicas del suelo, residuos mineros y estiércol.
| Variable | pH | Textura | CE (dS/m) | CIC (Cmol/kg) | MO (%) | CO (%) | C/N | N total (%) |
|---|---|---|---|---|---|---|---|---|
| Suelo | 7.89 | Franca | 280 | 13 | 3.3 | 1.19 | - | - |
| Residuos mineros | 6.64 | Arenosa | 2100 | 5.8 | 1.5 | 0.87 | - | - |
| Estiércol de cerdo | 6.8 | - | 789 | 30 | 26 | 17.4 | 3.6 | 4.85 |
| Estiércol de vaca | 7.8 | - | 1285 | 12 | 18 | 10.44 | 3.5 | 3 |
Por otra parte, al aplicar el estiércol tanto de cerdo como de vaca se observaron cambios en las propiedades químicas de los tratamientos (Tabla III): el pH incrementó ligeramente conforme aumentó la proporción del estiércol de vaca, no así con el estiércol de cerdo donde se presentó una ligera disminución, manteniéndose en un pH neutro. Por otra parte, la CIC cambió de 12.6 a 23 Cmol(+)/kg con el estiércol de cerdo y sólo hasta 14.30 Cmol(+)/kg con el de vaca. La CE incrementó de 810 en el tratamiento de 0% de estiércol hasta 960 dS/m con el de cerdo y 1,240 dS/m con el de vaca en los tratamientos de 24%.
Tabla III. Promedio de Parámetros químicos medidos en los distintos tratamientos.
| Variable | Tratamientos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0% | 3% | 6% | 12% | 24% | 0% | 3% | 6% | 12% | 24% | |
| Estiércol de vaca | Estiércol de cerdo | |||||||||
| pH | 7.1 | 7.2 | 7.4 | 7.7 | 7.8 | 7.1 | 7.1 | 7.0 | 7.0 | 6.9 |
| CE (dS/m) | 810 | 956 | 1089 | 1136 | 1240 | 810 | 816 | 837 | 924 | 960 |
| CIC (Cmol(+)/kg) | 12.6 | 12.9 | 13.4 | 14.26 | 14.30 | 12.6 | 13.7 | 18.1 | 21.3 | 23.0 |
Los componentes del suelo participan en el control de la movilidad de los metales pesados, en condiciones de pH neutras y alcalinas se presenta una menor movilidad y baja biodisponibilidad, mientras que el pH ácido incrementa su movilidad (Rog-Young et al. (2015). Las sales solubles influyen de manera importante en la movilidad de los metales pesados en el suelo (Hund-Rinke & Korrdel, 2003) y con la aplicación de los estiércoles, estas se incrementaron, lo que puede influir en su movilidad. En el caso de la CIC, está relacionada con la capacidad de intercambiar iones metálicos de la solución del suelo a la superficie de las arcillas, óxidos de Fe y Mn y a la MOS (Sparks, 2002), aunque la CIC encontrada en los estiércoles aplicados fue menor que en los resultados de otros trabajos con los mismos materiales (se han reportado hasta 36 Cmol(+)/kg), esta variable está relacionada con el tipo y proporción de MO (Albanell, Plaixats, Cabrero & Capellas, 1988). De acuerdo con Alloway & Trevors (2013) y Caporale & Violante (2016), otros componentes del suelo que también son responsables del control de la movilidad son la concentración y tipo de arcillas, MOS, óxidos de Fe y Mn, carbonatos, microorganismos, y complejos órgano- minerales. La MO participa en el control de la movilidad de los metales pesados en el suelo, pero depende de su composición, contenido de sales, relación C/N y de su grado de humificación, por lo que se hace difícil predecir su comportamiento (Zhou et al., 2018).
Por otra parte, los residuos mineros presentaron un alto contenido de Cu, con una concentración pseudo-total similar a los reportados por Duarte et al. (2015), en los mismos residuos. Además, se observó que tanto el suelo como el estiércol utilizado, al ser materiales sin tratamiento previo, presentan Cu, aunque en niveles muy bajos de los que son considerados para suelos contaminados (USEPA, 1996).
Fracciones químicas del Cu en los tratamientos
En la Figura 1 se muestran las gráficas de las fracciones químicas del Cu con los tratamientos de aplicación de los dos tipos de estiércol, donde también se aprecian las barras de error correspondientes a su desviación estándar y la prueba Tukey para la comparación de medias.
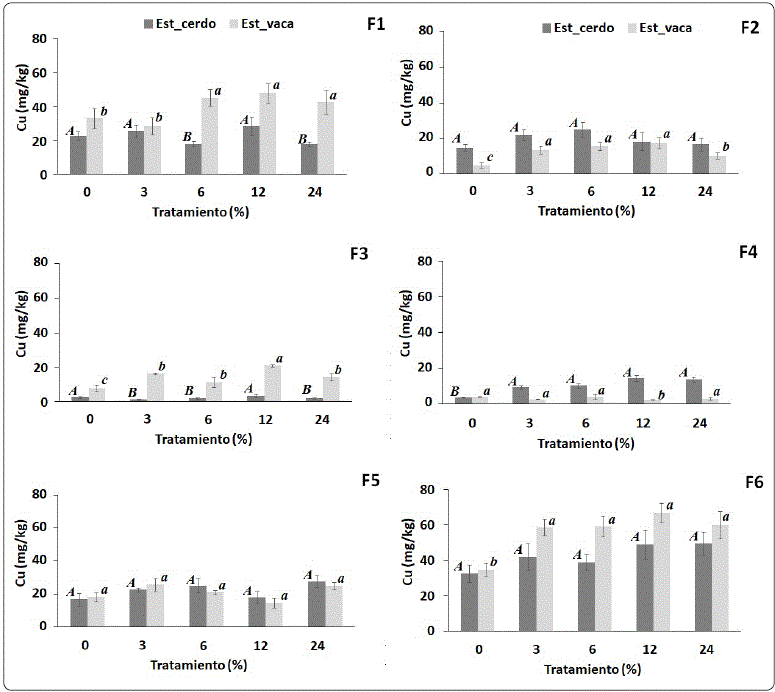
Figura 1 Fracciones químicas del Cu en los tratamientos con estiércol de cerdo y vaca; F1 = Cu-soluble-intercambiable, F2 = Cu-unido a óxidos de Fe y Mn, F3= Cu-unido débilmente con la MO, F4 = Cu-unido Fuertemente con la MO, F5 = Cu-unido a la Fase sulfida y F6 = Cu-unido al sólido residual. Los tratamientos con la misma letra de cada gráfica no son significativamente diferentes (Prueba Tukey: α = 0.05). Elaboración personal.
En F1 (Cu-soluble intercambiable) se registró una concentración de 22.5, 25.5, 17.8, 28.5 y 18.7 mg/kg de Cu en los tratamientos respectivos de 0, 3. 6, 12 y 24% de estiércol de cerdo, con una media de 22.4 mg/kg de Cu. En los tratamientos de estiércol de vaca se registraron 33, 28.5, 45.1, 47.6 y 42 4 mg/kg de Cu en los tratamientos a 0, 3. 6, 12 y 24%, respectivamente; con una media de 39.3 mg/kg de Cu. En ambos materiales aplicados con diferencia significativa entre los tratamientos (Pr < 0.0001).
En F2 (Cu-unido a óxidos de Fe y Mn), con el estiércol de cerdo se obtuvieron 14.7, 21.7, 24.9, 18.2 y 16.6 mg/kg de Cu en los tratamientos de 0, 3. 6, 12 y 24%, respectivamente; con una media de 19.3 mg/kg de Cu, con diferencia significativa entre los tratamientos (Pr = 0.0001). Mientras que con estiércol de vaca se registraron 4.8, 13.3, 15.7, 17.5 y 10.2 mg/kg de Cu con la aplicación de 0, 3. 6, 12 y 24% de estiércol, respectivamente; con una media de 12.3 mg/kg de Cu, no se observó diferencia significativa entre los tratamientos (Pr < 0.4672).
En F3 (Cu-débilmente unido a la MO), los tratamientos con aplicación de estiércol de cerdo registraron 7.7, 16.4, 11.3, 21.1 y 14.4 mg/kg de Cu en los tratamientos de 0, 3. 6, 12 y 24%, respectivamente; con una media de 2.3 mg/kg de Cu y una diferencia significativa entre los tratamientos (Pr < 0.0001). Mientras que en los tratamientos con estiércol de vaca 5.3, 16, 11.2, 21.1 y 14.4 mg/kg de Cu en proporción de 0, 3. 6, 12 y 24%, respectivamente; con una media 14.1 mg/kg de Cu, y una diferencia significativa entre los tratamientos (Pr < 0.0001).
En F4 (Cu-fuertemente unido a la MO) los tratamientos de estiércol de cerdo se encontraron 3.7, 9.4, 10.3, 14.6 y 13.8 mg/kg de Cu en los tratamientos de 0, 3. 6, 12 y 24%, respectivamente; con una media de 14.59 mg/kg de Cu. Por otra parte, los tratamientos con estiércol de vaca, registraron valores de 4.1, 2.7, 4.2, 2.4 y 3.1 mg/kg de Cu en los tratamientos respectivos de 0, 3. 6, 12 y 24%; con una media de 3.3 mg/kg de Cu. Con ambos materiales se observó diferencia estadística entre los tratamientos (Pr < 0.0001).
En F5 (Cu-unido a la fase sulfida) se registraron concentraciones de 16.6, 22.6, 24.9, 17.9 y 27.6 mg/kg de Cu en los tratamientos respectivos de 0, 3. 6, 12 y 24%; con una media de 29.9 mg/kg de Cu, sin diferencia significativa entre los tratamientos (Pr = 0.5510). En los tratamientos con estiércol de vaca se registraron concentraciones muy similares, presentando 18.2, 25.6, 21.1, 14.6 y 24.9 mg/kg de Cu en 0, 3. 6, 12 y 24% de estiércol, respectivamente; con una media de 20.9 mg/kg de Cu, sin diferencia significativa entre los tratamientos (Pr = 0.2310).
En F6 (Cu-unido al sólido residual), con aplicación de estiércol de cerdo, se encontraron 32.7, 41.8, 38.9, 48.9 y 49.43 mg/kg de Cu en los tratamientos respectivos de 0, 3. 6, 12 y 24%; una media de 42.4 mg/kg de Cu, sin diferencia significativa entre los tratamientos (Pr = 0.2310). Mientras que en los tratamientos con estiércol de vaca, se registraron concentraciones de 34.8, 58.6, 59.1, 66.8 y 60.1 mg/kg de Cu en 0, 3. 6, 12 y 24% de estiércol, respectivamente; una media de 50.9 mg/kg de Cu, y diferencia significativa entre los tratamientos (Pr = 0.0105).
Con el análisis de correlación de Pearson, se llegó a los siguientes resultados a partir de: la concentración de las fracciones químicas del Cu y las propiedades químicas del suelo (pH, CE y CIC) por cada tipo de estiércol utilizado. Con estiércol de cerdo, la F1 registró un bajo coeficiente de correlación (r), con pH r = -0.1, CE r = -0.1 y CIC r = -0.21; F2 con pH r = -0.27, CE r = -0.32 y CIC r = -0.04; F3 con pH r = 0.48, CE r = 0.29 y CIC r = 0.22; F4 con pH r = 0.77, CE r = 0.84 y CIC r =0.90; F5 con pH r = 0.22, CE r = 0.37 y CIC r = 0.49; y F6 con el pH r = 0.75, CE r = 0.89 y CIC r = 0.86. Con el estiércol de vaca la F1 registró un alto coeficiente de correlación (r), con pH r = 0.71, CE r = 0.74 y CIC r = 0.80; F2 con pH r = 0.28, CE r = 0.55 y CIC r = 0.51; F3 con pH r = 0.54, CE r = 0.55 y CIC r = 0.64; F4 con pH r = -0.42, CE r = -0.35 y CIC r =-0.55; F5 con pH r = -0.11, CE r = 0.14 y CIC r = -0.15; y F6 con el pH r = 0.59, CE r = 0.81 y CIC r = 0.76. En resumen, las mayores correlaciones con los parámetros químicos del suelo fueron F4 y F6 en el estiércol de cerdo y F1, F3 y F6 en el estiércol de vaca.
Las distintas mezclas de suelo realizadas registraron una concentración pseudo-total promedio de 664 mg/kg de Cu, nivel que de acuerdo con la USEPA (1996) se debe considerar un suelo como contaminado y con riesgo ambiental. Sin embargo, es de relevancia mencionar que en el experimento la concentración de Cu en la F1 (soluble intercambiable) representó la fracción biodisponible para plantas y animales, debido a su mayor movilidad. Según Tembo, Sichilongo & Cernak (2006) la Organización Mundial de la Salud (OMS) maneja un límite de concentración total de Cu en los suelos de 30 mg/kg para considerarlo contaminado. En el estudio realizado por Duarte et al. (2019) evaluaron el efecto del estiércol de vaca en la inmovilización de Pb, Cd, Cu y Zn directamente en los residuos mineros, donde reportaron una distribución de las fracciones químicas diferente a las encontradas en este trabajo, posiblemente porque los residuos pertenecían a un depósito de residuos mineros distinto, aunque sí de la misma zona. En la fracción soluble-intercambiable de Cu, se esperaba registrar una menor concentración de Cu en los tratamientos de mayor estiércol aplicado; sin embargo, con el estiércol de vaca la F1 aumentó probablemente debido a un incremento de la CE por el efecto de sales solubles en la movilidad de los metales en el suelo como ha sido reportado por (Usman, Kuzyakov & Stahr, 2005 y Acosta, Jansen, Kalbitz, Faz & Martínez-Martínez, 2011). Otra posibilidad, pudo ser por variación en la temperatura y la humedad, ya reportadas como influencia en la movilidad de los metales pesados en el suelo (Abollino et al., 2002).
Rodríguez, Ruiz, Alonso-Azcárate & Rincón (2009) establecieron un código de riesgo ambiental, que se basa en la fuerza del enlace entre los metales y las diferentes fracciones geoquímicas del suelo, los contaminantes contenidos en la Fracción soluble-intercambiable indican el riesgo que tienen sobre el ambiente, cuando la F1(soluble-intercambiable), es menor que el 1%, de la concentración total del elemento, no existe riesgo; por consiguiente, cuando F1 se encuentra en los siguientes rangos se valora el nivel de riesgo por ejemplo: en un rango de 1-10% el riesgo es bajo; de 11-30% medio; de 31-50% alto y mayor al 50% el riesgo es muy alto. Lo que nos indica en el presente trabajo es que existe un riesgo bajo en el resultado con los tratamientos donde se aplicó el estiércol de cerdo, ya que para F1 fue de 1.3 al 4.7%; y con el estiércol de vaca fue del 7 al 11% con un riesgo de bajo a medio.
La MOS tiene una elevada influencia sobre la retención de los metales pesados, siendo su composición y su dinámica en el suelo, factores importantes para el control de su movilidad (Zhou et al., 2018). No obstante, los metales unidos a la fracción ligera de la MO (F3) son más susceptibles a la oxidación y liberación de los contaminantes; mientras que los metales unidos a la fracción pesada de la MO, por el contenido de ácidos húmicos (F4), tienen una mayor estabilidad en el suelo (Shi et al., 2018). El estiércol de vaca presentó una mayor concentración de Cu en la F3, donde se extrae la fracción ligera de la MO, que de acuerdo con Bloomfield (1981), los complejos metálicos con ácidos fúlvicos, pueden ser promotores de la movilidad en el suelo. Por otra parte, los metales unidos a la fase sulfida (S=) después de la oxidación del azufre (SO =) son liberados en su fase catiónica M++ contaminando suelos y cuerpos de agua superficiales (Concas, Montinaro, Pisu & Cao, 2007). Los metales pesados registrados en la fracción residual (F6) son fuertemente estables, y ligados a la red cristalina de los minerales (Jiang et al., 2013).
Conclusiones
La elevada concentración pseudo-total de Cu contenida en los residuos mineros indica un riesgo importante para el ambiente y la salud de los pobladores y comunidades aledañas a Zimapán; sin embargo, con el uso de estrategias de remediación a través de materiales orgánicos, se pueden disminuir las concentraciones biodisponibles y se puede conocer el riesgo especifico que representa cada uno de los depósitos de residuos en el ambiente. No se observó una menor concentración de Cu soluble-intercambiable en los tratamientos con mayor aplicación de estiércol de vaca, probablemente debido al incremento de sales solubles, o a la presencia de una alta proporción de compuestos también solubles; mientras que con el estiércol de cerdo hubo una disminución, pero no estadísticamente significativa. La aplicación de estiércol modificó las fracciones químicas del Cu, en el de vaca se presentó una mayor concentración en F3, y en el de cerdo en F4, el Cu unido fuertemente con la MO, se le relaciona con la calidad de la materia orgánica adicionada que es muy importante en los procesos de retención del Cu. Los dos tipos de estiércol parecen tener gran interacción con el suelo y los residuos mineros, probablemente por la aportación de minerales arcillosos, ya que se observa una alta correlación entre la proporción adicionada y la concentración de cobre retenida en las fracciones residuales.











 nueva página del texto (beta)
nueva página del texto (beta)


