Introducción
Las frutas y hortalizas son tejidos vivos que están expuestos a un deterioro progresivo después de ser cosechados, ocasionado tanto por factores intrínsecos (fisiológicos y bioquímicos) como por factores extrínsecos (manejo, transporte y almacenamiento), además de la interacción con microorganismos patógenos causantes de distintas enfermedades en los mismos (Departamento de Agricultura de los Estados Unidos, USDA por sus siglas en inglés) (USDA, 2016). En este sentido, se estima que las pérdidas postcosecha a nivel mundial de frutas y hortalizas se sitúan entre el 30 y 50 % de la producción total (Porat, Lichter, Terry, Harker & Buzby, 2018), por lo que, su conservación representa un reto a nivel mundial (USDA, 2016; Rodríguez-Guzmán, González-Estrada, Bautista-Baños & Gutiérrez-Martínez, 2019). Con esta finalidad se han desarrollado y aplicado diversas tecnologías (bajas temperaturas, empaques con atmósferas modificadas, envasado al vacío y aditivos químicos), entre ellas la aplicación de recubrimientos comestibles, que actúan como una barrera física que protege al fruto de los factores ambientales, prolonga su vida de anaquel y le confiere valor agregado a los productos hortofrutícolas (USDA, 2016).
Los recubrimientos comestibles pueden ser elaborados a partir de proteínas, lípidos y/o polisacáridos. Los polisacáridos como el almidón, celulosa, pectina, alginato y quitosano destacan como los materiales más empleados para su elaboración (Rinaudo, 2014; Solano-Doblado, Alamilla-Beltrán & Jiménez-Martínez, 2018). Debido a sus propiedades antimicrobianas y de inducción de mecanismos de defensa en frutos, así como a sus propiedades tecnológicas (solubilidad, compatibilidad con compuestos orgánicos e inorgánicos y habilidad para formación de recubrimientos), el quitosano es una de las alternativas viables para la elaboración de recubrimientos comestibles (Berumen-Varela, Coronado-Partida, Ochoa-Jiménez, Chacón-López & Gutiérrez-Martínez, 2015; Bautista-Baños, Ventura-Aguilar, Correa-Pacheco & Corona-Rangel, 2017).
Investigaciones recientes se han centrado en la funcionalización del quitosano para la conservación de frutas y hortalizas, con lo que se ha demostrado que la incorporación de diversos compuestos orgánicos, inorgánicos y/o biológicos dentro de la matriz del quitosano ha mejorado y/o potencializado las propiedades tecnológicas y funcionales de este tipo de recubrimientos (permeabilidad al vapor de agua e intercambio de gases, propiedades mecánicas, actividad antimicrobiana y antioxidante), con lo que se han obtenido mejores resultados en términos de conservar la calidad de los frutos en los que se han utilizado, en comparación con la aplicación individual del quitosano o en frutos sin recubrimiento (Gol, Patel & Ramana-Rao, 2013; Fortunati et al., 2017; Hajji, Younes, Affes, Boufi & Nasri, 2018). El objetivo de esta revisión fue recopilar, describir y discutir los beneficios y limitaciones de la funcionalización con compuestos orgánicos, inorgánicos y/o biológicos de los recubrimientos comestibles a base de quitosano y su aplicación en productos hortofrutícolas.
Tecnologías de conservación e índices de calidad en frutos postcosecha
En la actualidad, se han estudiado diversas tecnologías para prolongar la vida útil de los productos hortofrutícolas como el uso de bajas temperaturas (refrigeración y congelación), inmersión en aditivos químicos, atmósferas modificadas, envasado al vacío y recubrimientos comestibles (de manera individual o en combinación). La finalidad de estas tecnologías es minimizar las pérdidas ocasionadas durante el manejo, transporte y almacenamiento postcosecha de los productos hortofrutícolas (USDA, 2016).
Actualmente, existen diversos índices utilizados para determinar la calidad de los productos hortofrutícolas y cambios postcosecha, los más importantes tienen relación con los parámetros fisiológicos (tasa de respiración y la producción de etileno), microbiológicos (presencia de microorganismos patógenos), físicos (pérdida de peso y firmeza) y fisicoquímicos (pH, acidez titulable y sólidos solubles totales) de los frutos (USDA, 2016). Asimismo, debe considerarse que durante y después de la cosecha, se pueden presentar cambios fisiológicos importantes en los frutos, algunos de estos son dependientes de la presencia de oxígeno, por ejemplo, la presencia de microorganismos fitopatógenos en la superficie del fruto puede promover un aumento en la tasa de respiración y la producción de etileno, lo que conduce a una mayor emisión de calor, incremento en la tasa metabólica y de descomposición en el fruto (USDA, 2016). Por lo que, una alternativa para minimizar estas reacciones metabólicas es la aplicación de recubrimientos comestibles (Bautista-Baños et al., 2017; Solano-Doblado et al., 2018). Adicionalmente, debe considerarse que cada tecnología tiene sus propias ventajas y limitaciones, ya que la eficacia de los tratamientos de conservación depende directamente de la interacción fruto-contaminación-almacenamiento (USDA, 2016).
Aspectos generales de los recubrimientos comestibles
Los recubrimientos comestibles son matrices complejas que, aplicadas al fruto, funcionan como una barrera protectora frente a factores ambientales (contaminación y microorganismos patógenos), y a su vez como una membrana semipermeable que permite el intercambio de gases (reducción de la disponibilidad de O2 e incremento de CO2), lo que favorece la creación de una atmósfera modificada entre el fruto y el recubrimiento que, principalmente, desacelera el metabolismo natural de los productos hortofrutícolas (tasa de respiración, producción de etileno), lo que resulta en una menor deshidratación y pérdida fisiológica de peso de los mismos (USDA, 2016; Solano-Doblado et al., 2018; Hajji et al., 2018; Jiao et al., 2019).
Un recubrimiento comestible es una capa delgada formada sobre el alimento, que puede ser aplicada por inmersión o aspersión (Solano-Doblado et al., 2018; Jiao et al., 2019). Estos pueden ser elaborados a partir de proteínas, lípidos y/o polisacáridos (solos o en combinación) provenientes de diferentes fuentes naturales (exoesqueleto de crustáceos, proteínas de soya y leche, almidón, pectinas, mucílago de nopal y gomas naturales) (Rinaudo, 2014; Solano-Doblado et al., 2018). La elección del material con el que se elaboran los recubrimientos estará en función del desempeño y características intrínsecas de cada material, como lo son costos, disponibilidad, propiedades mecánicas (tensión y flexibilidad) y ópticas (brillo, opacidad, transparencia), estabilidad, solubilidad, permeabilidad al vapor de agua y capacidad de intercambio de gases, adherencia al fruto y protección contra microorganismos patógenos o los asociados al deterioro del fruto. Dichos recubrimientos, deberán ser inocuos, biodegradables, incoloros e insípidos (USDA, 2016). Con base en esos criterios, uno de los materiales preferidos para este fin son los polisacáridos, de entre los cuales destaca el quitosano (Solano-Doblado et al., 2018; Mujtaba et al., 2019; Madera-Santana et al., 2019).
Quitosano como recubrimiento comestible
El quitosano es un heteropolisacárido formado por unidades de N-acetil-D-glucosamina mediante enlaces glicosídicos (β 1-4), que destaca por su biodegradabilidad, biocompatibilidad, funcionalidad, nula toxicidad, alta adherencia, propiedades antimicrobianas y capacidad para formar recubrimientos (Rinaudo, 2008; Bautista-Baños et al., 2017; Jiao et al., 2019; Mujtaba et al., 2019). Es un biopolímero de naturaleza policatiónica debido a la presencia de grupos amino en su estructura, los cuales juegan un papel importante dentro de las propiedades fisicoquímicas y biológicas del quitosano (Rinaudo, 2008; Berumen-Varela et al., 2015; Bautista-Baños et al., 2017). Se ha propuesto que las interacciones electrostáticas entre el grupo amino (que presenta alta densidad de carga) del quitosano con los grupos fosforilo presentes en los lípidos de membrana de los microorganismos son los principales responsables de la actividad antimicrobiana de este biopolímero (Bautista-Baños et al., 2017). Además, este grupo funcional, junto con los grupos hidroxilo (-OH) presentes en la estructura del quitosano pueden actuar como sitios activos para la interacción y/o adsorción de compuestos orgánicos e inorgánicos (Mohandas, Deepthi, Biswas & Jayakumar, 2017).
El quitosano puede obtenerse a partir de fuentes naturales (exoesqueleto de crustáceos, paredes celulares de hongos y algas) por medios químicos y/o enzimáticos a través de la desacetilación de la quitina (Bautista-Baños et al., 2017; Mujtaba et al., 2019). De acuerdo con la eficiencia y naturaleza del método de obtención, este biopolímero puede presentar diferentes grados de desacetilación (GDA) y peso molecular, lo anterior asociado al porcentaje de oxidación del quitosano y a la severidad de los procesos de desproteinización y desmineralización de cada método de obtención, además puede existir una despolimerización parcial de la quitina y por consiguiente resultar en un quitosano con peso molecular bajo (López, Rivas, Loaiza & Sabino, 2010). El GDA del quitosano determina la cantidad de grupos aminos libres que posee (a mayor GDA, mayor cantidad de grupos amino libres), lo que influye en las propiedades tecnológicas y funcionales del recubrimiento (Chen, Wang, Lai & Lin, 2003; Rinaudo, 2008; Mujtaba et al., 2019). Por ejemplo, la viscosidad de las soluciones del quitosano es influenciada por el GDA del biopolímero, como lo reportan Chen et al. (2003), que al utilizar quitosano con un GDA alto (> 85 %), la viscosidad de las soluciones formadoras de recubrimientos es baja (< 5 unidades de viscosidad rápida, UVR) en comparación con la obtenida al emplear quitosano con bajo (50 % = 30 UVR) y medio (75 % = 15 UVR) GDA, lo anterior, atribuido al incremento en la formación de puentes de hidrogeno con el medio, promovido por el incremento en las cargas positivas de los grupos amino del quitosano. En este contexto, se ha recomendado que para elaborar recubrimientos de quitosano uniformes y estables se empleen soluciones con baja viscosidad, debido a que una solución con una viscosidad alta es difícil de manejar y genera recubrimientos poco uniformes, con presencia de burbujas de aire, lo que afecta la calidad del mismo (Wu et al., 2016).
Los recubrimientos a base de quitosano se pueden preparar a partir de la disolución del quitosano en medios acidificados (preferentemente ácidos orgánicos) (Bautista-Baños et al., 2017) y se han empleado en la conservación de frutas y hortalizas debido a su actividad antifúngica (Berumen-Varela et al., 2015; Fortunati et al., 2017). Asimismo, el quitosano puede actuar como agente inductor de diferentes mecanismos de defensa del fruto (Romanazzi et al., 2016; Gutiérrez-Martínez, Bautista-Baños, Berumen-Varela, Ramos-Guerrero & Hernández-Ibáñez, 2017). Berumen-Varela et al. (2015) mencionan que el quitosano aplicado en frutos de mango, tiene un efecto positivo sobre la expresión y actividad de la enzima peroxidasa, que reduce los daños asociados a la presencia de microorganismos patógenos. Además, el análisis del transcriptoma de la interacción aguacate-Colletotrichum-quitosano, demostró que el quitosano induce la expresión de genes relacionados en la biosíntesis de compuestos fenólicos y regula un gran número de procesos metabólicos, que previenen la proliferación del fitopatógeno (Xoca-Orozco et al., 2017). Por su parte, Zhang, Wang, Hu and Liu (2015a) reportaron que la aplicación de quitosano al 0.2% en jitomate cherry induce la expresión de los genes MPK3, MPK6, PR1a1 y PR5, que le confiere al fruto resistencia en contra del moho gris causado por Botrytis cinerea, posiblemente asociado con la vía de señalización de la proteína quinasa activada por mitógeno (MAPK).
Factores como la viscosidad de la solución, temperatura de secado, modo de preparación, la concentración y tipo de ácido utilizado para su disolución, así como la concentración y el grado de desacetilación del quitosano, pueden limitar la efectividad de los recubrimientos resultantes, principalmente en términos de actividad antimicrobiana, rigidez y permeabilidad de gases (Rinaudo, 2008; Bautista-Baños et al., 2017; Jiao et al., 2019). Una alternativa para mejorar el desempeño (propiedades tecnológicas y funcionales) del quitosano como recubrimiento, es su funcionalización mediante la incorporación de diversos componentes orgánicos, inorgánicos y/o biológicos dentro de la matriz polimérica (Hajji et al., 2018; Kaewklin, Siripatrawan, Suwanagul & Lee, 2018; Jiao et al., 2019; Wang, et al., 2019).
Funcionalización del quitosano para la conservación de frutas y hortalizas
La funcionalización se define como la modificación de las propiedades fisicoquímicas de cualquier material mediante la incorporación de otro (Bilalis, Katsigiannopoulos, Avgeropoulos & Sakellariou, 2014). En general, existen dos tipos de funcionalización, covalente y no covalente (Layek & Nandi, 2013). La funcionalización covalente, se basa en la unión mediante enlaces covalentes y por reacción directa de los grupos funcionales de los diversos componentes, lo que en la mayoría de los casos, modifica las propiedades intrínsecas del material funcionalizado, mientras que la funcionalización no covalente o supramolecular, se basa en la adsorción física del material funcionalizante en la red (puede ser en la superficie) del material funcionalizado mediante interacciones electrostáticas o hidrofóbicas, sin alterar las características intrínsecas del material funcionalizado (Bilalis et al., 2014; Maccora et al., 2019).
En la actualidad existe un creciente interés por el desarrollo de tecnologías y/o materiales que permitan incrementar la vida de anaquel de los productos hortofrutícolas (USDA, 2016). Por lo que, la funcionalización del quitosano mediante la adición de compuestos orgánicos (compuestos bioactivos, ácidos orgánicos, aceites esenciales), inorgánicos (TiO2, SiO2, Ag), y microorganismos (levaduras y lactobacilos), además de la integración de otras biomoléculas como proteínas, polisacáridos y lípidos a la matriz polimérica mediante interacciones covalentes o no covalentes (Figura 1) puede ser una alternativa viable para mejorar las propiedades tecnológicas, funcionales y biológicas de este biopolímero (Rinaudo, 2008; Bautista-Baños et al., 2017; Solano-Doblado et al., 2018).
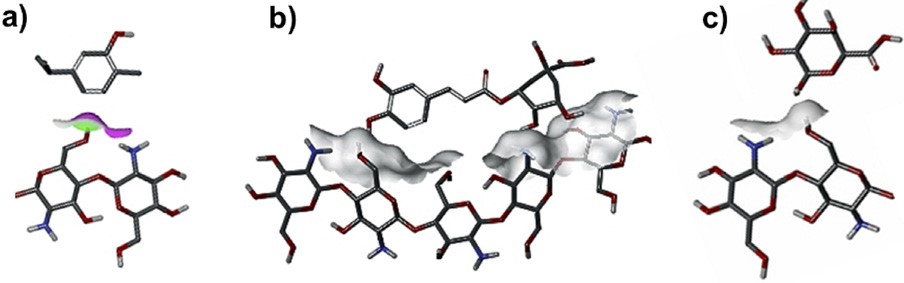
Fuente: Elaboración propia. Estructuras tomadas de la base de datos PubChem, National Center for Biotechnology Information (quitosano ID: 71853, carvacrol ID: 10364, ácido clorogénico ID: 1794427, pectina: 441476) y modificadas con uso del software Discovery Studio Predictive Science Application (Dassault Systèmes BIOVIA®).
Figura 1 Posible interacción estructural del quitosano funcionalizado con a) carvacrol, b) ácido clorogénico y c) pectina.
En la Tabla I se presentan algunos de los hallazgos más recientes relacionados con el uso de quitosano funcionalizado (RQF) con diferentes compuestos orgánicos e inorgánicos, así como su aplicación y principales efectos sobre los parámetros de calidad (fisicoquímicos, fisiológicos y microbiológicos), atributos sensoriales y vida de anaquel de frutas y hortalizas.
Tabla I Funcionalización de recubrimientos de quitosano y su efecto en la vida de anaquel de frutas y hortalizas.
| Fruto | *Composición del RQF | PM/GDA del quitosano | Aplicación | Almacenamiento | **Observación | Vida de anaquel (días) | Referencia |
|---|---|---|---|---|---|---|---|
| Fresa | Q-2 %; EA-hoja de Moringa oleifera 1% | NI/ 75 - 78 % | Recubiertas de forma manual con brocha de repostería y secado con corriente de aire frío durante 10 min. con secadora manual | 4 °C | Mejora índice de sabor (mayor dulzura), menor acidez. | 10 | Madera et al. (2019) |
| Melón | Q-1 %, AgNO3: 0.375 % | NI/ ≤ 75 % | Inmersión durante 8 min y secado con aire forzado a 10 °C durante 2 h | 5 °C con HR del 90 - 95 % | Reduce tasa de respiración, preserva atributos de calidad y sensoriales. | 13 | Ortiz-Duarte et al. (2019) |
| Durazno | Q-1 %, ácido clorogénico: 1% | 180 kDa / 85 % | Inmersión durante 2 min y secado en condiciones ambiente | 20 °C con HR del 80 - 90 % | Retarda proceso de maduración, mayor firmeza. | 8 | Jiao et al. (2019) |
| Toronja | Q-0.5 %, Cryptococcus laurentii 1×107 cels/mL) | NI/ 80 % | Inmersión durante 2 min y secado en condiciones ambiente | 20 °C | Mantiene calidad en general, mayor concentración de CF. | 28 | Wang et al. (2019) |
| Mandarina | Q-1.5 %, montmorillonita: 1 % p/v | 180 kDa/ 90 % | Inmersión durante 3 min y secado en condiciones ambiente | 10 °C con HR del 70 % | Menor tasa de descomposición, pérdida de peso y pérdida de sólidos solubles | 11 | Xu et al. (2018) |
| Albaricoque | Q-0.5 %, APS (50 g/L) | NI/ ≥ 90 % | Inmersión durante 3 min y secado en condiciones ambiente | 2 °C con HR del 75 % | Mejora textura, reduce degradación de pectina. | 42 | Zhang et al. (2018) |
| Mandarina | Q-1 %, ξ-polilisina: 7 % | NI/ ≥ 90 % | Inmersión durante 1 min y secado en condiciones ambiente | 10 °C con HR del 60 % | Preserva la calidad en general, retiene AA, menor incidencia de enfermedad. | 25 | Li et al. (2018) |
| Fresa | Q-2.4 %, carotenoproteínas: 0.005 % | 6120 g mol-1 / 75 % | Inmersión durante 3 min y secado en condiciones ambiente durante 15 min | 25 °C | Cambios mínimos en peso, pH y AT en comparación con el grupo control. | 11 | Hajji et al. (2018) |
| Jitomate | Q-1 %, nano-TiO2: 1 % p/v | 100 kg/mol-1 / 85 % | Inmersión | 20 °C con HR del 85 % | Retarda el proceso de maduración, mayor contenido de licopeno. | 15 | Kaewklin et al. (2018) |
| Lechuga | Q-0.1%, clorhidrato: 1 g/L | 60 kDa / 80 -90 % | Inmersión durante 30 s y secado en condiciones ambiente | 4 °C con HR del 90 % | Reduce incidencia de moho gris. | 7 | Fortunati et al. (2017) |
| Kiwi | Q-0.1%, clorhidrato: 1 g/L | 60 kDa / 80 -90 % | Inmersión durante 30 s y secado en condiciones ambiente | 4 °C con HR del 90 % | Reduce incidencia de moho gris. | 20 | Fortunati et al. (2017) |
| Nectarín | Q-1.5 %, alginato de sodio: 1 % | NI/ NI | Inmersión durante 2 min y secado en condiciones ambiente durante 30 min | 4 °C | Efectos negativos en parámetros de calidad. | 9 | Chiabrando & Giacalone (2016) |
| Fresa | Q-1 %, EA de Paeonia rockii: 125 µg/mL | 100 kDa /95 % | Inmersión | 4 °C | Extiende vida de anaquel sin alteración de atributos sensoriales. | 16 | Pagliarulo et al. (2016) |
| Plátano | Q-1.5 %, PLS: 3 % | NI/ 96 % | Inmersión durante 1 min y secado en condiciones ambiente durante 90 min | 25 °C con HR del 75 % | Prolonga aparición de pico climatérico, menor tasa de respiración. | 14 | Arce-Ortiz et al. (2016) |
| Guayaba | Q-3.0 %, estearina de palma a 4 % v/v | APM/ NI | Inmersión durante 15 s y secado en condiciones ambiente | 5 °C con HR del 80 - 85 % | Mitiga daños por frío, retiene mayor firmeza, reducción en emisión de CO2. | 31 | Nurul-Hanani et al. (2016) |
| Pepino | Q-0.5 %, ácido salicílico: 0.1 % | NI/ ≥ 90 % | Inmersión durante 5 min y secado con un ventilador | 2 °C con HR del 90 % | Mitiga daños por frío, previene oxidación de AA y clorofila. | 12 | Zhang et al. (2015b) |
| Pepino | Q-0.3 %, aceite esencial de canela 0.25 % | MPM /75 - 85 % | Inmersión durante 2 min y secado en condiciones ambiente | 10 °C con HR del 90 - 95 % | Extiende vida de anaquel, estabilidad microbiológica. | 21 | Mohammadi et al. (2015) |
| Fresa | Q-2 %, proteína de quinoa: 18 %, aceite de girasol: 2.9 % | NI/NI | Inmersión durante 1 min y secado en estufa con aire forzado durante toda la noche | 0 °C con HR del 90 % | Reducción en emisión de CO2, mantenimiento de calidad sensorial. | 15 | Valenzuela et al. (2015) |
| Arándano | Q-2 %, EA-hoja de arándano (8 %) | NI/ ≥ 90 % | Inmersión durante 15 s y secado en condiciones ambiente durante 30 min | 2 °C con HR del 95 % | Retrasa maduración, mayor retención de CF y mayor capacidad antioxidante. | 35 | Yang et al. (2014) |
| Mora azul | Q-1 %, carvacrol: 0.05 % p/v | 310 kDa/ 75 - 85 % | Inmersión durante 30 s y secado en condiciones ambiente durante 2 h | 10 °C | Reducción de la cuenta viable de bacterias y hongos, mantiene firmeza del fruto. | 7 | Sun et al. (2014) |
| Ciruela | Q-1%, AA: 40 mM/L | NI/ NI | Inmersión durante 15 min y secado en condiciones ambiente | 5 °C con HR del 90 - 95 % | Preserva calidad en general, incremento en enzimas antioxidantes. | 20 | Liu et al. (2014) |
| Uva roja | Q-1 %, β-CDT: 1 % | NI/ 85 % | Inmersión durante 3 min y secado con un ventilador | 4 °C con HR del 90 % | Incrementa enzimas antioxidantes. | 13 | Youwei & Yinzhe (2013) |
| Longan | Q-2 %, nano-SiO2: 0.5 % | APM-375 kDa/ 76 % | Inmersión durante 4 min y secado en condiciones ambiente | 25 °C con HR del 70 - 80 % | Reduce actividad de enzima polifenol oxidasa. | 8 | Shi et al. (2013) |
| Fresa | Q-1 %, CMC 1 % p/v | APM /82.7 % | Inmersión durante 2 min y secado en estufa a 26 °C durante 2 h | 11 °C con HR del 70 - 75 % | Mantiene calidad en general, mayor concentración de CF y antocianinas | 12 | Gol et al. (2013) |
| Fresa | Q-1 %, aceite esencial de limón: 3 % p/v | APM/ 75.6% | Inmersión durante 1 min y secado en condiciones ambiente durante 1 h | 5 °C con HR del 90 % | Preserva calidad en general, menor incidencia de moho gris, la presencia de AE de limón altera el aroma de la fresa | 7 | Perdones et al. (2012) |
| Fresa | Q-2 %, aceite esencial de canela: 0.1 % p/v | 128 kDa /66 % | Inmersión durante 90 s y secado con aire caliente para eliminar exceso de la solución | 5 °C | Reducción en crecimiento bacteriano, mayor vida de anaquel | 14 | López-Mata et al. (2012) |
| Jujube | Q-1 %, nano-SiO2: 0.04 % | 200 kDa/ 85 % | Inmersión durante 3 min y secado con un ventilador | temperatura ambiente con HR del 85 % | Retrasa senescencia, incrementa enzimas antioxidantes, mayor contenido de flavonoides. | 32 | Yu et al. (2012) |
| Carambola | Q-1 %, estearina de palma relación molar 1:1 | NI/ 85 % | Inmersión durante 15 s y secado en condiciones ambiente | 28 °C | Retrasa proceso de maduración, mantiene firmeza. | 20 | Nurul-Hanami et al. (2012) |
| Mango | Q-1 %, pectina: 0.2% multicapa | NI/ NI | Inmersión durante 15 min, repitiendo el proceso 5 veces para obtener multicapas con secado en condiciones ambiente | 4 °C con HR del 93 % | Mejora parámetros de calidad. | 45 | Medeiros et al. (2012) |
| Mango (cubos) | Q-2 %, aceite esencial de naranja y limón: 1 % v/v | NI/NI | Inmersión durante 10 min y secado en condiciones durante 1 h | 4 °C | Reducción en la cuenta viable de coliformes, psicrófilos, mohos y levaduras. | 12 | Rico et al. (2012) |
| Fresa | Q-1 %, almidón de yuca: 2 % | NI/ 98 % | Inmersión durante 1 min y secado en condiciones ambiente durante 3 h | 10 °C | Mejor apariencia y mayor retención AA. | 9 | Campos et al. (2011) |
| Pimiento morrón | Q-1 %, aceite esencial de canela: 0.25% | NI/ ≥ 95 % | Inmersión durante 5 min y secado con ventilador durante 50 min | 8 °C con HR del 95 % | Mayor contenido de AA y clorofila, mejora atributos sensoriales. | 35 | Xing et al. (2011a) |
| Jujube | Q-1 %, aceite esencial de canela: 0.75 % v/v | NI/ ≥ 95 % | Inmersión y secado en condiciones ambiente | 4 °C con HR del 90 - 95 % | Reduce actividad de enzima polifenol oxidasa, retiene contenido de AA y CF. | 20 | Xing et al. (2011b) |
| Lichi | Q-1 %, AA: 40 mmol/L | NI/NI | Inmersión durante 15 min y secado en condiciones ambiente | 5 °C con HR del 90 % | Reduce actividad de la enzima polifenol oxidasa, incrementa enzimas antioxidantes. | 30 | Sun et al. (2010) |
| Uva | Q-1 %, EA de semilla de uva: 0.1 % | NI/NI | Inmersión durante 1 min y secado en condiciones ambiente durante 1 h | 15 °C | Mantiene calidad general, reduce incidencia de moho gris. | 7 | Xu et al. (2007) |
| Mango | Q-0.5 %, Candida sp. 40 µL (1.5 x 106 UFC/mL) | NI/NI | Inmersión durante 5 min y secado en condiciones ambiente | 25 °C con HR del 95 % | Reduce signos de antracnosis hasta un 94 % | 7 | Chantrasri et al. (2007) |
*La composición del recubrimiento de quitosano funcionalizado (RQF) es tomando como base el tratamiento que presentó los mejores resultados; **La observación es en comparación con los resultados obtenidos al comparar frutos recubiertos con quitosano o frutos sin recubrir. PM: Peso molecular (APM: alto peso molecular, MPM: medio peso molecular); GDA: Grado de desacetilación del quitosano; Q: Quitosano; β-CDT: β-Ciclodextrina; AA: Ácido ascórbico; APS: Aislado proteico de soya; EA: Extracto acuoso; TA: Temperatura ambiente; CF: Compuestos fenólicos; HR: Humedad relativa; NI: No se presenta información
Funcionalización con aceites esenciales
La incorporación de aceites esenciales de canela, naranja y limón a recubrimientos a base de quitosano ha demostrado ser efectiva para prolongar la vida de anaquel de fresas (7-15 días a 5 °C), pepinos (21 días a 10 °C), jujube (20 días a 4 °C), pimiento morrón (35 días a 8 °C) y mango (11 días a 4 °C) (Xing et al., 2011a; Xing, Xu, Che, Li & Li, 2011b; Perdones, Sánchez-González & Vargas, 2012; Rico, Gutiérrez & Díaz-Moreno, 2012; López-Mata et al., 2012; Mohammadi, Hashemi & Hosseini, 2015). En general, los frutos tratados con los recubrimientos funcionalizados con aceites esenciales disminuyen su tasa de respiración, mantienen su firmeza y calidad (pH, sólidos solubles totales, acidez titulable y color). Además, reducen la incidencia y aparición de signos de enfermedad causada por los hongos B. cinerea en fresa (Perdones et al., 2012) y Penicillium citrinum en frutos de jujube (Xing et al., 2011b) y por el oomiceto Phytophthora drechsleri en pepino (Mohammadi et al., 2015), y les provee protección contra la proliferación de bacterias (reducción de coliformes, bacterias mesófilas aerobias y bacterias psicrófilas) durante su almacenamiento, en comparación con los frutos sin recubrir y/o recubiertos con quitosano sin funcionalizar (Rico et al., 2012). La baja incidencia de enfermedades en los frutos tratados se asocia directamente al control del patógeno causante de la misma por efecto aditivo o sinérgico entre el quitosano y los aceites esenciales (Gutiérrez-Martínez et al., 2017; Rodríguez-Guzmán et al., 2019). La incorporación de aceites esenciales a la matriz del quitosano mejoró significativamente las propiedades de barrera y de intercambio de gases (disminución en la permeabilidad de vapor de agua) (Perdones et al., 2012), lo anterior, atribuido a la naturaleza lipofílica de los aceites esenciales y al incremento del carácter hidrofóbico del recubrimiento, que eventualmente contribuye a retardar la maduración y deshidratación del fruto (Rinaudo, 2008; Mohammadi et al., 2015) sin detrimento en sus atributos sensoriales (sabor, color, apariencia, textura). Únicamente, se han reportado cambios en el sabor de fresas tratadas con el recubrimiento funcionalizado con aceite esencial de limón (Perdones et al., 2012). Adicionalmente, los frutos (pimiento morrón y jujube) recubiertos con quitosano funcionalizado con aceite esencial de canela presentaron una mayor retención de ácido ascórbico, compuestos fenólicos, flavonoides y clorofila en comparación con los frutos sin recubrir o recubiertos con quitosano sin funcionalizar (Xing et al., 2011a, Xing et al. 2011b), estos efectos pueden estar asociados principalmente a una reducción de la difusión del oxígeno entre el fruto y el recubrimiento, lo que ayuda a prevenir la oxidación de estos compuestos (USDA, 2016). El monoterpeno carvacrol, presente en el aceite esencial de algunas especies vegetales como orégano y tomillo (Robledo, Pierini, Díaz-Nieto, Fernández & Zon, 2019) ha sido utilizado para la funcionalización del quitosano y la conservación de la mora azul (7 días a 4 °C) con resultados positivos en mantener la calidad del fruto, similares a los ya descritos previamente (Sun, Narciso, Wang, Ference, Bai & Zhou, 2014). Sin embargo, este tipo de aceite puede presentar efectos fitotóxicos, citotóxicos y genotóxicos a concentraciones entre 0.375 y 3 mmol/L (de Assis-Alves et al., 2018), por lo que, resulta necesario evaluar la toxicidad potencial del sistema quitosano-carvacrol, cuando este compuesto se utilice como agente funcionalizante de recubrimientos de quitosano para la conservación de alimentos. Por otro lado, no todos los aceites esenciales con los que se puede funcionalizar el quitosano, brindan efectos positivos para la conservación de frutos. Por ejemplo, la funcionalización con aceite esencial de tomillo (0.1% p/v) y clavo (0.2 % v/v), no mostró ventajas sobre el control de Rizhopus stolonifer y Penicillium digitatum cuando se aplicó a jitomate y mandarina, respectivamente (Ramos-García et al., 2012; Shao et al., 2015).
Se ha reportado que la actividad antimicrobiana de los recubrimientos de quitosano funcionalizados se debe en gran medida a los grupos aminos libres del quitosano y a los enlaces formados con el aceite esencial, lo que permite al recubrimiento establecer interacciones electrostáticas con la pared externa del microorganismo, lo que resulta en interferencias sobre la síntesis de componentes esenciales para la célula, ya que el quitosano puede actuar como un agente quelante mediante la adsorción de iones metálicos esenciales para las reacciones enzimáticas, además de afectar directamente la estabilidad y permeabilidad (salida de K+ y entrada de Ca+) de la pared celular, lo que finalmente resulta en la inactivación o muerte de los microorganismos (Bosquez-Molina, Ronquillo-de Jesús, Bautista-Baños, Verde-Calvo & Morales-López, 2010; Yuan et al., 2016; Gutiérrez-Martínez et al., 2017; Ramos-Guerrero et al., 2018). Ramos-García et al. (2012) informaron que la combinación de quitosano con aceite esencial de lima y cera de abeja aplicado en jitomate afectó el desarrollo normal de R. stolonifer, mediante la alteración de las estructuras reproductivas del hongo, así como daño sobre el micelio e hifas del mismo. Yuan, Chen & Li (2016) sugieren que el efecto antibacteriano de los recubrimientos de quitosano funcionalizado con aceites esenciales contra microorganismos aerobios, pudiera incrementarse debido al bajo contenido de oxígeno entre el fruto y el recubrimiento.
Es importante resaltar que la efectividad de este tipo de recubrimientos sobre el control de los microorganismos estará en función de la pureza, grado de desacetilación y fuente de obtención del quitosano, además de la susceptibilidad de los microorganismos que se desee controlar, así como de la relación quitosano: aceite esencial, velocidad de liberación y disponibilidad de los aceites (Yuan et al., 2016; Gutiérrez-Martínez et al., 2017).
Funcionalización con extractos naturales, ácido ascórbico y ácido clorogénico
Los recubrimientos de quitosano también han sido funcionalizados con extractos acuoso-orgánicos de diferentes especies vegetales, como son Moringa oleifera, flores de Paeonnia rockii, hojas de arándano y semillas de uva para la conservación de las fresas (16 días a 4 °C), arándanos (35 días a 2 °C) y uva roja (28 días a 0-1 °C), respectivamente (Xu et al., 2007; Yang et al., 2014; Pagliarulo et al., 2016; Madera-Santana et al., 2019). Algunas ventajas particulares han sido reportadas para cada uno de estos recubrimientos. Por ejemplo, los frutos tratados con recubrimientos funcionalizados con extracto de flores de Paeonnia rockii y hojas de arándano exhibieron cambios mínimos sobre su calidad en general, así como mayor retención de ácido ascórbico y compuestos fenólicos en comparación con los frutos recubiertos con quitosano sin funcionalizar (Yang et al., 2014; Pagliarulo et al., 2016), lo anterior, sin modificar los atributos sensoriales de los frutos tratados (Xu et al., 2007; Pagliarulo et al., 2016). Por su parte, la aplicación de un recubrimiento de quitosano funcionalizado con extracto de Moringa oleifera mejora el índice de sabor y dulzura de las fresas, pero no los parámetros de calidad en comparación con el grupo control (Madera-Santana et al., 2019). En general, la composición de los extractos naturales que se agregan al quitosano, están fuertemente representados por compuestos con capacidad antioxidante demostrada (ácido ascórbico, compuestos fenólicos y flavonoides). Estos antioxidantes pueden reducir el ataque de microorganismos, disminuir reacciones de oscurecimiento en la cáscara de los frutos y disminuir el estrés oxidativo sobre todo en frutos precortados. Asimismo, su combinación con el quitosano puede cambiar la estructura del recubrimiento y reducir la entrada del oxígeno disminuyendo la tasa de respiración y producción de etileno, todo eso conlleva a retardar la maduración del fruto (Torres-Aguirre et al., 2018; Yuan et al., 2016). Adicionalmente, se ha reportado que el quitosano puede exhibir actividad antioxidante debido a la presencia de los grupos aminos libres, sin embargo, este efecto depende directamente de la concentración, peso molecular y grado de desacetilación del biopolímero (Kim & Thomas, 2007).
Liu, Yuan, Chen, Li & Liu (2014) demostraron que la aplicación del recubrimiento de quitosano con ácido ascórbico tuvo un efecto positivo sobre la firmeza y color de los frutos de ciruela durante 20 días a 5 °C, además de una disminución en la tasa de respiración en comparación con los frutos tratados individualmente con los mismos componentes. La retención de la firmeza fue asociada al decremento en las actividades enzimáticas de las enzimas pectin metil esterasa y poligalacturonasa. Por su parte, Sun, Liang, Xie, Lei and Mo (2010) reportaron una disminución en la actividad enzimática de la polifenol oxidasa y peroxidasa en frutos de lichi recubiertos con quitosano funcionalizado y ácido ascórbico, lo que ayudó a conservar la calidad del fruto durante su almacenamiento (30 días a 4 °C).
Por su parte, Jiao et al. (2019) evaluaron el efecto de la incorporación de ácido clorogénico en una matriz de quitosano y su efecto sobre la vida de anaquel en duraznos. Los autores reportaron que los parámetros de calidad (pérdida de peso, retraso de senescencia y tasa de respiración, sólidos solubles totales, acidez titulable, pH, retención de firmeza y ácido ascórbico) del fruto recubierto se mantuvieron adecuados durante 8 días a 20 °C. Estos efectos fueron atribuidos al efecto sinérgico entre el ácido clorogénico y el quitosano, así como a la disminución en la difusión de oxígeno entre el fruto y el recubrimiento.
Funcionalización con compuestos de origen proteico
Recientemente, diversos extractos proteicos (soya, quínoa, lactosuero y caroteno-proteínas) han sido aprovechados para funcionalizar al quitosano mediante la incorporación y homogenización de ambos componentes (Maccora et al., 2019), con el objetivo de prolongar la vida de anaquel del albaricoque (42 días a 4 °C), fresas (9-11 días a 4 °C) y plátanos (9 días a temperatura ambiente) (Valenzuela et al., 2015; Arce-Ortiz, Ortega-Villalba, Ochoa-Martínez & Vélez-Pasos, 2016; Zhang, Chen, Lai, Wang & Yang, 2018; Hajji et al., 2018). Los frutos tratados con los recubrimientos de quitosano con aislado de proteína de soya (albaricoque), quinoa y carotenoproteínas (fresas) mantuvieron estables los parámetros de calidad, principalmente la textura. Los efectos observados en albaricoque, se atribuyen a la inhibición de la degradación de la pectina presente en la pared celular del fruto (Zhang et al., 2018), mientras que los efectos observados en las fresas se asocian a la disminución en la emisión de CO2, que fue menor en comparación con frutos recubiertos sólo con quitosano (Hajji et al., 2018; Valenzuela et al., 2015). Adicionalmente, el uso de un recubrimiento funcionalizado con proteína de lacto suero retrasó (2 días) la aparición del pico climatérico en plátano en comparación con el fruto control (Arce et al., 2016). Di Pierro et al. (2006) mencionan que al funcionalizar el quitosano con matrices proteicas puede existir un mayor entrecruzamiento en la matriz, lo que mejora las propiedades mecánicas (esfuerzo a la tensión de 26.2 MPa) y de barrera (permeabilidad al oxígeno, CO2 y vapor de agua de 7.8, 8.3 y 0.88 cm3 µm/m2 día kPa, respectivamente) del recubrimiento resultante, en comparación con el recubrimiento de quitosano sin funcionalizar (esfuerzo a la tensión de 14.4 MPa, permeabilidad al oxígeno, CO2 y vapor de agua de 20.6, 20.7 y 3.24 cm3 µm/m2 día kPa, respectivamente). Es importante señalar que los resultados asociados al uso de aislados proteicos para funcionalizar quitosano, pueden optimizarse mediante cambios en las proporciones de cada componente del recubrimiento funcionalizado (Hajji et al., 2018).
Funcionalización con polisacáridos
Una alternativa viable para la funcionalización del quitosano es la adición de otros polisacáridos como la pectina, carboximetilcelulosa y almidón de yuca (Campos, Kwiatkowski & Clemente, 2011; Medeiros, Pinheiro, Carneiro-da-Cunha & Vicente, 2012; Gol et al. 2013), con lo que se mejoran las propiedades de barrera del recubrimiento (reducción en la permeabilidad de oxígeno y vapor de agua) y extiende la vida de anaquel de frutas y hortalizas con cambios mínimos en los parámetros de calidad (baja pérdida de peso con cambios mínimos en pH, acidez titulable y sólidos solubles totales), mayor retención de ácido ascórbico, compuestos fenólicos y antocianinas, además de mejorar su apariencia y brindarles protección antimicrobiana (Campos et al., 2011; Medeiros et al., 2012; Gol et al., 2013). Por otro lado, se han reportado efectos negativos sobre la calidad de los nectarines (4 °C, 95% HR, 9 días) al aplicar un recubrimiento de quitosano combinado con alginato de sodio, lo anterior, debido principalmente a la alta solubilidad y permeabilidad del vapor de agua del alginato de sodio, lo que rompe el equilibrio de la “atmósfera modificada” creada entre el fruto y el recubrimiento (Chiabrando & Giacalone, 2016). Aunque la funcionalización del quitosano con otros polisacáridos es una opción viable, deben considerarse factores como la solubilidad y estabilidad del biopolímero funcionalizante para obtener mejores resultados (Bautista-Baños et al., 2017; Rinaudo, 2014).
Funcionalización con agentes biológicos
La funcionalización del quitosano con agentes biológicos, principalmente levaduras y lactobacilos, es otra alternativa prometedora para minimizar las pérdidas postcosecha de frutas y hortalizas (Rojas-Grau, Soliva-Fortuny & Martín-Belloso, 2009). Chantrasri, Sardsud, Sangchote and Sardsud (2007) reportaron que la incorporación de Candida sp. al recubrimiento a base de quitosano minimizó la incidencia de antracnosis (hasta 94 %) causada por C. gloeosporioides en mango (7 días a 25 °C). De manera similar, Wang et al. (2019) reportaron que la funcionalización del quitosano con Cryptococcus laurentii redujo la incidencia del moho azul causado por P. italicum en frutos de uva (8 días a 20 °C). Además, a la matriz formada con quitosano y un agente biológico se le puede incorporar compuestos previamente encapsulados, como el ácido ascórbico, compuestos fenólicos y aceites esenciales que se liberan gradualmente bajo condiciones específicas, con el objetivo de mejorar las propiedades tecnológicas (mecánicas, fisicoquímicas, térmicas y de barrera) y funcionales (actividad antimicrobiana y antioxidante) del recubrimiento resultante (Yin et al., 2019). Sin embargo, aún se requieren más estudios para encontrar las condiciones adecuadas que permitan incrementar la vida de anaquel de los frutos tratados con este tipo de recubrimiento, sin afectar los atributos de calidad de los mismos, además de garantizar la viabilidad de los microorganismos empleados durante la funcionalización (Castillo-Escandón, Fernández-Michel, Cueto-Wong & Montfort, 2019).
Funcionalización con compuestos inorgánicos
Compuestos inorgánicos como el dióxido de silicio (Yu et al., 2012; Shi et al., 2013) y titanio (Kaewklin et al., 2018), montmorillonita (Xu, Qin & Ren, 2018) y plata (Ortiz-Duarte, Pérez-Cabrera, Artés-Hernández & Martínez-Hernández, 2019) se han utilizado para la funcionalización del quitosano con el objetivo de prolongar la vida de anaquel del fruto de jujube (32 días a temperatura ambiente), longan (8 días a temperatura ambiente), jitomate (15 días a 20 °C), mandarina (11 días a 10 °C) y melón (13 días a 5 °C), respectivamente; con modificaciones mínimas sobre parámetros de calidad y atributos sensoriales de los frutos en comparación con los controles recubiertos con quitosano sin funcionalizar. Se ha reportado además, que el recubrimiento de quitosano funcionalizado con TiO2 tiene la capacidad de degradar el etileno en presencia de luz UV (320 - 390 nm durante 180 min), debido a que el TiO2 tiene la capacidad de generar radicales •OH y especies reactivas de oxígeno en presencia de luz UV, los cuales a su vez pueden reaccionar con moléculas orgánicas como el etileno y descomponerlo en CO2 y agua, lo que ayuda a retardar el proceso de maduración de los frutos de jitomate (Kaewklin et al., 2018).
Funcionalización con otros compuestos
Se ha reportado que la funcionalización del quitosano con β-ciclodextrina extiende la vida de anaquel de uvas rojas (12 días a 4 °C) (Youwei & Yinzhe, 2013), mientras que, la funcionalización con clorhidrato prolonga la vida de anaquel de la lechuga (7 días) y kiwi (20 a 25 días, 4 °C), con una disminución en la incidencia del moho gris causado por B. cinerea y Pectobacterium carotovorum, respectivamente (Fortunati et al., 2017). De igual manera, Li, Ye, Hou & Zhang (2018) lograron extender la vida de anaquel (25 días a 10 °C) de frutos de mandarina tratados con un recubrimiento funcionalizado con ξ-polilisina, sin cambios en sus atributos de calidad y mayor retención de ácido ascórbico. Por su parte, la funcionalización con estearina de palma ha sido efectiva para prolongar la vida de anaquel de los frutos de carambola (20 días a temperatura ambiente) asociado a la reducción en la tasa de respiración y producción de etileno (Nurul-Hanani, Halimahton-Zahrah & Zaibunnisa, 2012). Resultados similares se reportaron al aplicar este tipo de recubrimiento (quitosano-estearina de palma) en guayaba (31 días a 5 °C), además de una disminución en el daño por frío y pérdida de peso en comparación con los frutos recubiertos sólo con quitosano o frutos sin recubrir (Nurul-Hanani, Halimahton-Zahrah & Zaibunnisa, 2016). Finalmente, la funcionalización con ácido salicílico ha sido efectiva para minimizar el daño por frío (12 días a 2 °C) y pérdida de peso (< 3 %) en pepino, además de favorecer la retención de ácido ascórbico y clorofila (Zhang et al., 2015b). Estos efectos se deben a que el ácido salicílico actúa como agente inductor para la activación del sistema de defensa del fruto, entre ellos la síntesis de proteínas de choque térmico, las cuales son proteínas que protegen a otras proteínas presentes en la membrana de la célula y evitan su desnaturalización, lo que retarda el deterioro de la membrana celular y pérdida de agua (Rasouli, Saba & Ramezanian, 2019).
Conclusiones
La funcionalización de recubrimientos comestibles mediante la incorporación de diversos compuestos es una alternativa viable para mejorar las propiedades tecnológicas y funcionales de los recubrimientos comestibles convencionales. El uso de recubrimientos a base de quitosano funcionalizado puede prevenir o minimizar la incidencia de enfermedades postcosecha, además de retrasar el deterioro natural de varios productos hortofrutícolas, conservar su calidad y aumentar su vida útil. Sin embargo, se requieren más estudios para mejorar las condiciones de obtención y aplicación de este tipo de recubrimientos comestibles en frutas y hortalizas, además de complementar la caracterización de sus propiedades fisicoquímicas, mecánicas y térmicas que pudieran condicionar el desempeño de los mismos tanto in vitro como in vivo.











 nueva página del texto (beta)
nueva página del texto (beta)


