Introducción
La flor de Dalia además de utilizarse como flor de ornato (nombrada la flor nacional mexicana), se ha usado como alimento en diversos platillos (Membre, Goubet & Kubaczka,1995; Bye & Linares, 2008; Díaz-López, 2017). Existen investigaciones que indican que esta flor posee algunos compuestos fenólicos de importancia para la salud humana (Bye & Linares, 2008; Lara-Cortés et al., 2014). Por su parte, Anan’ina, Andreeva, Mycots & Oganesyan (2009) señalan que la raíz de Dalia en forma deshidratada y pulverizada se ha empleado como parte de la gastronomía y la medicina herbolaria de México. Además, otros estudios indican que la inulina presente en sus raíces tuberosas sirve como fibra dietética y es considerada como un compuesto prebiótico que estimula especies bacterianas presentes en el colon como lactobacilos y bifidobacterias (Gibson & Beatty, 1995; Gibson & Roberfroid, 1995; López, Romero & Ureta, 2001; Huebner, Wehlingy & Hutkins, 2007; Puerta- García & Mateos-Rodríguez, 2010).
Dentro de las características con las que debe contar un producto para ser utilizado como alimento, destaca su inocuidad. Esto es que no contenga objetos, sustancias o microorganismos que pongan en riesgo la salud de quién los consume. Al respecto, los productos vegetales frescos merecen atención especial, ya que la transmisión de enfermedades entéricas a través de su consumo es un problema ampliamente conocido (Berger et al., 2010; Santana-Legorreta, Villanueva-Carvajal, Morales-Rosales, Laguna-Cerda & Domínguez-López, 2016; Alegbeleye, Singleton & Sant’Ana, 2018). Cabe destacar que, en plantas, esta contaminación proviene principalmente del agua de riego, que funciona como vehículo de transmisión de agentes patógenos como bacterias, virus y protozoos procedentes de la materia fecal de origen humano y animal (Marchetti, Casadei & Guerzoni, 1992; Leonila et al., 2017). Aunado a ello, la microbiota de los vegetales y frutas que crecen a ras del suelo está compuesta principalmente por microorganismos presentes de forma natural en el suelo, así como los que albergan las plantas en descomposición o bien por agentes microbianos que son incorporados después de la cosecha debido a la falta de higiene (Leonila et al., 2017).
Los principales agentes etiológicos relacionados con enfermedades transmitidas por vegetales y frutas frescas incluyen virus, bacterias, hongos y parásitos. Dentro de la población bacteriana que coloniza los vegetales frescos-cortados, típicamente encontramos levaduras, hongos, bacterias ácido-lácticas y bacterias de los géneros Pseudomonas spp., Xanthomonas spp., Janthinobacterium spp., Enterobacter spp.; y actualmente, como consecuencia de diversas prácticas agrícolas también se ha aislado en este tipo de productos, Listeria monocytogenes y Aeromonas hydrophila (Miceli & Settanni, 2019). Como principales enterobacterias (familia Enterobacteriaceae) que causan enfermedades transmitidas por el consumo de vegetales y frutas frescas, encontramos a E. coli, Enterobacter, Salmonella spp. y Shigella spp. (Alegbeleye et al., 2018).
Con respecto a la familia Enterobacteriaceae, ésta constituye un grupo grande y heterogéneo de bacterias Gram negativas, cuya reclasificación de varios de sus miembros ha sido propuesta actualmente con base a estudios de genómica comparativa (Alnajar & Gupta, 2017). Las bacterias miembros de este grupo reciben su nombre por la localización habitual como comensales intestinales, aunque se trata de bacterias ubicuas, que se encuentran de forma universal en el suelo, el agua y la vegetación, así como formando parte de la microbiota intestinal normal de muchos animales, además del hombre (NOM-093-SSA1-1994; Pachón-Cubillos, 2009). La importancia de este tipo de bacterias radica en que algunas son patógenos primarios para el ser humano (diversos patotipos diarréicos de E. coli, Salmonella spp., Shigella spp.) y en ocasiones cuando el paciente está inmunosuprimido (incluyendo pacientes alcohólicos y diabéticos), algunos miembros de esta familia se han reportado como causantes de infecciones, por lo que son considerados como patógenos oportunistas (E. coli, Enterobacter sp., Klebsiella sp., Citrobacter sp.), (Guentzel, 1996). Estas bacterias potencialmente patógenas, son comúnmente transmitidas por el agua contaminada, ocasionando diversas enfermedades de tipo gastrointestinal.
A nivel internacional, existe poca reglamentación con respecto al consumo de flores como alimento. En México, esta reglamentación es nula, no obstante, el Reglamento de control sanitario de productos y servicios de la Constitución, considera a las flores como un derivado de las frutas y hortalizas, por lo cual su objetivo es regular, controlar y fomentar la calidad sanitaria del proceso, importación y exportación, así como las actividades de servicios y establecimientos (DOF, 1999). La norma oficial mexicana NOM-093-SSA1-1994 (Mera-Ovando & Boettler, 2006), establece los límites máximos permisibles para coliformes fecales presentes en ensaladas verdes crudas o en frutas que son preparados en establecimientos fijos.
Por lo anteriormente expuesto, el aseguramiento de la calidad microbiológica de flores comestibles de Dalia resulta de vital importancia en la obtención de un alimento que sea inocuo para el consumo humano. El objetivo de esta investigación fue aislar e identificar bacterias entéricas predominantes en flores de Dalia.
Materiales y métodos
Material vegetal
Las flores de Dalia (Dahlia spp. var. Pompom) color púrpura fueron donadas por la Asociación Mexicana de la Dalia (AMD; Xochitla, Parque Ecológico, Tepotzotlán, México). Las flores fueron tratadas siguiendo los cuidados de riego, fertilización, control de plagas y enfermedades propios de la Dalia (Jiménez-Mariña, 2015).
Medios de cultivo y aislamiento bacteriano
Para el aislamiento bacteriano, fueron seleccionadas flores libres de daños mecánicos, insectos o signos de deterioro. Se pesaron 10 g de lígulas de flores de Dalias frescas y se incorporaron en 90 mL de caldo soya tripticaseína y caldo lactosado (MCD Lab.), respectivamente. Las muestras se homogenizaron y se incubaron a 35 °C por 24 horas. Al término de la incubación, las muestras se sembraron por estría cruzada en cajas de Petri que contenían gelosa soya tripticaseína (MCD Lab). Las cajas se incubaron a 35 °C por 24 horas. Pasado el tiempo de incubación, se realizó la tinción de Gram a los aislados obtenidos, así como la siembra de los aislados en medios de cultivo selectivos y diferenciales: gelosa de Xilosa, Lisina, Desoxicolato (XLD) (Becton, Dickinson de México), gelosa Verde Brillante (VB) (Laboratorios Britania), gelosa Mac Conkey (MCK) y gelosa Sulfito de Bismuto (SB) (MCD Lab.), con el propósito de observar las características morfológicas microscópicas y macroscópicas de las colonias aisladas. Cada medio de cultivo inoculado se incubó a 35 °C durante 24 horas.
Perfil bioquímico de los aislados bacterianos
Las colonias aisladas de Dalia se caracterizaron bioquímicamente usando el sistema de identificación BD BBL™ Crystal™ Identification Systems Enteric/Nonfermenter ID Kit (Becton Dickinson). Se hicieron determinaciones adicionales como las pruebas de oxidasa e indol. Los resultados fueron registrados posterior a las 24 horas de incubación a 35 °C ± 2 °C.
Identificación molecular de los aislados bacterianos
Preparación del cultivo
La bacteria se cultivó aeróbicamente en gelosa soya tripticaseína (AST) a 35 °C ± 2 °C durante 18-24 horas. Las células de un cultivo reciente (50-100 mg de biomasa bacteriana) (Toledo Hernández, 2013) se lavaron y resuspendieron en una solución de Mg2SO4 (10 mM). Y se mantuvieron hasta su utilización.
Extracción y purificación del DNA de los aislados bacterianos
La extracción del DNA fue realizada usando el método comercial ZR Fungal/ Bacterial DNA® (Zymo Research), con base en las instrucciones del fabricante. La integridad del DNA cromosomal, y los productos de PCR se evaluaron por electroforesis en geles de agarosa (1%) teñidos con bromuro de etidio (0.5 µg/mL) y se observaron en un transiluminador de luz ultravioleta a 254 nm. La concentración y pureza del DNA cromosómico se evaluó por espectrofotometría a 260/280 nm.
Amplificación de los genes 16S rRNA y gyrB del aislado bacteriano.
Los genes 16S rRNA y gyrB se amplificaron por PCR, con el método comercial DreamTaq PCR Master Mix 2X (Thermo Fisher Scientific, México). Los oligonucleótidos se utilizaron a una concentración de 10 pmol cada uno y 100 ng del DNA molde, en un volumen final de reacción fue de 50 µL. La secuencia de los oligos fueron: Pro K 63 5´-CAG GCC TAA CAC ATG CAA GTC-3´ y L1041 5´ GCG TGT GTA CAA GAC CC 3´ para el RNA 16 S (López et al., 2001), gyrB-UP1 5´ GAA GTC ATC ATG ACC GTT CTG CAY GCN GGN AAR TTY GA 3´ y gyrB-UP2r 5´ AGC AGG GTA CGG ATG TGC GAG CCR TCN ACR TCN GCR TCN GTC AT 3´, para amplificar gyrB ( Weinthal et al., 2007), gyrB-UP1 Sec 5´ GAA GTC ATC ATG ACC GTT CTG CA 3´ y gyrB-UP2r Sec 5´ AGC AGG GTA CGG ATG TGC GAG CC 3´, para secuenciar gyrB (Weinthal et al, 2007).La programación del termociclador (Lab. Net, Mod. Axigen MaxigeneII) consistió de una desnaturalización inicial a 95 °C por 5 min, seguida por 30 ciclos de 95 °C por 1 min, desnaturalización; 54 ºC (16 S rRNA) y 58 °C (gyrB) por 40 seg, alineamiento; y extensión a 72 °C por 80 seg; y al final un ciclo de extensión por 10 min a 72 ºC. Los productos amplificados de los genes fueron: ~1.3 pb para 16S rRNA y ~1.2 pb para gyrB. Los productos de PCR fueron purificados a partir de un gel de agarosa de bajo punto de fusión (1%) con un método comercial de purificación de PCR (GeneJet® Thermo Fisher Scientific), con base en las instrucciones del fabricante. Los productos de PCR fueron secuenciados (en ambas direcciones) en la unidad de síntesis y secuenciación del DNA del Instituto de Biotecnología, UNAM. Las secuencias se analizaron y editaron con el software ApE. Aplasmid Editor v2.0.45. Posteriormente, las secuencias fueron alineadas y comparadas para determinar la similitud con otras secuencias disponibles en la base de datos del Gen Bank (http://www.nlm.nih.gov) a través del Centro Nacional para la Información Biotecnológica (NCBI) de EE.UU., utilizando el programa bioinformático BLAST (http:www.ncbi.nlm.nih.gov/BLAST).
Construcción del árbol filogenético
Para la construcción del árbol filogenético se utilizaron las secuencias obtenidas de la base de datos del Gen Bank, correspondientes a los genes del marcador molecular gyrB, que codifican para la enzima DNA girasa. El árbol se enraizó tomando como referencia el clado externo Azotobacter vinelandii. El árbol filogenético fue construido con base en los valores de similitud de las secuencias, utilizando el método Neighbor Join (JN) y para el cálculo de las distancias genéticas se empleó el método Jukes-Cantor, ambos del programa de acceso libre MEGA 7 (http://www.megasoftware.net).
Resultados y discusión
Obtención de aislados bacterianos
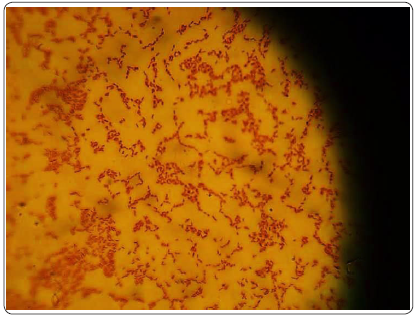
En los resultados de todas las muestras analizadas se observaron únicamente bacilos Gram negativos, delgados y cortos (Figura 1), al aislado se le denominó ET1. Las características del aislado ET1 de flores de Dalia se muestran en la Figura 2 y Tabla I. Los resultados de las características de la morfología colonial del aislado ET1 en medios de cultivo selectivos y diferenciales descartan que el microorganismo aislado, sea E. coli o Salmonella spp. (Balows, 1991). Esto debido a que no presenta las características típicas de estos microorganismos en los medios de cultivo utilizados (Tabla I).
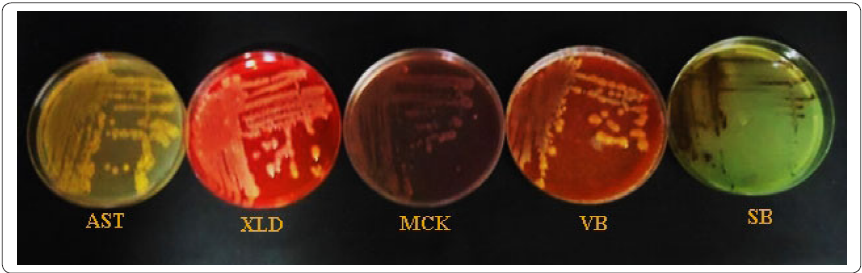
Figura 2 Crecimiento del aislado ET1 (Pantoea vagans) en diferentes medios de cultivo. Gelosa soya tripticaseína (AST), agar XLD, gelosa Mac Conkey (MCK), gelosa Verde Brillante (VB) y gelosa Sulfito de Bismuto (SB).
Tabla I Características morfológicas en medios de cultivo selectivos y diferenciales del aislado ET1 de flores de Dalia y características típicas de los microorganismos en los medios de cultivo utilizados.
| AISLADOS BACTERIANOS DE Dahlia sp. | |||
|---|---|---|---|
| Medio de cultivo | Aislado ET1 | E. coli* | Salmonella spp. * |
| Soya Tripticaseína | Colonias amarillas, circulares, rugosas, convexas, mucoides y húmedas. | - | - |
| Xilosa-Lisina-Desoxicolato (XLD) | Colonias circulares, amarillas, con halo transparente, convexas, mucoides, superficie lisa, brillante y húmeda. | Colonias grandes, amarillas con o sin precipitado de bilis. | Colonias de color rojo con el centro negro debido a la producción de H2S. |
| Mac Conkey | Colonias rosas brillantes, convexas con bordes irregulares, superficie lisa y consistencia mucoide. | Colonias de color rosa a rojo con precipitado de sales biliares que rodea a las colonias | Colonias incoloras |
| Verde Brillante | Colonias grandes, circulares, convexas, amarillas con un pequeño halo amarillo consistencia mucoide, superficie lisa y brillante. Fermentadoras de la lactosa. | Amarillo-verdosas sobre fondo amarillento Crecimiento entre nulo y moderado, colonias entre amarillas y amarillas verdosas, halo amarillo | Colonias pequeñas, incoloras, rosadas o fucsias, transparentes u opacas, sobre el medio coloreado de rosado a rojo |
| Sulfito de Bismuto | Colonias negras circulares convexas con brillo metálico y superficie rugosa | Crecimiento inhibido o colonias verdes | Colonias marrones o negras, algunas veces con brillo metálico alrededor de las colonias. Algunas cepas producen colonias verdes con poco o ningún oscurecimiento. |
*Manual of Clinical Microbiology. (1991). 5a Edición, American Society for Microbiology, Washington, D. C.
Perfil bioquímico del aislado bacteriano
Los resultados de las pruebas bioquímicas aplicadas al aislado bacteriano ET1 de flores de Dalia se muestran en la Tabla II, los cuales sugieren que corresponden a Enterobacter cancerogenus, bacteria que forma parte de la familia de las enterobacterias, recientemente propuesto por Adeolu, Alnajar, Naushad & Gupta (2016). Esta bacteria es considerada como un patógeno oportunista hospitalario, resistente a álcalis y antibióticos (Springer, Stockman, Teschner, Roberts & Bottger, 1996). Debido a que los resultados morfológicos y bioquímicos no coinciden con el perfil bioquímico y por tanto no pueden ser concluyentes, se procedió a la identificación del aislado ET1 de flores de Dalia con marcadores moleculares.
Tabla II Pruebas bioquímicas para la identificación del aislado ET1 de Dahlia.
| RESULTADOS | |||
|---|---|---|---|
| Prueba bioquímica | Aislado ET1 | E. coli* | Salmonella spp. * |
| Arabinosa | Positivo | Variable | Positivo |
| Manosa | Positivo | Positivo | Positivo |
| Sacarosa | Negativo | Negativo | Negativo |
| Melibiosa | Positivo | Positivo | Positivo |
| Ramnosa | Positivo | Positivo | Positivo |
| Sorbitol | Negativo | Positivo | Positivo |
| Manitol | Positivo | Positivo | Positivo |
| Adonitol | Negativo | Negativo | Negativo |
| Galactosa | Positivo | Positivo | Positivo |
| Inositol | Negativo | Negativo | Negativo |
| p-n-p-fosfato | Positivo | Variable | Negativo |
| p-n-p α-β-glucósido | Positivo | Negativo | Negativo |
| p-n-p-β-galactósido | Positivo | Positivo | Negativo |
| Prolinenitroanilide | Negativo | Negativo | Negativo |
| p-n-p bis-fosfato | Positivo | Variable | Positivo |
| Prueba Bioquímica | Aislados de Flores de Dalia | E. coli* | Salmonella spp.* |
| p-n-p-xilósido | Negativo | Negativo | Negativo |
| p-n-p-α-arabinósido | Positivo | (Negativo)p | Negativo |
| p-n-p-fosforilcolina | Negativo | Negativo | Negativo |
| p-n-p-β-glucurónido | Negativo | Positivo | Positivo |
| p-n-p-N-acetil glucosaminida | Positivo | Negativo | Negativo |
| γ-L-glutamil p-nitroanilida | Positivo | Negativo | Positivo |
| Esculina | Positivo | Negativo | Negativo |
| p-nitro-DL-fenilalanina | Positivo | Negativo | Negativo |
| Urea | Negativo | Negativo | Negativo |
| Glicina | Negativo | Negativo | Negativo |
| Citrato | Positivo | Negativo | Positivo |
| Ácido Malónico | Positivo | Negativo | Negativo |
| Cloruro trifeniltetrazolium | Positivo | (Positivo)p | Positivo |
| Arginina | Positivo | Variable | Positivo |
| Lisina | Positivo | Positivo | Positivo |
*Manual of Clinical Microbiology. (1991). 5a Edición, American Society for Microbiology, Washington, D. C. presultado más común.
Identificación molecular de los aislados bacterianos ET1
El resultado del alineamiento de la secuencia 16S rRNA del aislado bacteriano ET1 de flores de Dalia, mostró un 88% de identidad con diferentes especies del género Pantoea. Este hecho ha sido previamente señalado, indicando que las interrelaciones de los miembros del orden Enterobacteriales, se describen de forma limitada con árboles filogenéticos basados en este gen (Adeolu et al., 2016). Sin embargo, para el alineamiento del gen gyrB, se demostró una identidad de un 98% con cepas de Pantoea vagans, la cual incluye la cepa tipo P. vagans C9-1, de la cual se tiene su genoma secuenciado (Número de acceso CP002206). Estos resultados sugieren que el aislado ET1 aislado de flores de Dalia corresponde a Pantoea vagans ET1. Se construyó un árbol filogenético (Figura 3), con la secuencia de gyrB de P. vagans ET1, y de otras enterobacterias que se obtuvieron del Gen Bank (NCBI). En el árbol se observa que P. vagans ET1 aislada de flores de Dalia, se agrupa con otras cepas de P. vagans, la cual incluye a P. vagans PV989 (CP028349), cepa con la que exhibió la mayor similitud en los resultados de alineamiento con gyrB. En la identificación de aislados bacterianos con marcadores moleculares, el más usado es el 16S rRNA, pero como ya se mencionó, hay grupos bacterianos donde la identificación está limitada (Adeolu et al., 2016). En cambio gyrB presenta una mayor resolución tanto en grupos de Bacillus (Weinthal et al., 2007) como en este estudio. También comparando la identificación morfológica y bioquímica (fenotipo) con la identificación a nivel molecular (genotipo) de P. vagans ET1, se observa que éstas no coinciden. Al respecto Springer y colaboradores (1996) mencionan que el fenotipo (características morfológicas y bioquímicas) de una especie bacteriana, no es una propiedad absoluta, si no que puede exhibir una gran variabilidad. Esta variabilidad depende en gran parte de las condiciones ambientales así, como del hospedero del cual se aísle el microorganismo. De tal modo que las bacterias se caracterizan por mostrar una gran plasticidad fenotípica y metabólica. Además, la presencia de plásmidos (moléculas del DNA distintas al cromosoma bacteriano), aporta información genética adicional, aunque no esencial para la vida de diversas bacterias que los albergan. Los plásmidos, les confieren nuevas propiedades fenotípicas y en algunos casos, son útiles a las bacterias para su adaptación al crecimiento en determinados ambientes. Éstos pueden o no estar presentes en la célula bacteriana y por tanto son en parte responsables de la inestabilidad fenotípica. Tomando en cuenta la amplia diversidad fenotípica y genotípica que presentan las bacterias, es necesario realizar la identificación no sólo cultural y bioquímica, sino que también se debe recurrir a métodos moleculares (basados en la secuenciación genética) que hagan más robusta la identificación de este tipo de microorganismos.

Figura 3 Árbol filogenético utilizando la secuencia del gen DNA girasa (gyrΒ) de secuencias bacterianas obtenidas de la base de datos Gen Bank y de la bacteria aislada (P. vagans, ET1) de flores de Dahlia sp. La bacteria Azotobacter vinalandii DJ (*) se incluyó como clado externo. El árbol fue construido usando el método Neighbor-Join. El número en los nodos indica el valor del porcentaje bootstrap basado en 1,000 réplicas. La escala bajo el árbol filogenético indica el número de sustituciones por posición de los nucleótidos.
Por otro lado, respecto al microorganismo aislado e identificado en este trabajo, P. vagans, pertenece a la Clase de las Proteobacterias Gamma (γ). Anteriormente, se consideraba dentro de la familia Enterobacteriaceae. Sin embargo, recientemente, ha sido propuesta como un grupo separado del clado Klebsiella, en el clado Erwinia-Pantoea y dentro de un orden nuevo denominado Enterobacterales (Adeolu et al., 2016; Alnajar & Gupta, 2017).
P. vagans, es aislada de diversas áreas geográficas y fuentes ecológicas como plantas, semillas, agua, humanos y suelo (Koneman, Allen, Janda, Schreckenberger & Winn, 1997). Pantoea vagans (syn. Pantoea agglomerans, Erwinia herbicola) (Leonila et al., 2017) es una bacteria epífita común en plantas. La cepa C9-1, aislada de manzana Malus domestica ‘Jonathan’ (Michigan) (Ishimaru, Klos & Brubaker, 1988) está registrada como Blight Ban C9-1 (Nufarms America Inc., Burr Ridge, IL), para biocontrol del fuego bacteriano causado por la enterobacteria Erwinia amylovora. Sin embargo, a pesar de no ser una bacteria patógena como tal, algunos aislados han sido señalados como patógenos tumorogénicos (Grimont & Grimont, 2005; Weinthal et al., 2007). Como un patógeno oportunista en humanos, P. agglomerans puede ocurrir esporádicamente o en brotes. A principios de los años 1970, fue implicada en un brote de septicemia significativo en EE. UU. y Canadá, causado por cierres contaminados en las botellas de líquidos de infusión, donde 25 hospitales estuvieron involucrados, con 378 casos señalados (Maki et al., 1976). Koo y colaboradores (2006), en un estudio señalaron un total de 22 aislados de cepas de Pantoea, como agentes inusuales y causantes de infecciones clínicas. Las cepas fueron aisladas de cultivos sanguíneos de 9 pacientes, y un aislamiento del oído de un paciente, en el plazo de un mes en un hospital de tercer nivel. Considerando esta información, este hallazgo es de suma importancia debido a que las flores de Dalia se pueden consumir. Se sugiere monitorear la presencia de este microorganismo y eliminarlo, ya que puede representar un factor de riesgo para la salud humana.
Conclusiones
Con base en los resultados obtenidos el microorganismo aislado de flores de Dalia fue Pantoea vagans (Número de acceso CP002206). Con la consulta a la literatura realizada, este es el primer informe del aislamiento de P. vagans de flores de Dalia con fines de florifagia. Es importante que, en la floricultura, los productores que las cultivan con fines alimenticios sigan las buenas prácticas de higiene para garantizar la inocuidad microbiológica de sus productos. Debido a que la flor de Dalia está destinada al consumo como alimento, es necesario buscar alternativas de compuestos antimicrobianos contra P. vagans para que éstas sean inocuas para el consumidor o bien no causen problemas de sanidad vegetal en la flor.











 nueva página del texto (beta)
nueva página del texto (beta)