Introducción
El conocimiento de la biodiversidad puede enfrentarse desde diversos ángulos que en general contribuyen a entender a las formas de vida (organismos y especies) como “entes” con características únicas, además de que evidencian y resaltan patrones ecológicos, fisiológicos, anatómicos, morfológicos, filogenéticos, genéticos, etc., en que éstos se ven envueltos (e. g., Ackerly, 2003; Agrawal, 2007; Cadotte, 2012; Fine, 2015; Graham, 2011). La conjunción de formas de vida y patrones que les afectan obliga a preguntarse ¿cómo y cuándo las formas y patrones se vuelven únicos y diversos adquiriendo la habilidad de desarrollar procesos fisiológicos y metabólicos que permiten a los organismos y sus asociaciones no sólo crecer, desarrollarse, interactuar o morir, sino cambiar e influir en el mundo físico? (Ackerly, 2009; Axelrod, 1991; Becerra, 2005; Behrensmeyer et al., 1992). Los procesos son los que realmente generan las asociaciones e interacciones entre los organismos, y dan rasgos a las distintas formas de vida que las hacen únicas, irrepetibles y variadas en un momento dado y a través del tiempo (e. g., Benton et al., 2007; Blank & Sánchez-Baracaldo, 2010; Bond & Scott, 2010). En las próximas páginas se ejemplificarán momentos en los que la morfología y la anatomía, influenciadas por el medio ambiente han dado lugar a novedades que han enriquecido a la diversidad, alcanzando su máximo desarrollo en nuestros días. Sin embargo, hay que resaltar que la biodiversidad ha sido siempre importante, que sus interacciones han resultado variadas y distintas, y que el entendimiento de ellas amplía el concepto de la manera en la que la vida interactúa con otras formas de vida, o con el medio, estableciendo a través del tiempo patrones morfo-anatómicos, fisiológicos, reproductivos y/o ecológicos particulares que distinguen momentos diferentes (Figuras 1, 2, 3, 4, 5; e. g., Cornwell et al., 2014; Crepet et al., 2004). La explicación y observación de la biodiversidad puede enfocarse desde un punto de vista ecológico, genético o sistemático, pero sólo el estudio histórico a través del registro fósil permite conocer de manera directa la biodiversidad pasada; otras disciplinas plantean escenarios o alternativas que repetidamente son difíciles de ejemplificar con sólo la visión del mundo actual (Donoghue et al., 1989).

Figura 1 Inicio de la vida en la hidrósfera bajo condiciones contrastantes comparadas con el mundo actual. Presencia de gran actividad física y química, surgió la bioquímica, la fisiología y la genética logrando una manifestación organizada en los organismos. (Por Aldo Domínguez de la Torre).

Figura 2 SALIENDO DEL AGUA. La vida continuó restringida a los cuerpos de agua, pero la habilidad a vivir sobre las partes expuestas de los continentes continuó durante el Silúrico y desarrollándose durante el Devónico. (Por Aldo Domínguez de la Torre).

Figura 3 INTRUSIÓN MAYOR DE LA BIÓSFERA A LA ATMÓSFERA. La vida en las partes emergidas tendió a depender menos del agua, las plantas pasan de homospóricas a heterospóricas y finalmente desarrollan semillas, y crecen en altura y diámetro. Los detalles de sus procesos biológicos marcan grandes diferencias. (Por Aldo Domínguez de la Torre).

Figura 4 HACIA LA MODERNIZACIÓN. La adquisición del hábito de la semilla y el desarrollo de meristemos secundarios abre nuevas posibilidades para la reingeniería de las plantas en busca del ahorro y uso óptimo del agua. Ahora desarrollan embriones bipolares que generan raíces para anclar y absorber el agua. (Por Aldo Domínguez de la Torre).

Figura 5 ALCANZANDO EL ÉXITO Y PREPARÁNDOSE AL FUTURO. La semilla en el hábito angiospérmico disminuye aún más la necesidad del agua y el fruto revitaliza las interacciones entre animales y plantas, facilita la dispersión, aumentan las áreas de distribución, y surgen alternativas para diversificar a la vida, al punto que el regreso al agua parece una nueva e importante tendencia. (Por Aldo Domínguez de la Torre).
Generando un escenario
Antes de que la vida en la Tierra se estableciera y su diversidad aumentara, se presentaron condiciones que formarían lo que en este trabajo se refieren como escenarios (Figura 1). Éstos serían los sitios en los que la vida se desarrolló. Se pudiera comparar esta idea con obras de teatro. No en todos los escenarios tienen a los mismos actores, de acuerdo con el escenario se seleccionan los actores y éstos ejecutan una obra con características propias y particulares. Biológicamente esto implica que en un sitio particular se selecciona una comunidad con tipologías y procesos que sólo ahí pueden seleccionarse.
Pero entonces, ¿cuál fue el primer escenario en la Tierra sobre el cual la vida pudo desarrollarse? Las teorías sugieren que después de la gran explosión de una supernova y a través de la atracción de partículas por la acción de la fuerza de gravedad se formaron el núcleo, el manto y la corteza del planeta. Este proceso de acreción dio lugar a altas temperaturas fundiendo los elementos que estaban presentes y aparentemente generó repetidos eventos de vulcanismo (Figura 1). Entonces, en este momento la Tierra no era sólida y sus componentes se encontraban fundidos y eran semilíquidos (Canfield, 2005, Habicht et al., 2002; Walker, 1987). Conforme la Tierra se enfrió sucedieron eventos muy importantes. Por un lado, se formó una atmósfera, que pudiera llamarse secundaria, pues reemplazaría a la mezcla original de gases y en la que abundaron otros gases y elementos que se desprendían del interior de la Tierra debido al vulcanismo (Figura 1); entre otros pudieron estar presentes el hidrógeno, metano, amoníaco, dióxido de carbono, ácido sulfhídrico, y agua que escapaban en forma de vapor. Los meteoritos continuaron golpeando la Tierra y con ellos llegó agua que pudo ser parcialmente una importante fuente de líquido para formar los primeros mares (Figura 1) en donde se destacan algunos estromatolitos, escasa vida planctónica, y algunos representantes de la vida durante el Edacariano. Entonces, conforme la atmósfera cambiaba debido a fenómenos como la acreción y condensación, y los meteoritos colisionaban con la Tierra, los océanos se hicieron presentes (Figuras 1-2). Tiempo después, los continentes fueron tomando forma impulsados por la acumulación de granitos, formando los protocontinentes en cuyas plataformas continentales la vida encontraría más adelante condiciones favorables para establecerse (e. g., Canfield et al., 2006; Gerhart & Ward, 2010; Habicht, 2002; Kappler et al., 2005; Knauth, 2005; Walker, 1987). Durante estos primeros millones de años de existencia de la Tierra, se formó una atmósfera distinta a la que tenemos actualmente, se generaron grandes cuerpos de agua que funcionaron como mares, pero con una composición química distinta a los actuales, e inició la formación de los continentes (Figuras 1-2). Con ello se puede señalar que se establecieron algunas de las grandes capas naturales que reconocemos en la Tierra como son la atmósfera, la litósfera y la hidrósfera (Figuras 1, 2, 3, 4, 5). El o los escenarios sobre la Tierra en ese momento eran claramente distintos a los actuales, pero también fueron muy diferentes a los espacios que existieron entre estos dos extremos, el inicio y el hoy (e. g., Burchfield, 1998; Graham, 2011; Phillips, 1860; Zachos et al., 2001; Figuras 1, 2, 3, 4, 5). Estas capas tienen sus propios ritmos de cambio e interactuaron entre ellas de manera diferente a través del tiempo. En este trabajo la capa que más interesa es la biósfera, la última en formarse, que esperó las condiciones adecuadas para su desarrollo, mismas que son el resultado de las interacciones entre la atmósfera, la litósfera y la hidrósfera. Más adelante se menciona cómo la acumulación de cambios en las plantas da lugar a la biodiversidad, y al mejor manejo del agua a través de sus órganos reproductores y vegetativos, que son factores facilitadores del avance en la innovación morfo-anatómica y propulsores de los procesos vitales.
Hipótesis
La falta de conocimiento y/o entendimiento de la evolución de las plantas a través del tiempo restringe la discusión. Al hablar de las gimnospermas del Paleozoico o del Mesozoico, o de las angiospermas del Cretácico se piensa que poseen las características de las actuales. Sin minimizar la importancia de las actuales para entender las diferencias y semejanzas con sus ancestros. Es a través de estas comparaciones que se puede entender cómo se generaron nuevos grupos de plantas, asociaciones y comprender la forma en que interactuaron los organismos, las especies y como éstas colonizaron los espacios. A través de esta práctica los procesos que impulsan cambios, adaptaciones, radiaciones, extinciones, etc., se convierten en propulsores de la biodiversidad.
Materiales y métodos
Este trabajo está basado en la investigación que sobre plantas fósiles se ha realizado por más de 200 años. Es imposible resumirla en unas cuantas páginas, pero es posible resaltar algunos aspectos que permitan entender momentos determinados en la historia evolutiva de las plantas. Se explica el surgimiento de algunas innovaciones en la biósfera dividiendo la historia en cuatro episodios a través de los cuales se pueden comparar semejanzas y diferencias en las plantas de distinto o mismo linaje, pero de momentos disímiles, y así comprender el significado histórico de sus representantes fósiles. Esto se hace siguiendo algunos aspectos de las estrategias de las plantas por independizarse del agua, sin ser esto una revisión exhaustiva del tema.
Resultados
Se presentan ocho figuras (Figuras 6, 7, 8, 9, 10, 11, 12, 13) como una muy pequeña muestra de las plantas del pasado para dar seguimiento al escrito. Para más información se sugiere ver libros de paleobotánica y/o artículos en que se describen estas plantas. Se eligieron representantes del pasado de grupos que muestran su semejanza con las actuales, pero que claramente se ven distintas respecto a éstas. Se incluyen, además, cinco (Figuras 1, 2, 3, 4, 5) dioramas de las eras geológicas para mostrar la evolución de la vida y sus comunidades.

Figura 6 Plantas del Devónico inferior, Rhynia, Horneophyton y Steganotheca, y algunos descendientes, Equisetites, Isoestites, y Lepacylotes. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 7 Plantas del Paleozoico superior (Devónico-Pérmico), llegan a ser árboles con hojas y sin raíces verdaderas, como sus ancestros del Devónico tienen embrión unipolar y cambium unifacial. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 8 Las gimnospermas fueron variadas, diversas e importantes desde el Carbonífero. Sus órganos vegetativos son semejantes a los de las coníferas actuales, pero sus órganos reproductores eran distintos e igual el proceso de captura del grano de polen, traslado a la cámara polínica y fecundación. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 9 Las gimnospermas en el Mesozoico fueron también diversas, sus estrategias reproductoras fueron variadas, como lo siguen siendo en la actualidad. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 10 Los helechos fueron un grupo variado desde el Paleozoico superior. Aunque en general son pequeños, los hubo arborescentes y alcanzaban tallas de varios metros de altura. Formaron tallos falsos, compuestos por varios tallos verdaderos pequeños que se entrelazaban y se rodeaban de un manto de raíces adventicias. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 11 Las angiospermas son el grupo que desde el Cretácico ha dominado el paisaje. Sus pétalos y sépalos, al igual que sus frutos añadieron color a la biosfera, además tuvieron la peculiaridad de ofrecer aromas y sabores a los animales. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp

Figura 12 Conforme recorremos el tiempo hacia el Reciente las plantas se parecen más a las actuales, géneros actuales son cada vez más frecuentes a partir del Paleoceno y las especies a partir del Mioceno, pero la forma de asociarse para formar comunidades varía. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp
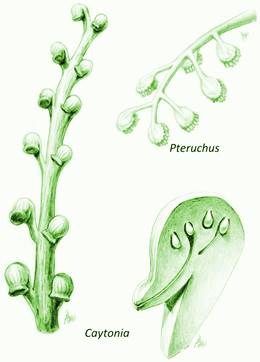
Figura 13 Varios grupos de gimnospermas intentaron encerrar a los óvulos, semejando el gineceo de las angiospermas, pero sólo un grupo (por reconocer) lo logró exitosamente y dio paso a las plantas con flor. Modificado de Taylor, Taylor & Krings (2009) y http://www.michaelwachtler.com/en/biographie-michael-wachtler.asp
Discusión
Manifestación de la biósfera (Episodio 1)
Todavía es motivo de discusión la forma en que se originó la vida, pero cada vez hay mayor consenso en que ésta procede de la interacción entre los elementos de la atmósfera primitiva en la que las altas temperaturas, descargas eléctricas, falta de capas en la atmósfera (e.g. la capa de ozono), y una mayor exposición a los rayos UV, dieron origen a compuestos relacionados sólo con los seres vivos. Éstos se han sintetizado en los laboratorios y están representados por algunos compuestos orgánicos como los aminoácidos, lípidos, urea, ácido acético, etc., y a partir de ellos se formaron compuestos más complejos que fueron “encapsulados” por otros pero que en conjunto pudieron reproducirse y replicarse (Bowler et al., 2013; Hernández & Piccirill, 2013; Hsiao, 2013). Aproximadamente a los 3,900-3,800 millones de años antes del presente, se da lo que se llama la síntesis prebiótica en la que se forman moléculas precursoras del RNA, para dar lugar a momentos caracterizados por su presencia, posteriormente del RNA y proteínas y finalmente del RNA, DNA y proteínas (Bowler et al., 2013; Hernández & Piccirilli, 2013; Hsiao, 2013).
Muchos de estos procesos o eventos no se conservaron en el resgistro fósil, otros pueden interpretarse de manera indirecta en las rocas, en donde dejaron evidencia de las actividades que se suscitaron para dar origen a la atmósfera, litósfera, hidrósfera y biósfera (Figuras 1-2; e.g., Hedberg, 1965). La lectura de las rocas es complemento importante para entender la historia geológica y natural de la vida pasada, pero también la influencia que tuvieron los cambios que la atmósfera y la hidrósfera sufrieron a través del tiempo. Si se deja aparte esta historia, la visión de la vida a lo largo del tiempo es fragmentaria y alejada de la realidad. Cuando toda esta información se reúne es sorprendente comprobar como el pasado y el presente tienen muchas cosas en común, pero también admirables diferencias que han dado lugar a la diversidad que encontramos a través del tiempo (e. g., Benton & Emerson, 2007; Brodribb & Feild, 2010; Cadotte et al., 2012; Field & Arens, 2005; Fine, 2015; Graham, 2011).
El estudio de los fósiles de los primeros organismos conservados en la roca esclarecen la evidencia indiscutible y más antigua que se tiene sobre la vida establecida hace 3,700 millones de años (Figura 1) y donde destacan algunos estromatolitos, escasa vida planctónica, y además otros grupos (Nutman et al., 2016; Mattheew et al., 2017). Esto significa que éstos existían antes, pues de otra manera no se hubieran podido registrar. Los estromatolitos más antiguos fueron descubiertos en Groenlandia en rocas de la edad citada, y la causa, el calentamiento global que derritió el hielo que los cubría. Existe también evidencia de vida presente hace 4,100 millones de años, pero los registros que se tienen de los posibles compuestos químicos aún son cuestionables, ya que demostrar su originalidad no ha sido tarea sencilla (e. g., Mojzsis, 1996). También, se han registrado estructuras que parecen fósiles, pero cuya conservación no es del todo convincente, y por lo mismo para la mayoría de los investigadores no son más que pseudofósiles (e. g., Lindsay et al., 2005). A partir de los 3,700 millones de años, la evidencia de vida es cada vez más confiable y abundante, especialmente a partir de los 3,500 millones de años. Así, mientras que la biodiversidad en un inicio debe entenderse a través de moléculas y compuestos orgánicos, poco tiempo después organismos comparables con algunos de la actualidad están bien representados y dan una imagen renovada de la biodiversidad pasada (Figuras 1-2; e. g., Hernández & Piccirilli, 2013; Taylor et al., 2009; Walker, 1987).
Procariontes
Los primeros organismos que se conocen y que se presume fueron responsables de construir estromatolitos son representantes de los procariontes (Figura 1). Estos se asumen como organismos bentónicos que carecen de membranas al interior de su cuerpo unicelular. Seguramente existieron otros organismos de vida libre que se podrían incluir en el plancton o necton de aquel tiempo, que también interactuaban con el mundo físico (Canfield, 2005; Canfield et al., 2006; Gould, 1996). Los primeros organismos fueron células cocoidales (esféricas) que pueden interpretarse como un punto en el espacio que al reunirse formaron una línea, lo que produjo una nueva geometría en los cuerpos de estos organismos que los llevó a interactuar de manera distinta con su medio, comparado con los organismos unicelulares. Se pude hipotetizar que un tercer momento en el aumento de la complejidad geométrica de los cuerpos de los organismos precámbricos fue el apilar en un plano varias de estas líneas, formando una “pared”, que obviamente resulta en novedosas interacciones con el cuerpo de agua. Finalmente, si se ordenan estas paredes de manera paralela los organismos tomaron formas de paralelepípedos (Battistuzzi et al., 2004). Conforme la manera de ocupar el espacio por los organismos cambiaba, también su metabolismo pudo intervenir directamente en la precipitación de CO2 y así los microorganismos fueron capaces de construir rocas finamente laminadas sobre el sustrato en que vivían. Esto tiene también implicaciones importantes para la vida (Battistuzzi et al., 2004; Matthew et al., 2017). Es indudable que, al menos a partir de ese momento, existían organismos bentónicos que tuvieron la capacidad de formar comunidades constructoras con la habilidad de repetir la forma de sus edificaciones, mismas que sin lugar a duda modificaron el espacio y las condiciones en los cuerpos de agua (Figuras 1-2; e.g., el movimiento de corrientes, la fuerza de éstas, etc.). Esto también generó variados nichos en los que la vida pudo encontrar nuevas condiciones, para desarrollarse pues las plataformas continentales relativamente lisas y uniformes en sus características comenzaron a ser irregulares en su superficie. Estos ejemplos, plantean cómo los organismos comienzan a interactuar entre ellos y con el medio físico, generando condiciones que les ofrecen a la vez nuevas oportunidades para diversificarse (Hartwell et al., 1999; Palmer et al., 2000).
Los organismos no sólo desarrollaron en su metabolismo la habilidad de precipitar CO2, sino que pudieron utilizar el O2 cambiando las condiciones de la atmósfera, la cual varió de reductora a oxidante, aunque algunos otros investigadores opinan que ocurrió al revés, es decir, de oxidante a reductora, lo importante en este contexto es que cambió. Estas historias pueden leerse en las rocas pues como atestiguan las llamadas Formaciones Bandeadas de Hierro se depositaron en momentos diferentes. Las primeras se conocen de hace ca. 3,800 millones de años, un segundo depósito de hierro se acentúa casi 1,000 millones de años después, y finalmente un tercer momento se da hacia finales del Precámbrico, ca. 800-600 m.a.a.p. (Kappler et al., 2005). La formación de estos depósitos tiene explicaciones variadas que se insertan en las condiciones de la Tierra en cada uno de estos momentos, pero explicarlos aquí, escapa al enfoque de este escrito. Lo importante en este momento es que las condiciones de la atmósfera cambiaban y los organismos tenían que aprovechar las nuevas circunstancias para continuar teniendo un balance con el mundo físico (e. g., Hazen & Sverjensky, 2010; Hernández & Piccirilli, 2013). El producto de estos cambios la ejemplifica la primera gran extinción hace ca. 2,800 m.a.a.p. en la que los organismos anaerobios se vieron muy afectados y los aerobios favorecidos. Las formas de vida cambiaron y las interacciones con el medio ambiente también se vieron afectadas (Benton & Emerson, 2007; Gould, 1989; Lin et al., 2014).
Protistas
La interacción entre organismos llega a un punto culminante cuando hay una simbiosis entre ellos, lo que da lugar a que una célula contenga a otra y funcionen coordinadamente. Por ejemplo, a través de la simbiosis surge el núcleo en los seres vivos, y con ello un nuevo tipo de organización, los eucariontes, entidades con membranas al interior de su cuerpo (Figuras 1, 2). Este cambio impulsa nuevas estrategias de vida de las que se pueden señalar dos muy importantes: en una el tamaño de los organismos aumenta y en la otra aparece la reproducción sexual (Figuras 1-2; Berney & Pawlowski, 2006; Koonin, 2010). A través de ésta, la recombinación de la información genética proveniente de dos organismos distintos ayuda a generar la diversidad. En este momento la biología del Precámbrico cambia significativamente. Por casi 1,800 millones de años los seres vivos no conocieron la reproducción sexual y el intercambio genético era en el mejor de los casos muy restringido o esporádico, ya que el aumento de la diversidad se llevaba a cabo por otros caminos. Es a partir del nivel de organización eucarionte y con ello el surgimiento de la reproducción sexual que se abren alternativas nuevas para los organismos, mismas que a través del tiempo explotan dando como resultado una gran variedad de grupos y procesos biológicos (Berney & Pawlowski, 2006; Koonin, 2010). Un primer episodio de gran importancia en la biología, aunque no bien documentado, es la aparición en algún momento de los ciclos de vida haplobióntico y diplobióntico. El primer caso, es característico de las algas en el que el gametofito domina, y el segundo, característico de los animales en el que el esporofito es dominante (Figuras 1-2). A partir de este momento, que aún no se puede marcar con precisión, tienen que transcurrir casi 1,000 millones de años más para que se dé una gran radiación en la que aparecen prácticamente todos los grupos de animales actuales, junto con otros muchos más que se extinguieron (Figura 2; Gaidos et al., 2007).
Los metazoarios se definen actualmente como un grupo monofilético que evoluciona de protistas coloniales, los coanoflagelados (Canfield et al., 2007; Gaidos et al., 2007; Gould, 1989; Koonin, 2010). Curiosamente las plantas tienen que esperar otro momento para expandir su diversidad, sin embargo, los organismos fotosintéticos que viven en el agua, como las algas, continúan diversificándose. Éstas son el grupo, del que las plantas vasculares se desarrollaron posteriormente.
En este espacio no se detallan las innovaciones que tuvieron los organismos y las especies a lo largo del Precámbrico, pero, así como se mencionó la forma en que los primeros procariontes cambiaron su manera de interactuar con el medio de ser un “punto” a ser “paralelepípedos”, los eucariontes siguieron un camino semejante, los hay unicelulares, pluricelulares (formados a partir de varias células que se coordinan) y multicelulares (formados a partir de una célula con divisiones de trabajo). Pero la primera gran radiación de organismos se puede relacionar con la Fauna de Ediacara (Figuras 1-2), en donde todos los organismos tienen cuerpos blandos, y distintas simetrías, incluyendo las bi y tridimensionales (ver MacGabhann, 2014). Un segundo evento de radiación que generó una nueva diversidad de organismos que aparecen en el Cámbrico. Se distinguieron por tener 2 características que sólo se pueden explicar, si antes hubo un cambio en los organismos que les precedieron. Los de cuerpo blando de Ediacara son difíciles de relacionar con estos nuevos grupos, lo que hace inevitable preguntarse ¿a partir de qué o de quién evolucionan las nuevas formas? No hay una respuesta clara en este momento, pero es un hecho que la simetría bilateral fue seleccionada y favorecida, lo que permitió otra serie de adaptaciones como son el establecimiento de la tripoblastia, y con ello la diferenciación de un celoma, de órganos y sistemas, como el sistema nervioso y el sistema digestivo con ano y boca (Gaines, 2014; Gould, 1989). Estas nuevas características inducen nuevamente a un cambio en las relaciones entre organismos, por lo que se incrementa la lista de consumidores, filtradores, difusores y depredadores (Figura 2, donde se ilustran algunos organismos fotosintéticos que cambian su ciclo de vida a la alternancia de generaciones, y diversifican estrategias de vida (e.g., briofitas vs pteridofitas). Además se observan costras biológicas, Prototaxites, Rhynia, Asteroxylon, Horneophyton, Nothia, Palaeocharinus rhyniensis (araña), Esponja, Anomalocaris, Hallucigenia, Trilobite, Wiwaxia, Pikaia, Medusa, Orthoceras (nautiloideo), pez mandibulado).
La biósfera emigra a la atmósfera (Episodio 2)
Durante el Fanerozoico continúan los eventos en la Tierra que al comprenderlos sorprenden. Los mares y la atmósfera continúan su evolución hacia las condiciones actuales, esto implica que lo que conocemos hoy se estableció recientemente, pero también hace evidente que siempre han existido variaciones y que inevitablemente cambiarán hacia el futuro. La biósfera establece su paso y en cierta forma lo acelera para ocupar y llenar espacios en la hidrósfera, litósfera y atmósfera. La biósfera básicamente estuvo restringida a la hidrósfera durante el Precámbrico, aunque ahora es cada vez más completa la documentación de costras biológicas sobre las partes emergidas de los continentes durante ese tiempo (Bowker et al., 2010). Esto implica que existía vida continental que sobresalía de la superficie unos cuantos milímetros y que estaba formada también por microorganismos semejantes a los que vivían en los cuerpos de agua. Las costras biológicas, pudieron facilitar el avance de otras formas de vida a los continentes pues seguramente fueron importantes modificadores de la hidrología de los ecosistemas terrestres, logrando captar y perder agua a tasas muy lentas, lo que permitía a la superficie continental almacenar agua, ofreciendo condiciones de humedad a los organismos y facilitándoles salir de los cuerpos de agua. Pero, además, su presencia modificó los procesos de erosión y como sucede en la actualidad, pudo ser fuente de elementos importantes para la vida como lo son el carbono y el nitrógeno. Las costras biológicas estuvieron presentes por muchos millones de años antes de que Metafita “colonizara” las partes emergidas de los continentes durante el Silúrico-Devónico, hace ca. 420-415 m.a.a.p., o ca. 120 m.a.a.p. después de la gran explosión del Cámbrico (542 m.a.a.p. aproximadamente). Las formas de vida autótrofas de ese momento, aunque son más semejantes a las formas que hoy conocemos, son claramente distintas en sus estrategias y en muchos de sus procesos (Figura 2, se ilustran algunos organismos fotosintéticos que cambian su ciclo de vida a la alternancia de generaciones, y diversifican estrategias de vida (e.g., briofitas vs pteridofitas). Además, se muestran costras biológicas, Prototaxites, Rhynia, Asteroxylon, Horneophyton, Nothia, Palaeocharinus rhyniensis (araña), Esponja, Anomalocaris, Hallucigenia, Trilobite, Wiwaxia, Pikaia, Medusa, Orthoceras (nautiloideo), pez mandibulado.).
De centímetros a decímetros
Discutir todas las innovaciones que aparecen y se suman supera la extensión de este escrito, pero resaltar algunos puntos importantes facilita entender los cambios por los que la vida pasó para alcanzar la biodiversidad actual. La sincronía de algunos cambios en Metazoarios y Metafita es realmente llamativa, por ejemplo, ambos linajes abandonan el agua y amplían su distribución a zonas con características físicas muy distintas a las que compartían habitual y prácticamente al mismo tiempo (Figura 2; ver Switek, 2012). Salen de la hidrósfera para adentrarse a la atmósfera. Son muchos los inconvenientes y complicaciones que tienen que afrontar. Por ejemplo, están expuestos a la desecación, ya que reciben los rayos UV de manera más directa, pierden su exoesqueleto hidráulico, los alimentos no “flotan” en el ambiente y los tienen que obtener de otras fuentes, etc. Los diferentes grupos resuelven de formas variadas los problemas que se les van presentando, pero llama la atención que las plantas vasculares cambian su ciclo de vida de manera drástica (Figuras 2, 3, 4, 5). Su antecesor tenía un ciclo de vida haplobióntico, con meiosis cigótica, y el retraso de la meiosis genera un ciclo de vida nuevo, el haplo-diplobióntico típico de las plantas, el cual posee dos generaciones, caracterizadas por desarrollar en cada una de éstas un organismo multicelular (Qiu et al., 2006; Lang & Cookson, 1935; Silvestro et al., 2015). En las briofitas la generación haploide sigue siendo dominante, mientras que en las plantas vasculares es la generación diploide la que se vuelve conspicua y dominante.
Se seguirá haciendo referencia a las plantas vasculares para ejemplificar la adquisición de las novedades que les permiten a las especies ser cada vez más competitivas y estar mejor adaptadas al ambiente (Figuras 2, 3, 4 5). En el Silúrico-Devónico (420 m.a.a.p.) los organismos tienen iniciativas que reflejan varias estrategias para colonizar las partes emergidas (Figura 2). Una de ellas es ejemplificada por la asociación de hongos y algas, semejando líquenes actuales. Sin embargo, las algas y hongos que se han encontrado participando en estas asociaciones no corresponden con los grupos que hoy forman líquenes. Aún más, las reconstrucciones de estos organismos del pasado no son comparables con los líquenes actuales. En ocasiones se representan como sistemas de ramas finas con hasta ca. 50 cm de largo, pero hay ejemplares que parecen ejes fuertes con aproximadamente 30 cm de diámetro y casi un par de metros de altura (Figura 2; Shaw et al., 2011). En ningún caso se conocen ni las estructuras de anclaje, ni los detalles de su fisiología que les facilitaron el establecimiento en las zonas emergidas de los continentes (Figuras 2 - 3, 6; e. g., Hetheringto et al., 2016).
Una segunda alternativa es representada por plantas cuyos ejes se ramificaban dicotómicamente, y sólo las más avanzadas lo hacían tricotómicamente, sus ejes tienen un par de centímetros de diámetro y hasta alrededor de 25 cm de alto (Figuras 2 - 3, 6). Como en el ejemplo anterior, no desarrollan órganos de anclaje en consecuencia algunos de los ejes aéreos toman esta función y crecen en posición horizontal y postrada sobre el suelo. Los demás ejes forman las partes aéreas (Figuras 2 - 3, 6; Kotyk et al., 2002; Labandeira, 2007; Qiu et al., 2006; Taylor et al., 2009). La dicotomía de trabajo es importante para estos organismos que colonizaban un escenario nuevo y abandonaban otro; su osadía responde a que tenían que hacer funcionar al unísono dos escenarios que antes no interactuaban por esta vía, la hidrósfera y la atmósfera. A través de este experimento logran incrementar la presencia de la biósfera más allá de los cuerpos de agua o regiones muy húmedas (Figura 2). La reingeniería de los organismos fotosintéticos que se aventuraron a las zonas emergidas de los continentes llevó a establecer una biósfera que intrusiona a la atmósfera, para lo cual muchas adaptaciones tuvieron que ser seleccionadas.
Posiblemente la primera gran diferencia morfológica de las plantas vasculares respecto a sus ancestros, las algas, es el desarrollo de un embrión. Esta fase del esporofito es tan importante que con base en su presencia se define al clado Embriofita que incluye a briofitas y a las plantas vasculares o traqueofitas reconocidas por la diferenciación de sus tejidos vasculares (Banks, 1992; Kato, 2010; Palovaara et al., 2016). Esto implica la actividad de una zona meristemática en donde se da la diferenciación de los distintos tejidos. En los ápices de los ejes aéreos de las plantas di-tricotómicas mencionadas anteriormente hay unas cuantas células que tuvieron esta función y en los ejes maduros se distinguen, con base en su morfología una zona central con células finas y alargadas que conducían agua y minerales, una zona media con células más o menos isodiamétricas y pared delgada, y una epidermis externa. Los esporangios son los órganos reproductores localizados en la zona distal de los ejes, los cuales contienen y protegen a las esporas, a partir de las cuales se desarrollan los gametofitos. A partir de esta construcción básica las plantas continúan modificando sus tejidos, órganos y estrategias reproductivas, generando cada vez mayor diversidad e incursionando una mayor área de la atmósfera. La biósfera sobre los continentes inició siendo milimétrica, pasó a centimétrica y llegó a las decenas de metros sobre el suelo (Figuras 2 - 3, 6).
La gran infraestructura hídrica
El tejido vascular no está claro cómo es que se desarrolló, pero existen propuestas, algunas atrevidas, como la que señala que puede ser producto de una simbiosis con hongos que finalmente pasaron a ser el sistema de conducción. Esto va acompañado del hecho de que los primeros “elementos traqueales” no tenían pared secundaria y los engrosamientos que semejan a los de éstas células de las plantas actuales son de pared primaria, o en el mejor de los casos con una pared secundaria muy delgada (Banks, 1992; Kenrick, 2000; Kenrick & Crane, 1997; Kato, 2010). Se reconocen varios tipos de estas primeras células conductoras; por ejemplo, se señala que el tipo “C” distingue únicamente a Cooksonia pertoni, el “P” se ha encontrado en especies de Psilophyton y también es representativo de las Euphyllophytas tempranas, el tipo “S” es común en Rhyniopsida, mientras el “G” se encuentra desde Sawdonia ornata hasta en las Lycopsidas tempranas. Se sugiere que todas estas tienen pequeñas cantidades de lignina, mostrando episodios en el proceso de evolución de las traqueidas (Kato, 2010). También es poco claro qué es lo que propicia que la epidermis secrete una cutícula, pero es un hecho que ésta se presenta en las primeras plantas. Sorprende la coordinación que existe para dejar de depositar esta capa cerosa en ciertas áreas para facilitar el intercambio gaseoso. Estos espacios pudieron ser en un principio simples orificios y las células que los limitaban se diferenciaron en células guarda para regular el intercambio gaseoso. También hay que tener presente que las primeras plantas vasculares no contaban con un sistema de absorción de agua y minerales, en lugar de éste tenían un eje aéreo encargado de esta función. Entonces, de este eje crecían finas extensiones que cumplían la función de transportar el líquido y minerales al interior de la planta; estas extensiones no son verdaderas raíces, son extensiones del tallo, y siendo muy positivos podrían ser raíces adventicias, o simplemente “raicillas”, nunca raíces verdaderas (Figuras 2, 3, 4, 5, 6; Banks, 1992; Kenrick, 2000; Taylor et al., 2009).
Las primeras plantas pueden entenderse como el inicio de una serie de modificaciones necesarias para establecerse cada vez con mayor éxito sobre la superficie emergida de los continentes. Durante este proceso destacan algunas características. Por ejemplo, se explica que no tengan raíces verdaderas porque carecen de meristemo subapical y entonces su embrión es unipolar por tener sólo al meristemo apical (Figuras 2, 3, 4, 5, 6). Las esporas al germinar desarrollan un gametofito exospórico que produce uno o ambos sexos y la unión de la célula femenina y masculina requiere de agua. Se debe aclarar que hay variabilidad en la forma en que estos gametofitos actúan y se desarrollan. Por ejemplo, un solo organismo haploide puede tener ambos sexos al mismo tiempo, o en distintos momentos, alternativamente pueden desarrollarse organismos con carga cromosómica “n” con sólo arquegonios o sólo anteridióforos. En este último caso también se asume que el momento de la producción de los gametos pudo variar, generando los dos sexos al mismo tiempo o madurándolos en distintos momentos (e. g., Bennici, 2008; Remy & Remi, 1980). Sin embargo, es importante señalar que el gametofito de estas primeras plantas vasculares es distinto al de cualquier planta actual o fósil; es más grande que el de cualquier planta vascular y un poco más pequeño que el de las briofitas. Aunque son pequeños, tienden a alcanzar ca. 1 cm de altura, tienen un eje principal que distalmente termina en una especie de “paraguas” con radios bien marcados y tejido entre ellos. Los ejes también pueden terminar formando un plato que en la superficie convexa contendría gametangios (Remy & Remi, 1980). En contraste con los gametofitos actuales, los de estas plantas tienen al centro de sus ejes tejido semejante al vascular de los esporofitos. Hay que recordar que entre las plantas actuales sus organismos haploides ocasionalmente tienen células aisladas que “semejan traqueidas”, sin embargo, no funcionan como un tejido de conducción, además de que su presencia no es algo constante en ellos (Taylor et al., 2009). Estos gametofitos por su estructura sugieren que representan una condición intermedia entre briofitas y plantas vasculares.
Secretos en los ciclos de vida
Rhyniophyta, Zosterophyta y Trimerophyta son representantes del primer grupo de plantas vasculares (Figuras 2, 3, 4, 5 6). Al esquematizar su ciclo de vida enfatizando algunas de sus características es claro que son miembros del grupo de las plantas vasculares por tener ciclo de vida haplo-diplobióntico, pero las diferencias para con las plantas actuales son muchas e importantes. Plantas que históricamente han sido incluidas en algunos de estos grupos, especialmente en Rhyniophyta, tuvieron variados intentos por responder a la vida en las partes emergidas de los continentes. Por ejemplo, Cooksonia, es un fragmento de planta del que no se conocen raíces, ni rizomas y en un estudio comparativo de la relación diámetro del tallo vs diámetro del tejido vascular entre los distintos grupos de plantas vasculares se sugirió que Cooksonia no podría vivir y sostenerse sola, ya que el tejido vascular que posee no era suficiente para mantenerla vertical. La interpretación sugirió que podría representar el esporofito de un musgo, lo que explicaría su pequeña talla, la ausencia de sistema de anclaje y/o absorción, y facilitaría entender cómo posiblemente el turgor le ayudaba a permanecer vertical sobre algún gametofito, por cierto, aún por encontrar.
La historia de Horneophyton es también llamativa (Figura 6). Tiene todas las características para ser una Rhyniophyta, aun los esporangios son terminales, pero sobresale el hecho de que es la única planta del Devónico de la que se ha descrito una estructura que morfológicamente recuerda una columela, típica de los esporangios de algunas briofitas. Aparentemente es resultado de la prolongación del eje que dio origen al esporangio, y se proyecta al interior de éste. De su tejido vascular se ha demostrado también que carece de lignina, acercándolo más a las briofitas. Esta última condición la comparte con Aglaeophyton, que se separó antes de las plantas vasculares y pasó a representar a las prototraqueofitas (e.g., Kenrick, 2000; Kenrick & Crane, 1997; Kato, 2010; Taylor et al., 2009). Estas plantas sorprenden aún más al no tener hojas, y en el mejor de los casos producen enaciones con lo que aumentan la superficie fotosintética (Figura 6; Nótese en el primer grupo la ausencia de raíces verdaderas y hojas y posición terminal de los esporangios. En el segundo grupo no hay hojas, ni raíces verdaderas y los esporangios están relacionados con ramas). Estas primeras plantas vasculares son fascinantes, distintas de las plantas vasculares actuales y pertenecen a un misterioso mundo biológico por descifrar a partir de ellas.
Con base en lo anterior, resulta fundamental preguntarse ¿hasta qué límite se le puede considerar alga o planta vascular a las primeras plantas que así parecen?, ¿Es suficiente la presencia de un ciclo de vida haplo-diplobióntico para decidir que son plantas vasculares?, porque las briofitas y algunas algas también lo poseen, o en otras palabras, ¿qué tan diferentes son estas primeras plantas vasculares de las briofitas y algunas algas?, porque estas últimas tampoco tienen hojas, ni tejido vascular como el de las plantas vasculares actuales, ni un sistema de raíces (Figura 2). Es interesante que se señale la presencia de tejido vascular en estas plantas del Silúrico/Devónico, pero resulta que sus “traqueidas” carecen, o poseen escasa, pared secundaria, lo que contrasta con la mayoría de las plantas vasculares actuales. La composición de la pared de las traqueidas de estas primeras plantas vasculares semeja la estructura obtenida de traqueidas de Huprezia y otras Molinofitas en el laboratorio (degradada o con poca pared secundaria; e. g., Friedmann & Cook, 2000; Kato, 2010). A esta interrogante hay que aumentar que no se ha documentado de forma convincente el floema (Decombeix et al., 2014, 2016; Taylor, 1990). Entonces la fisiología de este grupo de plantas vasculares (Figuras 2 - 6) ¿sería distinta a la de sus descendientes?
De decímetros a metros (Episodio 3)
La historia de las plantas del Silúrico/Devónico continuó ligada a la dependencia/liberación del agua. Por un lado, el linaje de las briofitas parece recorrer un camino ligado al agua y humedad, el cual restringió su diversidad y las acotó en espacio, pero las mantuvo y potenció a través del tiempo; aunque en su ciclo de vida la fase dominante es el gametofítico. Por otra parte, hay pasos importantes en la adaptación al depender cada vez menos del agua para la sobrevivencia en las zonas emergidas donde se encuentra un segundo grupo de plantas, las primeras plantas vasculares, que derivan de las algas y que dominó el resto del Paleozoico (Figuras 2 - 3, 6 - 7; ca. 416 - 250 m.a.a.p.); y de las que se diferencian un tercer grupo que es ampliamente diverso, novedoso y dominante en los escenarios desde el Mesozoico (Figuras 3 - 4, 6, 7, 8, 9; ca. 250 m.a.a.p.) y hasta la actualidad. A través de estos nuevos grupos es evidente que el esporofito es cada vez más conspicuo.
A través del tiempo, los distintos grupos de plantas continuaron encontrando diversas formas de ocupar mayor espacio en la atmósfera y depender aún menos del agua para completar su ciclo de vida. Dos grupos son especialmente importantes después del dominio de las primeras hierbas (Figuras 2 - 3, 6). Un grupo de plantas novedosas de ese tiempo continuó teniendo un solo meristemo primario, el apical, generador del crecimiento longitudinal, y desarrolla un meristemo secundario, el cambium vascular, que les permite crecer en diámetro, A diferencia de las plantas actuales cuyo cambium vascular es bifacial, produciendo xilema hacia el interior y floema hacia el exterior de la planta, en estas plantas del Paleozoico el cambium vascular es unifacial, sólo produce xilema hacia el interior (Figuras 3, 6 - 7; Decombeix et al., 2014, 2016; Taylor, 1990). Aunque se han interpretado algunas células como representantes del floema secundario, no se ha demostrado la presencia de un tejido que tuviera funciones de conducción de materiales elaborados (Taylor, 1990). La superficie fotosintética ahora se aumenta con la producción de hojas, que pueden ser micrófilas o megáfilas. Las plantas micrófilas son Lycophita, mientras que en Arthrophyta la presencia de una médula hueca ayuda a la producción de megáfilas (Figuras 3, 6 - 7; Tomescu, 2009). El segundo grupo incluye a Archaeopteris, una progimnosperma con cambium vascular bifacial, raíces verdaderas, embrión bipolar y eustele, y a los helechos aunque como en Pseudosporochnus pueden tener embrión bipolar pero eustele sin médula, aunque en algunas plantas varía de compacto a parcialmente dividido, formando placas unidas a la región central del eje, por lo que no produce laguna foliar y por tanto no hay la megáfila típica del grupo.
Innovando para reproducirse
Prácticamente al mismo tiempo en que Lycophyta y Arthrophya se establecen, se diferencia otro grupo de plantas, las Progimnospermophyta, que en contraste tienen dos meristemos primarios; además del meristemo apical se diferencia un sub-apical que dará origen a las partes subterráneas que anclarán a la planta y absorberán agua y minerales (Figuras 3 - 4, 7). Este otro grupo produce también un cambium vascular, pero es bifacial. De éste hay mayor evidencia de la producción de floema, como en las plantas actuales, y a diferencia de Lycophyta en donde el haploestele en distintas modalidades (protoestele, actinoestele, plectoestele) sigue dominando, en las Arthrophyta, progimnospermas y pteridospermas hay una médula rodeada por un cilindro vascular con “n” número de simpodios formando un eustele (Figuras 3 - 4, 6 - 7; Taylor, 1990; Tomescu, 2009). En estos grupos también las células conductoras son cada vez más parecidas a las de las plantas actuales en cuanto a que sí tienen una pared secundaria continua y pueden referirse con más claridad como elementos traqueales. Las hojas en este grupo son megáfilas, caracterizadas por la presencia de una laguna foliar (Figuras 3 - 4, 6 - 7; Tomescu, 2009).
Al irse dando esta dicotomía en cuanto al tipo de eustele y hoja, se diferencian y definen dos grupos de plantas, aquellas con embriones unipolares en Lycophyta y Arthrophyta (Figuras 3, 6 - 7), y el grupo de las primeras gimnospermas (progimnospermas y pteridospermas; Figuras 3 - 4, 8 - 9) con el embrión que es bipolar, lo que explica que éste último grupo de plantas desarrolle raíces verdaderas.
La mayoría de estos grupos de plantas continúan reproduciéndose a través de esporas, que les sirven para ampliar sus áreas de distribución. Sólo las pteridospermas desarrollan otro mecanismo que se discutirá más adelante, la semilla (Linkies et al., 2010; Rothwell & Serbet, 1994; Taylor et al., 2009). En cuanto al hábito reproductivo de los otros tres grupos (Lycophyta Arthrophyta y Progymnospermophyta) es interesante que existe una tendencia a la reducción de megaesporas por megaesporangio. Este proceso se da de manera independiente en ellos, pero siguen episodios semejantes. Por ejemplo, el número de megaesporas por megaesporangio llega en algunos casos a sólo una megaespora viable por megaesporangio (Bateman & Dimichele, 1994; Linkies et al., 2010; Rothwell & Serbet, 1994; Taylor et al., 2009; Stewart & Rothwell, 1993). Alcanzado este punto (y en las plantas heterospóricas en general) la megaespora deja de tener vida libre, es decir es retenida en el esporangio de la planta madre, y a su vez el megagametofito es retenido dentro de la espora. Al suceder esto, existe la tendencia a que el megasporangio sea cubierto por alguna estructura vegetativa, que puede ser hoja o rama. Todos estos cambios le permiten a las plantas depender menos del agua para completar su ciclo de vida y realizar la reproducción sexual. El tejido megagametofítico es protegido dentro de la espora, la célula huevo igualmente está bien resguardada dentro del arquegonio que se encuentra en el megagametofito. La protección de la nueva planta llega al punto de que el desarrollo temprano del embrión también se lleva a cabo al interior de la megaespora. Sin embargo, para realizar la fecundación y con ello el inicio de un nuevo organismo los anterozoides continúan requiriendo de agua para nadar hasta la célula huevo (Linkies et al., 2010; Rothwell & Serbet, 1994; Stewart & Rothwell, 1993; Taylor et al., 2009).
Estos megaesporangios unimegaesporados son el antecedente de lo que representa una semilla, que puede definirse como un megaesporangio unimegaesporado y tegumentado. Lo que hace inevitable la siguiente pregunta ¿qué es un tegumento? La respuesta no ha sido sencilla, ni unánime. Una de las primeras propuestas es que éste se origina al volverse estériles los esporangios de la periferia de un sinangio con arreglo radial de sus esporangios (Benson, 1904). También se ha propuesto que un indusio en forma de copa pudo tomar esta función, o que una porción de fronda se enrolló sobre el megaesporangio para cubrirlo (Oliver & Scott, 1904; Walton, 1953a). Continuando con los helechos (Figura 10) como el grupo del que pudo desarrollarse el tegumento se postula que éste pudo surgir a partir de la proliferación de células de la pared o del pedicelo del esporangio, lo que encontró cierto soporte en el hecho de que nucela y tegumento en ciertas plantas del Paleozoico están adnados (e.g., Lagenostoma, Conostoma; Walton, 1953b). Aunque estos dos últimos géneros son en realidad Pterdiospermas, ilustran que algo similar pudo suceder en los helechos (Figura 10), cuyo caso es pertinente para mostrar cómo varios grupos intentaron la formación de semillas durante el Devónico/Carbonífero (pero ver más adelante la explicación de las estructuras que se acercaron a formar semilla en los helechos; en ellos sí se llevó a cabo la reducción en el número de megaesporas, pero mantuvieron dos megaesporas por megaesporangio).
De nuevo a partir de lo logrado. Posiblemente una de las ideas más atractivas respecto al origen de la semilla se basa en la teoría del teloma (Zimmermann, 1938, 1952), sugerida antes de conocer detalles de las semillas del Paleozoico. Ésta sugiere que telomas con esporangios formaron un sistema en el que al centro quedó una rama con esporangio terminal, mientras que los esporangios de las ramas envolventes eventualmente dejaron de producirse. Éstas últimas poco a poco fueron fusionándose hasta cubrir al megaesporangio central casi en su totalidad (Smith, 1964). Bajo esta perspectiva el tegumento se origina a partir de ramas, y la hoja de las Lycophyta no puede ser catalogada como tegumento, aunque en este grupo es la que rodea al megaesporangio con una sola megaespora funcional. Además, en la mayoría de las plantas en las que sus estructuras reproductoras tenían tegumentos formados por hojas, y por lo tanto las acercan al concepto de semilla, la hoja parece no ser una estructura permanente que proteja al megaesporangio, como lo es el tegumento en las semillas verdaderas. Al dispersarse esta unidad reproductora (hoja + megaesporangio unimegaesporangiado), sus componentes, megáfila y megaesporangio, aparentemente se separan, lo que sugiere que nunca fueron una unidad funcional. En otros grupos, como los helechos (Figuras 3, 10), aunque existe la tendencia a tener un megaesporangio unimegaesporado (en realidad la máxima reducción de esporas en los helechos los hace biesporados), son las hojas o porciones de hojas los probables tegumentos. Entonces, en el mejor de los casos, en el Carbonífero existieron helechos con 2 megaesporas por megaesporangios rodeados por una hoja, lo que sugeriría una tercera forma de semilla o estructura semejante a semilla.
En las Arthrophyta el esporangióforo es la estructura que tiende a envolver al megaesporangio unimegaesporado. Aunque en este caso el esporangióforo es una rama, el registro fósil y los estudios filogenéticos muestran que son las plantas gimnospérmicas el linaje a través del cual se desarrollan las plantas con semilla actuales. En otras palabras, aunque en el caso de las Arthrophyta una rama envolvería al megaesporangio (esporangióforo), los fósiles que sirven para ejemplificar cómo se desarrolló esta cobertura del megaesporangio en las plantas con semilla actuales, sugieren que son varias, no una, las ramas las que participaron en el proceso de formación del tegumento (e. g., Stewart & Rothwell, 1993; Taylor, 2009).
La semilla, una estrategia multipropósito. Pues bien, la semilla apareció en los escenarios del Devónico (Figuras 3, 4), pero ¿qué tan comparables son esas primeras semillas con las de las plantas actuales? El desarrollo de esta estructura cambia radicalmente aspectos de la reproducción de las plantas. Por ejemplo, les permite ser menos dependientes del agua para completar el intercambio genético, están mejor equipadas para dispersar a las plantas, protege las formas juveniles del esporofito, y brinda alimento rico en nutrientes al embrión (Figuras, 3, 4). Seguramente si tuviéramos que definir lo que es una semilla contemplando sólo a las plantas del Devónico la definición de tegumento, no de semilla, variaría (Linkies et al., 2010; Rothwell & Serbet,1994; Taylor et al., 2009). En ese momento existían plantas en las que hojas y/o ramas brindaban protección al megaesporangio, aún más, la forma en que las ramas lo hacían tiene cuando menos dos posibilidades, la participación de una rama (esporangióforo) o la intervención de varias ramas (telomas). Seguramente sin conocer lo que pasaría posteriormente con las plantas sería difícil definir cuál de estas propuestas conduciría a la semilla de las plantas actuales, y la definición podría dar cabida a estas tres posibilidades. Las semillas fueron variadas y distintas, al punto que en Pteridospermas, del Devónico/Carbonífero (Figura 3; Se ilustran Protolepidodendron, Psilophyton, Valmeyerodendron, Baragwanathia, Drepanophycus, Sigillaria, Lepidodendron, Zosterophyllum, Sphenophyllum, Calamites, Glossopteris, Archaeopteris, Helechos, Psaronius, Medulosa, Dryopteris fragrans, Dimetrodon (reptil mamiferoide), Acanthostega [tetrápodo primitivo]; 359 m.a.a.p.), se desarrolló un tipo de reproducción distinto e interesante que precedió y compitió con la reproducción gimnospérmica, hoy típica de las plantas con semillas desnudas (Figuras 3 - 4, 8 - 9; Linkies et al., 2010; Rothwell & Serbet, 1994; Stewart & Rothwell, 1993; Taylor et al., 2009). Ésta es conocida como Reproducción Hidraspérmica. Aún dentro de estas semillas hidraspérmicas hay variaciones interesantes, como el que no todas las semillas están contenidas en una cúpula, es decir en una segunda ronda de ramas que no envuelve a la semilla, pero sí la delimitan dentro de un espacio. Además, la nucela, que es el nombre que en una semilla recibe la pared de la megaespora, sufre varias modificaciones, y puede elongarse y proyectarse por encima de las ramas que forman el tegumento, o la proyección puede ser más bien corta y encontrarse dentro del espacio delimitado por el tegumento (o ramas). La forma en que se captura el grano de polen también es diferente entre plantas con reproducción hidraspérmica y gimnospérmica. En las primeras, las proyecciones de la nucela y los tegumentos son movidos por el viento generando un remolino que atrae a los granos de polen a una cámara polínica al interior de la semilla, cuya base se rompe al descubrir la presencia de los granos de polen para que éstos lleguen al megagametofito y las células masculinas puedan alcanzar a la célula huevo en los arquegonios. En contraste, en la gimnospérmica los granos de polen son atrapados por una gota polínica que al “secarse” es succionada hacia la cámara polínica desde donde los granos de polen germinan para que las células masculinas lleguen a las células huevo, al interior de los arquegonios contenidos en el megagametofito (e.g., Linkies et al., 2010; Rothwell & Serbet, 1994; Stewart & Rothwel, 1993; Taylor et al., 2009).
Mientras que el resultado final es semejante, al irse fusionando los telomas que formaron al tegumento dejan en el extremo distal un pequeño micrópilo, la reproducción gimnospérmica fue seleccionada positivamente y linajes con este tipo de reproducción se diversificaron desde finales del Paleozoico, siendo dominantes durante casi todo el Mesozoico y convirtiéndose en cosmopolitas, aunque distintos grupos fueron más prósperos en distintos ambientes (Figuras 4, 8 - 9). Su presencia se ha demostrado en ambientes costeros y se asume que vivieron a grandes altitudes, además, de que se les ha recolectado desde el ecuador hasta los polos. Ciertamente la semilla ayudó a las plantas a dispersarse para ampliar sus áreas de distribución, a aumentar las interacciones con animales ofreciéndoles alimento concentrado en ellas, y a minimizar su dependencia del agua (líquido al interior de las células) aprovechando la poca agua disponible para completar sus ciclos de vida (Figuras 4 - 5; Se ilustran: Araucaria, Metasequoia, Cicadoidea, Williamsonia, Pleuromeia sternbergi, Pleuromeia longi-caulis, Pleuromeia dubia, Ginkgo, Helechos arborescentes, Tempskya, Palma (tipo Sabal), Arechaeofructus monita). En el ciclo de vida de las plantas con semilla las células reproductoras masculinas son transportadas por el polen a las inmediaciones de las células huevo, en el arquegonio contenido en el megagametofito, minimizando la distancia que tenían que desplazarse las primeras para lograr fecundar a la segunda. El líquido necesario para completar este proceso de fecundación pudo restringirse al citoplasma de las células participantes, lo que en realidad es de gran ayuda en la búsqueda de la independencia del agua para completar su ciclo de vida (Figuras 4 - 5, 8 - 9).
Máxima reingeniería (Episodio 4)
Hasta el momento son las angiospermas quienes muestran mayor y novedoso avance en el proceso de lucha por depender lo menos posible del agua para completar su ciclo de vida (Figura 5; Se ilustran Ficus, Sabal, Cedrela, Ulmus, Pastos, Acacia, Bursera, Agave, Cactaceas, Pseudosmogodium, Indricotherium (rino gigante), Tarsio [primate], Homo sapiens;Figuras 11 - 12; Márquez et al., 2013; Simpson, 2010). En ellas el tubo polínico dirige a las células reproductoras masculinas a la célula huevo y/o a los núcleos polares, reduciendo aún más la distancia a recorrer por las primeras con el fin de lograr la fecundación. Aunque hay que aclarar que es también en este grupo donde se encuentra el tubo polínico de mayor tamaño, lo que sugiere una distancia considerable entre el punto de origen del desplazamiento de los anterozoides y la célula huevo. En las plantas con flor se da el fenómeno de doble fecundación, con lo cual se forman dos embriones. Uno que desarrollará a la nueva planta a partir de la fecundación de la célula huevo, y otro que servirá de alimento formando un tejido triploide por la unión de un anterozoide con las células polares. La variación de este patrón básico es grande, y hay que aclarar que la doble fecundación también se conoce en algunos grupos de gimnospermas, pero en ellos no hay desarrollo posterior del segundo tejido embrionario. Entonces las semillas de angiospermas también contienen alimento de reserva para el nuevo embrión, el endospermo (3n), que contrasta con el alimento embrionario de las gimnospermas, el megagametofito (n). Las semillas en las plantas con flor son contenidas en un gineceo que al madurar se transforma en fruto, ayudando a la dispersión de las semillas y revitalizando las interacciones entre animales y plantas, ofreciendo alimento a los primeros que se encargarían de llevar cada vez más adentro de los continentes a las semillas, dispersando de esta forma a las plantas (Figura 5; Márquez et al., 2013; Simpson, 2010). Smith interesante señalar que el intento por “empacar” a las semillas en frutos se dio en varios grupos de gimnospermas (Figura 13), pero sólo tuvo éxito en las angiospermas. Las adaptaciones del cuerpo vegetativo de las plantas con flor son también muchas y muy variadas. El espacio en este trabajo es insuficiente para detallar sus estrategias para ocupar diferentes ambientes y ser exitosos en ellos, pero es muy importante mencionar al tejido de conducción que en todas las plantas preangiospérmicas está construido principalmente por traqueidas, mientras que en las angiospermas funciona mediante vasos conductores. Esto es, los vasos están constituidos por la superposición de elementos de vasos caracterizados por poseer paredes terminales perforadas en distintos grados. Es decir, las paredes y membranas celulares terminales desaparecen en distintos grados facilitando el movimiento del agua a lo largo de un tubo. Las estrategias para la conducción de agua de las raíces a las partes más altas de las plantas son variadas en éste (y otros) grupo e involucra no sólo al sistema conductor, sino a las hojas que funcionan como una gran bomba que aspira fuerte y jala la columna de agua desde las raíces hasta la copa de la planta. Las adaptaciones a los distintos escenarios son maravillosas y el funcionamiento es realmente el resultado de estrategias combinadas de distintos tejidos vegetativos. Así, aunque las plantas angiospérmicas funcionan bajo los mismos principios, la variabilidad de estos da lugar a estrategias que les permiten adaptarse a condiciones muy distintas, colonizando cuerpos de agua, lugares muy húmedos y muy secos, y aun lugares con abundante agua, aunque ésta no esté disponible por estar en forma de hielo o de vapor. Las plantas a través de una innovación constante, para establecer un mejor uso del agua, han colonizado los escenarios y establecido relaciones que sorprenden en el funcionamiento y capacidad de adaptación.
… y qué sigue?
En conjunto las adaptaciones de los cuerpos vegetativos y las estrategias reproductivas de los organismos fotosintéticos vistas a través del tiempo narran una historia de éxito (Figuras 1, 2, 3, 4 - 5; 6 , 7, 8, 9, 10, 11, 12, 13), de innovación y peculiaridades que dan a los distintos momentos de la historia de la vida matices especiales. Hacen resaltar la idea de que los procesos a través del tiempo pueden ser semejantes, pero los resultados de sus interacciones han sido únicos, provocativos y avanzados (Figuras 1,2 , 3, 4, 5; 6, 7, 8, 9, 10, 11, 12 13). Hacia el futuro indudablemente seguirán existiendo cambios que seguirán sorprendiéndonos, por el momento sólo alcanzamos a visualizar que curiosamente las plantas regresan al agua, aunque también han desarrollado estrategias formidables para vivir bajo condiciones extremas, como son las zonas áridas, y en ambos casos lo hacen como ha sido su historia, ¡con gran éxito!











 nova página do texto(beta)
nova página do texto(beta)


