INTRODUCCIÓN
El cromo es un elemento que principalmente existe en dos estados, hexavalente Cr(VI) y trivalente Cr(III) (O’Brien et al., 2003). El Cr(VI) es comúnmente originado de los desperdicios y contaminantes industriales, siendo por ésto causa importante de preocupación por la salud humana, ya que se ha asociado con diversos tipos de cáncer (O’Brien et al., 2002; Xie et al., 2005). En la naturaleza, su forma Cr(III) es la más común. Desde hace tiempo, se ha documentado que el Cr(VI) tiene la capacidad de penetrar las membranas celulares a través de transportadores de iones de sulfato. Una vez que el Cr(VI) entra en la célula, es reducido a Cr(III), su forma más estable (Cervantes et al., 2001). El Cr(III) es un componente que puede dañar al DNA y de igual manera, algunas otras formas intermediarias que son consecuencia de la reducción del Cr(VI) como por ejemplo: los radicales libres (Harris & Shi, 2003), el daño que causan los intermediarios al DNA son: cortes en cadena sencilla o doble, pérdida de bases y deleciones cromosomales, entre otros. Las consecuencias biológicas de estos daños pueden ser la aparición de mutaciones, rearreglos en el genoma y hasta inducir la muerte celular (O’Brien et al., 2002).
Las células han desarrollado sistemas que les permiten enfrentar y reparar daños al DNA (Aylon & Kupiec, 2004) como son: los eventos de recombinación homóloga, recombinación no homóloga y otros sistemas como la remoción de bases (Dudasova et al., 2004; Krogh & Symington, 2004). En algunos casos la reparación no es tan eficiente, pero en otros si el DNA ha sido dañado y no es removido antes de la replicación, polimerasas de baja fidelidad, también conocidas como mutasas (REV3), pueden sintetizar nuevas cadenas de DNA y ayudar a corregir el daño (Holbeck & Strathern,1997; Rattray et al., 2001; Rattray et al., 2002), incluso durante la recombinación homóloga, aunque esto conlleve a la aparición de mutaciones. De hecho se ha asociado la reparación de cortes en doble cadena con el papel del REV3, así como su alto efecto mutagénico asociado a la recombinación (Holbeck & Strathern, 1997; Rattray et al., 2001; Rattray et al., 2002). El gen REV3 codifica para la subunidad catalítica de la polimerasa zeta de baja fidelidad (Rattray & Strathern, 2003). Este DNA polimerasa es requerido durante la mutagénesis inducida por rayos UV. La polimerasa zeta no es esencial para el crecimiento celular y tiene la capacidad de sintetizar a través de dímeros de timina, que es importante para la sobrevivencia celular cuando existen dosis de radiación UV (Nelson et al., 1996).
La pérdida de heterocigocidad es un evento en el cual se pierde la única copia de algún alelo. Este tipo de eventos son importantes, ya que se ha asociado con la pérdida de genes supresores de tumores debido a los eventos mencionados (Nestor et al., 2007). Existen varios mecanismos por los cuales puede haber pérdida de heterocigocidad, entre ellos por conversión génica, deleciones, recombinación mitótica y pérdida cromosomal (Donahue et al., 2006; Santoyo & Romero, 2005).
En el presente estudio examinamos el efecto del Cr(VI) sobre la frecuencia de mutación y la pérdida de heterocigocidad en la levadura Saccharomyces cerevisiae, así como en una mutante rev3. Para esto utilizamos una cepa que contiene el gen CAN1, que codifica para una permeasa de arginina (Rattray et al., 2015). Este gen, en presencia del compuesto canavanina (análogo a la arginina) es letal para la célula. Por lo tanto, es útil para determinar la frecuencia de mutación. Las mutaciones que pueden surgir pueden ser diversas, incluyendo inserciones o deleciones puntuales o de varios nucleótidos que cambian el marco de lectura del gen. Sin embargo, la selección de colonias resistentes a la canavanina se pueden dar también por deleciones parciales del marcador o de mayor tamaño (cromosomales) que incluyan la pérdida del gen CAN1. Para esto, se insertó adyacente al alelo CAN1 el alelo HIS3. Por lo que seleccionando colonias resistentes a la canavanina y protótrofos de histidina podemos seleccionar mutantes can1 espontáneas y aquellas inducidas por elementos mutagénicos, como el cromo (Amberg et al., 2005; Santoyo & Strathern, 2008). Mediante la selección de colonias resistentes a la canavanina en presencia de histidina, la gran mayoría de los eventos estarán relacionados con la pérdida de heterocigocidad.
MATERIALES Y MÉTODOS
Cepas de levadura
Los genotipos de las cepas de levadura que se utilizaron en este trabajo son: YJM1 MATa-inc can1-Δ17 cyh2 R his3-Δ200 leu2-Δ1 lys::ΔhisG trp-Δ1 ura3-52 tyr 7-1 bud52::CAN1 HIS3. La cepa YJM1 fue mutada en el alelo REV3, generando la cepa YJM2. Su genotipo es el siguiente: MATa-inc can1-Δ17 cyh2 R his3-Δ200 leu2-Δ1 lys::ΔhisG trp-Δ1 ura3-52 tyr 7-1 bud52::CAN1 HIS3 rev3::LEU2. Las cepas fueron amablemente donadas por A. Rattray y J. Strathern del CCR-NIH, USA. Ambas cepas fueron construidas y descritas en un trabajo anterior (Rattray et al., 2015). Brevemente, la secuencia del marcador CAN1 presente en el casete va de la posición -148 a + 1973 en relación con el codón de inicio del marcador (CAN1). La cepa también alberga una deleción de 1844 pb del gen CAN1, la cual va de -151 a + 1995 con respecto al codón de inicio (ATG). La inserción de HIS3 (adyacente a CAN1) incluye secuencias de -191 a + 857 con respecto del marco de lectura abierto de HIS3. Finalmente, el tamaño total del casete CAN1HIS3 es de 3.8 Kb. Un esquema del sistema se muestra en la Figura 1.
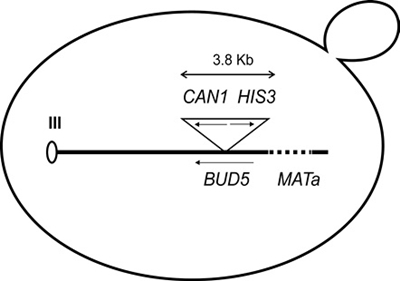
Figura 1 Esquema del sistema para detectar la frecuencia de mutación y pérdida de heterocigocidad en Saccharomyces cerevisiae. El marcardor CAN1 codifica para una permeasa de arginina, por lo que la resistencia a canavanina (un análogo de arginina), la cual es tóxica para la levadura, sucede cuando se generan mutaciones que anulan la función del gen. El gen HIS3 se emplea para evitar la deleción de CAN1 al analizar la frecuencia de mutación, pero no en la pérdida de heterocigocidad. Este sistema se ha empleado anteriormente (Ratrray et al., 2015).
Químicos utilizados
Se utilizó cromo hexavalente (CrO3, adquirido de Sigma-Aldrich, Milwaukee, WI) preparado en agua estéril, destilada y desionizada antes de cada experimento.
Análisis de sobrevivencia, pérdida de heterocigocidad y mutación
Los cultivos de levadura fueron crecidos hasta la fase logarítmica en medio YPD (Amberg et al., 2005) cuando se les agregaron las concentraciones indicadas de Cr(VI) por 2 horas a 300° C en agitación constante (250 rpm). Después de este tratamiento, los cultivos fueron centrifugados y lavados dos veces con PBS. El concentrado celular fue entonces resuspendido en agua estéril y se realizaron diluciones seriadas. Posteriormente se plaquearon en cajas con medio YPD, AA+canavanina-arginina y AA+canavanina-arginina-histidina (Amberg et al., 2005). El crecimiento celular fue determinado después de 3-4 días de incubación a 300° C. La frecuencia de mutación se determinó por el porcentaje de sobrevivencia en cajas AA+canavanina-arginina-histidina. Para la frecuencia en la pérdida de heterocigocidad, se determinó por el número de colonias crecidas en medio AA+canavanina-arginina. Cabe destacar que al eliminar la histidina del medio, el 90% de las clonas mutantes mostraron la pérdida total del marcador (Resultados no mostrados). Otros posibles eventos como conversiones, no fueron analizadas. El porcentaje de sobrevivencia, mutación espontánea y pérdida de heterocigocidad fue determinado con respecto al experimento control que careció de Cr(VI).
Análisis estadístico
Se realizaron las pruebas t de Student (P < 0.05) para determinar las diferencias significativas entre los diferentes tratamientos con la ayuda del siguiente sitio en la red: www.physics.csbsju.edu/stats/t-test.html.
RESULTADOS
Análisis de sobrevivencia
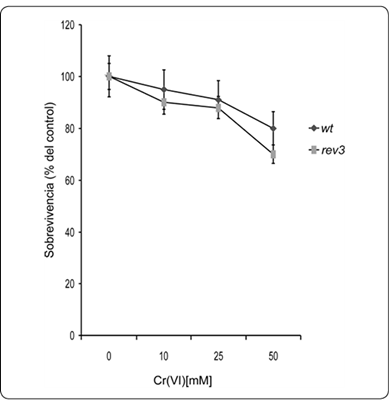
Las cepas YJM1 y YJM2, esta última mutada en el gen rev3, fueron analizadas mediante experimentos de sobrevivencia en presencia o no de cromo hexavalente. La curva de sobrevivencia que se observa para ambas cepas muestra una disminución dependiente de la dosis aplicada y una sobrevivencia similar en medios carentes de cromo. al adicionar el elemento hasta concentraciones de 50mM, la curva es nuevamente similar entre ambas cepas, la silvestre y la mutante rev3 (Figura 2). Para la cepa silvestre, a concentraciones de 50mM de cromo su sobrevivencia se afectó en un 20%, mientras que para la mutante rev3 se observó una disminución del 30%. Sin embargo, la diferencia entre los valores de ambas cepas no son significativos (P < 0.05). Estos resultados sugieren que la mutación en el gen rev3, el cual codifica para la polimerasa zeta, no juega un papel importante para contrarrestar los efectos tóxicos del cromo hexavalente.
Análisis de mutación en el gen CAN1 inducida por Cr(VI)
Anteriormente se habían reportado las tasas de mutación espontánea para el gen CAN1 de esta misma cepa (Rattray et al., 2015). Sin embargo, en este trabajo decidimos conocer si el cromo podría tener un efecto sobre la frecuencia de mutación, así como el papel que está jugando la polimerasa REV3. En la figura 3 se muestra un incremento en la frecuencia de mutación para la cepa silvestre, la cual es dependiente de la concentración del cromo. A concentraciones de 25 y 50 mM de cromo, se observó un incremento en la mutación de 20 y 28 veces, respectivamente. Estas frecuencias inducidas por cromo son significativamente diferentes con respecto a los experimentos controles, que carecen de la presencia del metal (P < 0.05).
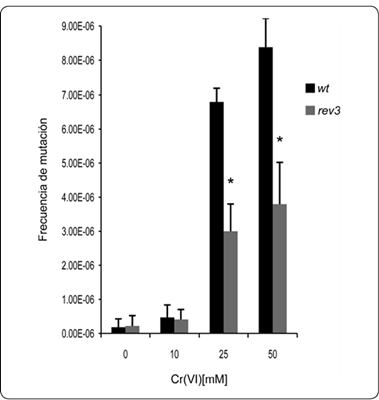
Figura 3 Frecuencia de mutación de las cepas YJM1 y YJM2 (mutante rev3) crecidas en diferentes concentraciones de cromo hexavalente.
Para la mutante rev3, no se observó una disminución en la frecuencia de mutación inducida por cromo (Figura 3). Por el contrario, la frecuencia se incrementó en niveles similares a la cepa silvestre. En presencia del metal las concentraciones de 25 y 50 mM, se notó un incremento en la mutación del marcador CAN1 de 18 y 20 veces, respectivamente. Esto sugiere que la presencia de cromo está teniendo un efecto importante sobre la frecuencia de mutación en ambas cepas. Así mismo, el efecto del Cr en una mutante rev3 sigue incrementando la frecuencia de mutación, aunque fueron significativamente menores las frecuencias comparadas con aquellas ocurridas en la cepa silvestre (2.2 veces para ambas concentraciones de 25 y 50 mM de Cr). Lo anterior sugiere que aproximadamente la mitad de las mutaciones se deben al afecto de REV3.
Efecto del cromo en la pérdida de heterocigocidad
El cromo puede dañar de varias maneras el DNA de los organismos por lo tanto, decidimos conocer si el elemento tenía un efecto sobre la pérdida de heterocigocidad del marcador CAN1 en la levadura Saccharomyces cerevisiae. Como se muestra en la Figura 4, la presencia del cromo hexavalente induce la pérdida de heterocigocidad de una manera dependiente de la dosis en la cepa silvestre y rev3. A concentraciones tan bajas como 10 mM, el cromo induce la pérdida de heterocigocidad 22 veces más alto en la cepa silvestre. En concentraciones mayores del metal (50 mM), la frecuencia fue de hasta 55 veces. En la mutante rev3, se observó una inducción similar a la cepa silvestre a concentraciones de 50 mM de hasta 57 veces. Estos valores son significativos respecto a los experimentos control sin adicionar cromo (P < 0.05). Por consiguiente, los resultados muestran que el cromo está teniendo un efecto significativo en la pérdida de heterocigocidad para el marcador CAN1 en la levadura.
DISCUSIÓN
El cromo es un metal que en altas concentraciones puede incidir en la salud humana de manera dañina (O’Brien et al., 2003; Cervantes et al., 2001). De hecho, se ha reportado y reconocido como un potente carcinógeno (O’Brien et al., 2003; O’Brien et al., 2002). El espectro de daños que puede causar este metal es muy amplio. Por ejemplo, una traducción inexacta del RNA mensajero y como consecuencia un incremento en los agregados proteicos, siendo tóxico para la célula (Holland et al., 2007). Adicionalmente, en el DNA puede causar cortes en cadena sencilla, cortes en doble cadena, inserciones, deleciones, así como entrecruzamientos DNA-proteína. Se sabe que durante la reducción del cromo hexavalente, se producen radicales libres y productos del oxígeno, los cuales pueden dañar de manera directa al DNA (O’Brien et al., 2003). En este trabajo reportamos que el cromo puede inducir de manera importante la frecuencia de mutación y ésto hace posible que a través de la producción de subproductos, como los radicales libres, se produzcan mutaciones (Harris & Shi, 2003; Santoyo & Strathern, 2008), aunque no se descartan otros mecanismos de toxicidad del Cr (Holland et al., 2007). Anteriormente, habíamos reportado el espectro de mutaciones espontáneas para el marcador CAN1 (Rattray et al., 2015). Sería importante conocer en un futuro, si el espectro de mutaciones inducidas por cromo es diferente a las inducidas espontáneamente. Resultados preliminares muestran que probablemente el cromo induce deleciones en CAN1 de más de 100 pares de bases, ya que al amplificar por medio de la reacción en cadena de la polimerasa el marcador can1 de diferentes cepas resistentes a canavanina, inducidas por cromo, muestran un patrón de bandas con tamaños diversos, lo que sugiere que la generación de deleciones es de tamaño variable. La pérdida de heterocigocidad es un importante mecanismo que se ha asociado con la pérdida de genes que son importantes para suprimir tumores (Muzumdar et al., 2016; Nestor et al., 2007). Los mecanismos para que se den este tipo de eventos son variados, como la conversión génica, recombinación, deleciones que incluyen desde unos cuantos pares de bases perdidas hasta la pérdida de cromosomas enteros (Donahue et al., 2006). Así, el tamaño de las deleciones en el DNA para que exista un evento de pérdida de heterocigocidad puede variar.
Desde hace algunos años se ha demostrado que el cromo induce cortes en doble cadena en el DNA de células de mamífero (Rothkamm et al., 2003), que puede desencadenar en una pérdida mayor de segmentos de DNA. Así mismo, en un reporte reciente (Kirpnick-Sobol et al., 2006) se mostró que al suplementar con Cr(III) la dieta de ratones, éste induce deleciones en su genoma. De igual manera, el cromo hexavalente indujo deleciones en la levadura (Kirpnick-Sobol et al., 2006).
Para que se dé este mecanismo en nuestro marcador CAN1, que mide aproximadamente 1,700 pb, la deleción del gen debe ser la casi totalidad o mayor que esa longitud. Ésto sugiere que el cromo está induciendo la pérdida o deleción de segmentos ¨grandes¨ de DNA, que abarcarían un tamaño similar o mayor a la longitud del marcador CAN1.
Los resultados muestran también que la mutante en rev3 tiene una respuesta similar a la cepa silvestre con respecto a la pérdida de heterocigocidad (Figura 4). El fundamento para analizar si REV3 podría tener un papel importante en este evento se basa en antecedentes que muestran que cortes en doble cadena, ya sea espontáneos o inducidos por agentes mutágenos como el Cr(VI), se procesan seguidos de una degradación del DNA para generar extremos 3´ (Santoyo et al., 2005). El extremo de cadena sencilla 3´ necesita buscar una región homóloga para reparar y rellenar el segmento degradado por acción de las polimerasas, como REV3. Por lo tanto, si no existe una cadena de DNA homóloga o polimerasas para reparar la ruptura como en nuestro sistema (Figura 1), se podrían generar deleciones y pérdida de heterocigocidad (Sonoda et al., 2003). Sin embargo, cabe destacar que nuestros resultados muestran que no hay una diferencia significativa entre las cepa silvestre y rev3 con respecto a la frecuencia de pérdida de heterocigocidad inducida por Cr, indicando que REV3 no juega un papel esencial en el evento.
El origen de las mutaciones puede ser también muy amplio, sin embargo, es conocido que algunas polimerasas, como rev3, son propensas a cometer errores y producir cambios en el DNA (Rattray & Strathern, 2003). Es por ello, que analizamos si el cromo tenía un efecto en la función del gen REV3, el cual codifica para la polimerasa zeta. Los resultados muestran que la mutante rev3 no está siendo afectada de manera única por la presencia del cromo. Se sabe que la expresión de REV3 y por lo tanto, la función de la polimerasa zeta es afectada por diversos factores externos, como la radiación ultravioleta (Singhal et al., 1992; Rajpal et al., 2000). Este tipo de radiación afecta directamente la expresión del gen REV3, por lo que su función se ve incrementada. Esto ha sido correlacionado con un aumento en la frecuencia de mutación en cepas de levadura donde la expresión del gen REV3 ha sido inducida por rayos UV (Rajpal et al., 2000). Actualmente estamos realizando experimentos en el laboratorio para saber si el Cr tiene la capacidad de inducir la expresión de REV3 en la levadura. Sin embargo, este resultado coincide con los publicados por Rattray y colaboradores, donde se observa que las mutaciones en CAN1 son producidas parcialmente por REV3 (Rattray et al., 2015) y posiblemente el cromo origine mutaciones a través de la producción de radicales libres en el marcador empleado en este trabajo, un efecto observado en otros trabajos (Harris & Shi, 2003; Holland et al., 2007). Sería interesante conocer si el Cr tiene una reacción sobre la expresión y/o actividad de otras mutasas (Rattray & Strathern, 2003). En conclusión, los resultados de este trabajo muestran que el Cr hexavalente tiene importantes repercusiones sobre la aparición de mutaciones y pérdida de heterocigocidad, eventos que podrían implicar la pérdida de actividades en genes importantes para la reparación y el funcionamiento celular.











 nova página do texto(beta)
nova página do texto(beta)