INTRODUCCIÓN
La infertilidad es un problema global que va en aumento, afecta tanto a hombres como mujeres y se presenta cuando una pareja con vida sexual regular y sin uso de métodos anticonceptivos intenta por un año quedar embarazada sin éxito o por la imposibilidad de llevar un embarazo a término1 2. Se estima que aproximadamente del 15 al 20% de todas las parejas experimentan infertilidad en algún momento de su vida reproductiva y aproximadamente la mitad de los casos son de origen masculino3.
Los factores que pueden afectar la capacidad reproductiva del varón son: problemas en los espermatozoides, trastornos hormonales, anomalías genéticas, enfermedades e infecciones del sistema reproductor masculino y factores externos como ciertos medicamentos, así como el tabaquismo, el estrés y el consumo de alcohol y otras drogas4 5 6 7 8 9 10.
En cuanto a los factores relacionados con problemas en los espermatozoides, el análisis del semen o también llamado seminograma o espermatobioscopía directa, es la prueba clínica más importante para diagnosticar la infertilidad masculina11 12. La Organización Mundial de la Salud (OMS) estableció los parámetros básicos que se deben tomar en cuenta para realizar este estudio, el cual incluye tanto un análisis macroscópico que comprende: la licuefacción, apariencia, viscosidad, volumen y pH como un examen microscópico que consta de la movilidad, morfología, vitalidad y concentración espermática13 14. Sin embargo, este análisis es subjetivo, ya que existe una variación importante de la prueba por su falta de estandarización15.
Es evidente que el número, la concentración, la movilidad y la normalidad morfológica espermática son factores importantes que determinan el éxito de un embarazo, sin embargo, en muchos casos no permiten detectar la presencia de alteraciones sutiles en el espermatozoide que afectan la integridad del genoma masculino16. Se estima que aproximadamente un 15% de los varones con problemas de infertilidad, presentan parámetros dentro de los rangos normales en el estudio del semen17 18 19, sin embargo son casos que podrían deberse entre otras causas, a defectos en la membrana del espermatozoide, a la fragmentación del ADN espermático y a factores ambientales o genéticos, parámetros que no son detectables en el seminograma y que por lo tanto, se tiene que recurrir a técnicas especializadas para su análisis20. El ADN del espermatozoide aporta la mitad del material genético a la descendencia y se requiere que sea sano para la fertilización, el desarrollo del embrión, el correcto desarrollo fetal y posnatal, de lo contrario un ADN anormal altera cualquiera de éstos procesos21.
ADN ESPERMÁTICO
La espermatogénesis es el mecanismo encargado de la producción, crecimiento, maduración y liberación del empaquetamiento del ADN de las células germinales masculinas de espermatogonias diploides a espermatozoides maduros haploides, este proceso se lleva a cabo en los túbulos seminíferos localizados en los testículos. Inicia en la pubertad y tiene una duración aproximada de 62 a 75 días en la especie humana. Consta de tres fases o etapas: la fase proliferativa, donde las espermatogonias, experimentan una serie de divisiones mitóticas y se diferencian en espermatocitos primarios; la fase meiótica, en la cual ocurre la meiosis y la recombinación genética, produciendo la formación de espermátides haploides y la fase llamada espermiogénesis, implicada en el rearreglo de la estructura del citoesqueleto, terminando con las células germinales especializadas llamadas espermatozoides22 23 24 (Figura 1).
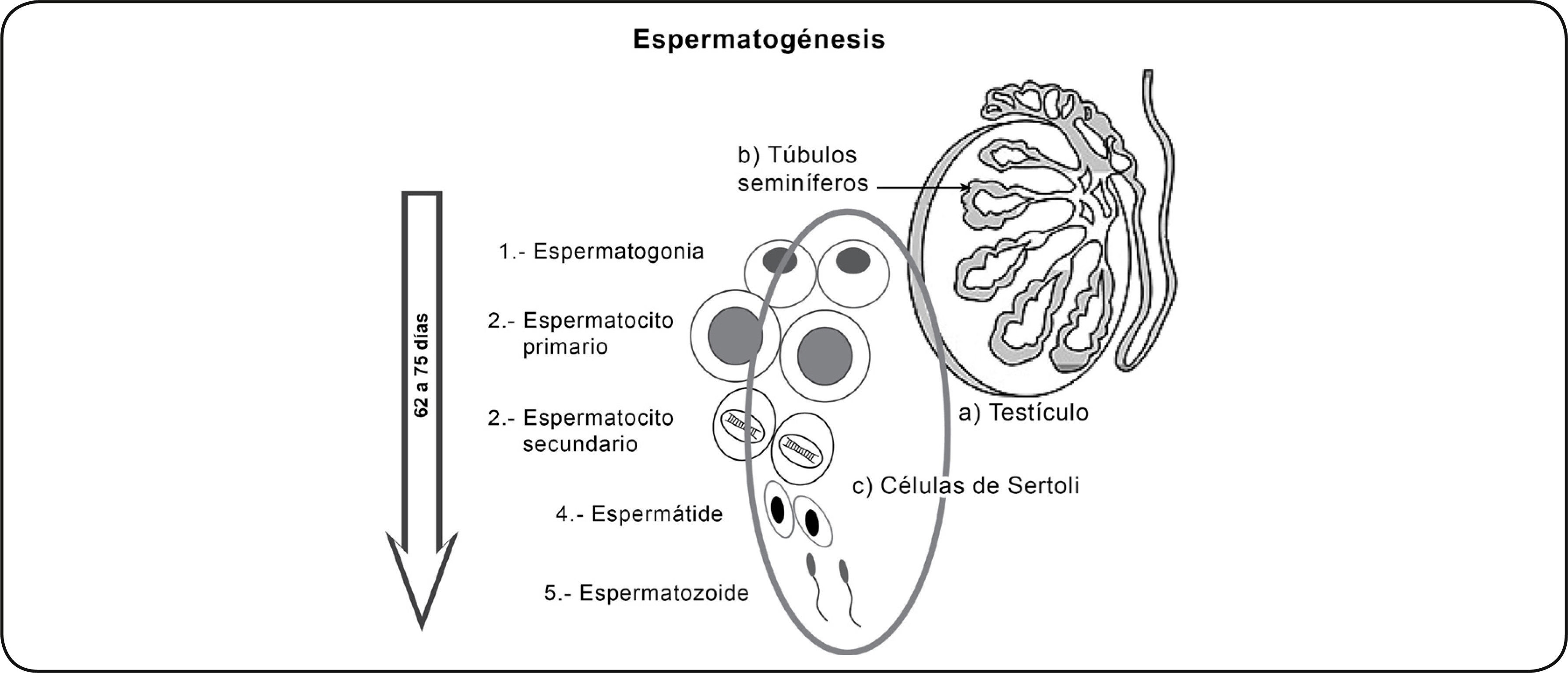
Figura 1 La espermatogénesis se lleva a cabo en los b) túbulos seminíferos ubicados en los a) testículos. c) Células de Sertoli 1) En la fase de proliferación, las espermatogonias se dividen mitóticamente y 2) originan espermatocitos primarios. 3) Durante la meiosis I, el espermatocito primario se divide originando dos espermatocitos secundarios, reduciendo el número cromosómico de diploide a haploide. 4) Durante la meiosis II, el espermatocito secundario se divide originando dos espermátides 5) y finalmente las espermátides mediante un proceso de diferenciación celular dan lugar a los espermatozoides.
Durante el proceso de la espermatogénesis las histonas somáticas son hiperacetiladas y reemplazadas por las proteínas de transición nuclear (TP1 y TP2) éstas a su vez son reemplazadas por otras proteínas, conocidas como protaminas (P1 y P2)25 26 27. Las protaminas son las proteínas más abundantes en el espermatozoide maduro y empaquetan el genoma paterno dentro del núcleo espermático. Estas proteínas son ricas en arginina y residuos de cisteína; la gran cantidad de arginina provee una fuerte carga positiva facilitando su unión al ADN y garantizando el reemplazo de las histonas y las proteínas de transición nuclear. Los múltiples residuos de cisteína son oxidados para formar puentes disulfuros (S-S) entre las protaminas y estabilizar la cromatina durante los estadios finales de la maduración espermática28 29.
Tanto la P1 como la P2 son necesarias para la condensación adecuada de la cromatina. La alta carga positiva de las protaminas permite la neutralización de la carga negativa del ADN, lo que genera mayor compactación en el núcleo espermático. Esto hace que el ADN del esperma esté seis veces más condensado que el de los cromosomas mitóticos y así el material genético esté protegido durante su travesía a lo largo de los aparatos genitales masculino y femenino. Un defecto en la síntesis de protaminas y en la formación de puentes disulfuro afecta el empaquetamiento de la cromatina, lo que aumenta la vulnerabilidad de los espermatozoides a la fragmentación del ADN30 31 32.
DAÑO AL ADN ESPERMÁTICO
En cualquier etapa del proceso de la espermatogénesis se puede producir un daño en el ADN espermático, éste es un fenómeno multifactorial y no del todo dilucidado que puede afectar tanto al ADN mitocondrial como al nuclear. Se conocen algunos factores que pueden producir daño irreversible en el ADN del gameto masculino, éstos pueden ocurrir durante la producción o el transporte de las células espermáticas e incluyen: la generación de radicales libres de oxígeno o estrés oxidativo (incluidos el radical hidroxil y óxido nítrico durante el transporte espermático a través de los túbulos seminíferos y el epidídimo), el empaquetamiento anormal de la cromatina (errores en la sustitución de histonas por protaminas en el proceso de espermiogénesis), deficiencias en la recombinación, apoptosis en el proceso de espermatogénesis tras la salida del espermatozoide a los túbulos y causas externas que pueden provocar o potenciar los efectos anteriores dentro de los que se consideran determinadas condiciones ambientales como la contaminación, el tabaquismo, la temperatura testicular elevada o patológicas como la criptorquidia, varicocele, procesos inflamatorios o infección del tracto genital, cáncer, episodios febriles y estrés, entre otras33 34 35 36 37 38 39 (Figura 2). Estas alteraciones en el material genético del espermatozoide pueden incluir anomalías en la condensación de la cromatina y en la integridad de la molécula del ADN cuando presenta rupturas tanto de doble como de simple cadena y también anomalías cromosómicas, demostradas por una correlación entre las alteraciones en la organización del material genómico del ADN y su potencial de fertilización; enfatizando el hecho de que la estabilidad del ADN espermático es un criterio a tener en cuenta para considerar si un espermatozoide podría ser fértil o no40 41 42.
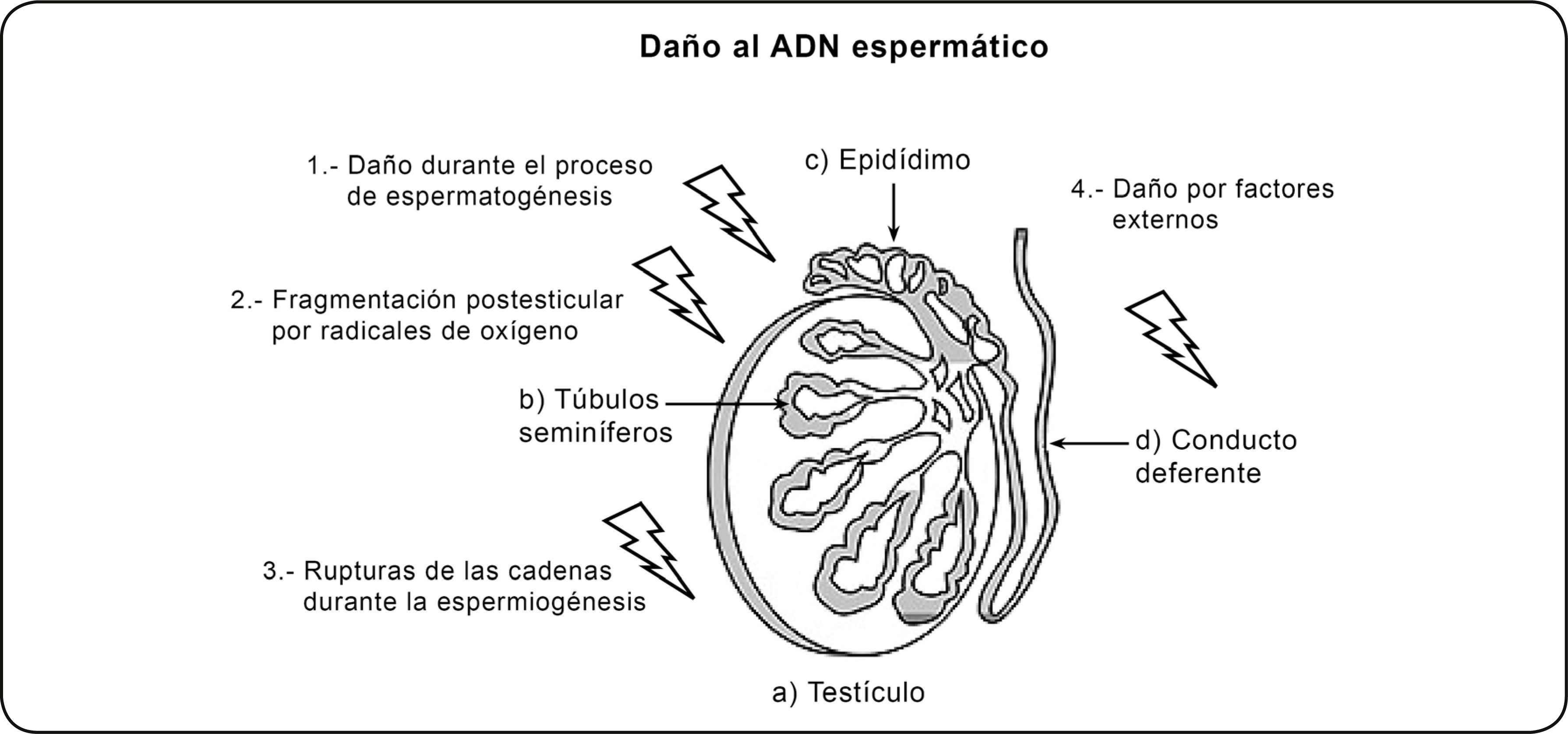
Figura 2 Daño al ADN espermático. El daño al ADN en los espermatozoides puede ocurrir durante la producción o el transporte de las células espermáticas e incluye: 1) apoptosis durante el proceso de espermatogénesis; 2) fragmentación postesticular del ADN inducida principalmente por radicales de oxígeno (incluidos el radical hidroxil y óxido nítrico) durante el transporte espermático a través de los túbulos seminíferos y el epidídimo 3) fragmentación en las cadenas de ADN producidas durante la remodelación de la cromatina espermática y durante el proceso de espermiogénesis; 4) daño al ADN inducido por tóxicos ambientales y factores externos.
En los últimos años se ha considerado como causa probable de infertilidad el daño al ADN espermático y de ahí ha aumentado el interés en desarrollar técnicas encaminadas a evaluar la fragmentación. Existen diferentes estrategias para estudiar la fragmentación del ADN espermático. Por un lado se encuentran las metodologías encaminadas a detectar las rupturas, tanto de cadena sencilla como de cadena doble que se registran de forma natural o fortuita en la molécula del ADN, como es la metodología del Túnel o Ensayo in situ nick translation (NT) que incorpora moléculas marcadas con fluorocromos en los extremos rotos del ADN. Por otro lado, tenemos las estrategias de estudio de la fragmentación que se basan en medir la capacidad de la cromatina y en particular del ADN para desnaturalizarse frente a determinados tratamientos. En este grupo se encuentran: Ensayo de la estructura de la cromatina espermática (SCSA), dispersión de la cromatina espermática (SCD) y ensayo cometa43 44 45 46.
TÉCNICAS UTILIZADAS PARA EVALUAR EL ADN ESPERMÁTICO
Ensayo de Túnel
El ensayo de TÚNEL (Terminal dUTP Nick-End Labeling), permite visualizar la incorporación de nucleótidos marcados en los extremos del ADN que quedan libres a causa de las rupturas de éste, bien sean de cadena simple o doble. La reacción se cataliza mediante la acción de una tranferasa terminal. Esta enzima incorpora desoxiuridina, modificada con biotina o digoxigenina, en el extremo 3'-OH de la cadena afectada. El nucleótido incorporado está directamente marcado con un fluorocromo. Esta técnica ha tenido muy buena aceptación dado que es versátil, está comercialmente disponible y los resultados pueden ser interpretados fácilmente. La señal es mayor cuanto mayor sea el grado de fragmentación del ADN. Esta técnica fue desarrollada para identificar una población apoptótica de espermatozoides en el eyaculado, sin embargo la fragmentación del ADN medida mediante el TÚNEL no está siempre asociada con un fenómeno apoptótico, ya que podría deberse a una maduración espermática defectuosa por un empaquetamiento incorrecto de la cromatina47 48 49.
ENSAYO IN SITU NICK TRANSLATION
El análisis de in situ nick translation (ISNT) cuantifica la incorporación dUTP (desoxiuridín trifosfato) biotinilado en las rupturas del ADN de cadena sencilla en una reacción catalizada por la polimerasa I. El ensayo NT detecta a los espermatozoides que contienen valores apreciables de daño endógeno en su ADN, estos resultados indican la presencia de anomalías originadas durante la remodelación de la cromatina del espermatozoide. El estudio de la integridad nuclear espermática mediante el análisis NT evidencia una buena correlación con la movilidad y la morfología espermática, y en menor medida con la concentración de espermatozoides en el semen50 51.
Ensayo cometa
El ensayo cometa o electroforesis en gel de células individuales es un método sensible, rápido y relativamente de bajo costo, para cuantificar daño en el ADN de células individuales. En esta técnica las células son colocadas en gel de agarosa en un portaobjeto y sometidas a lisis mediante un agente reductor de grupos sulfidrilo de las protaminas que permite que el ADN fragmentado pueda migrar en un proceso de electroforesis durante un corto tiempo. Para visualizar el ADN que se separó de la célula, éste es teñido con sustancias fluorescentes como DAPI (4,6 diamidino-2-phenylindole), Ioduro de Propidio o SYBR-GREEN (Synergy Brand). Las células con mayor daño del ADN muestran una migración aumentada desde el núcleo hacia el ánodo, generando una imagen similar a la cola de un cometa. La presencia de daño en el ADN se cuantifica midiendo la longitud de la cola, que a su vez pueden utilizarse también otros parámetros de medida, como el "momento de la cola", que es el producto de la longitud de la cola por su intensidad (fracción total del ADN de la cola). La importancia de este ensayo radica en la posibilidad de poder detectar fragmentación de simple o doble cadena del ADN espermático en una sola célula46 52 53.
Ensayo de la estructura cromatínica del espermatozoide (SCSA)
Es una técnica que desnaturaliza la molécula de ADN mediante una solución ácida o mediante un tratamiento con calor y una vez desnaturalizada se tiñe con naranja de acridina. Este fluorocromo se intercala entre las dos cadenas de ADN y al ser excitado emite una longitud de onda de 530 nm y se visualiza de color verde, mientras que al intercalarse en el ADN de cadena sencilla (ADN desnaturalizado) emite una longitud de onda de 640 nm de color rojo. Las células se separan y leen por citometría de flujo. El ADN fragmentado es más susceptible a ser desnaturalizado y por tanto se visualiza en color rojo54 55 56 57.
Dispersión de la cromatina espermática (SCD)
Esta técnica consiste en producir una descondensación diferencial de la cromatina en aquellos espermatozoides que tienen su ADN fragmentado respecto de aquellos que no lo tienen. Este efecto se consigue mediante un tratamiento ácido seguido de una desproteinización, de forma que los espermatozoides con fragmentación no generan un halo de dispersión de la cromatina. Por el contrario, los que no están fragmentados dan lugar a grandes halos de dispersión. Se valora el tamaño de los halos de dispersión mediante microscopía de campo claro o de fluorescencia. Es posible reconocer la presencia de fragmentación del ADN de la siguiente forma: cabezas de espermatozoides con halos grandes o medianos significan que no hay daño en el ADN espermático, mientras que aquellos con halos pequeños o sin ellos sugieren un daño en el ADN44 58 59 60.
VALOR PREDICTIVO DE LAS PRUEBAS PARA EVALUAR LA FRAGMENTACIÓN DEL ADN ESPERMÁTICO
El valor predictivo de las pruebas de fragmentación del ADN espermático en una pareja con infertilidad depende de una serie de factores, entre los que se incluyen: el tipo de daño al ADN ya sea daño de cadena sencilla o doble, el porcentaje de espermatozoides con daño en el ADN, la extensión del daño, si existe daño combinado de nucleótidos y fragmentación, si el daño afecta intrones o exones, el tipo de prueba de fragmentación del ADN utilizado y la capacidad del ovocito de reparar el daño al ADN espermático61 62 63 (Tabla 1).
Tabla 1 Ventajas e inconvenientes de las metodologías utilizadas para evaluar la fragmentación del ADN de los espermatozoides, relación de fragmentación espermática de otros autores en distintas técnicas de reproducción y la relación con el seminograma
| Método | Ventajas | Desventajas | (% SDF) | Relación en el seminograma |
|---|---|---|---|---|
| TÚNEL | Cumple con parámetros de control de calidad. | Equipos sofisticados y costosos (Citometría de flujo y microscopía de fluorescencia)Capacitación técnicaNo se ha establecido punto de corte entre fértiles e infértiles | Daris et al. 67 (2010) ICSI (FR 65.6% con SDF ≤20%, 54.9% con SDF < 20%) n=20Frydman et al.68 (2008) IVF (FR 69.9% con 35%, 71.7% con SDF ≥35%), CP (62.5% con SDF <35%; 37.5% con SDF ≥35%), IR (42.4% con SDF<35%; 24.5% con SDF≥35%), PL (10% con SDF<35%; 36.8% con SDF≥35%), n=117 | Se ha demostrado una correlación entre el porcentaje de espermatozoides con ADN fragmentado, la motilidad, la concentración y los parámetros morfológicos relacionados con formas anormales. |
| ISNT | Reacción de marcaje directo | |||
| SCSA | Punto de corte establecido (30% para diferenciar entre pacientes fértiles e infértiles) | Equipo sofisticado y costoso (Citometría de flujo).Capacitación técnica | Kennedy et al. 69 (2011) IVF/ICSI (NV (r=0.42, P=0.01); (NE r=0.47, p=0.01), n=233; (PL p<0.001)Lin et al.70 (2008) IVF (FR 82% con SDF< 9%; 84.87% con SDF = 9% - 27%; 84.74% con SDF <27%); ER (55.2% con SDF 9%; 58.67% con SDF = 9% - 27%; 55.03% con SDF>27%) n=137 | El índice de fragmentación del ADN, presenta una débil correlación con los criterios clásicos de calidad espermática. |
| COMETA | Bajo costo | Equipo sofisticado y costoso (Citometría de flujo)Capacitación técnica.Requiere observador con experiencia. | Simon et al .71 (2011) IVF FR (r2= 0.243, P=0.050 en semen; r2= 0.276, P=0.050 en semen seleccionado); calidad del embrión (r2= -0415, P=0.002 en semen; r2= -0.373, P=0.007 en semen seleccionado) n=75Lewis et al. 72 (2004) ICSI No hubo relación significativa entre SDF y FR, n=77 | Se ha observado una correlación entre el porcentaje de espermatozoides con ADN fragmentado y los criterios clásicos de calidad espermática. |
| SCD | Análisis simple de resultados.Bajo costo | Lento de ejecución. | Payne et al. 73 (2005) DFI= 27%. El DFI se correlacionó negativamente con la densidad de espermatozoides (r = -0,23; p <0,03) y la motilidad (r = -0,55; p <0,00) n=100 | Se determinó un incremento en el daño al ADN espermático en pacientes con oligoastenoteratozoospermia. |
TÚNEL: Terminal dUTP Nick-End Labeling. ISNT= In situ Nick Translation. SCSA: Estructura cromatínica del espermatozoide SCD: Dispersión de la cromatina espermática CP, embarazo clínico; ER, pérdida del embrión; FR, tasa de fertilización; ICSI, inyección intracitoplasmática de espermatozoides; IVF, fertilización in vitro; NV, nacidos vivos; SDF, fragmentación de ADN espermático; DFI, índice de fragmentación del ADN.
Diversos estudios han demostrado que la expresión genética del embrión y del ovocito están equipados con mecanismos para hacer frente a algunas anomalías en el ADN paterno, sin embargo, la capacidad del ovocito de iniciar la reparación depende, en gran medida, de su calidad citoplásmica y genómica. Por ejemplo, se sugiere que la fragmentación de doble cadena es aquella "no reparable" por el ovocito, mientras que la simple podría llegar a ser reparada por un ovocito sano y joven64 65 66.
INFERTILIDAD Y CALIDAD EN LOS ESPERMATOZOIDES
Los parámetros obtenidos a través de un seminograma no aportan una información completa sobre el potencial fecundante del semen y la capacidad de dar lugar a un embrión sano y un embarazo evolutivo 74. Cuando un espermatozoide con un daño severo en su ADN fecunda un ovocito el embrión puede alterarse en su desarrollo o implantarse en el útero y provocar un aborto espontáneo en un estadio más tardío. De igual manera, cuando un espermatozoide con un mínimo de daño en su ADN es utilizado, el desarrollo fetal puede verse afectado tardíamente y puede dar lugar a un niño con anomalías75 76.
Existe una población de hombres con problemas reproductivos que muestran características de concentración, movilidad y morfología normales; indicando que los parámetros seminales no son del todo indicativos de la calidad espermática 77. Por otro lado parámetros seminales alterados están en estrecha asociación con la presencia de daño en el ADN del espermatozoide y la calidad del semen. Confirmando que diversas alteraciones en las características del espermatozoide se asocian con un aumento en la proporción de espermatozoides con ADN fragmentado, situación que ha merecido la atención en los últimos años. Demostrando que un incremento de la fragmentación está relacionado con una disminución de la concentración espermática, la motilidad y la morfología y por consiguiente con posibles problemas reproductivos78 79 80.
Las circunstancias cambiantes obligan al desarrollo de procedimientos alternativos que permitan evaluar la calidad espermática, como el estudio del daño del ADN espermático, procedimiento que adquiere una mayor relevancia y que muestra una significativa correlación entre el daño y el índice de fertilidad, con repercusiones en la tasa de fertilización, la tasa de división del embrión, la tasa de implantación, el índice de embarazos y el índice de natalidad81 82 83 84.
En conclusión, es importante el poder protocolizar de manera sistemática el estudio cromosómico de espermatozoides en los laboratorios clínicos, como complemento de otros estudios y poder evidenciar un daño al ADN genómico, ya que estos resultados pueden ser de gran ayuda al médico para identificar las causas de la infertilidad masculina y orientar de mejor manera a las parejas para lograr un embarazo a término85 86 87.











 nueva página del texto (beta)
nueva página del texto (beta)


