INTRODUCCIÓN
Los ecosistemas áridos y semiáridos de México ocupan casi el 60% del territorio y desde un punto de vista ecológico, son importantes porque mantienen alta diversidad florística estimada en 6,000 especies de plantas, de las cuales, aproximadamente el 50% son endémicas1 2 3. En estos ecosistemas las plantas enfrentan diversos factores de estrés, entre ellos altas temperaturas y baja disponibilidad de agua y nutrimentos como el nitrógeno y fósforo que limitan su crecimiento4 5. Ante estas condiciones, las especies vegetales han establecido una asociación simbiótica mutualista con los hongos micorrizógenos arbusculares (HMA), en esta simbiosis micorrícica arbuscular (MA), los HMA favorecen la absorción de nutrimentos de baja movilidad en el suelo como el fósforo, e incrementan la tolerancia del hospedero al estrés hídrico6 7 y a organismos patógenos8, aspectos que pueden ser decisivos para la sobrevivencia de las plantas en estos ambientes estresantes.
Los HMA son un componente microbiano constante e importante en la rizósfera y en las raíces de las plantas de ecosistemas áridos y semiáridos, se estima que más del 80% de las especies vegetales en estos ambientes establecen la simbiosis MA9 10, entre ellas grupos emblemáticos como las cactáceas11, gramíneas12 y leguminosas del género Prosopis L. y Mimosa L.; en particular, estas leguminosas son elementos importantes en la estructura de los matorrales xerófilos13 14, al actuar como reservorios de propágulos micorrícicos15 y contribuir a la fertilidad del suelo con materia orgánica, nitrógeno y fósforo al formar islas de recursos (IR)14 15 16 17 que favorecen el establecimiento y supervivencia de otras especies vegetales bajo su copa17 como las cactáceas18.
Se ha reconocido la importancia de los HMA para las plantas de matorral xerófilo, en especial para aquellas especies vegetales que forman IR, ya que tienen implicaciones en su funcionamiento11 15, por ejemplo, los HMA al formar redes de micelio pueden contribuir a la agregación y estabilidad del suelo en las IR19. A pesar del papel clave de los HMA en la estructura del suelo19, así como en la diversidad florística en los ecosistemas20, sólo se cuenta con información de la condición micorrícica y de la riqueza de especies de HMA (39 de 101 especies registradas a nivel nacional3 21) para el 7% de la flora presente en los ecosistemas áridos y semiáridos de México3.
La riqueza de especies de HMA es un componente biótico importante para los ecosistemas porque determinan la productividad vegetal y ésta, puede variar dependiendo de la composición de especies de HMA20. La influencia de los HMA sobre las plantas es recíproca, ya que también se ha reportado que la composición vegetal22 23 e identidad de la planta hospedera24 determinan la riqueza y la composición de especies de HMA asociados.
Por otro lado, también se reconoce que las condiciones climáticas (precipitación y temperatura), el tipo de suelo y sus propiedades físicas (e. g. pH) y químicas (e. g. materia orgánica, fósforo disponible), ejercen influencia en las comunidades de HMA afectando la abundancia de esporas o la riqueza de especies25 26. Estas propiedades del suelo suelen modificarse por factores de perturbación como el cambio de uso de suelo25 o los incendios forestales que provocan alteraciones en la cobertura vegetal, en la humedad del suelo27 y en el contenido de materia orgánica, que al quemarse y depositarse en forma de cenizas en el suelo, también modifican el pH28; esto en conjunto, tiene implicaciones indirectas en las comunidades de HMA, mientras que de forma directa, se ha demostrado que los incendios también reducen la concentración de glomalina27, el número y la viabilidad de los propágulos micorrícicos arbusculares en el suelo29.
Este trabajo analizó el efecto de un incendio forestal sobre las propiedades del suelo (pH y humedad) y en la riqueza de especies de HMA asociadas a la rizósfera de las especies de matorral xerófilo: Cylindropuntia imbricata (Haworth) F.M. Knuth (Cactaceae), Mimosa biuncifera Benth. (Mimosaceae) y Zaluziana augusta (Lag.) Sch. Bip. (Asteraceae). Las hipótesis de trabajo fueron H1: Si la identidad de la planta hospedera tiene influencia en los HMA entonces la riqueza de especies de HMA en C. imbricata , M. biuncifera y Z. augusta será diferente; y H2: Si el fuego reduce la cantidad de propágulos micorrícicos en el suelo entonces la riqueza de especies de HMA en C. imbricata , M. biuncifera y Z. augusta disminuirá pero dependerá de la identidad de la especie vegetal.
MATERIALES Y MÉTODOS
La investigación se realizó en El Parque Ecológico "Cubitos", un área natural protegida en la categoría de parque estatal. Se ubica en Pachuca, Hidalgo (20° 06' 33" Longitud Oeste y 98° 44' 60" Latitud Norte) a una altitud entre 2,245 y 2,495 msnm, presenta un clima cálido seco con temperaturas promedio mínimas de 10 °C y máximas de 22.7 °C. La estación de lluvias ocurre de mayo a octubre, mientras que, de noviembre a abril es la estación seca. El matorral crasicaule, micrófilo y espinoso son los principales tipos de vegetación en la zona30.
Dentro del Parque Ecológico "Cubitos", en agosto de 2013 se seleccionaron dos sitios de estudio (S). El S1 consistió de un matorral xerófilo conservado y el S2 fue un matorral xerófilo perturbado por el efecto de un incendio forestal que ocurrió el 5 de marzo del 2013 y que no son frecuentes en la zona, de acuerdo a los responsables del área natural protegida se desconocen las causas y no se cuenta con información de la intensidad y efectos sobre la vegetación. Al S1 se le consideró conservado porque no fue afectado por el incendio forestal. En ambos sitios se realizó un transecto para establecer tres puntos de muestreo cada 300 m, en cada punto se seleccionó un individuo de C. imbricata , M. biuncifera y Z. augusta separados entre ellos mínimo 5 m, estas especies se seleccionaron por su abundancia y por estar presentes en ambos sitios. Alrededor del tronco y en los cuatro puntos cardinales, se tomó una muestra compuesta de suelo (1 Kg) de la rizósfera a una profundidad de 0 a 20 cm. Adicionalmente, en cada punto de muestreo se eligió una área sin plantas presentes de forma natural en ecosistemas áridos y semiáridos, que consideramos como áreas abiertas (AA). De estas AA se tomó una muestra de suelo como control, en la misma cantidad y profundidad como se mencionó anteriormente. Cada muestra de suelo fue colocada en una bolsa de plástico y se guardaron en una hielera para su transporte al laboratorio de Zonas Áridas de la Facultad de Estudios Superiores Zaragoza, Universidad Nacional Autónoma de México.
Para evaluar la riqueza de especies de HMA en cada planta, se realizó la extracción de las esporas mediante el método propuesto por Gerdemann y Nicolson31 y Brundrett et al .32 que consistió en: a) pesar 120 g de suelo, b) agregar la muestra en un vaso de 750 mL de capacidad, c) adicionar 500 mL de agua corriente, d) realizar una agitación mecánica durante 5 minutos para romper los agregados y las raíces, y de esta manera, mantener en suspensión las esporas, e) filtrar la suspensión en tamices de apertura de malla de 1,000 y 44 μm, f) centrifugar, durante 5 minutos a 2,500 rpm, la muestra retenida en el tamiz de 44 μm para eliminar la materia orgánica suspendida; g) transferir la muestra de suelo centrifugada a otro tubo que contenía una solución de sacarosa al 60% (peso/vol.), h) centrifugar durante 3 minutos a 1000 rpm, i) filtrar el sobrenadante en el tamiz de 44 μm y j) recuperar la muestra en una caja de Petri para su revisión en un microscopio de disección.
De cada caja Petri se recuperaron las esporas de HMA y se elaboraron preparaciones permanentes con alcohol polivinílico en lactoglicerol (PVLG) y PVLG + Melzer como reactivos de conservación, el Melzer se usó para ver las posibles reacciones y cambios de coloración de las capas que componen la pared de las esporas de HMA32. Estas preparaciones se observaron en detalle en un microscopio compuesto equipado con luz polarizada para hacer un registro de las características morfológicas de las esporas: tamaño, color, tipo de hifas, capas que componen su pared, reacción al reactivo de Melzer, ornamentaciones y escudos de germinación32 33. Estos caracteres morfológicos fueron la base para la determinación taxonómica de las especies de HMA, considerando las descripciones especializadas de las especies reportadas a nivel mundial34 y disponibles en el sitio web http://schuessler.userweb.mwn.de/amphylo/; así como las descritas en el manual de Schenck y Pérez35, en la International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi33 y en la colección de Glomeromycota de Janusz Blaszkowski, Department of Plant Pathology, University of Agriculture in Szczecin, Poland36. Para los nombres científicos de los HMA listados en esta investigación se siguió la nomenclatura de Schüßler y Walker34.
También se evaluaron dos variables del suelo, para determinar variaciones entre plantas y los sitios de estudio. El porcentaje de humedad se determinó por el método gravimétrico que consistió en pesar 15 g de suelo en charolas de aluminio (estimando previamente su peso); después el suelo + la charola se colocaron en un horno a 105 °C para secarlas hasta que mantuvieron un peso constante. El pH activo se determinó en una suspensión de suelo y agua destilada (proporción 1:2 peso/volumen) con un potenciómetro equipado con un electrodo (Corning)37.
Análisis estadístico Para la riqueza de géneros y especies de HMA, humedad y pH se realizaron pruebas de normalidad (Kolmogorov-Smirnov) y homogeneidad de varianzas (prueba de Levene). A las variables al cumplir con los supuestos se les aplicó un Análisis de Varianza (ANOVA) de dos factores: a) microambiente, especie de planta o AA, b) condición, conservado o perturbado. Cuando el ANOVA indicó diferencias significativas (P ≤ 0.05), la comparación de las medias se realizó mediante una prueba de diferencia mínima significativa de Fisher. Con los datos de riqueza de especies de HMA se elaboró una matriz de presencias/ausencias (filas microambientes y columnas especies de hongos) para realizar un análisis de similitud (índice de Jaccard) y uno de correspondencia para explorar de forma gráfica la relación entre la composición de especies de HMA y los microambientes en ambas condiciones38 39 40.
RESULTADOS
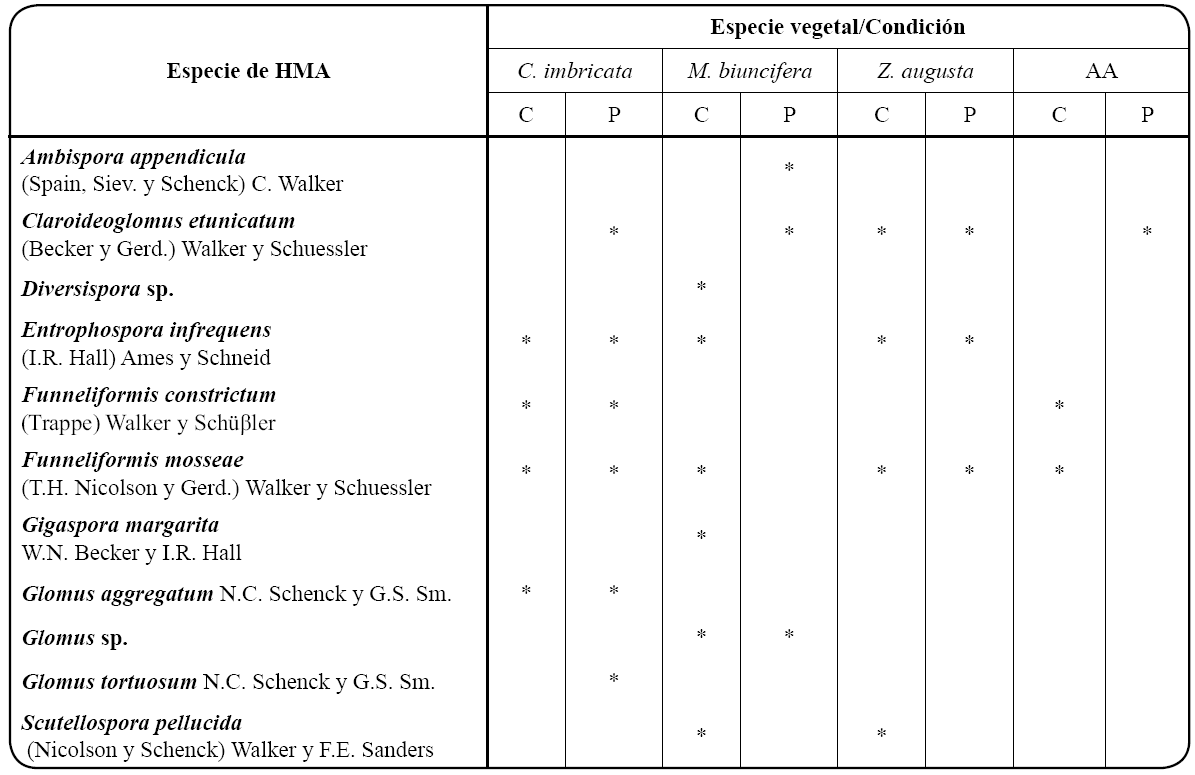
En ambos sitios de estudio del Parque Ecológico "Cubitos" C. imbricata , M. biuncifera y Z. augusta presentaron hongos formadores de la micorriza arbuscular asociados a su rizósfera. La riqueza total de HMA consistió de once morfo-especies, nueve determinadas a nivel de especies y dos a nivel de género (Tabla I), distribuidas dentro de las familias Ambisporaceae, Claroideoglomeraceae, Diversisporaceae, Entrophosporaceae, Gigasporaceae y Glomeraceae.
Tabla I Composición de especies de hongos micorrizógenos arbusculares (HMA) en tres especies vegetales y de áreas abiertas (AA) de un matorral xerófilo conservado (C) y uno perturbado (P) por un incendio forestal en el Parque Ecológico “Cubitos”, Pachuca, Hidalgo
La riqueza de géneros de HMA en el suelo asociado a C. imbricata , M. biuncifera y Z. augusta estuvo en función de la especie vegetal (microambiente) y la condición (F=17.5, P =0.0001, g. l. 3/16); de modo que en el S1 conservado, M. biuncifera fue la planta con la mayor riqueza de géneros (6), mientras que en el S2 perturbado por el fuego fue C. imbricata (4), en ambos casos se presentaron diferencias con respecto a las AA que tuvieron la menor riqueza (1 género). El fuego afectó la riqueza de géneros de HMA, mientras que en M. biuncifera se redujo en un 50% en C. imbricata se incrementó un 33% (Tabla II).
Tabla II Propiedades del suelo asociadas a la rizósfera de tres especies vegetales en un matorral xerófilo conservado y un matorral xerófilo perturbado por un incendio forestal en el Parque Ecológico “Cubitos”, Pachuca, Hidalgo
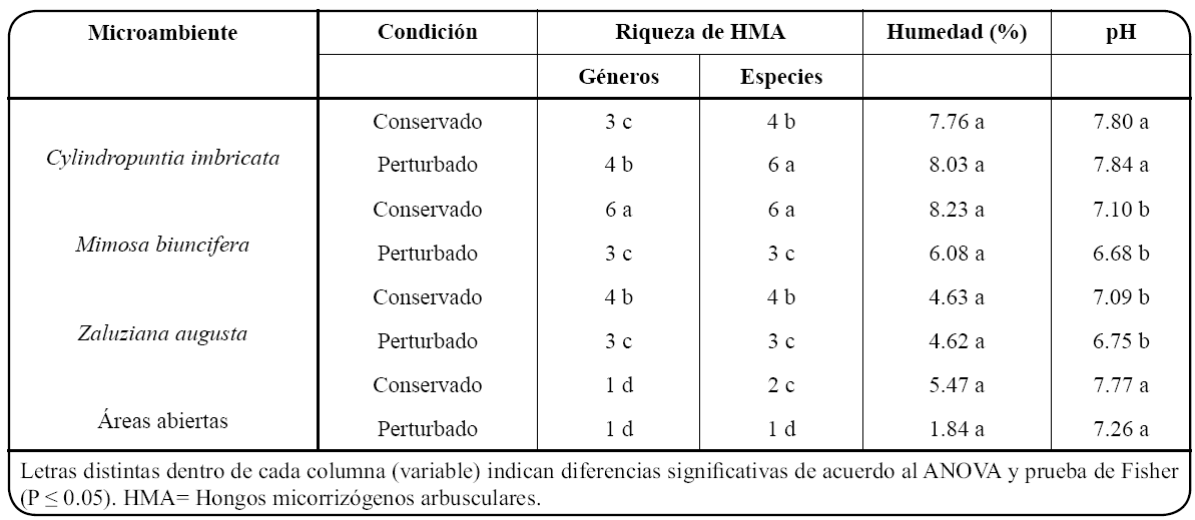
La variable riqueza de especies de HMA presentó una interacción significativa entre la especie vegetal y la condición (F=25.5, P =0.0001, g. l. 3/16), de esta forma, M. biuncifera en la condición conservada registró la mayor riqueza de especies de HMA (6 spp), mientras que en la condición perturbada fue C. imbricata (6 spp.); en ambos casos hubo diferencias con las AA que presentaron el menor número de especies de HMA (2 y 1spp. respectivamente). En todos los microambientes, el fuego afectó la riqueza de especies de HMA, en M. biuncifera , Z. augusta y AA se redujo en un 50, 25 y 50% la riqueza, respectivamente; mientras que en C. imbricata se incrementó en un 34% (Tabla II).
El análisis de similitud generó tres grupos principales, el primero constituido por Z. augusta (condición conservada y perturbada) y M. biuncifera (condición conservada), el segundo con C. imbricata de ambas condiciones y las AA de la condición conservada, y por último, el tercer grupo lo conformaron M. biuncifera y las AA, ambas de la condición perturbada (Figura 1).

Figura 1 Análisis de similitud de la riqueza de especies de hongos micorrizógenos arbusculares de tres especies de matorral xerófilo bajo dos condiciones (conservado y perturbado por un incendio forestal) en el Parque Ecológico “Cubitos”, Pachuca, Hidalgo.
El ordenamiento dimensional de la riqueza de especies de HMA en los microambientes y condiciones evaluadas se explicó por dos principales ejes (62.7% de inercia) de acuerdo al análisis de correspondencia. En el primer cuadrante (I) Gi. margarita y S. pellucida se asociaron a condiciones conservadas en M. biuncifera y Z. augusta ; en el segundo cuadrante (II) Claroideoglomus etunicatum y Ambispora appendicula se agruparon a condiciones afectadas por el fuego con M. biuncifera y las AA; mientras que, en el tercer cuadrante los HMA Funneliformis constrictum , Glomus aggregatum y Glomus tortuosum se asociaron a condiciones conservadas y afectadas por el fuego con C. imbricata (Figura 2).
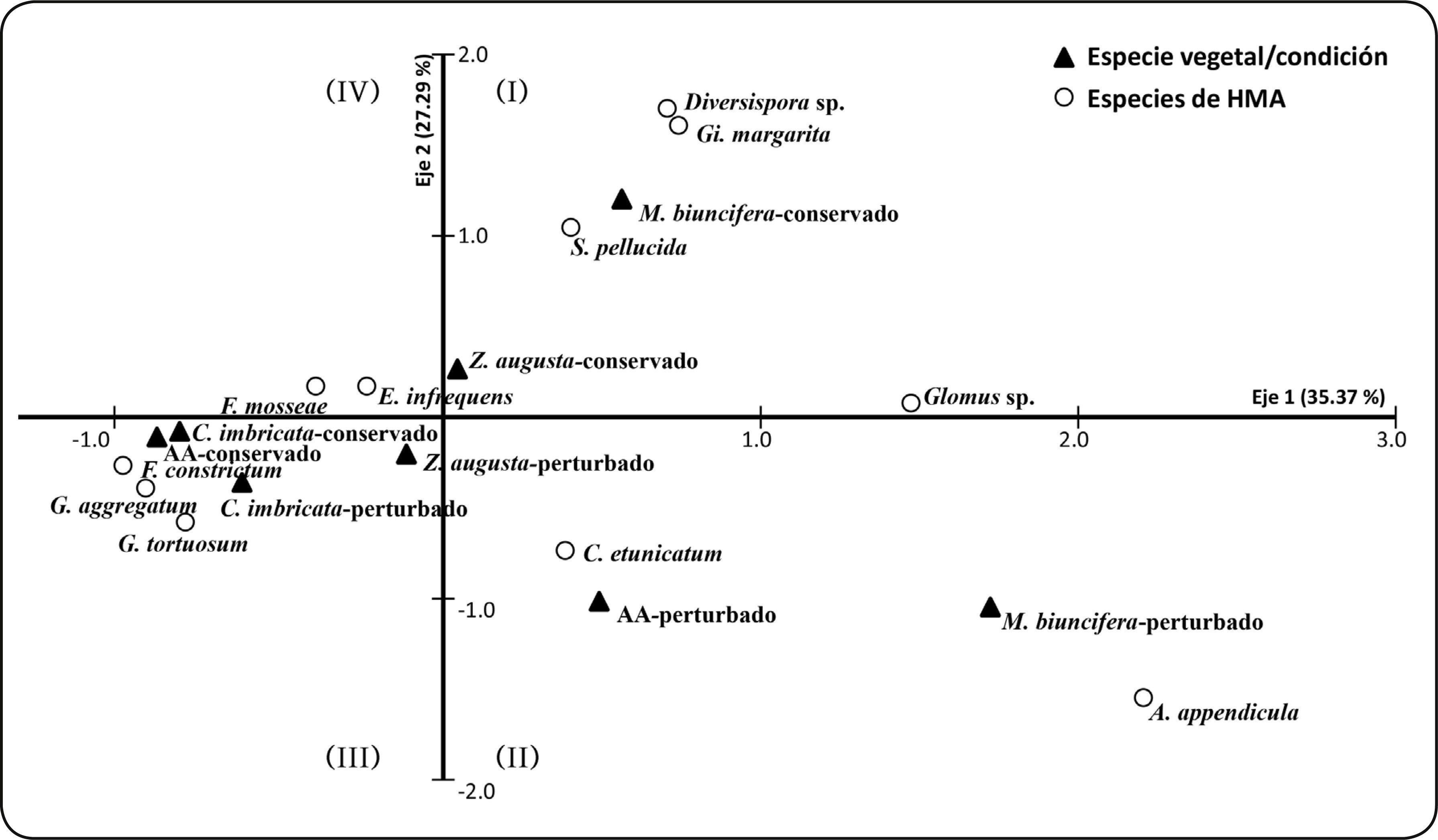
Figura 2 Análisis de correspondencia entre la composición de especies de HMA asociada a tres especies de matorral xerófilo y dos condiciones (conservado y perturbado por un incendio) en el Parque Ecológico “Cubitos”, Pachuca, Hidalgo.
Los porcentajes de humedad en el suelo asociado a C. imbricata , M. biuncifera y Z. augusta no difirieron entre ellos ni con respecto a las AA (F=2.09, P =0.1415, g.l. 3/16). Asimismo, el incendio forestal no tuvo efectos en la humedad del suelo en ninguno de los microambientes evaluados (F=0.97, P =0.3405, g. l. 1/16; Tabla II).
El pH en el suelo asociado a M. biuncifera y Z. augusta tuvo valores cercanos a la neutralidad y fueron más bajos en comparación al pH medianamente alcalino que se registró en el suelo de C. imbricata y de las AA (F=6.82, P =0.0036, g. l. 3/16). Entre los sitios conservado y perturbado por el incendio no se registraron diferencias en los valores de pH en el suelo (F=3.12, P =0.0964, g.l. 1/16; Tabla II).
DISCUSIÓN
La presencia de HMA en la rizósfera de C. imbricata , M. biuncifera y Z. augusta (Tabla I) sugieren que estos microorganismos simbióticos son un componente fúngico constante e importante para las plantas de este matorral xerófilo, como se ha sugerido para grupos vegetales como gramíneas12, leguminosas9 15 y cactáceas9 en distintos ecosistemas áridos y semiáridos. En este tipo de ambientes, también se ha indicado que las comunidades de HMA asociadas a la vegetación están constituidas en gran medida por hongos que pertenecen al orden Glomerales41, lo cual es consistente con lo reportado en el matorral xerófilo del Parque Ecológico "Cubitos", ya que la riqueza de HMA estuvo constituida en un 54.5% con especies que pertenecen a los géneros Claroideoglomus , Funneliformis y Glomus (Glomerales).
La riqueza de especies de HMA asociada a las tres especies vegetales evaluadas en el matorral xerófilo del Parque Ecológico "Cubitos" (Tabla I) presentó valores similares a los reportados en matorrales dominados por leguminosas que forman IR del género Prosopis L. en los Desiertos de Chihuahua (14 spp. de HMA) y Sonora (15 spp.), así como en diversos matorrales y plantas del Desierto de Namibia (13 spp.)41. De estas regiones áridas y semiáridas se han reportado con frecuencia a C. etunicatum , Entrophospora infrequens y Funneliformis mosseae 12 41, HMA que también fueron frecuentes en la rizósfera de C. imbricata , M. biuncifera y Z. augusta en la zona de estudio (Tabla I). En matorrales de la región semiárida del Valle del Mezquital, Hidalgo, García-Sánchez42 reportó a estas tres especies de HMA, así como a A. appendicula , G. aggregatum, G. tortuosum y Scutellospora pellucida en IR de Prosopis laevigata (Humb. et Bonpl. Ex Willd) y M. biuncifera , estos HMA también han sido reportados de otros ambientes xéricos de México3.
El análisis de correspondencia sugiere que C. imbricata , M. biuncifera y Z. augusta tuvieron influencia sobre la riqueza de especies de HMA, debido a que cada especie vegetal presentó su propia comunidad fúngica, aunque hay algunas especies de HMA como C. etunicatum , E. infrequens y F. mosseae que son comunes en la rizósfera de las tres especies de plantas evaluadas; otras como A. appendicula , Diversispora sp. y Gigaspora margarita sólo se registraron en M. biuncifera , mientras que F. constrictum, G. aggregatum y G. tortuosum sólo en C. imbricata (Tabla I; Figura 2).
Similar a lo reportado en esta investigación, en ambientes semiáridos de España Alguacil et al. 43 al evaluar la composición de HMA asociados a las especies de plantas Gypsophila struthium L. (Caryophyllaceae), Teucrium libanitis Schreber (Lamiaceae), Ononis tridentata L. (Leguminosae) y Helianthemum squamatum (L.) Dum. Cours (Cistaceae) y Torrecillas et al. 44 en Hieracium vulgare Tausch (Asteraceae), Anagallis arvensis L. (Primulaceae), Stipa capensis Thunb (Poaceae), Carduus tenuiflorus Curtis (Asteraceae), Avena barbata Brot. (Poaceae) y Brachypodium retusum (Pers.) P. Beauv. (Poaceae) reportaron diferencias en la composición de especies de HMA asociados a la rizósfera de estas especies vegetales que coexisten en los matorrales xerófilos, de esta manera, proponen que la identidad de la especie vegetal es clave en la determinación de la riqueza de especies de HMA en su rizósfera.
La identidad de la planta, así como su capacidad de formar IR como M. biuncifera 14,42 afectan la composición de HMA, pero también se ha reportado en distintos matorrales de ecosistemas semiáridos, que variables ambientales como la temperatura promedio anual y edáficas como la conductividad eléctrica, el fósforo disponible y el pH son importantes predictores de la riqueza de HMA26, en el caso del Parque Ecológico "Cubitos" se registró que las comunidades de HMA entre M. biuncifera y Z. augusta con un pH del suelo cercano a la neutralidad tuvieron mayor similitud entre ellas y menor similitud con C. imbricata y las AA que tuvieron un pH ligeramente alcalino (Figura 1). Aunque estos resultados no son concluyentes, sugieren que las condiciones y recursos del suelo pueden tener implicaciones en la riqueza, por lo que es necesario que futuras investigaciones consideren otras propiedades del suelo como el porcentaje de agregados estables al agua y las concentraciones de carbono, nitrógeno y fósforo para evaluar de forma conjunta la relación e influencia sobre los HMA, ello debido a que se considera que la estequiometría en la relación C:N:P determina la eficiencia y el funcionamiento de la simbiosis micorrícica45.
Con respecto al incendio forestal, la alta similitud en la composición de especies de HMA entre la condición conservada y perturbada en Z. augusta (75%) y C. imbricata (66%) (Figura 1) sugieren que el fuego provocó menores cambios en la riqueza de HMA. De manera contrastante, M. biuncifera tuvo un 11% de similitud en la composición de HMA entre ambas condiciones, indicando que en esta especie vegetal, los HMA se afectaron en mayor medida por el incendio. Es conocido que la cantidad de propágulos micorrícicos y su viabilidad se reduce después de un incendio forestal29, pero con base en los resultados de este estudio, indicarían que la riqueza de especies de HMA presentes en el ecosistema se modifica también dependiendo de la especie vegetal, como lo indicó la interacción estadística entre el microambiente y la condición.
Las especies de HMA que pertenecen a la familia Gigasporaceae se han reportado como las más susceptibles a diversos factores de perturbación como cambio de uso de suelo, prácticas agrícolas y uso de agroquímicos46, la ausencia de los HMA Gi. margarita y S. pellucida (Gigasporaceae) en la rizósfera de M. biuncifera y Z. augusta sustentan que también son susceptibles a otros factores de perturbación como los incendios forestales. Al respecto, también se han reportado cambios en las propiedades del suelo28, sin embargo, en este estudio la humedad y el pH del suelo no difirieron entre la condición conservada y perturbada. Aunque hay que mencionar, que la ausencia de especies de la familia Gigasporaceae puede también estar relacionada con cambios estequiométricos en otras propiedades del suelo que no se evaluaron como carbono (C), nitrógeno (N) y fósforo (P), ya que es importante evaluar la relación C:N:P, porque cambios en esta relación pueden afectar la función de la simbiosis micorrícica45 lo que podría explicar en parte cambios en la riqueza de HMA.
Amanera de conclusión, evaluar la riqueza de HMA en plantas de matorral xerófilo en el Parque Ecológico "Cubitos" y en especial en aquellas especies que forman IR como M. biuncifera 14 42 es importante desde varios puntos de vista. Como área natural protegida en la categoría de parque estatal, es necesario contar no sólo con un inventario de la riqueza de la flora y la fauna, sino también de la diversidad microbiana del suelo; sobre todo para el manejo y conservación in situ 46 de la riqueza de estos microorganismos simbióticos, importantes para la diversidad florística y la productividad de los ecosistemas20 y por último, el conocimiento de la interacción planta-HMA permitiría su uso potencial en prácticas de restauración ambiental47, lo cual requiere comprender que las especies de matorral xerófilo como C. imbricata , M. biuncifera y Z. augusta posiblemente necesiten de una composición de HMA particular, por lo que debe de considerarse al momento de la elaboración y uso de un inoculante micorrícico.
AGRADECIMIENTOS
A la Dra. Esther M. García Amador y al grupo de maestros que conformaron el diplomado "Restauración ecológica de zonas semiáridas" de la Facultad de Estudios Superiores Zaragoza, UNAM. Un agradecimiento especial a Luis Fernando Garduño Cabrera por su apoyo en la recolecta de muestras de suelo en campo y análisis en el laboratorio. A los revisores quienes contribuyeron a mejorar el manuscrito.











 nueva página del texto (beta)
nueva página del texto (beta)


