Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.15 no.2 Ciudad de México dic. 2012
Artículo de revisión
La mitocondria como fábrica de cofactores: biosíntesis de grupo hemo, centros Fe-S y nucleótidos de flavina (FMN/FAD)
The mitochondron as a biosynthesis factory for heme groups, iron-sulphur clusters and flavin nucleotides
Alexa Villavicencio-Queijeiro
Departamento de Genética Molecular, Instituto de Fisiología Celular, Universidad Nacional Autónoma de México. Apdo. Postal 70-242, C.P. 04510, Coyoacán, México, D.F. Correo: queijeiro@email.fc.unam.mx
Artículo recibido el 20 de agosto de 2012
Aceptado el 27 de septiembre de 2012
Resumen
Los cofactores hemo, centros Fe-S y los nucleótidos de flavina (FMN y FAD) son esenciales para muchos organismos, existen un gran número de proteínas que dependen de ellos para llevar a cabo sus funciones biológicas. Estos cofactores han sido reconocidos como esenciales para las reacciones de óxido-reducción, pero también están involucrados en otros procesos celulares como la catálisis química, la regulación, la señalización y la detección de señales intra y extra celulares. Diversos grupos de investigación han contribuido al establecimiento de las rutas bioquímicas por las que se sintetizan estos cofactores, así como a la forma en que se transportan y regulan en los diferentes organismos. Todo este conocimiento ha permitido asociar algunas enfermedades con defectos metabólicos en estas rutas de biosíntesis, así como plantear nuevas estrategias terapéuticas y algunas aplicaciones biotecnológicas.
Palabras Clave: Biosíntesis, centros Fe-S, cofactores, grupo hemo, nucleótidos de flavina.
Abstract
Iron-sulphur clusters, heme cofactors and flavin-nucleotides are essential for many microorganisms. There are many proteins that depend upon them to perform their biological activities. These cofactors have been recognized as essential for redox reactions and are also involved in many cellular functions such as chemical catalysis, regulation and signalling. Many groups have contributed to the establishment of the biochemical routes by which these cofactors are synthesized, transported and regulated in different organisms. All this knowledge has allowed to link defects on these routes with diseases and syndromes, as well as to propose new therapeutic strategies and biotechnological applications.
Key Words: Biosynthesis, iron-sulphur clusters, cofactors, heme group, flavin nucleotides.
Introducción
Muchos microorganismos crecen en presencia de glucosa y sales inorgánicas, generando energía catabólica mediante la glucólisis, el ciclo de los ácidos tricarboxílicos y la fosforilación oxidativa. También sintetizan simultáneamente componentes universales como aminoácidos, ácidos nucleicos, lípidos y vitaminas, a partir de los intermediarios que se producen en el catabolismo.
Las rutas biosintéticas de estos componentes se han establecido utilizando a la bacteria Escherichia coli como modelo de los procariontes y a la levadura Saccharomyces cerevisiae como modelo de los eucariontes. Por mucho tiempo se pensó que estas vías eran ubicuas entre todos los microorganismos, pero ahora se sabe que los procariontes y los eucariontes emplean rutas diferentes para sintetizar los mismos componentes, sobre todo para la biosíntesis de cofactores. Muchas proteínas dependen de cofactores para llevar a cabo su función; de manera general estos compuestos de bajo peso molecular se unen en motivos de secuencia bien definidos y evolutivamente conservados ya sea de manera covalente o no covalente. Entre los cofactores orgánicos se encuentran varios nucleótidos (flavín-mononucleótido y flavín adenín dinucleótido), vitaminas (biotina, pantotenato y folato), compuestos metalorgánicos que pueden contener elementos metálicos como hierro y molibdeno (hemo y nitrogenasas). También existen cofactores inorgánicos, como iones metálicos Mg2+ Zn2+, Cu'+/2+ Mn2+, Fe'+/2+ que regularmente se encuentran en sitios de unión mononucleares.
En esta revisión se abordarán las rutas de biosíntesis del grupo hemo, de los centros Hierro-Azufre y de los nucleótidos de flavina (FMN y FAD).
Grupo hemo
El hierro es indispensable para la vida; funciona como un cofactor metálico en varias enzimas, que pueden o no ser hemoproteínas. Las hemoproteínas están involucradas en un amplio espectro de funciones biológicas cruciales que incluyen la unión a oxígeno (hemoglobinas), el metabolismo de oxígeno (oxidasas, peroxidasas, catalasas e hidroxilasas) y la transferencia de electrones (citocromos). Por tanto, el grupo hemo se forma en casi todos los sistemas vivos, excepto por algunos anaerobios obligados y ciertos organismos unicelulares que presentan auxotrofía por las porfirinas y/o por el grupo hemo.
Los estudios que se han hecho han llevado a pensar que el grupo hemo es solamente un grupo prostético, que puede estar o no unido covalentemente y que cumple una función biológica de acuerdo con los requerimientos celulares, pero ésto sólo representa una parte de un papel mucho más amplio y complejo. Por ejemplo, se ha descrito que el hemo funge como regulador de la expresión de varios factores de transcripción1. Se le ha relacionado también con el control en canales iónicos de potasio activados por calcio2 y en la regulación del ciclo circadiano3. Recientemente, se le ha adjudicado un papel preponderante en la enfermedad de Alzheimer, aunque aún no se sabe si la deficiencia del hemo puede ser una causa del síndrome o si es consecuencia de los cambios dramáticos que se suscitan con la enfermedad4.
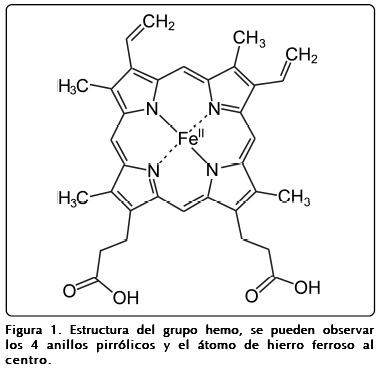
Estructuralmente el grupo hemo está compuesto por un átomo de hierro y un anillo orgánico heterocíclico de gran tamaño denominado porfirina, es decir un tetrapirrol cíclico en el que los 4 anillos de pirrol están unidos por enlaces metileno (=CH-) y en el centro de este anillo se encuentra el átomo de hierro (Figura 1). Aunque presenta cargas negativas que le confieren un extremo polar, el grupo hemo tiene propiedades apolares y es por tanto insoluble en agua por lo que se sitúa en una cavidad hidrofóbica dentro de las proteínas. Resulta interesante el hecho de que los anillos de porfirina que tienen metal unido ya estaban presentes cuando la fotosíntesis apareció en la tierra, lo que indica que algunos organismos ya sintetizaban hemo incluso antes de que el oxígeno estuviera presente en la atmósfera terrestre5.
Biosíntesis del grupo Hemo
En animales, hongos y procariontes de la división de las α-proteobacterias el grupo hemo es sintetizado mediante 8 pasos enzimáticos. En eucariontes el proceso está espacialmente dividido: 4 pasos se llevan a cabo en el citoplasma y 4 en la mitocondria (Figura 2). Las porfirinas libres no cumplen una función en la célula y generalmente se producen accidentalmente como productos secundarios de la síntesis del grupo hemo. De manera normal, la biosíntesis del grupo hemo es extremadamente eficiente, con un uso casi total de los intermediarios de porfirina.
El primer paso consiste en la condensación entre la glicina y la succinil coenzima A en ácido 5 aminolevulínico (ALA). Esta reacción es catalizada por la sintasa del ácido aminolevulínico (ALAS). El precursor de la enzima es sintetizado en el citosol y dirigido a la mitocondria mediante un péptido señal que es removido posteriormente, lo que permite el plegamiento, dimerización y la adición del cofactor piridoxal fosfato. Se sabe que la mayoría de las proteínas ALAS contienen de 2 a 3 motivos (HRMs) que están involucrados en la regulación a nivel postraduccional, ya que el grupo hemo se une a ellos previniendo la translocación del precursor a la mitocondria con el concomitante resultado de una concentración menor de ALAS en la matriz mitocondrial.
Después de ser sintetizado el producto es transportado al citoplasma; la deshidratasa de ALA (ALAD) condensa 2 moléculas para formar 4 porfobilinógeno (PBG), este compuesto ya tiene el anillo pirrólico. La ALAD puede dividirse en 2 clases: zinc-dependiente, que está presente en los animales, las levaduras y las bacterias y la magnesio-dependiente presente en las plantas.
A continuación la enzima desaminasa de PBG (PBGD) toma 4 moléculas de PBG para dar lugar al precursor inestable hidroximetilbilano (HMB), es en este paso donde se produce la estructura tetrapirrólica característica del hemo. En S. cerevisiae este es el paso limitante en la síntesis de hemo; la expresión del gen hem3, que da lugar a la proteína PBGD, es constitutiva pero se reprime en presencia de fuentes de carbono fermentables y en condiciones de hipoxia7. Si bien se tiene ya una estructura tetrapirrólica, ésta difiere mucho de la del grupo hemo pues carece del átomo central de hierro ferroso y el anillo contiene sólo 8 de los 11 dobles enlaces que debe tener. Además las cadenas laterales están cargadas y dado que los grupos hemo actúan en el interior apolar de las proteínas, el carácter polar debe modificarse a uno menos polar.
La uroporfirinógeno III sintasa (UROS) cataliza la ciclización del HMB a uriporfirinógeno III (UROIII). Esta molécula es el precursor de todos los tetrapirroles, además de ser el intermediario común entre la vía de síntesis del grupo hemo y del sirohemo; este último es cofactor de las reductasas de nitrito y sulfito y se abordará posteriormente. La quinta enzima de la vía de biosíntesis del grupo hemo es la uroporfirinógeno III descarboxilasa (UROD), que cataliza la descarboxilación de 4 cadenas laterales de acetilo del uroporfirinógeno III a coproporfirinógeno III (COPROIII).
Con excepción de la levadura S. cerevisiae, el producto es transportado a la mitocondria, donde es convertido a protoporfirinógeno IX por la coproporfirinógeno III oxidasa (CPO). Ésta es la primera reacción de la vía que requiere oxígeno para la descarboxilación oxidativa de las cadenas laterales carboxietil 2- y 4- del sustrato COPROIII, para dar lugar a 2 grupos vinilo en el protoporfirinógeno IX8. En S. cerevisiae la CPO está asociada a la membrana externa mitocondrial con el sitio activo orientado hacia el citosol; la diferencia entre la proteína de la levadura y la de los vertebrados es la presencia o ausencia del péptido señal.
El siguiente paso consiste en la oxidación del protoporfirinógeno con la transferencia de 6 electrones mediada por la protoporfirinógeno oxidasa (PPO) para obtener protoporfirina IX (PPIX). Esta reacción dependiente del oxígeno es llevada a cabo en 3 ciclos independientes por la PPO, en cada uno se transfieren 2 electrones9. El producto final, el grupo hemo, es formado por la ferroquelatasa (FC) que cataliza la inserción de un átomo ferroso en la protoporfirina IX10.
En eucariontes la apoproteína es sintetizada en el citosol y es translocada a su destino final: la matriz mitocondrial. Esta translocación requiere energía dado que involucra la remoción de la secuencia líder en el amino terminal y el ensamblaje del centro hierro-azufre [2Fe-2S].
Transporte del hierro y hemo
El hierro es el cuarto elemento más abundante en la corteza terrestre pero su adquisición e incorporación en los sistemas biológicos es muy difícil dada la alta toxicidad del hierro ferroso y la insolubilidad del hierro férrico. A pesar de estos desafíos los organismos han desarrollado mecanismos para importar y utilizar el hierro.
El hierro es transportado de los sitios donde se absorbe y se almacena en aquéllos donde es utilizado por la proteína transferrina. Esta proteína es tan importante que se le considera también parte de la maquinaria de síntesis del grupo hemo. Se ha demostrado que es la única fuente de donde la ferroquelatasa toma el hierro necesario para llevar a cabo el último paso en la síntesis del grupo hemo11. Se ha visto que humanos y ratones con atransferrinemia hereditaria tienen anemia hipocrómica microcítica, ésto se correlaciona con la dependencia de la ruta de síntesis de hemoglobina en el hierro proveniente de la transferrina12.
Después de la síntesis del hemo, su transporte o el de sus intermediarios es también un paso limitante en la producción de hemoproteínas. Probablemente se requiere un transporte dirigido para proveer de cantidades suficientes del grupo hemo a diferentes organelos como el retículo endoplásmico, el núcleo y los peroxisomas. Dada la naturaleza hidrofóbica y la reactividad del grupo hemo es poco probable que éste se difunda libremente en el citosol.
Aunque el campo de investigación del transporte del grupo hemo y sus intermediarios está en ciernes, se han identificado algunos transportadores en las células de mamífero: la proteína acarreadora de hemo 1 (HCP1), la proteína de resistencia al cáncer de mama (BCRP) y el receptor del virus C involucrado en la leucemia felina (FLVCR)13. Además de estos transportadores se ha descrito a la subfamilia B perteneciente a la superfamilia de los transportadores ABC. El ABCB6 es el transportador del intermediario COPRO, fue localizado inicialmente en la membrana externa mitocondrial y se sabe que puede transportar con menor afinidad otras porfirinas. Se han localizado isoformas de este transportador en la membrana plasmática y en el aparato de Golgi14. Defectos en este transportador han sido relacionados con el síndrome metabólico letal en niños recién nacidos15. El transportador ABCB7 se encuentra en la membrana interna mitocondrial y es esencial, ya que la interrupción del gen que lo codifica es letal. Este transportador se requiere para la maduración de las proteínas Fe-S en el citosol y para el transporte de los intermediarios de esta ruta. De manera interesante ABCB7 parece estar involucrado en la síntesis de hemo a través de una interacción con la ferroquelatasa.
Algunos microorganismos presentan también otro mecanismo para el transporte de hierro: los sideróforos, que son compuestos solubles en agua y derivados del ácido hidroxámico, cuya función es acoplarse al hierro en su estado de oxidación +3, lo que permite su transporte dentro de la célula por mecanismos de transporte activo. Algunos ejemplos de sideróforos producidos por bacterias y hongos son: ferricromo (Ustilago sphaerogena), enterobactina (Escherichia coli), enterobactina y bacillibactina (Bacillus subtilis), ferrioxamina B (Streptomyces pilosus), fusarinina C (Fusarium roseum), vibriobactina (Vibrio cholerae), azotobactina (Azotobacter vinelandii) y pseudobactina (Pseudomonas B 10).
Rama del sirohemo
Como se mencionó, UROIII es un intermediario común para las vías de síntesis del grupo hemo y del sirohemo. El sirohemo es un grupo prostético similar al grupo hemo presente en las sulfito y nitrito reductasas y está involucrado en la reducción del sulfito y nitrito a sulfuro y amoniaco, respectivamente. La importancia del sirohemo se puede ejemplificar con la función de las sulfito reductasas que son indispensables para la síntesis de los aminoácidos metionina y cisteína16.
El sirohemo es sintetizado en 4 pasos a partir del UROIII; dos S-adenosil-L-metionina transmetilaciones, una deshidrogenación y una ferroquelación. En E. coli todas estas funciones son llevadas a cabo por la proteína cysG. En comparación, la levadura S. cerevisiae posee 2 enzimas; MET1p cataliza la reacción de transmetilación y MET8p que es responsable de las reacciones de deshidrogenación y ferroquelación17.
Patologías relacionadas con el grupo hemo
El grupo hemo está involucrado en muchos procesos esenciales en la mayoría de los organismos. Como resultado de ésto, su ruta de síntesis está muy conservada (aunque con algunas modificaciones) y fuertemente regulada, debido a la naturaleza reactiva del hemo y sus intermediarios. A pesar de lo anterior los mecanismos por los que se regula no parecen estar conservados entre los eucariontes.
Se ha descrito un gran número de enfermedades relacionadas con este grupo y en varias de ellas ocurre la presencia de precursores de hemo en las heces o la orina, volviéndolas de color rojo oscuro. Existen un gran número de afectaciones hereditarias en la síntesis de porfirinas, a las que se conoce de manera general como porfirias. En total existen 7 tipos de porfirias; 4 son agudas y se han denominado así porque generalmente causan repentinos ataques de dolor abdominal que duran varios días. Las otras 3 afectan principalmente a la piel y no causan síntomas agudos en otros órganos. Todas las porfirias se deben a un defecto en alguna de las 7 enzimas de la vía de síntesis del grupo hemo.
La biosíntesis del grupo hemo requiere de manera indirecta vitamina B6, riboflavina, biotina, ácido pantoténico y ácido lipoico, así como zinc, hierro y cobre que son esenciales para la producción del succinil CoA. También se sabe que en el envejecimiento se presenta un fenómeno de hipometabolismo lo que ocasiona una disminución en los requerimientos de la ruta y a su vez cambios en la concentración del grupo hemo. Por lo anterior, se ha relacionado al hemo con enfermedades degenerativas asociadas con el envejecimiento, tales como la enfermedad de Alzheimer. Se sabe que las afectaciones en el metabolismo de hemo se traducen en decaimiento mitocondrial, estrés oxidativo y acumulación de hierro, siendo todas estas características del envejecimiento.
Las porfirinas tienen también una utilidad médica: la terapia fotodinámica es un tratamiento alternativo para el cáncer de piel, ya que permite la eliminación selectiva de las células cancerígenas. Es una técnica no invasiva en la que se administran de manera intravenosa porfirinas que se concentran en los tumores malignos, después se hace incidir luz sobre el tumor, la luz es absorbida por las porfirinas que al activarse reaccionan con el oxígeno, produciéndose así especies reactivas de oxígeno, lo que al final se traduce en la destrucción de las células malignas.
Centros Hierro-Azufre
Los centros Hierro-Azufre (Fe-S) son cofactores pequeños y ubicuos que representan uno de los catalizadores más antiguos en la evolución de las biomoléculas. Están involucrados en procesos bioquímicos fundamentales que incluyen fotosíntesis, regulación de la actividad enzimática, respiración mitocondrial, fijación de nitrógeno, unión y activación de sustratos, biogénesis de ribosomas, catálisis redox, replicación y reparación de ADN, regulación de la expresión genética y metabolismo de nucleótidos.
El hierro y el azufre son dos de los elementos más versátiles y cruciales en el planeta y su importancia biológica es incuestionable. Los centros Fe-S contienen hierro y azufre en diferentes relaciones molares. Los más sencillos y comunes son el rómbico [2Fe-2S] y el cúbico [4Fe-4S] ;en la Figura 3 se muestran estas estructuras. Existen otros [3Fe-4S] en enzimas como la ferrodoxina I en bacterias y más complejos [8Fe-7S] como el que está presente en la nitrogenasa Mo-Fe, cuyo centro se compone de hierro y molibdeno18.
En la mayoría de las proteínas hierro-azufre, el hierro se une a residuos de cisteína, aunque también las cadenas laterales de la histidina, la serina y del ácido aspártico pueden funcionar como ligandos. A pesar de que se han identificado un gran número de proteínas hierro-azufre no se ha encontrado un motivo consenso que permita predecir si una proteína puede unir un centro Fe-S. La función más común de los centros Fe-S es la transferencia de electrones basada en la propensidad del hierro a cambiar entre sus estados de oxidación +2 y +319. Dentro de un ambiente proteico los centros Fe-S adoptan potenciales redox desde -500 mV hasta +300 mV lo que los convierte en excelentes donadores y aceptores de electrones20. Algunas proteínas de este grupo son los complejos mitocondriales I y III, el fotosistema I, las ferredoxinas e hidrogenasas.
Otra función muy estudiada de los centros Fe-S es la de la catálisis enzimática, el ejemplo clásico es la aconitasa que posee un centro cúbico [4Fe-4S] con un hierro que no está coordinado con la proteína, el hierro funciona como un ácido de Lewis para ayudar a la sustracción de una molécula de agua del citrato, que es convertido a isocitrato. Un tercer papel de los centros Fe-S es el de sensores de las condiciones ambientales o intracelulares para regular la expresión genética. Ejemplos de este tipo de proteínas son los factores de transcripción bacterianos FNR, IscR y SoxR que perciben oxígeno, centros Fe-S y superóxido, respectivamente.
BlOSÍNTESIS DE CENTROS Fe-S
La química ha revelado que existe una gran diversidad de centros Fe-S en las proteínas, si bien la estructura de los centros Fe-S es sencilla, su biogénesis requiere complejas maquinarias proteicas y diferentes rutas para su ensamblaje. Los centros Fe-S son ensamblados a partir de hierro, asociado a proteínas transportadoras y azufre, este último proviene de residuos de cisteína. El proceso se lleva a cabo en proteínas que fungen como andamios y, posteriormente, se transfieren a las apoproteínas receptoras.
La maduración de las proteínas hierro-azufre ha sido intensamente estudiada en E. coli y en A. vinelandii; este último es un organismo fijador de nitrógeno. Se han identificado 3 sistemas diferentes para la biogénesis de estas proteínas: el sistema de fijación del nitrógeno (NIF), encargado específicamente de la maduración de la nitrogenasa en bacterias azotróficas; los sistemas ISC (de centros Fe-S) y SUF (factor de utilización del azufre) encargados de la generación de proteínas Fe-S que cumplen funciones de mantenimiento en la célula en condiciones normales y de estrés oxidativo, respectivamente.
Durante la evolución las maquinarias ISC y SUF se transfirieron por endosimbiosis a eucariontes que poseen proteínas Fe-S en la mitocondria, citosol y núcleo21,22. El sistema ISC está presente en mitocondrias, en tanto que los plástidos albergan al sistema SUF. En el citosol y núcleo eucarionte el ensamblaje de proteínas Fe-S requiere de la acción coordinada de la maquinaria ISC de ensamble mitocondrial y del sistema ISC de exportación. La maduración de las proteínas Fe-S depende de la maquinaria de ensamblaje citosólica (CIA), que está presente en virtualmente todos los eucariontes.
La levadura S. cerevisiaeha servido como un organismo modelo para el estudio detallado de la biosíntesis de proteínas Fe-S en eucariontes23,24. A pesar de las diferencias obvias entre los sistemas de bacterias y eucariontes existen principios básicos que subyacen a la síntesis in vivo de los centros Fe-S y el ensamblaje en apoproteínas; esto se muestra en la Figura 4.
Los sistemas NIF, ISC, SUF y CIA tienen reglas biosínteticas en común. El proceso de biosíntesis puede dividirse en 2 pasos principales: el ensamblaje de novo de un centro Fe-S en una proteína de andamiaje y la transferencia del centro Fe-S de la proteína andamio a la apoproteína, así como su posterior incorporación a la cadena polipeptídica. Cada uno de estos pasos involucra la participación de muchas proteínas y cofactores que ejecutan reacciones específicas que definen principios generales que son aplicables a todos los sistemas conocidos, aunque para algunos sistemas falta determinar reacciones parciales específicas a cada uno.
Los números que se muestran en la Figura 4 corresponden a los siguientes pasos:
1. Donador de azufre: una desulfurasa de cisteína (NifS, IscS o SufS) libera el azufre necesario para la formación del centro Fe-S, éste proviene de un residuo de cisteína que se transforma en alanina, la transferencia implica la formación de un intermediario persulfuro entre el azufre que se transfiere y un residuo de cisteína conservado en la desulfurasa. Este intermediario se transfiere después a residuos conservados de cisteína en proteínas auxiliares como SufE o directamente a proteínas andamio.
2. Donador de hierro: dado que es poco probable que el hierro se encuentre libre en solución, deben existir donadores de hierro que garanticen su entrega a proteínas de andamiaje. Esta función es llevada a cabo por la proteína bacteriana CyaY (Yfh1 en mitocondrias), que une al hierro, a la desulfurasa y a la proteína andamio Isu1/IscU.
3. Transferencia de electrones: se requieren electrones para llevar a cabo la reducción del elemento azufre (S0) proveniente de la cisteína a sulfuro (S2-) que es la forma presente en los centros Fe-S. Esta función podría recaer en la ferredoxina reductasa y la ferredoxina del sistema ISC y por el dominio de ferredoxina reductasa de NifU en el sistema NIF.
4. Proteínas de andamiaje: estas proteínas sirven como plataforma para la biosíntesis de novo de los centros Fe-S. Contienen residuos de cisteína muy conservados y unen al centro Fe-S de forma lábil, por lo que el centro puede ser transferido e integrado establemente a su proteína blanco. Los andamios más conservados son las proteínas bacterianas IscU y SufU y en los eucariontes Isu1. Las proteínas NFU y NifU en plástidos. En bacterias existen también las proteínas SufA e IscA.
5. Transferencia del centro Fe-S: existen factores específicos involucrados en la transferencia del centro Fe-S de la proteína andamio a la apoproteína. Estas proteínas pueden tener 3 funciones: inducir la disociación del centro Fe-S del andamio; garantizar la transferencia correcta y específica del centro a la apoproteína adecuada y promover el correcto ensamblaje del centro en los sitios aceptores adecuados. Entre estas proteínas se encuentran Ssq1 y Jac1, que son mitocondriales, HscA y HscB que son chaperonas del sistema bacteriano ISC y Nar1 y Cia1 de la maquinaria CIA.
Sistema ISC (bacterias y mitocondrias)
El estudio experimental de la biogénesis de las proteínas Fe-S fue impulsado por la identificación del operón bacteriano isc26. Este descubrimiento no sólo tuvo efecto en la investigación del ensamblaje de estas proteínas en bacterias, sino que también potenció los primeros intentos por identificar la biogénesis de estas proteínas en eucariontes. Dada la relación evolutiva entre bacterias y mitocondrias, se han identificado y caracterizado funcionalmente componentes en mitocondrias que son homólogos al sistema ISC bacteriano27.
En la Figura 5 se muestra cómo se lleva a cabo este proceso: de manera inicial el centro Fe-S se ensambla de manera transitoria en la proteína de andamiaje IscU (bacterias) e Isu1 (mitocondrias), que contiene 3 residuos conservados de cisteína. Posteriormente el centro es transferido de IscU/Isu1 a la apoproteína correspondiente mediante la coordinación con residuos específicos. La primera reacción, es decir el ensamble del centro Fe-S en la proteína IscU/Isu1, depende de forma crítica de una desulfurasa de cisteína (abordada previamente) que actúa como donador del sulfuro. En bacterias esta reacción es llevada a cabo por IscS que es muy similar a NifS, que es el miembro fundador de esta familia de proteínas y está involucrada en la maduración de la nitrogenasa28.
En las bacterias, IscS es una proteína dimérica con 2 dominios; un dominio posee el sitio de unión de piridoxal fosfato y un dominio más pequeño que contiene el sitio activo que retiene transitoriamente el azufre liberado de la cisteína como persulfuro y lo transfiere a IscU. En las mitocondrias la función de desulfurasa de cisteína es llevada a cabo por el complejo de las proteínas Nfs1 (similar a IscS) e Isd11, in vivo este complejo se encarga de transferir el azufre de Nfs1 a Isu1 (IscS e IscU en bacterias)29,30.
Se cree que en levaduras y bacterias la proteína de unión a hierro Frataxina (Yfh1 en levaduray CyaY en bacterias) funciona como el donador del hierro al interactuar con Nfs1-Isu 31,32. El ensamblaje de los centros Fe-S en Isu1 (la proteína andamio) depende de la transferencia de los electrones de la reductasa mitocondrial ferredoxina Yah1 (Fdx en bacterias), la cual recibe a los electrones de la ferredoxina -reductasa Arh1 y de NADH33.
El segundo paso en la biogénesis comprende formalmente la liberación del centro Fe-S de la proteína de andamiaje (IscU/ Isu1), el cual es transferido y ensamblado en la apoproteína blanco, estos 3 pasos no han podido ser evaluados experimentalmente de manera individual pero se sabe que en bacterias el proceso es asistido por un sistema de chaperonas; HscA que establece una interacción dependiente de ATP muy específica con la proteína de andamiaje (IscU/Isu1), y HscB que induce un cambio estructural en IscU/Isu1, con lo que desestabiliza al centro Fe-S facilitando así su disociación y posterior inserción en la apoproteína .
El sistema ISC descrito previamente se encarga de la síntesis de la mayoría de las proteínas con centros Fe-S, pero se sabe que hay algunas proteínas cuya maduración requiere la participación de más componentes, tal es el caso de los miembros de la superfamilia Aconitasa y las proteínas SAM, en cuya biogénesis están involucradas las proteínas mitocondriales Isa1, Isa2 e Iba5734. Otra clase de proteínas particulares son las ErpA, que son esenciales para el crecimiento y están involucradas en la maduración de una proteína Fe-S de la ruta de biosíntesis de isoprenoides35.
Sistema SUF (bacterias y plástidos)
En E. coli la interrupción del operón isc no está asociada a un fenotipo notorio, la viabilidad celular se afecta sólo cuando se inactiva de manera simultánea al sistema SUF36. Los genes suf están organizados en un operón que se induce en condiciones de estrés oxidativo y cuando el hierro está en concentraciones limitadas37. La expresión de los genes de los operones isc y suf se regula de manera coordinada por las proteínas Fe-S: IscR y SufR, que funcionan como represores transcripcionales de su respectivo operón. Cuando las concentraciones de hierro son bajas o la célula está en condiciones de estrés oxidativo, la forma inactiva (apo) de IscR activa aún más al operón suf, lo que muestra que ambas proteínas están ligadas en la maduración eficiente de las proteínas Fe-S38.
Los componentes de la maquinaria SUF están presentes en muchos procariontes, incluyendo a las arqueas y las bacterias fotosintéticas. Estos componentes llevan a cabo algunas de las funciones previamente descritas.
El complejo SufS/SufE funge como desulfurasa de cisteína, SufS es similar a IscS o NifS pero su mecanismo es diferente: SufE estimula la actividad de SufS en más de 10 veces lo que permite que el intermediario persulfuro unido en un residuo de cisteína en SufS se transfiera a un residuo de cisteína en SufE, de donde pasa a las proteínas andamio39,40.
Aunque no se ha descrito qué proteína pudiera ser la responsable de donar el hierro, es de esperarse que exista un componente con esta actividad en la vía. Varias proteínas SUF podrían fungir como andamios para la síntesis de novo de centros Fe-S, aunque su papel específico debe ser clarificado. La homología funcional entre los componentes del sistema ISC y del sistema SUF se muestra en la Tabla I.
Las proteínas del sistema SUF están presentes también en plástidos, lo que refuerza que esta vía es menos sensible a altas concentraciones de oxígeno. La funcionalidad de las proteínas SufS, SufE y SufA se ha confirmado mediante experimentos in vitro y ensayos de complementación en bacterias, pero la evidencia directa de su función in planta ha sido más difícil de lograr41.
Biogénesis de proteínas Fe-S citosólicas y nucleares
La maduración de las proteínas Fe-S tanto en el citosol como en el núcleo depende estrictamente de la maquinaria mitocondrial ISC. Se han encontrado niveles bajos de proteínas de la maquinaria ISC en el citosol de células humanas en cultivo, por lo que se ha sugerido que la maquinaria ISC produce un componente (X en la Figura 6) que aún no ha sido caracterizado pero que podría contener azufre y al ser exportado de la matriz mitocondrial al citosol estar involucrado en el proceso de maduración de las proteínas Fe-S42,43.
Se desconoce si el hierro también es exportado de la mitocondria o si proviene del citosol. La proteína Atm1 es la encargada del transporte, pertenece a la superfamilia de trasportadores ABC y se encuentra en la membrana interna mitocondrial. Otro componente que se requiere para la exportación es la oxidasa de sulfhidrilo Erv1, que se localiza en el espacio intermembranal, esta proteína también cataliza la formación de puentes disulfuro durante la importación de proteínas al espacio intermembranal, mediada por Mia-40. Se ha observado que levaduras en las que el glutatión (GSH) está agotado muestran un fenotipo similar al de la falta de Atm1 o Erv1, es decir, fallas en la biogénesis de proteínas Fe-S sin que se afecte el ensamblaje, por lo que se ha establecido que Atm1, Erv1 y GSH forman a la maquinaria de exportación ISC44.
La maduración de las proteínas Fe-S citosólicas y nucleares involucra a la maquinaria citosólica de ensamblaje de proteínas Fe-S (CIA), que está compuesta de 5 proteínas, que se muestran en la Tabla I (ver también la Figura 6). Con base en estudios in vivo e in vitro, el proceso puede dividirse en 2 reacciones parciales; primero, un centro Fe-S es ensamblado transitoriamente en las NTPasas Cfd1 y Nbp35, que forman un complejo heterotetramérico y que fungen como andamio, como se mencionó previamente, este paso requiere a la maquinaria mitocondrial ISC. Posteriormente, el centro Fe-S es transferido a las apoproteínas, este proceso es asistido por las proteínas Nar1 y Cia1, pertenecientes al sistema CIA. A su vez Cdf1 y Nbp35 participan en la maduración de Nar1, por lo que esta proteína es parte y blanco del sistema CIA, con lo que se establece un mecanismo de retroalimentación en el sistema. La holoproteína Nar1 está encargada de transferir los centros Fe-S a las apoproteínas blanco mediante la interacción con Cia145.
Si bien el organismo modelo en el que se ha estudiado la biogénesis de centros Fe-S en eucariontes es la levadura S. cerevisiae, este proceso se conserva en todos los eucariontes, lo que se ha comprobado con estudios funcionales en modelos de cultivo celular, ratones, pez cebra y Drosophila en los que se han encontrado a las proteínas Nfs1, Isu1, frataxina, Atm1, Nbp35 y Nar1, así como genes duplicados de los sistemas ISC y CIA, lo que sugiere que en vertebrados el proceso podría ser más complejo24.
La mayoría de los componentes de los sistemas ISC y CIA son esenciales para la viabilidad de la levadura y de las células humanas; de hecho, se sabe que la biogénesis de centros Fe-S es la única función indispensable para la viabilidad de la levadura, a diferencia de los defectos en la fosforilación oxidativa en los que las levaduras pueden crecer en medios fermentables como la glucosa. Dado que la única proteína mitocondrial en levaduras que se sabe es esencial y contiene centros Fe-S es la ferredoxina Yah1, se cree que este fenotipo se debe a que la maquinaria ISC está involucrada en la maduración de proteínas Fe-S extramitocondriales. El primer ejemplo de una proteína Fe-S esencial en el citosol es la proteína Rli1, que pertenece a la superfamilia ABC y está involucrada en el ensamblaje y exportación del núcleo del ribosoma.
Recientemente se identificaron dos proteínas Fe-S que también son esenciales: Rad3 que funciona en la reparación de ADN por escisión de nucleótidos y Pri2 que está implicada en la síntesis de moldes de ARN en la replicación del ADN46,47. Estos ejemplos son una muestra de la relación tan importante que guardan las mitocondrias con otros procesos fundamentales para la vida como es el proceso de maduración de proteínas Fe-S extra mitocondriales.
El papel tan preponderante de las mitocondrias en la biogénesis de proteínas Fe-S ha planteado la pregunta de cómo los organismos amitocondriados (Giardia, Microsporidia y Entamoeba), que no poseen mitocondrias canónicas llevan a cabo el ensamblaje de sus proteínas Fe-S. La información genómica de algunos de estos organismos ha mostrado que existen homólogos de las maquinarias ISC y CIA, en tanto que los genes de otros procesos clásicos de la mitocondria como la respiración, la biosíntesis del grupo hemo o los del ciclo del ácido cítrico no se encuentran. El proceso de biogénesis de los centros Fe-S en organismos amitocondriados se lleva a cabo en un pequeño organelo de doble membrana denominado mitosoma que contiene a las chaperonas Hsp60 y Hsp70, que son utilizadas como marcadores de este organelo. Se ha aceptado que los mitosomas descienden de mitocondrias y que en el curso de la evolución fueron perdiendo las funciones que les eran dispensables por su estilo intracelular de vida. Se ha encontrado que en mitosomas de Giardia y Microsporidia está presente el sistema ISC, por lo que la biogénesis de proteínas Fe-S parece ser una función remanente de estos organelos48,49.
Enfermedades asociadas a deficiencias del grupo Fe-S
La biogénesis de los centros Fe-S es de vital importancia en mamíferos, esto se ha documentado en varias enfermedades que están asociadas a defectos en la biogénesis de los centros Fe-S o de las proteínas Fe-S.
La falta de frataxina, el donador putativo de hierro para la formación de los centro Fe-S es la causa de la ataxia de Friedrich, que es una enfermedad neurodegenerativa asociada a defectos en las proteínas Fe-S y a la acumulación de hierro. También se han identificado algunas enfermedades con fenotipos hematológicos, como la anemia microcítica y la protoporfiria eritropoyética, lo que resalta la conexión que existe entre la biogénesis de proteínas Fe-S y la hematopoyesis. Esto se explica por el hecho de que la biogénesis de proteínas Fe-S es crucial para la maduración de la proteína IRP1 que regula la síntesis general de proteínas involucradas en la asimilación, almacenamiento y utilización del hierro.
Otro ejemplo es la enzima ALAS2 (aminolevulinato sintasa) que cataliza el primer paso de la biosíntesis del grupo hemo en las mitocondrias (Figura 2). La traducción del ARN mensajero de esta proteína en el citosol disminuye dramáticamente cuando la concentración de hierro es baja o cuando la biogénesis de las proteínas Fe-S se ve afectada, lo que establece una relación estrecha entre la ruta de biosíntesis del grupo hemo y de la biosíntesis de proteínas Fe-S, los dos procesos que más consumen hierro en la célula.
Flavín nucleótidos
Los cofactores biológicos son empleados generalmente por las enzimas para facilitar una amplia gama de transformaciones bioquímicas necesarias en todos los aspectos de la vida. Algunos de estos cofactores, como la vitamina B12 y la vitamina H o biotina, catalizan un número pequeño pero importante de reacciones. Otros llevan a cabo tareas muy diversas, como la vitamina B2 o riboflavina. La riboflavina funciona como precursor de las coenzimas de flavina (Figura 7): flavín mononucleótido (FMN) y flavín adenín dinucleótido (FAD), también es precursor de otras flavinas naturales como la lumazina, deazaflavina y la roseoflavina, que no serán abordadas en esta revisión.
Se ha estimado que entre 1 y 3% de los genes en los genomas bacterianos y eucarióticos codifican para proteínas que unen a la flavina50. Las flavoproteínas se pueden definir como enzimas que catalizan reacciones de óxido-reducción utilizando FMN o FAD como coenzima. La entidad química responsable de la diversidad funcional de las flavinas es el anillo de isoaloxazina que existe en 3 estados redox: totalmente oxidado o quinona; reducido con un electrón o semiquinona y totalmente reducido o hidroquinona, las formas completamente reducidas se abrevian FMNH2 y FADH2. Sin embargo, el papel de la flavina no se limita a los procesos redox, aproximadamente el 10% de las enzimas dependientes de la flavina no catalizan reacciones redox, sino que están involucradas en una amplia gama de procesos biológicos como la eliminación de catecolaminas, la síntesis de proteínas, la hematopoyesis y el movimiento de cloroplastos51. Incluso el cofactor flavina es empleado como una molécula señalizadora y de detección en procesos biológicos como el fototropismo y la fijación del nitrógeno52. Está involucrada también en la detección de la luz azul en plantas, esta capacidad se ha explotado para desarrollar proteínas fluorescentes de FMN que pueden fluorescer en presencia o ausencia de oxígeno, a diferencia de la proteína verde fluorescente53,54.
Biosíntesis de nucleótidos de flavina
La riboflavina es sintetizada por todas las plantas y la mayoría de los microorganismos. Los animales, microorganismos procariontes y eucariontes, como Corynebacterium pyogenes, Streptococcus pyogenes, Listeria monocytogenes, algunas bacterias lácticas, micoplasmas, espiroquetas, ricketsiales y protistas no pueden sintetizarla por lo que deben obtenerla de su dieta55-57. Este compuesto es manufacturado a gran escala (aproximadamente 300 toneladas al año) para ser usado como suplemento vitamínico para animales y humanos y como aditivo para la industria alimenticia58.
Las reacciones bioquímicas que dan como resultado la síntesis de las coenzimas FAD y FMN se establecieron hace muchos años a partir del trabajo de grupos de investigación en Estados Unidos, Japón, Ucrania, Rusia y Alemania59-62.
La vía de biosíntesis de riboflavina es similar pero no idéntica en bacterias, hongos y plantas; en eubacterias y plantas la vía es idéntica pero diferente a la de hongos y arqueas63-66. En microorganismos y plantas comienza con una molécula de GTP y 2 de ribulosa-5-fosfato y presenta intermediarios de pirimidina y pteridina. Los nucleótidos de flavina se sintetizan a través de 2 reacciones consecutivas a partir de riboflavina en procariontes y eucariontes (ver Figura 8).
En la Figura 8 se muestra la ruta de biosíntesis de riboflavina. En la primera reacción, la GTP ciclohidrolasa II cataliza la liberación del formato del anillo de imidazol y la liberación de pirofosfato de la cadena lateral del precursor del nucleótido lo que da como producto 2,5-diamino-6-ribosilamino-4(3H)-pirimidinediona 5'-fosfato (A). La GTP ciclohidrolasa II de Escherichia coli es homodimérica y tiene un ión zinc en cada subunidad que participa en la apertura del anillo de imidazol del GTP. Esta enzima se relaciona con la GTP ciclohidrolasa I, que es la primera enzima de la ruta de biosíntesis del tetrahidrofolato y la tetrahidropterina67-69.
En las siguientes 2 reacciones se desamina el grupo amino en la posición 2 y se reduce la cadena lateral de ribosil a ribitil. La desaminación da como producto 5-amino-6-ribosilamino-2,4(1H,3H)-pirimidinediona 5'-fosfato (B) que posteriormente es reducido a 5-amino-6-ribitilamino-2, 4(1H,3H)-pirimidinediona 5'-fosfato (C) y es catalizada por la enzima reductasa de 2,5-diamino-6-ribosilamino-4(3H)-pirimidinediona 5'fosfato, que utiliza NADPH. La secuencia de estas reacciones difiere entre hongos y arqueas por una parte y plantas y bacterias por la otra63.
El producto 2,5-diamino-6-ribitilamino-4(3H)-pirimidinediona 5'-fosfato (D) se obtiene por reducción del sustrato A. Posteriormente, la diamino hidroxi fosforibosil aminopirimidín desaminasa cataliza la desaminación hidrolítica del sustrato D, lo que conlleva a la formación del producto C. En eubacterias, como E. coli y B. subtillis esta enzima es bifuncional, con un dominio de reductasa (N-terminal) y uno de desaminasa (C-terminal)70. Toda la información disponible indica que el producto principal de la vía (C) es producido a partir de (B), en eubacterias y plantas, y en hongos y arqueas a partir de (D).
La siguiente reacción que sucede es la desfosforilación de C para dar lugar al 5-amino-6-ribitilamino-2,4(1H,3H)-pirimidinediona (E), cabe señalar que esta molécula es el precursor que se utiliza para la síntesis de lumazinas (proteínas fluorescentes de los géneros Photobacterium y Vibrio). Se desconoce el mecanismo mediante el cual se lleva a cabo esta reacción pero es poco factible que se trate de una fosfatasa inespecífica dado que no sería capaz de discriminar entre los productos A, B y D que están fosforilados. Se cree que se trata de una fosfatasa de gran actividad que está simultáneamente involucrada en la síntesis de riboflavina y de otro compuesto desconocido71.
El precursor de pirimidina (E) es convertido a un compuesto de pteridina: 6,7-dimetil-8-ribitil lumazina (G). La conversión de un anillo de pirimidina a un compuesto de 2 anillos condensados de pteridina requiere la unión de un compuesto de 4 carbonos. Durante mucho tiempo se discutió el origen de este compuesto, hipotetizando que el donador pudiera ser diacetilo, acetoína o intermediarios de la vía de las pentosas.
Mediante experimentos utilizando a la levadura flavinogénica Pichia guilliermondii72 se demostró que el donador es 3,4-dihidroxi-2-butanona 4-fosfato (F) que se produce en un paso enzimático a partir de ribulosa-5-fosfato. La enzima encargada de esta reacción es la sintasa de 3,4-dihidroxi-2-butanona 4-fosfato, que se ha aislado de varios organismos y se sabe que en eubacterias y plantas está fusionada a la primera enzima de la vía, es decir a la GPT ciclohidrolasa II. En el caso de los hongos ambas funciones se encuentran en proteínas independientes64-73. La ruta de biosíntesis en arqueas es similar a la de los hongos pero tiene características únicas, como la utilización de la ciclohidrolasa III y una hidrolasa específica para llevar a cabo la primera reacción74.
El paso final de la biosíntesis de riboflavina es catalizado por la sintasa de riboflavina, que involucra la dismutación de 2 moléculas de 6,7-dimetil-8-ribitil lumazina (G) con un intercambio de 4 carbonos, por lo que se obtiene una molécula de riboflavina (H) y una de 5-amino-6-ribitilamino-2,4(1H,3H)-pirimidinediona (E). Se han caracterizado riboflavina sintasas de varios organismos y se sabe que la enzima funciona como un homotrímero en eubacterias y plantas a diferencia de las arqueas en las que funciona como un homopentámero75,76.
El FMN se produce por la fosforilación específica de la riboflavina en la posición 5' de la cadena de ribitil en una reacción irreversible que es catalizada por la riboflavín cinasa. Se han reconocido 2 grupos de riboflavín cinasa: el que posee una enzima monofuncional y está presente en hongos, plantas, animales, arqueas y en algunas eubacterias77 y el que presenta una enzima bifuncional Riboflavina cinasa/FAD sintetasa y al que pertenecen la mayoría de las eubacterias78-79.
El FAD es a su vez sintetizado por la FAD sintetasa que cataliza la transferencia del grupo adenilil del ATP al FMN. En organismos eucariontes se han encontrado sólo FAD sintetasas monofuncionales, en comparación con las bacterias en las que la enzima es parte de una proteína bifuncional (RF cinasa/FAD sintetasa)80-81. Existen 2 superfamilias de FAD sintetasa en bacterias y eucariontes, con base en los residuos implicados en la reacción. En levaduras existe sólo una enzima, que se localiza tanto en el citoplasma como en la mitocondria, mientras que en humanos y plantas se han localizado 2 isoformas. En humanos una es de localización mitocondrial y otra citoplásmica, mientras que en plantas sólo se ha encontrado en el citoplasma82.
Transporte de riboflavina
La riboflavina debe penetrar en las células de los organismos que presentan auxotrofía a esta vitamina. Aunque se han aislado y caracterizado los transportadores involucrados en el transporte de riboflavina de varios organismos es importante recalcar que los mecanismos implicados en el flujo de riboflavina no han sido elucidados.
En los organismos eucariontes posiblemente existe un sistema específico para el transporte de la riboflavina y/o sus derivados a los organelos. Se ha estudiado más a fondo este fenómeno en bacterias, hongos y animales pero en arqueas y plantas no hay información disponible.
Recientemente se han clasificado muchas proteínas transportadoras de riboflavina en bacterias, todas pertenecen a una clase novedosa de transportadores modulares conocidos como ECF (Energy-Copupling Factor) que involucra principalmente a transportadores de vitaminas83. De acuerdo con la estructura modular propuesta, estos transportadores consisten de proteínas integrales de membrana que reconocen al sustrato de manera específica y lo translocan con ayuda de otros módulos que acoplan el proceso al consumo de energía: el módulo A contiene una ATPasa (similar a la que está presente en los transportadores de la superfamilia ABC); el módulo T es una proteína transmembranal cuya función no ha sido elucidada y el módulo S, que es específico del sustrato. Los módulos A y T pueden ser compartidos entre diferentes sistemas de transporte y es el módulo S el que brinda la especificidad al sistema ECF84.
En bacterias el transporte se ha estudiado en B. subtilis y Lactococcus lactis ya que E. coli no transporta riboflavina exógena ni posee los genes homólogos del sistema de transporte de otras bacterias. En el caso de B. subtilis el transportador pertenece al sistema ECF y se ha observado que la interrupción del gen ecfT, que codifica para la proteína del módulo T, abate completamente el transporte de riboflavina en este microorganismo.
Se han identificado varios genes implicados en el transporte de riboflavina, éstos pertenecen a familias independientes: la superfamilia de transportadores BART (bilis/arsenito/ riboflavina) que también es modular. Dentro de este tipo de transportadores existen 3 clases: la que es homóloga a ribU de B. Subtilis, la homóloga a ribM de L. lactis y la homóloga a impX de Fusobacterium nucleatum.
El transporte de riboflavina en animales ha sido estudiado en varios tejidos, así como en vesículas de membranas, especialmente de intestino delgado y colon. Los datos bioquímicos que se tienen sugieren la existencia de 2 mecanismos membranales de transporte, uno dependiente de energía y el otro de difusión facilitada cuando las concentraciones de riboflavina son muy altas. También se ha sugerido la endocitosis mediada por un receptor y se han encontrado proteínas solubles que unen riboflavina cuya función es la de almacenar riboflavina y posteriormente, liberan su contenido a la célula por endocitosis. Particularmente en el caso de la secreción de riboflavina a la leche materna, se ha identificado al transportador multidrogas denominado BCRP (Breast Cancer Resistance Protein), éste se sobreexpresa durante el embarazo y la lactancia y pertenece a la superfamilia de transportadores ABC. Se ha sugerido que la secreción de riboflavina podría usarse como marcador de resistencia a múltiples drogas en cánceres malignos.
Enfermedades asociadas con deficiencias en nucleótidos de flavina
La fuente principal de riboflavina son los productos lácteos y la carne, también los cereales y los pescados grasos, así como algunas frutas y los vegetales de color verde oscuro. La deficiencia en esta vitamina es endémica en poblaciones que carecen de productos lácteos y cárnicos. Esta deficiencia puede contribuir a un incremento en la concentración de homocisteína en la sangre, lo que se ha asociado a un aumento en el riesgo de enfermedades cardiovasculares, fallas metabólicas y ceguera nocturna.
En los animales la deficiencia trae como consecuencia retrasos en el crecimiento, fallas en el desarrollo y finalmente la muerte. En humanos cuya dieta es baja en riboflavina se presenta dermatitis, pérdida del cabello, opacidad de la córnea, cataratas, hemorragia de las glándulas adrenales y degeneración del riñón y el hígado. Este problema es poco común en países desarrollados pero existen grupos de riesgo como las mujeres embarazadas y lactando, niños, atletas y en pacientes que toman ciertos medicamentos85.
Comentarios finales
A pesar del gran avance que se ha hecho en la determinación de las rutas de biosíntesis de los centros Fe-S, los grupos hemo y los nucléotidos de flavina (FMN y FAD), la investigación a futuro permitirá descifrar detalles estructurales, bioquímicos y biológicos de estas rutas. Estos detalles darán paso al uso del conocimiento básico generado a partir de la investigación fisiológica y en medicina molecular, así como a la aplicación biotecnológica.
Para el caso particular de la biosíntesis de centros Fe-S se podría establecer una correlación entre defectos en esta vía y fenotipos deletereos o enfermedades no caracterizadas previamente. La resolución de estructuras tridimensionales de las proteínas de los sistemas ISC y CIA, en particular de las formas holo de los andamios Fe-S facilitará elucidar los mecanismos moleculares para el ensamble de novo de centros Fe-S en células in vivo. La combinatoria de enfoques in vivo e in vitro permitirá evaluar la relevancia fisiológica de los resultados obtenidos con proteínas aisladas, así como esclarecer la especificidad y requerimientos particulares de cada tipo de andamio. Es posible que conforme avance la investigación en este campo se encuentren proteínas moonlighting, esto es, proteínas con una función dual, no sólo dentro de la ruta de biosíntesis sino en procesos celulares independientes a ella. Por lo que es claro que un conocimiento profundo de los mecanismos moleculares de este proceso es indispensable para el desarrollo futuro de terapias para el tratamiento de enfermedades asociadas a los centros Fe-S.
En la biosíntesis del grupo hemo, si bien se ha establecido puntualmente cómo se lleva a cabo este proceso, hay algunas piezas faltantes, particularmente en el metabolismo del hierro; es crucial identificar la molécula mediadora entre la mitocondria y el citosol; determinar si esta molécula está asociada con un producto como el hemo o a la maquinaria ISC y cuál es el papel preciso que lleva a cabo la frataxina en la regulación. Si bien se requiere más investigación en este campo, es innegable que todo apunta a que la mitocondria es un sitio de intensa actividad metabólica del hierro y que los requerimientos de hierro en este organelo podrían dictar la dinámica de éste en toda la célula.
Existen también preguntas sin resolver en el campo de la investigación de la síntesis de flavinas y sus derivados; por ejemplo, se desconoce la razón por la que una parte de la riboflavina es secretada al medio. Se ha hipotetizado que pudiera ser el resultado de una regulación imprecisa; sin embargo, no puede excluirse que tenga un papel como en la inmovilización del hierro o en la defensa contra el estrés oxidativo. En estudios aplicados de flavinogénesis, la búsqueda se ha centrado en encontrar inhibidores potentes de la síntesis de riboflavina para emplearlos contra patógenos infecciosos.
El conocimiento básico y extenso de las rutas de biosíntesis de estos cofactores ha sentado las bases para entender la relación que hay entre las deficiencias en estas rutas y algunas enfermedades, así como emplear el conocimiento básico para el desarrollo de estrategias terapéuticas o de aplicaciones biotecnológicas.
Agradecimientos
Se agradece a los doctores: Oscar Flores Herrera (Facultad de Medicina,UNAM), Javier Plascencia de la Parra (Facultad de Química, UNAM), Marina Gavilanes Ruiz (Facultad de Química, UNAM) y Diego González Halphen (Instituto de Fisiología Celular, UNAM) la lectura crítica al manuscrito y las correcciones al mismo; al Dr. Francisco Figueroa Martínez (Universidad de New Brunswick, Fredericton) por el apoyo técnico para la realización de las figuras; así como el apoyo otorgado por el Consejo Nacional de Ciencia y Tecnología (donativo 128110), por la Dirección General de Asuntos del Personal Académico (DGAPA-UNAM IN203311-3) y la beca 229468 que otorgó el CONACyT para la realización de su proyecto doctoral.
Referencias
1. Sassa, S. & Nagai, T. The role of heme in gene expression. Int. J. Hematol. 63, 167-178 (1996). [ Links ]
2. Tang, X.D., Xu, R., Reynolds, M.F., Garcia, M.L., Heinemann, S.H. & Hoshi, T. Haem can bind to and inhibit mammalian calcium-dependent Slo1 BK channels. Nature 425, 531-535 (2003). [ Links ]
3. Imaizumi, S., Kay, A. & Schroeder, J.I. Circadian rhythms. Daily watch on metabolism. Science 318, 1730-1731 (2007). [ Links ]
4. Chernova, T., Smith, A.G. & Lloyd Raven, E. The regulatory role of heme in neurons. Metallomics 3(10), 955-962 (2011). [ Links ]
5. Hardison, R.C. A brief history of hemoglobins: Plant, animal, protist, and bacterial. Proc. Nat. Acad. Sci. USA 93, 5675-5679 (1996). [ Links ]
6. Franken, A.C. et al. Heme biosynthesis and its regulation: towards understanding and improvement of heme biosynthesis in filamentous fungi. Appl. Microbiol. Biotechnol. 91(3),447-460 (2011). [ Links ]
7. Hoffman, M., Góra, M. & Rytka, J. Identification of rate-limiting steps in yeast heme biosynthesis. Biochem. Biophys. Res. Commun. 310(4), 1247-1253 (2003). [ Links ]
8. Zagorec, M. et al. Isolation, sequence, and regulation by oxygen of the yeast HEM13 gene coding for coproporphyrinogen oxidase. J. Biol. Chem. 263(20), 9718-9724 (1998). [ Links ]
9. Dailey, T.A. & Dailey, H.A. Identification of [2Fe-2S] clusters in microbial ferrochelatases. J. Bacterial. 184(9), 2460-2464 (2002). [ Links ]
10. Bermúdez Moretti, M., Correa García, S & Batlle, A. Porphyrin biosynthesis intermediates are not regulating 8-aminolevulinic acid transport in Saccharomyces cerevisiae. Biochem. Biophys. Res. Commun. 272(3), 946-950 (2000). [ Links ]
11. Morgan, E.H. Transferrin biochemistry, physiology and clinical significance. Mol. Aspects. Med. 4, 1-23 (1981). [ Links ]
12. Goya, N., Miyazalo, S., Kodate, S. & Ushino, E. A family of congenital atransferrinemia. Blood 40, 239-245 (1972). [ Links ]
13. Hamza, I. Intracellular trafficking of porphyrins. ACS Chem. Biol. 1(10), 627-629 (2006). [ Links ]
14. Tsuchida, M., Emi, Y., Kida, Y. & Sakaguchi, M. Human ABC transporter isoform B6 (ABCB6) localizes primarily in the Golgi apparatus. Biochem. Biophys. Res. Commun. 369(2), 369-375 (2008). [ Links ]
15. Krishnamurthy, P.C. et al. Identification of a mammalian mitochondrial porphyrin transporter. Nature 443, 586-589 (2006). [ Links ]
16. Keng, T. & Guarente, L. Constitutive expression of the yeast HEM1 gene is actually a composite of activation and repression. Proc. Natl. Acad. Sci. USA 84(24), 9113-9117 (1987). [ Links ]
17. Leustek, T. et al. Siroheme biosynthesis in higher plants. Analysis of an S-adenosyl-L-methionine-dependent uroporphyrinogen III methyltransferase from Arabidopsisthaliana. J.Biol. Chem. 272(5), 2744-2752 (1997). [ Links ]
18. Kasting, J.F. & Howard, M.T. Atmospheric composition and climate on the early Earth. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361, 1733-1741 (2006). [ Links ]
19. Beinert, H., Holm, R.H. & Münck, E. Iron-sulfur clusters: nature's modular, multipurpose structures. Science 277, 653-659 (1997). [ Links ]
20. Meyer, J. Iron-sulfur protein folds, iron-sulfur chemistry, and evolution. J. Biol. Inorg. Chem. 13, 157-170 (2008). [ Links ]
21. Bandyopadhyay, S., Chandramouli, K. & Johnson, M.K. Iron-sulfur cluster biosynthesis. Biochem. Soc. Trans. 36, 1112-1119 (2008). [ Links ]
22. Fontecave, M. & Ollagnier-de-Choudens, S. Iron-sulfur cluster biosynthesis in bacteria: mechanisms of cluster assembly and transfer. Arch. Biochem. Biophys. 474, 226-237 (2008). [ Links ]
23. Lill, R. & Mühlenhoff, U. Iron-sulfur protein biogenesis in eukaryotes: components and mechanisms. Annu. Rev. Cell Dev. Biol. 22, 457-486 (2006). [ Links ]
24. Lill, R. & Mühlenhoff, U. Maturation of iron-sulfur proteins in eukaryotes: mechanisms, connected processes, and diseases. Annu. Rev. Biochem. 77, 669-700 (2008). [ Links ]
25. Lill, R. Function and biogenesis of iron-sulphur proteins. Nature 460 (7257), 831-838 (2009). [ Links ]
26. Zheng, L., Cash, V.L., Flint, D.H. & Dean, D.R. Assembly of iron-sulfur clusters. Identification of an iscSUA-hscBA-fdx gene cluster from Azotobactervinelandii. J.Biol. Chem. 273, 13264-13272 (1998). [ Links ]
27. Schilke, B., Voisine, C., Beinert, H. & Craig, E. Evidence for a conserved system for iron metabolism in the mitochondria of Saccharomyces cerevisiae. Proc. Natl. Acad. Sci. USA 96, 10206-10211 (1999). [ Links ]
28. Yuvaniyama, P., Agar, J.N., Cash, V.L., Johnson, M.K. & Dean, D.R. NifS-directed assembly of a transient [2Fe-2S] cluster within the NifU protein. Proc. Natl. Acad. Sci. USA 97, 599-604 (2000). [ Links ]
29. Kaiser, J.T. et al. Crystal structure of a NifS-like protein from Thermotoga maritima: implications for iron-sulfur cluster assembly. J. Mol. Biol. 297, 451-464 (2000). [ Links ]
30. Cupp-Vickery, J.R., Urbina, H. & Vickery, L.E. Crystal structure of IscS, a cysteine desulfurase from Escherichia coli. J. Mol. Biol. 330, 1049-1059 (2003). [ Links ]
31. Gerber, J., Mühlenhoff, U. & Lill, R. An interaction between frataxin and Isu1/Nfs1 that is crucial for Fe/S cluster synthesis on Isu1. EMBO Rep. 4, 906-911 (2003). [ Links ]
32. Bencze, K.Z. et al. The structure and function of frataxin. Crit. Rev. Biochem. Mol. Biol. 41, 269-291 (2006). [ Links ]
33. Mühlenhoff, U., Gerber, J., Richhardt, N. & Lill, R. Components involved in assembly and dislocation of iron-sulfur clusters on the scaffold protein Isu1p. EMBO J. 22, 4815-4825 (2003). [ Links ]
34. Gelling, C., Dawes, I.W., Richhardt, N., Lill, R. & Mühlenhoff, U. Mitochondrial Iba57p is required for Fe/S cluster formation on aconitase and activation of radical SAM enzymes. Mol. Cell. Biol. 28, 1851-1861 (2008). [ Links ]
35. Loiseau, L. et al. ErpA, an iron sulfur (Fe S) protein of the A-type essential for respiratory metabolism in Escherichia coli. Proc. Natl. Acad. Sci. USA 104, 13626-13631 (2007). [ Links ]
36. Takahashi, Y. & Tokumoto, U. A third bacterial system for the assembly of iron-sulfur clusters with homologs in archaea and plastids. J. Biol. Chem. 277, 28380-28383 (2002). [ Links ]
37. Tokumoto, U., Kitamura, S., Fukuyama, K. & Takahashi, Y. Interchangeability and distinct properties of bacterial Fe-S cluster assembly systems: functional replacement of the isc and sufoperons in Escherichia coli with the nifSU-like operon from Helicobacter pylori. J. Biochem. 136, 199-209 (2004). [ Links ]
38. Ayala-Castro, C., Saini, A. & Outten, F. W. Fe-S cluster assembly pathways in bacteria. Microbiol. Mol. Biol. Rev. 72, 110-125 (2008). [ Links ]
39. Outten, F.W., Wood, M.J., Muñoz, F.M. & Storz, G. The SufE protein and the SufBCD complex enhance SufS cysteine desulfurase activity as part of a sulfur transfer pathway for FeS cluster assembly in E. coli. J.Biol. Chem. 278, 45713-45719 (2003). [ Links ]
40. Loiseau, L., Ollagnier-de-Choudens, S., Nachin, L., Fontecave, M. & Barras, F. Biogenesis of Fe-S cluster by the bacterial Suf system: SufS and SufE form a new type ofcysteine desulfurase. J. Biol. Chem. 278, 38352-38359 (2003). [ Links ]
41. Xu, X.M. & Moller, S.G. Iron-sulfur cluster biogenesis systems and their crosstalk. Chem. Bio. Chem. 9, 2355-2362 (2008). [ Links ]
42. Rouault, T.A. & Tong, W.H. Iron-sulphur cluster biogenesis and mitochondrial iron homeostasis. Nature Rev. Mol. Cell Biol. 6, 345-351 (2005). [ Links ]
43. Rouault, T.A. & Tong, W.H. Iron-sulfur cluster biogenesis and human disease. Trends Genet. 24, 398-407 (2008). [ Links ]
44. Kispal, G., Csere, P., Prohl, C. & Lill, R. The mitochondrial proteins Atm1p and Nfs1p are required for biogenesis of cytosolic Fe/ S proteins. EMBO J. 18, 3981-3989 (1999). [ Links ]
45. Roy, A., Solodovnikova, N., Nicholson, T., Antholine, W. & Walden, W.E. A novel eukaryotic factor for cytosolic Fe-S cluster assembly. EMBO J. 22, 4826-4835 (2003). [ Links ]
46. Rudolf, J., Makrantoni, V., Ingledew, W.J., Stark, M.J. & White, M.F. The DNA repair helicases XPD and FancJ have essential iron-sulfur domains. Mol. Cell. 23, 801-808 (2006). [ Links ]
47. Kispal, G. et al. Biogenesis of cytosolic ribosomes requires the essential iron-sulphur protein Rli1p and mitochondria. EMBO J. 24, 589-598 (2005). [ Links ]
48. Tovar, J. et al. Mitochondrial remnant organelles of Giardia function in iron-sulphur protein maturation. Nature 426, 172-176 (2003). [ Links ]
49. Goldberg, A.V. et al. Localization and functionality of microsporidian iron-sulphur cluster assembly proteins. Nature 452, 624-628 (2008). [ Links ]
50. De Colibus, L. & Mattevi, A. New frontiers in structural flavoenzymology. Curr. Opin. Struct. Biol. 16, 722-728 (2006). [ Links ]
51. Haupt, W. Chloroplast movement: from phenomenology to molecular biology. Prog. Bot. 60, 3-35 (1999). [ Links ]
52. Briggs, W.R. & Christie, J.M. Phototropins 1 and 2: versatile plant blue-light receptors. Trends Plant Sci. 7, 204-210 (2002). [ Links ]
53. Drepper, T. et al. Reporter proteins for in vivo fluorescence without oxygen. Nat. Biotechnol. 25, 443-445 (2007). [ Links ]
54. Tielker, D., Eichhof, I., Jaeger, K.E., Ernst, J.F. Flavin mononucleotide-based fluorescent protein as an oxygen-independent reporter in Candida albicans and Saccharomyces cerevisiae. Eukaryot. Cell. 8, 913-915 (2009). [ Links ]
55. Fraga, A.A. & Reddy, C.A. Nutritional requirements of Corynebacterium pyogenes. J. Clin. Microbiol. 16, 334-340 (1982). [ Links ]
56. Siddiqi, R. & Khan, M.A. Vitamin and nitrogen base requirements for Listeria monocytogenes and haemolysin production. Zentralbl. Bakteriol. Mikrobiol. Hyg. A. 253, 225-235 (1982). [ Links ]
57. Terrade, N. & Mira de Orduña, R. Determination of the essential nutrient requirements of wine-related bacteria from the genera Oenococcus and Lactobacillus. Int. J. Food Microbiol. 133, 813 (2009). [ Links ]
58. Stahmann, K.P., Revuelta, J.L. & Seulberger, H. Three biotechnical processes using Ashbya gossypii, Candida famata, or Bacillus subtilis compete with chemical riboflavin production. Appl. Microbiol. Biotechnol. 53(5), 509-516 (2000). [ Links ]
59. Katagiri, H., Yamada, H. & Imai, K. Biosynthesis of flavin coenzymes by microorganisms. II. Enzymatic synthesis of flavin adenine dinucleotide in Escherichia coli. J. Vitaminol. 5, 307-311 (1959). [ Links ]
60. Kearney, E.B. & Englard, S. The enzymatic phosphorylation of riboflavin. J. Biol. Chem. 193, 821-834 (1951). [ Links ]
61. Kobayashi, T. & Suzue, T. Flavin adenine dinucleotide-synthesiz- ing enzyme in Eremothecium ashbyii. J. Vitaminol. 7, 42-47 (1961). [ Links ]
62. Schrecker, A.W. & Kornberg, A. Reversible enzymatic synthesis of flavin-adenine dinucleotide. J. Biol. Chem. 182, 795-803 (1950). [ Links ]
63. Fischer, M. & Bacher, A. Biosynthesis of flavocoenzymes. Nat. Prod. Rep. 22, 324-350 (2005). [ Links ]
64. Fischer, M. & Bacher, A. Biosynthesis of vitamin B2 in plants. Physiol. Plant. 126, 304-318 (2006). [ Links ]
65. Fischer, M. & Bacher, A. Biosynthesis of vitamin B2: structure and mechanism of riboflavin synthase. Arch. Biochem. Biophys. 474, 252-265 (2008). [ Links ]
66. Fischer, M. & Bacher, A. Riboflavin biosynthesis, p. 3-36. In Mander, L. & Liu, H.W. (eds.). Comprehensive natural products. II. Chemistry and biology, vol. 7. Cofactors (Elsevier, Philadelphia, PA. 2010). [ Links ]
67. Bracher, A., Eberhardt, D., Fischer, M., Kis, K. & Richter, G. Biosynthesis of vitamin B2 (riboflavin). Annu. Rev. Nutr. 20, 153-167 (2000). [ Links ]
68. Bracher, A., Schramek, N. & Bacher, A. Biosynthesis of pteridines. Stopped-flow kinetic analysis of GTP cyclohydrolase I. Biochemistry 40(26), 7896-7902 (2001). [ Links ]
69. Schramek, N.A. et al. Reaction mechanism of GTP cyclohydrolase I: single turnover experiments using a kinetically competent reaction intermediate. Mol. Biol. 316(3), 829-837 (2002). [ Links ]
70. Richter, G. et al. Biosynthesis of riboflavin: characterization of the bifunctional deaminase-reductase of Escherichia coli and Bacillus subtilis. J. Bacteriol. 179, 2022-2028 (1997). [ Links ]
71. Perkins, J. B. et al. Genetic engineering of Bacillus subtilis for the commercial production of riboflavin. J. Ind. Microbiol. Biotechnol. 22, 8-18 (1999). [ Links ]
72. Logvinenko, E.M., Shavlovskii, G.M., Zakalskii, A.E. & Zakhodylo, I.V. Biosynthesis of 6,7-dimethyl-8-ribityllumazine in the extracts of the yeast Pichia guilliermondii. Biokhimiia 47, 931-936 (1982). [ Links ]
73. Herz, S., Eberhardt, S. & Bacher, A. Biosynthesis of riboflavin in plants. The ribA gene of Arabidopsis thaliana specifies a bifunctional GTP cyclohydrolase II/3,4-dihydroxy-2-butanone 4-phosphate synthase. Phytochemistry 53, 723-731 (2000). [ Links ]
74. Graupner, M., Xu, H. & White, R.H. The pyrimidine nucleotide reductase step in riboflavin and F420 biosynthesis in Archaea proceeds by the eukaryotic route to riboflavin. J. Bacteriol. 184, 1952-1957 (2002). [ Links ]
75. Fischer, M. et al. Evolution of vitamin B2 biosynthesis. A novel class of riboflavin synthase in Archaea. J. Mol. Biol. 343 (1), 267-278 (2004). [ Links ]
76. Ramsperger, A. et al. Crystal structure of an archaeal pentameric riboflavin synthase in complex with a substrate analog inhibitor: stereochemical implications. J. Biol. Chem. 281, 1224-1232 (2006). [ Links ]
77. Mack, M., van Loon, A.P. & Hohmann, H.P. Regulation of riboflavin biosynthesis in Bacillus subtilis is affected by the activity ofthe flavokinase/flavin adenine dinucleotide synthetase encoded by ribC. J. Bacteriol. 180(4), 950-955 (1998). [ Links ]
78. Manstein, D.J. & Pai, E.F. Purification and characterization of FAD synthetase from Brevibacterium ammoniagenes. J.Biol. Chem. 261, 16169-16173 (1986). [ Links ]
79. Nakagawa, S. et al. Nucleotide sequence of the FAD synthetase gene from Corynebacterium ammoniagenes and its expression in Escherichia coli. Biosci. Biotechnol. Biochem. 59, 694-702 (1995). [ Links ]
80. Frago, S., Martínez-Júlvez, M., Serrano, A. & Medina, M. Structural analysis of FAD synthetase from Corynebacterium ammoniagenes. BMC Microbiol. 8, 160-176 (2008). [ Links ]
81. Frago, S.,Velázquez-Campoy, A. & Medina, M. The puzzle of ligand binding to Corynebacterium ammoniagenes FAD synthetase. J. Biol. Chem. 284, 6610-6619 (2009). [ Links ]
82. Huerta, C., Borek, D., Machius, M., Grishin, N.V. & Zhang, H. Structure and mechanism of a eukaryotic FMN adenylyltransferase. J. Mol. Biol. 389, 388-400 (2009). [ Links ]
83. Rodionov, D.A. et al. A novel class of modular transporters for vitamins in prokaryotes. J. Bacteriol. 191, 42-51 (2009). [ Links ]
84. Henderson, G.B., Zevely, E.M. & Huennekens, G. M. Coupling of energy to folate transport in Lactobacillus casei. J. Bacteriol. 139, 552-559 (1979). [ Links ]
85. Foraker, A.B., Khantwal, C.M. & Swaan, P.W. Current perspectives in cellular uptake and trafficking of riboflavin. Adv. Drug Deliv. Rev. 55, 1467-1483 (2003). [ Links ]
Información sobre el autor
Alexa Villavicencio-Queijeiro
Alexa Villavicencio-Queijeiro obtuvo la Licenciatura en Investigación Biomédica con mención honorífica en la Universidad Nacional Autónoma de México y es candidata a Doctora en Ciencias Biomédicas, en la misma institución. Es miembro de la Sociedad Mexicana de Bioquímica y su interés es la investigación en la bioenergética y los complejos mitocondriales de algas clorofíceas, campo en el que ha publicado 2 artículos en revistas internacionales, así como 2 artículos más en otros campos de la bioquímica.














