Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.15 no.2 Ciudad de México dic. 2012
Artículo de revisión
Estructura y función de la ATP sintasa de las arqueas aeróbicas
Structure and function of ATP synthase in aerobic archaea
Héctor Vicente Miranda-Astudillo
Departamento de Genética Molecular, Instituto de Fisiología Celular, Universidad Nacional Autónoma de México. Apdo. Postal 70-600, C.P. 04510, Coyoacán, México, D.F. Correo: hmiranda@email.ifc.unam.mx
Artículo recibido el 29 de agosto de 2012
Aceptado el 01 de octubre de 2012
Resumen
Desde el descubrimiento de las arqueas ha llamado la atención su capacidad para sobrevivir en ambientes difíciles. A través de los años, las arqueas han pasado de ser rarezas extremófilas a ser consideradas organismos de importancia universal que han sido utilizados para elucidar preguntas biológicas fundamentales. La filogenia del dominio Arquea se encuentra en constante cambio y cuenta hasta la fecha con 5 ramas principales: Crenarchaeota, Euryarchaeota, Thaumarchaeota, Korarchaeota y Nanoarchaeota. En el presente trabajo se enlistan las principales características estructurales de los complejos respiratorios de los géneros de arqueas aeróbicas más estudiados. Se presenta una comparación morfológica de la ATP sintasa de estos organismos con el resto de la familia de las ATPasas rotatorias (F- y V-ATPasas); así como un análisis topológico de este complejo enzimático (A1Ao-ATP sintasa) tomando como base la función de cada una de las subunidades que lo conforman.
Palabras Clave: ATPasas rotatorias, A1 Ao-ATP sintasa, cadena respiratoria, dominio Arquea.
Abstract
Ever since Archaea were discovered, their ability to thrive in extreme environments has attracted much attention. Over the years, archaea have gone from microbial extremophilic oddities to organisms of universal importance and have been used to elucidate fundamental biological questions. The phylogeny of the Archaea domain is in constant evolution; to this day it is composed by five main branches: Crenarchaeota, Euryarchaeota, Thaumarchaeota, Korarchaeota and Nanoarchaeota. In the present study, we list the main structural features of the respiratory complexes of the most studied genera of aerobic archaea. We present a morphological comparison of the ATP synthase of these organisms with the rest of the family of rotary ATPases (F- and V-ATPases) as well as a topological analysis of this enzymatic complex (A1Ao-ATP synthase) based on the function of each of the subunits that comprise it.
KeyWords: Rotary ATPases, A1Ao-ATP synthase, respiratory chain, Archaea domain.
Introducción
Desde el descubrimiento de las arqueas su capacidad para sobrevivir en ambientes difíciles con temperaturas elevadas, pHs extremos o altas concentraciones de sales ha llamado la atención. Aun cuando comparten muchas características básicas de su maquinaria genética y metabólica con las bacterias1, se ha propuesto que la organización estructural y metabólica de las arqueas corresponde a organismos ancestrales, ya que poseen propiedades esenciales distintas de las bacterias y eucarias, que las ubican filogenéticamente más cerca de la raíz hipotética del árbol de la vida2. A través de los años, las arqueas han pasado de rarezas extremófilas a organismos de importancia universal pues han sido utilizadas para elucidar preguntas biológicas fundamentales3.
A la fecha, el árbol filogenético de las arqueas se separa en dos grandes ramas: la Crenarchaeota y la Euryarchaeota; y tres menores: Thaumarchaeota, Korarchaeota y Nanoarchaeota4 (Figura 1)5, esta última representada únicamente por la especie Nanoarchaeum equitans, la cual crece adherida a la superficie de otra arquea del género lgnicoccu6. Aún no se ha logrado cultivar algún miembro de la rama Korarchaeota y este grupo de organismos sólo ha sido identificado por estudios metagenómicos7. El grupo Thaumarchaeota está formado solamente por la especie mesófila Cenarchaeum symbiosum8. Por su parte, el grupo Crenarchaeota está constituido en su mayoría por organismos hipertermófilos que se consideran modelos de la vida temprana en la Tierra. Finalmente, la rama Euryarchaeota es filogenéticamente muy diversa e incluye metanógenos anaeróbicos estrictos, halófilos extremos y acidófilos extremos como los Thermoplasmatales.5

Las arqueas son un grupo muy heterogéneo con respecto a su metabolismo energético. Dentro de las reacciones asociadas con la obtención de energía en este grupo de organismos, se encuentran: respiración aeróbica y anaeróbica (que utilizan oxígeno y azufre/nitratos, respectivamente), fermentación, fotorrespiración anaeróbica (que utiliza bacteriorodopsina como bomba de protones activada por luz), reacciones de transferencia de metilos para generación de gradientes de sodio e hidrogenasas reductoras de protones9. En este sentido, debe remarcarse que la conservación de energía para la mayoría de las formas existentes de vida recae en el principio universal de transducción quimiosmótica10, que en términos filogenéticos evolucionó de forma temprana. En las arqueas la síntesis de ATP se encuentra acorde con la teoría quimiosmótica, basada en gradientes de iones a través de membranas. La Figura 2 a ilustra los procesos para la generación de gradientes iónicos mediante bombas primarias y su utilización en la síntesis de ATP en arqueas.
En las siguientes secciones, se revisan las propiedades estructurales de los complejos membranales respiratorios involucrados en la síntesis de ATP en las arqueas aeróbicas, principalmente la ATP sintasa de arqueas (A1Ao-ATP sintasa). Con respecto al resto de la bioenergética de estos organismos existen revisiones excelentes5,9,11,12, por lo que esos aspectos no se abordarán en este trabajo.
Componentes de la cadena de transporte de electrones
El paradigma derivado de los estudios de la cadena respiratoria mitocondrial y de bacterias sugiere la presencia de cuatro complejos principales para una generación óptima de energía. En este esquema, el complejo I actúa como una NADH deshidrogenasa (NDH) en el punto más bajo de su potencial, mientras que el complejo II sirve como una succinato deshidrogenasa (SDH); ambos son reductores de quinonas (Q). Las quinonas reducidas son reoxidadas por el complejo III, llamado complejo bcl, el cual transfiere los electrones a un aceptor proteico de potencial mayor en la fase acuosa, el citocromo c (cyt c), que finalmente transfiere los electrones a una oxidasa terminal (complejo IV) (Figura 2b). En contraste con este concepto clásico, los complejos integrales de membrana encargados del transporte de electrones en algunas arqueas pueden estar fusionados y, en algunos casos, tener composiciones polipeptídicas inusuales13,14.
Dentro del estudio reciente del metabolismo de las arqueas el papel preponderante lo ocupan los organismos metanogénicos, seguido de los implicados en los ciclos del azufre y nitrógeno, debido a su importancia ecológica y biotecnológica3. El grupo de arqueas aeróbicas estudiado se reduce a pocos géneros entre los que destacan: Acidianus, Aeropyrum, Halobacterium, Picrophilus, Pyrobaculum, Sulfolobus, Thermoplasma y Metallosphaera9,14,15. Sin embargo, existen muy pocos estudios estructurales de los complejos respiratorios de estos géneros de microorganismos. La Tabla I13,15-30 presenta las características principales encontradas en los complejos respiratorios de arqueas aeróbicas.
De algunos de estos organismos sólo se conoce su carácter aeróbico, no existen estudios bioquímicos o genéticos sobre sus complejos respiratorios, como es el caso del género Picrophilus; por otro lado, existen géneros que se destacan por el estudio de su complejo V31-33, pero en cuanto a sus complejos respiratorios no hay estudios bioquímicos o estructurales disponibles.
A1Ao-ATP sintasa (EC 3.6.3.14)
Como se mencionó, dentro del dominio Arquea existe una gran diversidad de formas de obtención del potencial electroquímico de membrana y la mayoría de estas rutas convergen en el complejo A1Ao-ATP sintasa (Figura 2a). Este complejo se encuentra presente en todas las arqueas secuenciadas y, en la mayoría de estos organismos, es el encargado de llevar a cabo la síntesis de ATP34. Sin embargo, para obtener un modelo universal de la ATPasa de arqueas deben tomarse en cuenta todas las diferencias fisiológicas dentro del dominio Arquea.
Los metanógenos son estrictamente quimiosmóticos, lo que significa que es indispensable una enzima que sintetice ATP35. Por otro lado, los halófilos pueden realizar respiración/ fotosíntesis, e igualmente fermentación; en este caso necesitan una enzima capaz de trabajar en ambas direcciones (síntesis e hidrólisis)36. La mayoría de los hipertermófilos son estrictamente anaerobios y la obtención de ATP se encuentra ligada a la enzima Acetil CoA sintetasa (ACS), en donde el ATP se forma a partir de un derivado de CoA, ADP y fosfato inorgánico37, por lo tanto, no hay necesidad de una A1Ao-ATP sintasa.
Se ha propuesto que las ATPasas provienen de un ancestro común, la hipótesis más aceptada postula que un organismo anaeróbico desarrolló una bomba de protones dependiente de ATP para la formación de un gradiente en su membrana, esta enzima evolucionó a una ATP sintasa y, posteriormente, a una bomba de H+ ajustando nuevamente la relación estructural mediante la duplicación de genes en el rotor y la inactivación de sitios catalíticos en el sector soluble, a fin de modificar la relación H+/ATP de acuerdo a la función a desarrollar34, 38 (Figura 3).
La familia de los complejos membranales de ATPasas rotatorias contiene tres miembros y cada uno juega un papel fundamental en la conversión de la energía. La F1Fo-ATPasa (F-ATPasa) acopla la síntesis de ATP con el potencial electroquímico de membrana (Δμi) en bacteria, mitocondria y cloroplasto, mientras que la H+-ATPasa (V-ATPasa) opera como una bomba de protones dependiente de la hidrólisis de ATP en membranas de eucariontes. En diferentes especies de arqueas y bacterias, la A1Ao-ATPasa (A-ATPasa) puede funcionar tanto como una ATP sintasa o como una bomba de iones39. Basados en su composición polipeptídica y la secuencia primaria de las subunidades, las A-ATPasas se encuentran más relacionadas con las V-ATPasas que con las F-ATPasas40. Morfológicamente, las A- F- y V-ATPasas contienen tres componentes (Figura 4a y 4b): un dominio de membrana AO/FO/VO formado por el canal de protones, un tallo central (rotor) y un dominio soluble A1/F1/ V1 que contiene las subunidades catalíticas41-43. Una diferencia fundamental entre las ATPasas tipo V- y A- es la disociación reversible del dominio V1 del Vo como un mecanismo de regulación in vivo de la actividad de ATPasa44.
Debido a su origen común, las subunidades mayores de las A-ATPasas comparten cerca del 50% de identidad en la secuencia con las V-ATPasas y alrededor del 25% con las F-ATPasas45. Las estructuras cristalográficas de las subunidades catalíticas de los tres tipos de ATPasas al empalmarse muestran que la diferencia primordial entre estas estructuras es la denominada región no homóloga (NHR) (Figura 4c), que se encuentra presente en las ATPasas tipo -V y tipo -A, únicamente, y se ha sugerido que juega un papel en la regulación de la actividad enzimática46.
Los modelos tridimensionales obtenidos mediante crio-microscopía electrónica de la A-ATPasa de Pyrococcus furiosus permitieron la observación de lo que corresponde a una estructura de "collar" que actúa como un segundo estator alrededor del núcleo catalítico A3/B347,48. Esta estructura se encuentra más pronunciada en la familia de las V-ATPasas como se observa en el modelo del gusano de tabaco, Manduca sexta49, esta estructura de "collar" no se encuentra en las F-ATPasa (Figura 4b). La A1Ao-ATP sintasa está compuesta por un dominio catalítico (A3/B3), un rotor central (D, F, C y c), dos brazos periféricos (E y G), una región translocadora de protones embebida en la membrana (I) y una estructura tipo "collar" compuesta por el extremo amino de la subunidad I (Figura 5).
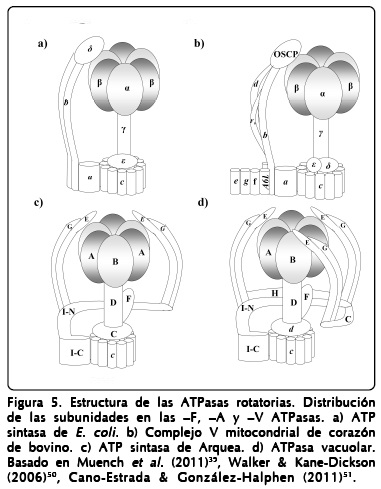
A la fecha no se ha reportado la estructura completa de una ATP sintasa. Para este tipo de enzimas existen 155 estructuras disponibles en el banco de datos estructurales de proteínas (PDB), las más completas corresponden a las F-ATPasas mitocondriales de bovino, de levadura y de E. coli. En el caso de las A-ATPasas sólo se encuentra disponible un número reducido de estructuras (25), la mayoría de ellas corresponden a subunidades aisladas (A, B, E y F). Uno de los mejores acercamientos a una estructura completa de una V-ATPasa se realizó mediante un empalme de los modelos cristalográficos de las subunidades de 6 especies diferentes ajustando al mapa tridimensional obtenido para la V-ATPasa de M. sexta49; esta misma estrategia se utilizó para reconstruir un modelo completo para la A1Ao-ATPasa de la bacteria Thermus thermophilu52.
Núcleo catalítico
Como se anotó, la estructura del núcleo catalítico de la familia de las ATPasas se encuentra altamente conservada. Se ha propuesto que el trímero de dímeros A/B (p/a para las F-ATPasas) proviene de una duplicación de los genes de la subunidad catalítica y la subsecuente pérdida de la actividad de tres de ellas (Figura 3). Como las A-ATPasas comparten una estructura central con las V-ATPasas, es posible equiparar la información estructural de estas ATPasas. Existe un total de seis posibles sitios de unión a nucleótido en el sector A1 localizados en el núcleo catalítico A3/B39. Estudios de marcaje de fotoafinidad y espectroscopía de correlación de fluorescencia (FCS) demostraron que tanto la subunidad catalítica A como la no catalítica B pueden unir análogos de nucleótido a pesar de que la secuencia consenso GXXGXGKTV, denominada región de unión a fosfato P-Loop, no se encuentra en la subunidad B53. El mecanismo catalítico de la A A -ATP sintasa es acorde con el propuesto por Paul Boyer para la catálisis rotacional54 en los tres sitios catalíticos formados en la interfase B-A del dominio A1.
La estructura cristalográfica de la subunidad A de la A-ATPasa de Pyrococcus horikoshii reveló una inserción de aproximadamente 90 residuos en la parte superior, denominada región no homóloga (NHR), la cual no se encuentra en la subunidad no catalítica B de las A/V-ATPasas y en las F-ATPasas (Figura 6a y 6b)55. Como se observa en la estructura cristalográfica del sector A3/B3 de la bacteria T. thermophilus, esta NHR también se encuentra presente en la subunidad A de las V-ATPasas56. Lo anterior implica que la estructura global del sector A1/V1 difiere notablemente de la estructura semiesférica observada para el dominio F1 de las F-ATPasas, en donde las subunidades α y β se sobreponen con un RMS menor a 1 sin tomar en cuenta el P-Loop57. Estructuralmente, la subunidad B puede ser dividida en tres dominios: amino terminal barril β (1-71), dominio α/β (113-184) y extremo carboxilo (442-565). Por su parte, la subunidad catalítica A adicionalmente posee el dominio NHR (185-204), el P-loop (222-250), y un asa hidrofóbica (374-407)56 (Figura 6a).
Canal de H+/Na+ y rotor central
El dominio traslocador de iones (Ao) contiene un anillo de proteolípidos (subunidad c) y una copia de la subunidad anfifílica I que se encuentra adyacente al anillo, ambos forman un canal para el flujo de iones58. Por otro lado, el tallo central se compone por las subunidades C, D y F. La subunidad D tiene una estructura larga de hélices entrecruzadas y se inserta en una cavidad hidrofóbica en el interior del núcleo catalítico A3/B359 de forma similar a la subunidad y de las F-ATPasas60. La evidencia experimental de la rotación del tallo central de la A-ATPasa se obtuvo de forma análoga a la del dominio F1 de la F-ATPasa61, detectando el movimiento de una perla unida a la subunidad D mediante un filamento de biotina-estreptavidina al agregar ATP que es hidrolizado por el dominio V1 (A3/B3, D, F), que a su vez se encuentra inmovilizado en una superficie por medio de una etiqueta de histidinas en la subunidad A62.
Asociada a la subunidad D en el tallo central se ubica la subunidad F que sólo se encuentra presente en las A- y V-ATPasas y no tiene contraparte en las F-ATPasas39 (Figura 5). Utilizando estructuras de RMN de segmentos de las subunidades D y B de Methanosarcina mazei, en estudios de dinámica molecular y otros, se ha propuesto que ambas subunidades interaccionan por sus extremos carboxilos de forma tal que la subunidad D adquiere una estructura contraída o elongada acorde a la rotación del tallo central en esta arquea63. Sin embargo, esta interacción no pudo ser corroborada en la estructura cristalográfica obtenida para el dominio V1 de Thermus thermophilus debido a la baja resolución (4.51À) del modelo obtenido59. En un estudio reciente, se ha propuesto una contribución de esta interacción entre las subunidades D y B en la síntesis de ATP favoreciendo la unión del nucleótido a la subunidad B, acoplando energéticamente la rotación del tallo central con el núcleo catalítico64.
En general, las subunidades c que han sido purificadas a partir de arqueas tienen una masa molecular parecida a la subunidad c de las F 1Fo-ATPasas de aproximadamente 8 kDa con dos segmentos transmembranales65-67. En contraste, algunos metanógenos como Methanothermobacter thermoautotrophicus y M. jannaschii poseen subunidades de mayor tamaño de dos o tres rizos transmembrana que posiblemente provienen de duplicación y triplicación de genes respectivamente, con la subsecuente fusión de éstos (Figura 7)68. En el caso de M. thermoautotrophicus el carboxilato del canal de iones se encuentra presente en las hélices 2 y 4, mientras que en M. jannaschii se encuentra únicamente en las hélices 4 y 6, dado que en la hélice 2 ha sido sustituido por un residuo de glutamina69,70. En el organismo hipertermófilo P. furiosus la subunidad ctiene una masa molecular de ~16 kDa. Al purificar la enzima se observó una asociación del oligómero de subunidades cy la subunidad I de 60 kDa resistente al SDS en geles desnaturalizantes48. Un caso extraordinario es el organismo Methanopyrus kandleri en donde el gen ntpK codifica para una subunidad c repetida 13 veces y se propone que la base del rotor se forma por una sola subunidad, aunque no es posible descartar una edición postraduccional de la proteína, por lo que el tamaño real de la subunidad en el complejo debe ser verificado71.
Brazos periféricos
El brazo periférico es un componente adicional requerido para contrarrestar la fuerza de torsión mecánica generada por la rotación del tallo central de la enzima durante la síntesis e hidrólisis de ATP, así como para conectar el núcleo catalítico con la base membranal. El número de estos estatores varía según el tipo de ATP sintasa siendo de 1, 2 y 3 para las F-, A- y V-, respectivamente (Figura 5). Cada uno de los tallos periféricos de las enzimas tipo A- y V- se forman por un heterodímero de subunidades E y G52, 72, mientras que la composición del brazo en las F-ATPasas es muy variable entre organismos51. A la fecha no se ha logrado resolver la estructura de ningún estator periférico completo junto con la porción membranal y la información disponible corresponde a estudios estructurales de subcomplejos aislados o junto al núcleo catalítico73-75.
Las subunidades G(H) y E fueron propuestas inicialmente para la formación de la estructura de tipo "collar" por los grupos de Müller y Gruber47, 76; sin embargo, a partir de estudios del mismo y otros grupos de investigación se ha podido llegar a un modelo más detallado en el cual la estructura de "collar" se encuentra formada por la subunidad I que extiende su extremo amino hacia la fracción extramembranal77 y es la encargada de unir los dos estatores31, 52 (Figura 5), en contraste con las F-ATPasas, en las que la subunidad b desarrolla esta función78.
La estructura cristalográfica del estator heterodimérico (E y G) que une a la subunidad I con una subunidad B del núcleo catalítico permitió observar una estructura de hélices entrecruzadas dextrógiras75 (Figura 6). Se ha postulado que este tipo de plegamiento se encuentra presente en la región formadora del dímero de las subunidades B del brazo de la F-ATPasa de E. coli79, 80; sin embargo, existen estudios que proponen que esta región podría formar hélices entrecruzadas levógiras81, 82. En el caso del brazo periférico de la F-ATPasa de bovino no está claro el sentido de las hélices presentes, ya que las estructuras se han obtenido a partir de segmentos de las subunidades73, 74 (Figura 6).
Utilización del Δμ(Na+) y Δμ(H+) en arqueas Metanogénicas
Las arqueas metanogénicas son una de las pocas formas de vida que producen un potencial electroquímico transmembranal (Δμi) de iones H+ y Na+, simultáneamente. La metanogénesis se sugiere como una de las primeras rutas metabólicas desarrolladas en la Tierra83. La especificidad de la ATP sintasa por el ión a utilizar se encuentra definida por la región traslocadora en la base de la enzima (Ao), formada por un anillo que agrupa múltiples copias de la subunidad c (K/L), cada una de las cuales posee un sitio de unión68. Una de las incógnitas más representativas es cómo aprovechan cada uno de estos gradientes este grupo de organismos. Los primeros estudios con inhibidores indicaron la presencia de una F 1Fo-ATP sintasa y una A1Ao-ATP sintasa en la membrana plasmática de M. mazei Go1, se propuso que estas enzimas utilizan los iones Na+ y H+ para la síntesis de ATP respectivamente, lo que indica una independencia del ión en la síntesis de ATP84. Por otra parte, el crecimiento de la especie Methanobrevibacter ruminantium M1 fue inhibido por ionóforos y protonóforos de sodio lo que demuestra que ambos gradientes son esenciales85. Para elucidar la importancia de la F1Fo-ATPasa en estos organismos, el operón de la ATPasa en Methanosarcina acetivorans se intercambió por un cassette de resistencia a puromicina. La mutante presentó un crecimiento equivalente al de la cepa silvestre, con un contenido de ATP celular idéntico, lo que demostró que los genes de la F1Fo-ATPasa no son esenciales para la supervivencia de este organismo86. Recientemente, Schlegel y colaboradores demostraron que la A1Ao-ATP sintasa de M. acetivorans es capaz de utilizar ambos gradientes (Na+ y H+) simultáneamente para sintetizar ATP87.
Conclusiones
El estudio de los complejos respiratorios en arqueas aeróbicas aún se encuentra en una etapa temprana, lo que parcialmente se debe a la dificultad para aislar y cultivar estos organismos, por su dependencia de condiciones muy específicas (extremas) para su desarrollo. Sin embargo, la investigación con arqueas ha permitido esclarecer mecanismos biológicos y características estructurales que proporcionan una visión mucho más amplia de los organismos vivos y, por lo tanto, es necesario continuar con el estudio de estos complejos para abrir las puertas a todo un abanico de nuevas posibilidades sobre la transducción primaria de energía a través de las membranas.
Por otro lado, muchas vías de obtención de energía en arqueas involucran al complejo A1Ao-ATP sintasa (Figura 2a); esto, aunado a su similitud con las V V -ATP sintasa de eucariontes y su importancia en las arqueas metanogénicas, ha despertado interés por una gran diversidad de estudios estructurales y bioquímicos sobre este complejo. El conjunto de trabajos disponibles hasta la fecha permitió proponer un modelo estructural (inicial) que ha evolucionado y actualmente ha sido construido casi por completo (Figura 8). Esto no implica el final de su estudio, sino el comienzo de una nueva etapa abriendo puertas hacia la elucidación de su mecanismo catalítico, su regulación y las diferencias estructurales dentro de cada una de las especies, entre otros aspectos.
En general, la información disponible acerca de las arqueas se ha obtenido en relativamente poco tiempo; su importancia evolutiva, biológica y biotecnológica3, 88 parece representar sólo una pequeña proporción de lo que las arqueas tienen que ofrecer, lo que es un incentivo para continuar con la investigación referente a este fascinante dominio de la vida.
Agradecimientos
Este trabajo fue apoyado por los proyectos: 128110 (CONACyT) e IN203311-3 de la DGAPA (UNAM). Héctor Vicente Miranda-Astudillo es becario de CONACyT (229474). Se agradece a los doctores Diego González-Halphen (IFC-UNAM), Salvador Uribe-Carvajal (IFC-UNAM) y Arturo Becerra-Bracho (FC-UNAM) por sus valiosas opiniones en la realización de este manuscrito.
Referencias
1. Zillig, W. Comparative biochemistry of Archaea and Bacteria. Curr. Opin. Genet Dev. 1, 544-551 (1991). [ Links ]
2. Woese, C.R., Kandler, O. & Wheelis, M.L. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. Proc. Natl. Acad. Sci. USA 87, 4576-4579 (1990). [ Links ]
3. Jarrell, K.F. et al. Major players on the microbial stage: why archaea are important. Microbiology 157, 919-936 (2011). [ Links ]
4. Gupta, R.S. & Shami, A. Molecular signatures for the Crenarchaeota and the Thaumarchaeota. Antonie van Leeuwenhoek 99, 133-157 (2011). [ Links ]
5. Lewalter, K. & Müller, V. Bioenergetics of archaea: ancient energy conserving mechanisms developed in the early history of life. Biochim. Biophys. Acta 1757, 437-445 (2006). [ Links ]
6. Huber, H. et al. A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont. Nature 2, 63-67 (2002). [ Links ]
7. Barns, S.M., Delwiche, C.F., Palmer, J.D. & Pace, N.R. Perspectives on archaeal diversity, thermophily and monophyly from environmental rRNA sequences. Proc. Natl. Acad. Sci. USA 93, 9188-9193 (1996). [ Links ]
8. Brochier-Armanet, C., Boussau, B., Gribaldo, S. & Forterre, P. Mesophilic Crenarchaeota: proposal for a third archaeal phylum, the Thaumarchaeota. Nat. Rev. Microbiol. 6, 245-252 (2008). [ Links ]
9. Schafer, G., Engelhard, M. & Müller, V. Bioenergetics of the Archaea. Microbiol. Mol. Biol. Rev. 63, 570-620 (1999). [ Links ]
10. Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature 4784, 144-148 (1961). [ Links ]
11. Deppenmeier, U. Redox-driven proton translocation in methanogenic Archaea. Cell Mol. Life Sci. 59, 1513-1533 (2002). [ Links ]
12. Müller, V. et al. Bioenergetics of archaea: ATP synthesis under harsh environmental conditions. J. Mol. Microbiol. Biotechnol. 10, 167-180 (2005). [ Links ]
13. Iwasaki, T., Matsuura, K. & Oshima, T. Resolution of the aerobic respiratory system of the thermoacidophilic archaeon, Sulfolobus sp. strain 7. I. The archaeal terminal oxidase supercomplex is a functional fusion of respiratory complexes III and IV with no c-type cytochromes. J. Biol. Chem. 270, 30881-30892 (1995). [ Links ]
14. Schafer, G., Purschke, W.G., Gleissner, M. & Schmidt, C.L. Respiratory chains of archaea and extremophiles. Biochim. Biophys. Acta 1275, 16-20 (1996). [ Links ]
15. Pereira, M.M. et al. Respiratory chains from aerobic thermophilic prokaryotes. J. Bioenerg. Biomembr. 36, 93-105 (2004). [ Links ]
16. Brito, J.A., Bandeiras, T.M., Teixeira, M., Vonrhein, C. & Archer, M. Crystallisation and preliminary structure determination of a NADH: quinone oxidoreductase from the extremophile Acidianus ambivalens. Biochim. Biophys. Acta 1764, 842-845 (2006). [ Links ]
17. Gomes, C.M., Bandeiras, T.M. & Teixeira, M. A new type-II NADH dehydrogenase from the archaeon Acidianus ambivalens: characterization and in vitro reconstitution of the respiratory chain. J. Bioenerg. Biomembr. 33, 1-8 (2001). [ Links ]
18. Gomes, C.M. et al. The unusual iron sulfur composition of the Acidianus ambivalens succinate dehydrogenase complex. Biochim. Biophys. Acta 1411, 134-141 (1999). [ Links ]
19. Lemos, R.S., Gomes, C.M. & Teixeira, M. Acidianus ambivalens Complex II typifies a novel family of succinate dehydrogenases. Biochem. Biophys. Res. Commun. 281, 141-150 (2001). [ Links ]
20. Bandeiras, T.M. et al. The cytochrome ba complex from the thermoacidophilic crenarchaeote Acidianus ambivalens is an analog of bc1 complexes. Biochim. Biophys. Acta 1787, 37-45 (2009). [ Links ]
21. Gilderson, G. et al. Kinetics of electron and proton transfer during O2 reduction in cytochrome aa3 from A. ambivalens: an enzyme lacking Glu(I-286). Biochim. Biophys. Acta 1503, 261-270 (2001). [ Links ]
22. Kabashima, Y. & Sakamoto, J. Purification and biochemical properties of a cytochrome bc complex from the aerobic hyperthermophilic archaeon Aeropyrum pernix. BMC Microbiology 11, 52 (2011). [ Links ]
23. Ishikawa, R. et al. Aeropyrum pernix K1, a strictly aerobic and hyperthermophilic archaeon, has two terminal oxidases, cytochrome ba3 and cytochrome aa3. Arch. Microbiol. 179, 42-49 (2002). [ Links ]
24. Sreeramulu, K., Schmidt, C.L., Schafer, G. & Anemüller, S. Studies of the electron transport chain of the euryarcheon Halobacterium salinarum: indications for a type II NADH dehydrogenase and a complex III analog. J. Bioenerg. Biomembr. 30, 443-453 (1998). [ Links ]
25. González, O. et al. Systems analysis of bioenergetics and growth of the extreme halophile Halobacterium salinarum. PLoS Comput. Biol. 5, e1000332 (2009). [ Links ]
26. Nunoura, T., Sako, Y., Wakagi, T. & Uchida, A. Regulation of the aerobic respiratory chain in the facultatively aerobic and hyperthermophilic archaeon Pyrobaculum oguniense. Microbiology 149, 673-688 (2003). [ Links ]
27. Nunoura, T., Sako, Y., Wakagi, T. & Uchida, A. Cytochrome aa3 in facultatively aerobic and hyperthermophilic archaeon Pyrobaculum oguniense. Can. J. Microbiol. 51, 621-627 (2005). [ Links ]
28. Bandeiras, T.M., Salgueiro, C.A., Huber, H., Gomes, C.M. & Teixeira, M. The respiratory chain of the thermophilic archaeon Sulfolobus metallicus: studies on the type-II NADH dehydrogenase. Biochim. Biophys. Acta. 1557, 13-19 (2003). [ Links ]
29. Hamann, N. et al. The CCG-domain-containing subunit SdhE of succinate: quinone oxidoreductase from Sulfolobus solfataricus P2 binds a [4Fe-4S] cluster. J. Biol. Inorg. Chem. 14, 457-470 (2009). [ Links ]
30. Auernik, K.S. & Kelly, R.M. Identification of components of electron transport chains in the extremely thermoacidophilic crenarchaeon Metallosphaera sedula through iron and sulfur compound oxidation transcriptomes. Appl. Environ. Microbiol. 74, 7723-7732 (2008). [ Links ]
31. Kish-Trier, E., Briere, L.K., Dunn, S.D. & Wilkens, S. The stator complex of the A1A0-ATP synthase-structural characterization of the E and H subunits. J. Mol. Biol. 375, 673-685 (2008). [ Links ]
32. Kish-Trier, E. & Wilkens, S. Domain architecture of the stator complex of the A1A0-ATP synthase from Thermoplasma acidophilum. J. Biol. Chem. 284, 12031-12040 (2009). [ Links ]
33. Kish-Trier, E. & Wilkens, S. Interaction of the Thermoplasma acidophilum A1A0-ATP synthase peripheral stalk with the catalytic domain. FEBS Letters 583, 3121-3126 (2009). [ Links ]
34. Cross, R.L. & Müller, V. The evolution of A-, F-, and V-type ATP synthases and ATPases: reversals in function and changes in the H+/ATP coupling ratio. FEBS Letters 576, 1-4 (2004). [ Links ]
35. Deppenmeier, U., Müller, V. & Gottschalk, G. Pathways of energy conservation in methanogenic archaea. Arch. Microbiol. 165, 149-163 (1996). [ Links ]
36. Bickel-Sandkotter, S., Gartner, W. & Dane, M. Conversion of energy in halobacteria: ATP synthesis and phototaxis. Arch. Microbiol. 166, 1-11 (1996). [ Links ]
37. Adams, M.W. The biochemical diversity of life near and above 100°C in marine environments. J. Appl. Microbiol. Syn. Sup. 85, 108s-117s (1998). [ Links ]
38. Cross, R.L. & Taiz, L. Gene duplication as a means for altering H+/ ATP ratios during the evolution of FoF1 ATPases and synthases. FEBS Letters 259, 227-229 (1990). [ Links ]
39. Muench, S.P., Trinick, J. & Harrison, M.A. Structural divergence of the rotary ATPases. Q. Rev. Biophys. 44, 311-356 (2011). [ Links ]
40. Iwabe, N., Kuma, K., Hasegawa, M., Osawa, S. & Miyata, T. Evolutionary relationship of archaebacteria, eubacteria, and eukaryotes inferred from phylogenetic trees of duplicated genes. Proc. Natl. Acad. Sci. USA 86, 9355-9359 (1989). [ Links ]
41. Stock, D., Gibbons, C., Arechaga, I., Leslie, A.G. & Walker, J.E. The rotary mechanism of ATP synthase. Curr. Opin. Struct. Biol. 10, 672-679 (2000). [ Links ]
42. Grüber, G., Wieczorek, H., Harvey, W.R. & Müller, V. Structure-function relationships of A-, F- and V-ATPases. J. Exp. Biol. 204, 2597-2605 (2001). [ Links ]
43. Nishi, T. & Forgac, M. The vacuolar H+-ATPases—nature's most versatile proton pumps. Nat. Rev. Mol. Cell Biol. 3, 94-103 (2002). [ Links ]
44. Wieczorek, H. et al. Structure and regulation of insect plasma membrane H+ V-ATPase. J. Exp. Biol. 203, 127-135 (2000). [ Links ]
45. Müller, V., Ruppert, C. & Lemker, T. Structure and function of the A1A0-ATPases from methanogenic Archaea. J. Bioenerg. Biomembr. 31, 15-27 (1999). [ Links ]
46. Shao, E., Nishi, T., Kawasaki-Nishi, S. & Forgac, M. Mutational analysis of the non-homologous region of subunit A of the yeast V-ATPase. J. Biol. Chem. 278, 12985-12991 (2003). [ Links ]
47. Coskun, U. et al. Structure and subunit arrangement of the A-type ATP synthase complex from the archaeon Methanococcus jannaschiivisualized by electron microscopy. J. Mol. Biol. 279, 38644-38648 (2004). [ Links ]
48. Vonck, J., Pisa, K.Y., Morgner, N., Brutschy, B. & Müller, V. Three-dimensional structure of A1A0 ATP synthase from the hyperthermophilic archaeon Pyrococcus furiosus by electron microscopy. J. Biol. Chem. 284, 10110-10119 (2009). [ Links ]
49. Muench, S.P. et al. Cryo-electron microscopy of the vacuolar ATPase motor reveals its mechanical and regulatory complexity. J. Mol. Biol. 386, 989-999 (2009). [ Links ]
50. Walker, J.E. & Kane-Dickson, V. The peripheral stalk of the mitochondrial ATP synthase. Biochim. Biophys. Acta 1757, 286-296 (2006). [ Links ]
51. Cano-Estrada, A. & González-Halphen, D. F1Fo-ATP sintasa y sus diferencias estructurales. REB 30, 98-108 (2011). [ Links ]
52. Stewart, A.G., Lee, L.K., Donohoe, M., Chaston, J.J. & Stock, D. The dynamic stator stalk of rotary ATPases. Nat. Commun. 3, 687 (2012). [ Links ]
53. Schafer, I.B. et al. Crystal structure of the archaeal A1Ao ATP synthase subunit B from Methanosarcina mazei Go1: Implications of nucleotide-binding differences in the major A1Ao subunits A and B. J. Mol. Biol. 358, 725-740 (2006). [ Links ]
54. Boyer, P.D. A perspective of the binding change mechanism for ATP synthesis. FASEB J. 3, 2164-2178 (1989). [ Links ]
55. Maegawa, Y. et al. Structure of the catalytic nucleotide-binding subunit A of A-type ATP synthase from Pyrococcus horikoshü reveals a novel domain related to the peripheral stalk. Acta Crystallogr. D. Biol. Crystallogr. 62, 483-488 (2006). [ Links ]
56. Maher, M.J. et al. Crystal structure of A3B3 complex of V-ATPase from Thermus thermophilus. EMBO Journal 28, 3771-3779 (2009). [ Links ]
57. Abrahams, J.P., Leslie, A.G., Lutter, R. & Walker, J.E. Structure at 2.8 À resolution of F 1-ATPase from bovine heart mitochondria. Nature 370, 621-628 (1994). [ Links ]
58. Bernal, R.A. & Stock, D. Three-dimensional structure of the intact Thermus thermophilus H+-ATPase/synthase by electron microscopy. Structure 12, 1789-1798 (2004). [ Links ]
59. Numoto, N., Hasegawa, Y., Takeda, K. & Miki, K. Inter-subunit interaction and quaternary rearrangement defined by the central stalk of prokaryotic V1-ATPase. EMBO Reports 10, 1228-1234 (2009). [ Links ]
60. Gibbons, C., Montgomery, M.G., Leslie, A.G. & Walker, J.E. The structure of the central stalk in bovine F1-ATPase at 2.4 À resolution. Nature Structural Biology 7, 1055-1061 (2000). [ Links ]
61. Noji, H., Yasuda, R., Yoshida, M. & Kinosita, K. Direct observation of the rotation of F1-ATPase. Nature 386, 299-302 (1997). [ Links ]
62. Imamura, H. et al. Evidence for rotation of V1-ATPase. Proc. Natl. Acad. Sci. USA 100, 2312-2315 (2003). [ Links ]
63. Raghunathan, D., Gayen, S., Grüber, G. & Verma, C.S. Crosstalk along the stalk: dynamics of the interaction of subunits B and F in the A1AOATP synthase of Methanosarcina mazei Go1. Biochemistry 49, 4181-4190 (2010). [ Links ]
64. Raghunathan, D. et al. Subunit F modulates ATP binding and migration in the nucleotide-binding subunit B of the A1AOATP synthase of Methanosarcina mazeiGo1. J. Bioenerg. Biomembr. 44, 213-224 (2012). [ Links ]
65. Ihara, K., Watanabe, S., Sugimura, K., Katagiri, I. & Mukohata, Y. Identification of proteolipid from an extremely halophilic archaeon Halobacterium salinarum as an N,N'-dicyclohexyl-carbodiimide binding subunit of ATP synthase. Arch. Biochem. Biophys. 341, 267-272 (1997). [ Links ]
66. Wilms, R. et al. Subunit structure and organization of the genes of the A1A0 ATPase from the Archaeon Methanosarcina mazei Go1. J. Biol. Chem. 271, 18843-18852 (1996). [ Links ]
67. Inatomi, K., Maeda, M. & Futai, M. Dicyclohexylcarbodiimidebinding protein is a subunit of the Methanosarcina barkeri ATPase complex. Biochem. Biophys. Res. Commun. 162, 1585-1590 (1989). [ Links ]
68. Müller, V., Lingl, A., Lewalter, K. & Fritz, M. ATP synthases with novel rotor subunits: new insights into structure, function and evolution of ATPases. J. Bioenerg. Biomembr. 37, 455-460 (2006). [ Links ]
69. Ruppert, C., Wimmers, S., Lemker, T. & Müller, V. The A1A0 ATPase from Methanosarcina mazei cloning of the 5' end of the aha operon encoding the membrane domain and expression of the proteolipid in a membrane-bound form in Escherichia coli. J. Bacteriol. 180, 3448-3452 (1998). [ Links ]
70. Ruppert, C. et al. The proteolipid of the A1A0 ATP synthase from Methanococcus jannaschii has six predicted transmembrane helices but only two proton-translocating carboxyl groups. J.Biol. Chem. 274, 25281-25284 (1999). [ Links ]
71. Lolkema, J.S. & Boekema, E.J. The A-type ATP synthase subunit K of Methanopyrus kandleri is deduced from its sequence to form a monomeric rotor comprising 13 hairpin domains. FEBS Lettes 543, 47-50 (2003). [ Links ]
72. Zhang, Z. et al. Structure of the yeast vacuolar ATPase. J. Biol. Chem. 283, 35983-35995 (2008). [ Links ]
73. Dickson, V.K., Silvester, J.A., Fearnley, I.M., Leslie, A.G. & Walker, J.E. On the structure of the stator of the mitochondrial ATP synthase. EMBO Journal 25, 2911-2918 (2006). [ Links ]
74. Rees, D.M., Leslie, A.G. & Walker, J.E. The structure of the membrane extrinsic region of bovine ATP synthase. Proc. Natl. Acad. Sci. USA 106, 21597-21601 (2009). [ Links ]
75. Lee, L.K., Stewart, A.G., Donohoe, M., Bernal, R.A. & Stock, D. The structure of the peripheral stalk of Thermus thermophilus H+-ATPase/synthase. Nature Structural Biology 17, 373-378 (2010). [ Links ]
76. Grüber, G. & Marshansky, V. New insights into structure-function relationships between archeal ATP synthase (A1A0) and vacuolar type ATPase (V1V0). BioEssays30, 1096-1109 (2008). [ Links ]
77. Müller, V. & Grüber, G. ATP synthases: structure, function and evolution of unique energy converters. Cell Mol. Life Sci. 60, 474-494 (2003). [ Links ]
78. Weber, J. ATP synthase-the structure of the stator stalk. Trends Biochem. Sci. 32, 53-56 (2007). [ Links ]
79. Del Rizzo, P.A., Bi, Y., Dunn, S.D. & Shilton, B.H. The "second stalk" of Escherichia coli ATP synthase: structure of the isolated dimerization domain. Biochemistry 41, 6875-6884 (2002). [ Links ]
80. Del Rizzo, P.A., Bi, Y. & Dunn, S.D. ATP synthase b subunit dimerization domain: a right-handed coiled coil with offset helices. J. Mol. Biol. 364, 735-746 (2006). [ Links ]
81. Wise, J.G. & Vogel, P.D. Subunit b-dimer of the Escherichia coli ATP synthase can form left-handed coiled-coils. Biophysical Journal 94, 5040-5052 (2008). [ Links ]
82. Wise, J.G. & Vogel, P.D. Accommodating discontinuities in dimeric left-handed coiled coils in ATP synthase external stalks. Biophysical Journal 96, 2823-2831 (2009). [ Links ]
83. Deppenmeier, U. & Müller, V. Life close to the thermodynamic limit: how methanogenic archaea conserve energy. Results Probl. Cell Differ. 45,123-152 (2007). [ Links ]
84. Becher, B. & Müller, V. ΔµNa+ drives the synthesis of ATP via an ΔµNa+-translocating F 1Fo-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazeiGö1. J. Bacteriol. 176, 2543-2550 (1994). [ Links ]
85. McMillan, D.G. et al. A1Ao-ATP synthase of Methanobrevibacter ruminantium couples sodium ions for ATP synthesis under physiological conditions. J. Biol. Chem. 286, 39882-39892 (2011). [ Links ]
86. Saum, R., Schlegel, K., Meyer, B. & Müller, V. The F1FO ATP synthase genes in Methanosarcina acetivorans are dispensable for growth and ATP synthesis. FEMS Microbiol. Lett. 300, 230-236 (2009). [ Links ]
87. Schlegel, K., Leone, V., Faraldo-Gómez, J.D. & Müller, V. Promiscuous archaeal ATP synthase concurrently coupled to Na+ and H+ translocation. Proc. Natl. Acad. Sci. USA 109, 947-952 (2012). [ Links ]
88. de Champdoré, M., Staiano, M., Rossi, M. & D'Auria, S. Proteins from extremophiles as stable tools for advanced biotechnological applications of high social interest. J. R. Soc. Interface 4, 183-191 (2007). [ Links ]
Información sobre el autor
Héctor Vicente Miranda-Astudillo
Héctor Vicente Miranda-Astudillo es Químico Farmacéutico Biólogo (2009), por la Facultad de Química de la Universidad Nacional Autónoma de México. Fue miembro del equipo que representó a México en el 15th International Young Physicist' Tournament en Odessa, Ucrania (2002). A partir del año 2006 se incorporó al grupo de trabajo del Dr. Diego González Halphen. en el Instituto de Fisiología Celular (UNAM). Es coautor del artículo "Subunit-subunit interactions and overall topology of the dimeric mitochondrial ATP synthase of Polytomella sp", Biochimica et Biophysica Acta (2010). Actualmente es candidato a Doctor en Ciencias, bajo la dirección del Dr. Diego González Halphen; y Profesor Invitado en el posgrado de Doctorado en Ciencias Biomédicas (UNAM).














