Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
TIP. Revista especializada en ciencias químico-biológicas
Print version ISSN 1405-888X
TIP vol.14 n.2 Ciudad de México Dec. 2011
Artículo original
Componentes conductuales del cortejo incrementan la exposición a parásitos en el pez vivíparo Xenoophorus captivus
Courtship display increases exposure to parasites in the viviparous fish Xenoophorus captivus
Edgar G. Ávila, Alejandra Valero y Constantino Macías-Garcia*
Instituto de Ecología, Universidad Nacional Autónoma de México. Apdo. Postal 70-275, C.P. 04510, Coyoacán, México, D.F. *E-mail: maciasg@servidor.unam.mx
Artículo recibido el 27 de septiembre de 2011;
Aceptado el 03 de noviembre de 2011.
Resumen
Un aspecto importante de la teoría de la selección sexual es el comprender por qué las hembras prefieren machos que ostentan ornamentos. Una de las teorías sugiere que desplegar caracteres sexuales secundarios es costoso, y que esto revela información cualitativa sobre el fenotipo del macho. En este estudio ponemos a prueba la hipótesis de que el cortejo expone a los machos a infecciones por parásitos y, por lo tanto, puede revelar información relevante a la calidad fenotípica de una pareja potencial. Usamos al pez vivíparo Xenoophorus captivus (Goodeidae), ya que los machos remueven sedimentos del sustrato como parte de su cortejo (barrido). Como primer paso, evaluamos la preferencia de las hembras por machos que realizan despliegues de cortejo frecuentes y de larga duración. Después, expusimos a machos al contacto con ectoparásitos manipulando sus posibilidades de desplegar la conducta de barrido. Encontramos que los machos que hicieron barridos se infectaron y, por lo tanto, interrumpieron el cortejo para rascarse; a consecuencia de esto, la intensidad del cortejo se redujo. Esto sugiere que las hembras de X. captivus pueden determinar si un macho está infectado indirectamente a través de la duración de sus despliegues de cortejo.
Palabras Clave: Elección femenina, Goodeidae, handicap, mecanismos indicadores, parásitos, tasa de cortejo.
Abstract
A central issue in sexual selection theory is to understand why there are female preferences for males displaying ornaments. One theory proposes that displaying male secondary sexual characters is costly, and that this reveals information about the male's phenotypic quality. Here, we used the viviparous Xenoophorus captivus (Goodeidae), a fish whose males often remove the bottom sediments during courtship (substrate sweeping), to test the hypothesis that male courtship displays expose males to parasitic infection, and thus may convey relevant information on the quality of a mating partner. First, we evaluated the females preference for males that perform more and longer courtship displays. Then, we exposed courting males to the presence of ectoparasites while manipulating their opportunity to perform substrate sweeping. We found that males that were allowed to sweep the substrate became infected and, as a consequence, interrupted their displays and began scratching, resulting in shorter courtship bouts in comparison to males prevented from sweeping the substrate. Thus, the occurrence of substrate sweeping in this species allows females to determine whether a male is infected with skin parasites through assessing the length of his courtship bouts.
Key Words: Female choice, Goodeidae, revealing handicap, indicator mechanisms, parasites, display rate.
Introducción
Uno de los aspectos más intrigantes de los estudios de la selección sexual es comprender las razones de la elección que las hembras de muchas especies hacen por machos que despliegan caracteres sexuales secundarios como cantos, estructuras elaboradas o despliegues de cortejo1; un área plagada de debates2,3. Los modelos tradicionales4 sugieren que el simple hecho de que dichos ornamentos sean atractivos para las hembras (ya sea por sesgos sensoriales u otras causas5), es suficiente para generar un proceso de retroalimentación genética (lo que se conoce como runaway) que promueve la elaboración de estos caracteres4,6. Modelos más recientes proponen que los ornamentos masculinos son costosos de producir o mantener, de tal manera que expuestas a una variedad de machos con distintos grados de elaboración de ornamentos, las hembras seleccionarían para aparearse a aquellos de alta calidad fenotípica7, lo cual puede incluso tener un correlato genético8,9.
Por lo menos dos predicciones deben confirmarse para apoyar las hipótesis derivadas de estos modelos: que exista correlación genotípica entre el ornamento masculino y la preferencia femenina, y también entre la expresión del ornamento y la viabilidad10. Si se pretende comprender de manera integral la relación entre la magnitud del ornamento y la calidad del macho, es necesario considerar tanto la naturaleza de la señal como el aspecto de calidad fenotípica al cual hace referencia. Por ejemplo, los caracteres morfológicos pueden señalar cualidades fenotípicas del pasado (del desarrollo temprano11), mientras que los caracteres conductuales como el desempeño en el cortejo pueden estar más relacionados a la condición física y/o fisiológica en el presente12-14. Adicionalmente, la calidad fenotípica puede abarcar el estado nutricional, la proporción de reservas grasas, el estado toxicológico, la carga parasitaria, etc15. Por lo tanto, se espera que el blanco de la elección femenina varíe entre especies como función del sistema de apareamiento y entre individuos como función del momento dentro del ciclo reproductivo.
Desde el punto de vista de la hembra, un aspecto importante a evaluar en el fenotipo del macho es su carga de parásitos, ya que este atributo contiene información sobre el componente heredable de la resistencia9, y porque también determina la probabilidad de que la hembra se contagie durante el apareamiento, como ocurre por ejemplo durante la cópula en guppies16. Sin embargo, la fidelidad con la cual la carga parasitaria actual es un indicador de resistencia en general, depende de que los machos hayan estado expuestos a parásitos de manera homogénea antes de la evaluación femenina. Las hembras favorecerían aquellos patrones de cortejo que incluyen conductas que incrementan la exposición de los machos a los parásitos si los machos pueden realizarlas sin quedar infectados. En el presente estudio evaluamos si esto sucede en el pez vivíparo Xenoophorus captivus, cuyos machos despliegan una conducta durante el cortejo en la cual incrementan su exposición a parásitos al realizar movimientos altamente energéticos (barridos) en contacto con el sustrato del cuerpo de agua. Primero evaluamos si la intensidad del cortejo es un criterio de elección femenina en X. captivus; posteriormente evaluamos si el realizar los barridos sobre el sustrato durante el cortejo incrementa la probabilidad de contagio de los machos, y si una vez contagiados esta condición reduce la intensidad del cortejo.
Materiales y métodos
Sujetos de estudio y condiciones de cautiverio
Los peces utilizados fueron adultos colectados en tres localidades de San Luis Potosí, México (Tabla I). Catorce machos y catorce hembras fueron transportados al laboratorio y se mantuvieron separados por población y sexo, en peceras de 40 litros con aireación y plantas acuáticas como refugio, pero sin grava o arena en el fondo. Los peces fueron alimentados dos veces al día con hojuelas comerciales para peces y se mantuvieron en un fotoperiodo de 12/12 h de luz /oscuridad. La temperatura de las peceras se mantuvo en un intervalo de 29-30 °C. Los experimentos se llevaron a cabo 12 meses después de que los peces llegaron al laboratorio. Para preservar la identidad de cada pez, unos días antes del comienzo del experimento fueron alojados individualmente en tres compartimentos de igual tamaño dentro de peceras de 40 L.

Conducta de los machos
Xenoophorus captivus es un pez vivíparo de la familia Goodeidae que presenta dimorfismo sexual. Los machos poseen las aletas dorsal, anal y caudal más grandes que las hembras y además, el borde posterior de la aleta caudal es de color amarillo17. La aleta caudal del macho y la coloración general del cuerpo se intensifica durante las interacciones con otros peces, un fenómeno común que ocurre en diversos contextos en otras especies de goodeidos18. En condiciones de laboratorio, los machos de X. captivus cortejan a las hembras en el fondo de una pecera. El macho se acerca a la hembra a una distancia de una longitud de un cuerpo de distancia y se coloca de frente o lateralmente a ella; el cortejo consiste en mostrar sus aletas dorsal, anal y caudal, seguido de movimientos rítmicos del cuerpo, junto con la ondulación de la aleta dorsal y anal (flagging). Después del baile de cortejo, el macho realiza barridos: movimientos vigorosos de nado en reversa que lo alejan de la hembra (a una distancia de aproximadamente 3 longitudes del cuerpo). En esta etapa del cortejo, el opérculo y vientre del macho hacen contacto con el sedimento del fondo, lo cual incrementa la probabilidad de infestación con parásitos que se encuentren en el sedimento. El macho puede intentar la cópula en cualquier momento del cortejo.
Experimento 1. Respuesta de la hembra al cortejo
El objetivo de este experimento fue evaluar el papel de los caracteres morfológicos y conductuales de los machos en la elección de la hembra. Pusimos a prueba la predicción de que componentes conductuales como la frecuencia y duración del cortejo contienen información que ayuda a la elección de la hembra. Se utilizó una pecera de 60 L (100 x 25 x 25 cm) dividida en tres compartimentos iguales por medio de unos paneles de cristal, para evaluar la preferencia de las hembras por el tamaño del macho o por la intensidad del cortejo. Catorce hembras (longitud estándar X ± DS = 41.1 ± 5.4 mm) fueron expuestas a dos machos procedentes de los grupos de 14 individuos (X ± DS = 35.8 ± 4.2). Dado que las hembras vieron sólo los machos de su propia población, esto significó que algunos machos se usaron con más frecuencia que otros, pero sólo dos pares de machos fueron usados más de una vez. El día anterior al inicio de los experimentos, dos machos de diferente tamaño (diferencia de LS X ± DS=4.5 ± 3.6 mm) se introdujeron en los compartimentos externos y una hembra en el compartimento central. Durante este tiempo (24 horas) se cubrieron los paneles de cristal con paneles opacos, con la finalidad de impedir que los peces establecieran contacto visual antes del experimento. Al iniciar una prueba experimental, se retiraron las cubiertas opacas y el sistema de aireación; diez minutos después se registró la conducta de las hembras. Se cuantificó la frecuencia y duración de los acercamientos de las hembras a los machos. Una visita a un macho consistió en que la hembra se acercaba a un cuerpo de distancia del cristal. Se colocaron marcas en el tanque a una distancia apropiada (para esto se usó el tamaño promedio de todas las hembras) facilitando el registro de las visitas. También se registró la frecuencia y la duración de los flagging y barridos de los machos, registrando todas las instancias de estas conductas19. Las observaciones duraron 105 minutos; después de que los peces fueron devueltos a los tanques de donde provenían, las cubiertas opacas se colocaron de nuevo en su lugar y se introdujeron nuevos peces en el tanque experimental para observarlos al día siguiente. Con el fin de evitar que las hembras desarrollaran una preferencia por un lado del tanque experimental y que esto interfiriera con el análisis de su elección de pareja, se repitieron todas las observaciones cambiando el lado en el que los machos habían sido presentados a cada hembra.
Experimento 2. Relación entre el cortejo y la exposición a los parásitos
El objetivo de este experimento era poner a prueba la predicción de que el barrido en X. captivus, es un componente del cortejo que aumenta la probabilidad de infección, con la consiguiente reducción en la frecuencia o la duración del cortejo. En preparación a las pruebas experimentales se usó una pecera de aclimatación, una pecera llamada línea de base y una de observación, pero únicamente la última fue inoculada con el parásito Ichthyophthirius multifiliis, introduciendo en ella 10 peces poecílidos (Heterandria bimaculata) que se usaron como hospederos entre las pruebas. Debido a que el ciclo de vida de I. multifiliis está asociado con la temperatura20, el agua en todas las peceras se mantuvo a una temperatura de 31 °C con la ayuda de calentadores de acuario. Los días del 1 al 7 de los experimentos, un macho y una hembra se introdujeron por separado, en bolsas de plástico que contenían agua de sus peceras de origen, en alguno de los dos compartimentos de una pecera de aclimatación. Una pared opaca impidió el contacto visual entre los peces durante los 30 minutos que permanecieron allí. Cuando fueron trasladados a la pecera de línea de base o a la de observación, las hembras permanecieron en la bolsa, mientras que a los machos se les permitió nadar libremente. En los días 1y 7 únicamente, los peces pasaron por la pecera de línea de base. La bolsa que contenía a la hembra se mantuvo en el fondo de la pecera con ayuda de piezas de plomo. En los días 2-6 del experimento, los peces fueron transferidos directamente a la pecera de observación. En las peceras de observación, los machos fueron expuestos a pruebas de fondo (B) o de superficie (S), dependiendo de si la bolsa que contenía a la hembra se mantenía en el fondo o flotando en la superficie de la pecera de observación. Los machos y las hembras fueron asignados a pruebas B o S de forma arbitraria. Después de la primera fase de pruebas, se repitió el procedimiento completo (incluidos los registros de la línea de base), pero esta vez los machos que habían sido asignados a pruebas B durante la primera fase de observaciones fueron asignados a pruebas S y viceversa. Las pruebas tuvieron una duración de 30 minutos, durante los cuales se cuantificó la frecuencia y duración de los despliegues (flagging) del macho, de los movimientos de barrido y los casos en que el macho se rascó contra superficies duras. Dado que en las pruebas S, las hembras no podían seguir a los machos, éstos no podían alejarse hacia el fondo de la pecera sin alejarse de la hembra, por lo que rara vez realizaron barridos en estas pruebas.
Varios meses después de finalizado, el experimento se repitió con el objetivo de cuantificar de manera directa la infección por parásitos. En esta ocasión sólo se usó una pecera de aclimatación y una de observación. Se usaron 20 machos en total; 10 de ellos fueron asignados a pruebas B y los 10 restantes a pruebas S; se realizaron dos pruebas por día en la misma pecera de observación, una en B y una en S. Durante las pruebas y fuera de ellas, se observó a los machos con el fin de registrar los síntomas de infección por I. multifiliis: puntos blancos que se desarrollan sobre las escamas o en las aletas. Se cuantificó el número de puntos blancos por cada macho infectado durante el primer día de haberlos descubierto y también durante el día después de esto. Los peces usados (X. captivus y H. bimaculata) fueron tratados con medicamentos después del experimento, y ningún pez murió de una infección parasitaria durante este estudio.
Análisis
Se usaron los paquetes estadísticos SPSS v 12.0 y MINITAB. Dado que la especie de estudio se encuentra en peligro de extinción21, el número de individuos que se podían colectar y usar para experimentos era limitado. Los datos de días consecutivos del experimento 2 se usaron en conjunto para obtener un promedio por individuo (excepto los datos de línea de base) y fueron analizados por medio de pruebas no paramétricas: comparamos la línea de base entre grupos experimentales usando la U de Mann-Whitney, y la abundancia de puntos de infección entre machos mediante la prueba de Wilcoxon para muestras pareadas. En todos los casos se reporta X ± DS, a menos que se indique lo contrario.
Resultados
Experimento 1
El diseño experimental fue efectivo en motivar a los machos a cortejar activamente a las hembras y, en algunos casos, a intentar copular con ellas aunque existía un vidrio de por medio. En promedio, las hembras pasaron 49% del tiempo de observación en proximidad a alguno de los machos (3512 ± 2025 s). Sólo cinco de 10 hembras pasaron más tiempo con el macho más grande (4318 ± 2422 s) que con el más pequeño (2705 ± 1343) aunque la diferencia no fue significativa (prueba de t para muestras pareadas, t = 1.57, gl = 9, p = 0.15). La magnitud de la diferencia en tamaño entre machos no estuvo asociada a la diferencia en tiempo que las hembras pasaron con alguno de los machos (tiempo con el macho grande - tiempo con el macho pequeño: r = 0.12, gl = 8, p = 0.7) y tampoco con la frecuencia con que los visitaban (r = 0.23, gl = 8, p = 0.53). En todas las pruebas experimentales, las hembras realizaron un total de 272 ± 164 visitas. Aunque el número de hembras que visitaron al macho grande más frecuentemente que al pequeño se desvía de lo esperado por azar (3 de 10 hembras hicieron esto), la desviación no fue significativa (x2 = 1.6, gl = 1, p = 0.2).
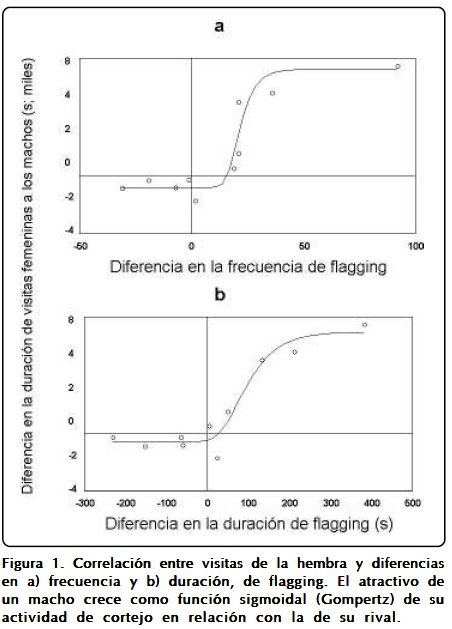
Al incorporar el cortejo en el análisis, se observaron diversos patrones. La diferencia en tiempo que las hembras pasaron en proximidad a machos grandes se explica en mayor grado (r2 = 0.83) por la diferencia en frecuencia de despliegues flagging entre machos (F(3,6) = 15.42, p=0.003; función sigmoidal de Gompertz; Fig. 1a). No sólo eso: la diferencia en duración de flagging explica la mayoría de la varianza (r2= 0.92) en la preferencia de las hembras (F(3,6)=34; p<0.001; función sigmoidal de Gompertz; Fig. 1b). La función de Gompertz indica que existe una interacción entre el tamaño del macho y la frecuencia de flagging, es decir, el efecto de la frecuencia de flagging en la preferencia de las hembras es mayor si los machos grandes se están desplegando activamente (ver las pendientes positivas en los cuadrantes superiores de la Figura 1a y 1b). Dado que los machos tuvieron contacto visual con las hembras, la cercanía a los machos puede haberlos motivado a incrementar la intensidad del cortejo. Sin embargo, esto es poco probable, ya que la gran mayoría de las visitas (99%) terminaron sólo hasta que el cortejo acabó, lo cual indica que la duración de la visita era una función de la duración de un episodio del cortejo y no al revés.
Experimento 2
En la primera fase de las pruebas experimentales, todos los machos cortejaron a las hembras durante las pruebas de línea de base (Tabla II). El colocar a las hembras sobre el fondo de la pecera provocó que los machos incluyeran en su cortejo el flagging y el barrido: los machos asignados a pruebas de fondo durante la primera fase de pruebas experimentales realizaron barridos con igual frecuencia que cuando fueron observados en línea de base, e incluso significativamente con más frecuencia que los machos que vieron a las hembras en la superficie (Tabla II). En la segunda fase, sólo los machos asignados a superficie cortejaron a las hembras durante las pruebas de línea de base. Sin embargo, tan pronto los machos asignados a fondo fueron presentados con las hembras, su frecuencia de barrido se incrementó hasta el punto de realizar barridos casi tan frecuentemente como los machos asignados a fondo en la primera fase (Mann-Whitney U = 12, p(2 colas) = 0.12, Tabla II). Por el contrario, los machos asignados a la superficie redujeron de manera importante sus barridos en comparación a la línea de base (aunque la diferencia no fue significativa, rangos de Wilcoxon Z = -1.82, p(2 colas)=0.06).
Los machos asignados a las pruebas de fondo se rascaron contra objetos de la pecera significativamente más que aquéllos asignados a la superficie (Tabla II). En particular, los machos que cortejaron sobre el fondo en la segunda fase de las pruebas, se rascaron contra objetos sólidos tan frecuentemente como los machos que cortejaron sobre el fondo en la primera fase de pruebas (Mann-Whitney U = 15.5 p(2 colas)=0.23). La frecuencia acumulada de rascado, que puede considerarse como un indicador de la intensidad de la infección, aparentemente estuvo relacionada con una disminución de la intensidad del cortejo hacia el final del experimento, pero dicha relación negativa no fue significativa (R2=0.39, p>0.05).
Los machos asignados a pruebas B (de fondo) desarrollaron más puntos de infección que los machos asignados a pruebas S (de superficie) durante el primer día del conteo (machos B: 8.5 ± 11.7, machos S: 3.0 ± 6.4; rangos de Wilcoxon Z=-2.22, g.l. = 9, P=0.01, Fig. 2); durante el segundo día de conteo, la cantidad de puntos en ambos tipos de machos se incrementó, pero la diferencia entre machos dejó de ser significativa (machos B: 19.2 ± 16.07, machos S: 14.1 ± 13.8).

Discusión
En el presente estudio se confirmó que la preferencia de las hembras de X. captivus por los machos de su especie está sesgada con más fuerza a los componentes conductuales del cortejo (en particular, la duración), que a elementos morfológicos (como ornamentos sexuales o tamaño corporal), al menos dentro del espectro de las diferencias observadas. Esto quedó demostrado durante las pruebas de elección de pareja en las cuales las hembras no mostraron preferencia por los machos grandes, pero sí fue evidente que preferían machos cuyos despliegues de cortejo eran de mayor duración. Esto es congruente con las preferencias que muestra otro goodeido, el pez amarillo Girardinichthys multiradiatus22 y las que muestran hembras de otro pez vivíparo, el guppy, Poecilia reticulata23-27. Otros estudios han ido más lejos al demostrar una asociación positiva entre la intensidad de cortejo y la calidad del esperma producido (número de espermatozoides12), habilidades natatorias prolongadas27 o han proporcionado evidencia que sugiere que la tasa de despliegues de cortejo es un indicador de la resistencia de los machos a la invasión por parásitos16. En especies como los peces vivíparos, donde los machos sólo contribuyen con esperma, la teoría predice que las hembras son más rigurosas en su elección de pareja1 y, por lo tanto, han desarrollado preferencias por machos que poseen características que indican calidad, como la resistencia a parásitos. Hamilton y Zuk9 propusieron que el grado de elaboración de los caracteres sexuales secundarios puede ser indicador de la resistencia inmediata a parásitos, y que al elegir machos con estas características, las hembras obtienen beneficios directos (reducción en transmisión de parásitos) e indirectos (heredar esta información genética a la descendencia). Creemos entonces que en X. captivus, al igual que en otros goodeidos, cuyos machos sólo aportan genes a sus descendientes, la frecuencia y duración del cortejo puede servir como indicador de la resistencia a los parásitos.
Nuestros resultados refuerzan la idea de que hay una estrecha relación entre la elaboración de un caracter sexual secundario (frecuencia y duración del cortejo) y la susceptibilidad de infección de los machos. En este estudio se confirmó la predicción de que el barrido de los machos incrementa su exposición a la infección, ya que se observó que después de haber cortejado en un sustrato rico en parásitos (el fondo de la pecera), los machos desarrollaron más puntos blancos que los machos que cortejaron en la superficie, se incrementó la frecuencia de rascado y se redujo la frecuencia de flagging. La conducta de rascado no forma parte del cortejo de X. captivus,más bien es -como en otras especies- una consecuencia de la infección con ectoparásitos; así mismo, dicha conducta es responsable por la reducción en componentes del cortejo (flagging) observada en las pruebas experimentales. Otros estudios con peces han documentado modificaciones en el cortejo debidas a parásitos, por ejemplo en guppies24,28, en el pez espinoso, Gasterosteus aculeatus29, y en gobios, Gobiusculus flavescens30. Una hipótesis alternativa a la selección sexual mediada por parásitos es que las hembras eligen machos con menos parásitos debido a que esto disminuye su probabilidad de infectarse por contacto (ver el modelo propuesto por Loehle31). No pusimos a prueba esto, pero dado que la duración de las visitas de las hembras está en función de la duración del cortejo de los machos, creemos que la elección que realizan las hembras tenderá a favorecer a machos resistentes, ya que son estos machos los que pueden sostener la intensidad de los despliegues del cortejo, independientemente del beneficio (genético, beneficios a largo plazo para la descendencia o beneficios directos para la hembra).
Conclusiones
En este estudio hemos demostrado que se cumplen dos de las cinco condiciones que se han sugerido para implementar una prueba formal a la hipótesis de que la elección de la hembra está guiada por mecanismos indicadores (sensu Andersson1), en particular: 1) que en el goodeido X. captivus, la condición de un caracter sexual secundario (en este caso, intensidad del cortejo) disminuye al estar el macho expuesto a parásitos y 2) que la elección de la hembra favorece a los machos con caracteres sexuales secundarios más desarrollados (en este caso, machos que despliegan el cortejo con mayor frecuencia y duración). Nuestros resultados también sugieren que una tercera condición se puede cumplir: que, al preferir machos con despliegues más intensos, las hembras de X. captivus favorecen a los machos menos parasitados (o bien, a los más resistentes). Por ahora, la evidencia sugiere que la evolución de la elección de pareja en los goodeidos se basa en caracteres masculinos indicadores11, pero se requieren más estudios que investiguen si los machos de X. captivus infectados interrumpen el cortejo más frecuentemente que los machos resistentes, si la adecuación de los machos disminuye por la infección y si hay un componente genético en la variación de la resistencia a parásitos.
Agradecimientos
Agradecemos a Alejandro Moyaho Martínez por su asesoría en diferentes etapas del proyecto, que fue financiado por el Instituto de Ecología y con fondos del CONACyT (proyecto 32005-N asignado a Constantino Macías-García).
Referencias
1. Andersson, M.B. Sexual Selection (Princeton University Press,1994). 624 págs. [ Links ]
2. Kokko, H., Brooks, R., McNamara, J.M. & Houston, A.I. The sexual selection continuum. Proc. Roy. Soc. Lond. B 269,1331-1340 (2002). [ Links ]
3. Kokko, H., Brooks, R., Jennions, M.D. & Morley, J. The evolution of mate choice and mating biases. Proc. Roy. Soc. Lond. B 270, 653-664 (2003). [ Links ]
4. Fisher, R.A. The Genetical Theory of Natural Selection (Dover, 1985). 298 págs. [ Links ]
5. Ryan, M.J. & Keddy-Hector, A. Directional patterns of female mate choice and the role of sensory biases. Am. Nat. 139, 35-35 (1992). [ Links ]
6. Kirkpatrick, M. Sexual Selection and the Evolution of Female Choice. Evolution 36, 1-12 (1982). [ Links ]
7. Zahavi, A. The cost of honesty (Further remarks on the handicap principle). J. Theor. Biol. 67, 603-605 (1977). [ Links ]
8. Andersson, M. Sexual selection, natural selection and quality advertisement. Biol. Linn. Soc. 17, 375-393 (1982). [ Links ]
9. Hamilton, W.D. & Zuk, M. Heritable true fitness and bright birds: a role for parasites? Science 218, 384-387 (1982). [ Links ]
10. Pomiankowski, N.A. The evolution of female mate preferences for male genetic quality. Oxf. Surv. Evol. Biol. 5, 136-184 (1988). [ Links ]
11. Arellano-Aguilar, O. & Macías García, C. Exposure to pesticides impairs the expression of fish ornaments reducing the availability of attractive males. Proc. Roy. Soc. London B275, 1343-1350 (2008). [ Links ]
12. Matthews, I.M., Evans, J.P. & Magurran, A.E. Male Display Rate Reveals Ejaculate Characteristics in the Trinidadian guppy Poecilia reticulata. Proc. Roy. Soc. Lond. B 264, 695-700 (1997). [ Links ]
13. Velando, A., Beamonte-Barrientos, R. & Torres, R. Pigment-based skin colour in the blue-footed booby: an honest signal ofcurrent condition used by females to adjust reproductive investment. Oecologia 149, 535-542 (2006). [ Links ]
14. Williams, G.C. Adaptation and Natural Selection. A critique of some current evolutionary thought (Princeton University Press, 1966). 320 págs. [ Links ]
15. West-Eberhard, M.J. Developmental plasticity and evolution (Oxford University Press, 2003). 816 págs. [ Links ]
16. López, S. Acquired Resistance Affects Male Sexual Display and Female Choice in Guppies. Proc. Roy. Soc. Lond. B 265, 717-723 (1998). [ Links ]
17. Macías García, C. & Ramírez, E. Evidence that sensory traps can evolve into honest signals. Nature 434, 501-505 (2005). [ Links ]
18. Macías García, C. & Valero, A. Context-dependent sexual mimicry in the viviparous fish Girardinichthys multiradiatus. Ethol. Ecol. Evol. 13, 331-339 (2001). [ Links ]
19. Altman, J. Observational study of behavior. Sampling methods. Behaviour 49, 227-267 (1974). [ Links ]
20. Johnson, A.K. Ichthyophthiriasis in a recirculating closed-water hatchery. Progress Fish. Cultur. 23, 79-82 (1961). [ Links ]
21. NOM-ECOL-059-1994 Norma Oficial Mexicana. Que determina las especies y Subespecies de Flora y Fauna Silvestres Terrestres y Acuáticas en Peligro de Extinción, Amenazadas, Raras y las Sujetas a Protección Especial y que Establece Especificaciones para su Protección. Diario Oficial de la Federación 31 de diciembre de 2010. [ Links ]
22. Macías-García, C. & Saborio, E. Sperm Competition in a Viviparous Fish. Environ. Biol. Fishes 70, 211-217 (2004). [ Links ]
23. Farr, J.A. Social behavior patterns as determinants of reproductive success in the guppy, Poecilia reticulata Peters (Pisces: Poeciliidae): an experimental study of intermale competition, female choice, and sexual selection. Behaviour 74, 38-91 (1980). [ Links ]
24. Kennedy, C.E.J., Endler, J.A., Poynton, S.L. & McMinn, H. Parasite load predicts mate choice in guppies. Behav. Ecol. Sociobiol. 21, 291-295 (1987). [ Links ]
25. Kodric-Brown, A. & Nicoletto, P. Female choice in the guppy (Poecilia reticulata): the interaction between male color and display. Behav. Ecol. Sociobiol. 50, 346-351 (2001). [ Links ]
26. McMinn, H. Effects of the Nematode Parasite Camallanus cotti on Sexual and Non-Sexual Behaviors in the Guppy (Poecilia reticulata). Am. Zool. 30, 245-249 (1990). [ Links ]
27. Nicoletto, P.F. Female sexual response to condition-dependent ornaments in the guppy, Poecilia reticulata. Anim. Behav. 46, 441-450 (1993). [ Links ]
28. Houde, A.E. & Torio, A.J. Effect ofparasitic infection on male color pattern and female choice in guppies Behav. Ecol. 3,346-351 (1992). [ Links ]
29. Rushbrook, B.J. & Barber, I. Nesting, courtship and kidney hypertrophy in Schistocephalus-infected male three-spined stickleback from an upland lake. J. Fish Biol. 69, 870-882 (2006). [ Links ]
30. Pélabon, C., et al. Do microsporidian parasites affect courtship in two-spotted gobies? Mar. Biol. 148, 189-196 (2005). [ Links ]
31. Loehle, C. The pathogen transmission avoidance theory of sexual selection. Ecol. Model. 103, 231-250 (1997). [ Links ]
Información sobre los autores
Edgar G. Ávila
Edgar G. Ávila estudió la carrera de Biología en la FES Iztacala (UNAM), ha trabajado como técnico académico especializado desde hace más de 7 años en el estudio de la conducta, conservación y el manejo de especies de peces nativos (principalmente de la familia Goodeidae) y desde hace tres años en el estudio de la conducta, dimorfismo sexual y manejo de aves marinas (Sala leucogaster). Ha publicado cuatro artículos en revistas internacionales especializadas y participa en varias actividades académicas de estudiantes de posgrado. Es coautor de doce presentaciones en congresos nacionales e internacionales, y ha asistido a siete cursos de especialización sobre los campos de su interés.
Alejandra Valero
Alejandra Valero obtuvo el título de Licenciada en Biología por la Facultad de Ciencias, UNAM) graduándose con una tesis sobre conflicto entre sexos en un pez Goodeido. Su doctorado lo realizó en la Universidad de St. Andrews, en Escocia, estudió la conducta de orientación espacial del mono araña. Ha realizado varias estancias postdoctorales con apoyo de la Fundación Leverhulme (Reino Unido) y de la UNAM. Se ha especializado en el estudio de la interferencia entre especies de peces exóticas y nativas, sobre lo que ha publicado varios artículos en revistas prestigiadas, y dicta regularmente cursos sobre Evolución, Ecología de ia Conducta, y Conservación. Ha publicado 8 artículos en revistas científicas, 3 en revistas de divulgación, y ha participado en 13 ponencias en congresos nacionales e internacionales.
Constantino Macías Garcia
Constantino Macias Garcia obtuvo la Licenciatura en Biología y la Maestría en Ciencias en la Facultad de Ciencias, UNAM, con trabajos relacionados con el estudio de la dieta se serpientes de agua. Se ha especializada desde entonces en el estudio de las presas de esas serpientes, particularmente los peces de la familia Goodeidae, a los que usan como modelo para entender el origen y funciones de los ornamentos usados en el cortejo, así como las consecuencias de la selección sexual en el origen de las especies y en su extinción. Más recientemente ha incursionado en el estudio de los efectos antropogénicos en la comunicación sexual, en la elaboración de ornamentos, y en el mantenimiento de barreras reproductivas. Ha publicado 54 artículos en revistas internacionales indexadas, 16 artículos de divulgación y varios capítulos en libros nacionales e internacionales. Ha presentado más de noventa contribuciones en congresos internacionales.





![Study of the interaction of the compound monomercaptoundecahydro-closo-dodecaborate [B12H H SH]2- with Cu(II) using electrochemical and spectroscopic techniques](/img/en/next.gif)








