Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
TIP. Revista especializada en ciencias químico-biológicas
Print version ISSN 1405-888X
TIP vol.14 n.2 Ciudad de México Dec. 2011
Artículo original
Estudio sintético y caracterización por infrarrojo de derivados 2-(amino)-1,4-naftoquinona y su evaluación antibacteriana preliminar
Synthesis, IR characterization and preliminary antibacterial evaluation of 2-(amine)-l,4-naphthoquinone derivatives
Marlene Lariza Andrade-Guel, Lluvia Itzel López-López* y Aidé Sáenz-Galindo
Depto. de Química Orgánica, Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila, Blvd. V. Carraza e Ing. José Cárdenas, C.P. 25280. Saltillo, Coahuila, México. *E-mail: lluvialopez@uadec.edu.mx
Artículo recibido el 24 de junio de 2011;
Aceptado el 26 de agosto de 2011.
Resumen
Las naftoquinonas son compuestos de origen natural o sintético que han mostrado importantes actividades biológicas, resaltando como agentes antibacterianos, antifúngicos, antimaláricos y anticancerígenos. En el presente trabajo se reportan los resultados de la síntesis utilizando diferentes métodos como la síntesis a temperatura ambiente (STA), síntesis por calentamiento convencional (SCC) y síntesis asistida por ultrasonido (SAU) de los derivados 2-(amino)-1,4-naftoquinona. Se realizó su caracterización por espectroscopía de infrarrojo. Además se determinó su capacidad como agentes antibacterianos frente a las cepas proteus sp. y Enterococcus faecalis. La mayor actividad lo mostró el derivado 2-bencilamino-1,4-naftoquinona.
Palabras Clave: 1,4-naftoquinona, agente antibacteriano, ultrasonido.
Abstract
Naphthoquinones are compounds of natural or synthetic origin which have shown important biological activities, as antibacterial, antifungal, antimalarial and anticancer agents. This paper reports the 2-(amine)-1,4-naphthoquinone synthesis using different methods such as the room temperature synthesis (RTS), conventional heating synthesis (CCS) and ultrasound-assisted synthesis (UAS). Characterization was performed by infrared spectroscopy. in addition, antibacterial capacity was also determined against proteus sp. and Enterococcus faecalis strains. The 2-benzylamine-1,4-naphthoquinone derivative showed the highest activity.
Key Words: 1,4-naphthoquinone, antibacterial agent, ultrasound.
Introducción
Las quinonas son compuestos de origen natural, que han mostrado interesantes propiedades biológicas[1], de las cuales derivan las 1,4-naftoquinonas naturales I_|y sintéticas. Se ha descrito a las naftoquinonas naturales y sus derivados sintéticos como agentes con actividad antibacteriana[2-5], anticancerígena[6-10] y que presentan respuesta antimalárica[9,11]. Algunas naftoquinonas han sido empleadas en cosmética como colorantes naturales, un ejemplo es la lawsona (2-hidroxi-1,4-naftoquinona), también con actividad fungicida, ésta se encuentra presente en las hojas de la alheña o henna (Lawsonia inermis L., familia Lythraceae), se fija a los grupos tiólicos de la queratina capilar proporcionándole un color rojo-anaranjado[2].
Se han examinado compuestos con estructura naftoquinona con propiedades como antifúngicos y estructura aromática policíclica presentes en bacterias y eucariotas, a menudo implicados en el transporte de electrones, siendo productos naturales de defensa en la planta; también han sido utilizados como antibacterianos de amplio espectro y están siendo investigadas como agentes contra el cáncer[6-10].
Las naftoquinonas, en especial compuestos amino y heterocíclicos se han empleado como intermediarios sintéticos para la construcción de numerosos compuestos con estructura más compleja[12]. Además, los compuestos 2-(amino)-1,4-naftoquinona y su reacción con compuestos carbonílicos, mediante la reacción de oxidación por radicales libres promovida por acetato de manganeso (III), proveen una forma de síntesis de derivados heterocíclicos indólicos interesantes[13,14].
Los derivados de 1,4-naftoquinona representan compuestos con diferentes actividades, una de las más recientes es como agentes citotóxicos en el estudio de cáncer[15], además de sus múltiples usos debido a sus interesantes propiedades electrónicas[16-18].
En la síntesis de nuevos compuestos se busca que sean más amigables con el medio ambiente por medio de la "química verde", conocida también como la "química ambientalmente benigna" o "química limpia", en la cual se plantean alternativas para la prevención de contaminación y hacer frente al problema generado por las industrias químicas[19]. En el ultrasonido, la formación y rendimiento de los compuestos se ve aumentada de manera considerable. Ejemplo de ello, es en la preparación de compuestos Al-orgánicos con alquilhaluros poco activos, los complejos de sodio y naftalina, benzoquinolina y otros compuestos aromáticos[20]. Otro ejemplo son los derivados 1,3,5-triaril-2-pirazolinas por medio de la reacción de chalconas y clorhidrato de fenilhidrazina, en donde los rendimientos son mayores (83-96%) a los encontrados con metodología sin uso de ultrasonido[21].
Hoy en día es indispensable tener nuevas moléculas en contra de enfermedades causadas por microorganismos, ya que existe una resistencia a los fármacos, en especial la farmacorresistencia bacteriana[22-24]. Debido a esta necesidad latente de nuevas moléculas como fármacos potenciales, en este artículo se reporta la obtención de amino derivados de 1,4-naftoquinona utilizando el ultrasonido como una fuente de activación no convencional, comparado con otras metodologías convencionales reportadas en la literatura, como la síntesis a temperatura ambiente y calentamiento a reflujo de solvente. Posteriormente se realizó la evaluación antibacteriana preliminar de cada uno de los compuestos preparados. Esta propuesta resulta beneficiosa debido a que se involucran fuentes alternativas de activación, como lo es el ultrasonido, además de emplear solventes, menos tóxicos.
Materiales y métodos
Síntesis química
Los reactivos utilizados fueron la hexilamina 99%, CeCl3.7H2O 99%, pentilamina 99%, bencilamina 99% y 1,4-naftoquinona 97%, los cuales se adquirieron de Sigma-Aldrich. Los solventes metanol 99.9%, cloroformo 99.9%, acetato de etilo 99.8%, cloruro de metileno 99.9%, éter etílico 99.9%, hexano 99.7%, benceno 99.7%, tolueno 99.7% se adquirieron de Fermont. El etanol 99.9% grado solvente de CTR-scientific y THF 99.0% grado analítico adquirido de Química Analítica S.A. de C.V.; todos los reactivos y solventes se utilizaron sin previa purificación. Para las reacciones desarrolladas bajo radiación ultrasónica, se empleó un baño de ultrasonido marca Branson 5510, con temperatura programable. La caracterización por infrarrojo se realizó en un espectrofotómetro FT-IR PerkinElmer con dispositivo de ATR GX00, los espectros se obtuvieron con 10 barridos a temperatura ambiente. Los espectros de ultravioleta-visible se desarrollaron en un espectrofotómetro marca Perkin Elmer modelo Lambda 25, se realizaron a temperatura ambiente utilizando metanol como solvente. Las cromatografías en capa fina (TLC) se realizaron en cromatoplacas de aluminio con capa de sílica F254, éstas se revelaron bajo lámpara de Uv-vis Spectroline CM-10.
La preparación de los derivados 2-(amino)-1,4-naftoquinona se realizó por reacción de la 1,4-naftoquinona y tres diferentes aminas primarias: pentilamina, hexilamina y bencilamina. Se utilizaron tres diferentes métodos, síntesis a temperatura ambiente (STA), síntesis a calentamiento convencional (SCC) y síntesis asistida por ultrasonido (SAU), ésta considerada como una fuente alternativa de reacción.
Síntesis a temperatura ambiente (STA)
En un matraz balón se disolvió 1,4-naftoquinona (5 mmol) en 50 mL de metanol, se añadió el catalizador CeCl3.7H2O (0.1 mmol). La mezcla de reacción se dejó en agitación por 30 min. Después se le adicionó la amina (5 mmol) correspondiente (pentilamina, hexilamina o bencilamina). Se dejó en agitación moderada por 7 días, protegida de la luz a una temperatura ambiente promedio de 30 °C. La reacción se monitoreo por TLC. Concluidos los siete días de reacción, se filtró el sólido obtenido y se secó bajo presión reducida.
Síntesis por calentamiento convencional (SCC)
Se montó un sistema de reacción para reflujo, se mezclaron en 50 mL de metanol, 5 mmol de 1,4-naftoquinona, 0.1 mmol de CeCl3.7H2O, se dejó en agitación por 30 min, después se le adicionó 5 mmol de la amina correspondiente (pentilamina, hexilamina o bencilamina). Se procedió a calentar dejándose a reflujo de metanol por una hora. Terminado el tiempo se dejó enfriar el sistema a temperatura ambiente y se agitó toda la noche. El sólido formado se recuperó por filtración y se secó bajo presión reducida.
Síntesis asistida por ultrasonido (SAU)
En un matraz balón se añadieron 5 mmol de 1,4-naftoquinona y 0.1 mmol de CeCl3.7H2O se dejaron en agitación por 30 min, utilizando como solvente metanol. Posteriormente se le agregó la amina correspondiente (pentilamina, hexilamina y bencilamina), colocándose la mezcla de reacción en el baño de ultrasonido por 5 horas. El progreso de la reacción se monitoreó por TLC. Terminado el tiempo de reacción, se dejó en agitación por 24 h. El sólido formado se recuperó por filtración y se secó bajo presión reducida.
Ensayo biológico
Determinación de la actividad antibacteriana
Una vez sintetizados los derivados 2-pentilamino-1,4-naftoquinona, 2-hexilamino-1,4-naftoquinona y 2-bencilamino-1,4-naftoquinona, se determinó su actividad antibacteriana contra la cepa Proteus sp. y Enterococcus faecalis con número de identificación ATCC 29212. El ensayo consistió en determinar la concentración mínima inhibitoria (CMI) en μg/mL de los 3 compuestos sintetizados, utilizando la técnica de microdilución en placa de 96 pozos.
Propagación bacteriana
Para el ensayo de determinación de la CMI, se utilizaron cultivos bacterianos no mayores de 24 hrs., para lo cual, la propagación bacteriana se llevó a cabo en una serie de tubos de cultivo (16x150 mm) con tapón de rosca. En cada tubo se colocaron 8 mL de caldo Müller Hinton (MH, BDBixon, preparado bajo las condiciones del fabricante) se esterilizaron por calor húmedo a 121 °C durante 30 min. En condiciones estériles, bajo campana de flujo laminar, y con el caldo de cultivo templado, se tomó una asada del cultivo anterior de cada una de las cepas originales empleadas y se inocularon los tubos correspondientes con el caldo. Posteriormente se llevaron a incubar a una temperatura de 37 °C durante 24 h.
Determinación de la concentración mínima inhibitoria
El método utilizado fue el de microdilución en placa, para el cual se requirió de placas con 96 pozos tipo "U". El primer pozo correspondió al control negativo de crecimiento bacteriano, al cual se añadió un volumen de 50 μL del compuesto a una concentración de 1000 μg/mL sin añadir caldo de cultivo MH. A todos los pozos a partir del pozo 2 se les agregó 50 μL de caldo MH. Por lo que el segundo pozo contenía 50 (μg/mL de caldo MH y 50 μg/mL de la solución del compuesto (1000 μg/mL) a determinar. Posteriormente se realizaron diluciones 1:2 seriadas a partir del segundo y así sucesivamente hasta el pozo 11. En el pozo 12 se colocó el control positivo de crecimiento del microorganismo, teniendo solamente la suspensión bacteriana y caldo de cultivo MH.
Una vez que se llenaron los pozos con una mezcla de medio de cultivo MH y de la solución a diferentes concentraciones de cada compuesto, se realizó la adición de 50 jL de la suspensión bacteriana en todos los pozos. La solución bacteriana se estandarizó con el reactivo de Macfarland 0.5 correspondiendo a una concentración de 1.2 x de 108 UFC/mL, diluyendo con buffer de fosfatos para tener una concentración de 105 UFC/mL. Las placas se incubaron a 37 °C por un tiempo de 24 h. Transcurrido el tiempo de incubación, las placas se leyeron, y se determinó la concentración a la cual ya no existió crecimiento bacteriano, lo cual se observó por ausencia de turbidez en el pozo y se tomó esta CMI, y se reportó en jg/mL. Se realizó el ensayo para cada compuesto por duplicado, determinando además la CMI del blanco del solvente utilizado (DMSO).
Resultados y Discusión
La 1,4-naftoquinona es un pigmento natural que por sí mismo representa una estructura que muestra actividades biológicas interesantes. Debido a ello, se han propuesto diversos derivados con el objeto de ampliar y potenciar las propiedades biológicas o bien disminuir efectos no deseables. Particularmente, se tiene reporte en la literatura que los derivados con sustitución en el carbono 2 por aminas han mostrado importantes actividades como antimaláricos[25], antibacterianos[7], antiparasitarios[25] y anticancerígenos[13].
Además, se ha reportado que la síntesis de amino derivados de la 1,4-naftoquinona por reacción de la 1,4-naftoquinona y aminas primarias alifáticas provee muy bajos rendimientos o trazas de los mismos. Cabe mencionar que los derivados 2-(amino)-1,4-naftoquinona son importantes intermediarios en la síntesis de compuestos con estructura benzo[f]indol-4,9-diona[26]. En la Figura 1 se muestra el esquema de reacción estudiado en este trabajo.

El progreso de la reacción en cada una de las metodologías (STA, SCC y SAU) se monitoreo por TLC, cuando en la cromatoplaca se observó la presencia de una nueva mancha con diferente Rf a la de la materia prima, la reacción se detuvo, se aisló el producto por filtración, determinando su punto de fusión, patrón de solubilidad y se caracterizó por espectroscopía de infrarrojo y ultravioleta-visible.
2-pentilamina-1,4-naftoquinona
La 2-pentilamina-1,4-naftoquinona (2PANQ), se obtuvo como un sólido color rojo con un punto de fusión de 212°C. Presentó las siguientes bandas principales de absorción en el infrarrojo: 3331 cm-1 correspondiente a la vibración de estiramiento del enlace N-H de una amina secundaria, 1677 cm-1 asignado a la vibración de C=O, 1591 cm-1 al estiramiento C=C aromático, 1495 cm-1 correspondiente a la vibración de flexión de N-H, 1257 cm-1 de la vibración de estiramiento C-N, 813y 727 cm-1 a la flexión C-H aromático. En la Figura 2 se muestran los espectros de IR de la pentilamina (materia prima) y el derivado sintetizado (2PANQ). Realizando el análisis comparativo entre los dos espectros, se observa que el cambio más importante en las bandas de absorción se presenta en la región de la vibración de estiramiento para el enlace N-H; para la pentilamina (la cual es una amina primaria) se encuentran dos bandas en 3363 y 3287 cm-1, referidas al estiramiento simétrico y asimétrico de la vibración del enlace N-H. En el caso del producto sólo se observa una banda de absorción en 3331 cm-1, correspondiente a la vibración de estiramiento del enlace N-H de una amina secundaria. Esta observación, nos da un buen indicio de la formación de enlace entre la amina y el anillo de la 1,4-naftoquinona.
2-hexilamina-1,4-naftoquinona
La 2-hexilamina-1,4-naftoquinona (2HANQ), se obtuvo como un sólido color rojo con un punto de fusión de 215°C. Las bandas de absorción en el infrarrojo características son: 3336 cm-1 correspondiente al estiramiento del enlace N-H, 2954 cm-1 del estiramiento C-H sp3, 1634 cm-1 de la vibración de estiramiento del enlace C=O, 1592 cm-1 asignado a la vibración de estiramiento de C=C aromático, 1508 cm-1 de la flexión N-H, 1259 cm-1 de la vibración de estiramiento C-N y 813 cm-1 de la flexión C-H. En la Figura 3 se muestra la comparación de dos espectros, el primero es el espectro del compuesto 2HANQ y el segundo es el correspondiente a la hexilamina (materia prima). El cambio más importante en el infrarrojo es en la región correspondiente a la vibración de estiramiento para el enlace N-H; para la amina primaria (hexilamina) se encuentran dos picos en 3400 y 3287 cm-1, mientras que para la 2HANQ sólo se observa una banda de absorción en 3336 cm-1, correspondiente a una amina secundaria, lo que indica la formación de enlace entre la amina y el anillo de la 1,4-naftoquinona.
2-bencilamina-1,4-naftoquinona
La 2-bencilamina-1,4-naftoquinona (2BANQ), se obtuvo como un sólido color rojo con un punto de fusión de 214 °C. Las bandas de absorción en el infrarrojo características son: 3330 cm-1 correspondiente al estiramiento del enlace N-H, 2928 y 2866 cm-1 de la vibración de estiramiento de C-H sp3, 1671 cm"1 de la vibración de estiramiento C=O, 1600 cm-1 correspondiente a la vibración de estiramiento C=C aromático, 1514 cm-1 asignada a la vibración de flexión de N-H, 1257 cm-1 de la vibración de estiramiento C-N, y 723 cm-1 de la flexión C-H.
Los compuestos se caracterizaron por espectroscopia de UV-vis, teniendo una coloración rojo-naranja en solución de metanol a temperatura ambiente. Los espectros mostraron dos bandas de absorción electrónica en las regiones de longitud de onda máxima (λmax) entre 269-279 nm y 329-368 nm, debido a la transición electrónica π→π* asociada a la estructura de la naftoquinona, una tercera banda de absorción muy débil y ancha en la región de λmax345-350 nm asociada a la transferencia de carga entre la amina y la 1,4-naftoquinona y por la transición η→π π*. En la Tabla I se muestran las absorciones de 2PANQ, 2HANQ y 2BANQ.

En este estudio se utilizaron tres diferentes métodos en la obtención de los derivados, la síntesis a temperatura ambiente (STA), síntesis a calentamiento convencional (SCC) y síntesis asistida por ultrasonido (SAU). Los rendimientos de cada producto obtenido por los diferentes métodos se muestran en la Tabla II.

Los rendimientos encontrados en el derivado 2PANQ van de 20% para STA y SCC y 35% para SAU, en el caso de la 2HANQ se obtuvo con rendimientos bajos para STA y SCC con 35 y 50% respectivamente, en comparación con el ultrasonido que se obtuvo en 70%, la síntesis a temperatura ambiente y calentamiento convencional resultaron relativamente bajas en comparación del ultrasonido. Para el derivado 2BANQ, se obtuvieron los mejores rendimientos con 35% y 70% para la STA y SCC, respectivamente, al igual que los rendimientos de los otros dos derivados, la mejor metodología en la cual se obtuvo el mejor rendimiento es el ultrasonido con un 88%.
De acuerdo a los resultados mostrados para la preparación de los derivados 2PANQ, 2HANQ y 2BANQ, se puede observar que en los tres diferentes métodos empleados (STA, SCC y SAU), al usar el ultrasonido como fuente de activación aumenta considerablemente el rendimiento. La aceleración de reacciones químicas usando el ultrasonido se propone como consecuencia de la energía aplicada y el fenómeno de cavitación, en donde las burbujas que tienden a romperse generan puntos de alta presión y temperaturas, además de enormes turbulencias que son transmitidas a la mezcla de reacción. Estos resultados, demostraron el uso potencial de la activación por medio de ultrasonido en este tipo de reacciones de adición por aminas primarias al anillo de la 1,4-naftoquinona, mostrando mejores rendimientos en comparación con métodos convencionales reportados en la literatura como la agitación a temperatura ambiente, la cual implica un tiempo de reacción largo (7 días), o bien, el calentamiento a reflujo del solvente mediante una parrilla.
Cabe mencionar que un parámetro importante, es la temperatura, lo cual se traduce tanto en su rendimiento como en la pureza del producto. Las reacciones realizadas con el ultrasonido se desarrollaron a temperatura ambiente, ya que a temperaturas mayores de 40 °C el resultado fue la disminución del producto deseado. Otro parámetro a considerar es la agitación, ya que los mejores resultados en los métodos de STA y SCC, se dieron cuando la agitación se hacía moderadamente, ya que si ésta era interrumpida o aumentaba a una agitación intensa, en el crudo de reacción se observaban 2 señales más en la TLC. Los bajos rendimientos de reacción observados en los métodos de STA y SCC, se pueden explicar debido a la presencia de diferentes centros electrofílicos de comparable reactividad en el anillo de la 1,4-naftoquinona, la cual puede producir además del compuesto de adición 1,4, el producto de adición 1,2. Asimismo, debido a las propiedades redox del anillo 1,4-naftoquinona, favorece la formación del 1,4-naftodiol. Cabe mencionar que estos derivados no fueron separados, encontrándose solubles en el metanol de la fracción filtrada.
Se utilizó como catalizador ácido de Lewis el CeCl3.7H2O. El catalizador se adicionó a la solución de la 1,4-naftoquinona (30 min) previo a la adición de la amina correspondiente. En ausencia del catalizador, no se forman los productos deseados.
El mecanismo de reacción se muestra en la Figura 4. En el primer paso se propone que la 1,4-naftoquinona es activada por el catalizador ácido de Lewis formando un complejo orgánico, considerando que en solución de metanol y debido al bajo potencial redox entre Ce4+/Ce3+ (1.7 V), se encuentra predominantemente la forma oxidada Ce4+. En el paso siguiente por transferencia de carga se activa la posición dos del anillo de la 1,4-naftoquinona con una carga positiva, debido a la resonancia presente en la estructura, de esta manera, se aumenta la naturaleza electrofilica del anillo y es posible el ataque por un nucleófilo. Asó en el siguiente paso la amina (pentilamina, hexilamina o bencilamina) ataca la posición 2 del anillo. Finalmente, en condiciones de metanol (solvente) se produce una reducción de ion Ce+3 y el compuesto oxidado 2-(amino)-1,4-naftoquinona18.

En la Tabla III se muestra el patrón de solubilidad de cada uno de los compuestos 2PANQ, 2HANQ y 2BANQ, determinado a temperatura ambiente. En una placa excavada de porcelana se puso 0.01 g del compuesto y se adicionó 1 mL de solvente. Se presentó menor solubilidad en solventes con naturaleza no polar como hexano y tolueno, aumentando la solubilidad en solventes con polaridad intermedia como cloruro de metileno y cloroformo, disminuyendo la solubilidad en solventes de mayor polaridad como etanol y metanol, siendo insolubles en agua.

Determinación de la concentración mínima inhibitoria
Se realizó la CMI mediante el ensayo de inhibición por microdilución en placa de multipozos, reportando la CMI como la concentración en la cual no se observó crecimiento bacteriano. La Tabla IV muestra los resultados obtenidos de la susceptibilidad antibacteriana de los compuestos 2PANQ, 2HANQ y 2BANQ contra Proteus sp. y E. faecalis.
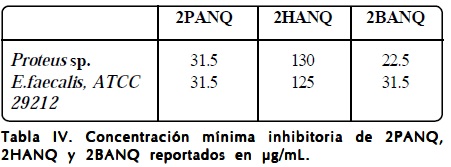
Los resultados demuestran que el derivado 2HANQ presenta la actividad antibacteriana menor debido a una CMI de 130 μg/ mL para Proteus sp. y 125 μg/mL para E. faecalis, sin embargo se muestra cierta selectividad en la inhibición. La actividad antibacteriana se ve aumentada con un CMI de 31.5 μg/mL para el derivado 2PANQ, no obstante la inhibición se mostró tanto para la bacteria Gram negativa como Gram positiva. Los mejores resultados de actividad antibacteriana lo mostró el compuesto 2BANQ con una CMI de 22.5 y 31.5 para Proteus sp. y E. faecalis, respectivamente. Por lo que podemos decir es que la presencia de un anillo aromático enlazado al NH permite que haya un mejor efecto. Se ha descrito en la literatura que los derivados de 1,4-naftoquinona actúan como aceptores y donadores de electrones, mediando la generación de radicales libres de oxigeno en las especies bacterianas1271. A la concentración empleada el solvente DMSO no causó inhibición bacteriana.
Conclusiones
Se sintetizaron los derivados 2-pentilamina-1,4-naftoquinona, 2-hexilamina-1,4-naftoquinona y 2-benzilamina-1,4- naftoquinona, utilizando diferentes métodos de activación como la STA, SCC y SAU. Los rendimientos de reacción más altos se obtuvieron utilizando como fuente de activación no convencional el ultrasonido, lo que representa una alternativa viable en la síntesis de derivados 2-(amino)-1,4-naftoquinona, en especial con aminas primarias.
De manera preliminar se evaluó la actividad antibacteriana de los derivados preparados contra una bacteria Gram positiva y una Gram negativa. El mejor compuesto antibacteriano fue 2-bencilamina-1,4-naftoquinona obteniendo una CMI de 22.5 y 31.5 μg/mL para Proteus sp. y E. faecalis, respectivamente. Este resultado, requiere de desarrollar el ensayo con diferentes cepas bacterianas, que nos permita determinar el uso potencial de este tipo de derivados como agentes antibacterianos.
Agradecimientos
Se agradece el apoyo financiero interno de la Facultad de Ciencias Químicas de la Universidad Autónoma de Coahuila.
Referencias
1. Lana, E., Carazza, F. & Takahashi, J. Antibacterial evaluation of 1,4-benzoquinone derivatives. J. Agric. Food Chem. 54(6), 2053-2056 (2006). [ Links ]
2. Ferreira, D.T. et al. Antimicrobial activity and chemical investigation of Brazilian Drosera. Memórias do Intituto Oswaldo Cruz, Rio de Janeiro 99, 753-755 (2004). [ Links ]
3. Tran, T., Saheba, E. & Arcerio, A. Quinones as antimycobacterial agents. Bioorg. Med. Chem. 12, 4809-4813 (2004). [ Links ]
4. Da Silva, J.L., Mesquita, A.R. & Ximenes, E.A. In vitro synergic of β-lapachone and isoniazide on the growth of Mycobacterium fortuitum and Mycobacterium smegmatis. Mem Inst Oswaldo Cruz 104(4), 580-582 (2009). [ Links ]
5. López L., Ll.I. et al. Las naftoquinonas: más que pigmentos naturales. Revista Mexicana de Ciencias Farmacéuticas 42(1), 6-17 (2011). [ Links ]
6. Chang, H.X. et al. Design of antineoplastic agents based on the "2- phenylnaphthalene-type" structural pattern. Synthesis and biological activity of 2-chloro-3-(substituted phenoxy)-1,4-naphthoquinones and related 5,8-dihydroxy-1,4-naphthoquinones. J. Med. Chem. 42(3), 405-408 (1999). [ Links ]
7. Bipul, R., Acharya, B.R., Bhattacharyya, B. & Chakrabarti, G. The natural naphthoquinone Plumbagin exhibits antiproliferative activity and disrupts the microtubule network through tubulin binding. Biochem. 47(30), 7838-7845 (2008). [ Links ]
8. Kumar, S. et al. Indoleamine 2,3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors. J. Med. Chem. 51(6), 1706-1718 (2008). [ Links ]
9. Kongkathip, N. et al. Transforming Rhinacanthin analogues from potent anticancer agents into potent antimalarial agents. J. Med. Chem. 53(3), 1211-1221 (2010). [ Links ]
10. Eufranio, N., Da Silva, J. & De Deus, F.C. 3-Arylamino and 3-alkoxy-nor-β-lapachone derivatives: synthesis and cytotoxicity against cancer cell lines. J. Med. Chem. 53, 504-508 (2010). [ Links ]
11. Gaitán, R. et al. Síntesis de análogos furonaftoquinónicos con posible actividad antimalárica contra Plasmodium falciparum. Revista Cubana de Química 19, 64-66, (2007). [ Links ]
12. Malamidou, E., Spyroudis, S. & Tsanakopoulou, M. Studies on the reactivity of aryliodonium ylides of 2-hydroxy-1,4-naphthoquinone: reactions with amines. J. Org. Chem. 68(14), 5627-5631 (2003). [ Links ]
13. Jiang, M. & Chuang, Ch. Manganese (III) acetate initiated oxidative free radical reactions between 2-amino-1,4-naphthoquinones and β-dicarbonyl compounds. J. Org. Chem. 65, 5409-5412 (2000). [ Links ]
14. Wu, Y., Chuang, Ch. & Lin, P. Oxidative free radical reactions between 2-amino-1,4-naphthoquinones and carbonyl compounds. Tetrahedron 57, 5543-5549 (2001). [ Links ]
15. Pérez, E. & Díaz, R. Synthesis and pharmacophore modeling of naphthoquinone derivatives with cytotoxic activity in human promyelocytic leukemia HL-60 cell line. J. Med. Chem. 50, 696-706 (2007). [ Links ]
16. Wang, Y. Bulky DNA lesions induced by reactive oxygen species. Chem. Res. Toxicol. 21, 276-281 (2008). [ Links ]
17. Jiménez-Alonso, S. et al. Electronic and cytotoxic properties of 2-amino-naphtho[2,3-b]furan-4,9-diones. J. Org. Chem. 76(6), 1634-1643 (2011). [ Links ]
18. Leyva, E., López, Ll. I., Loredo-Carrillo, S.E., Rodríguez-Kessler, M. & Montes-Rojas, A. Synthesis, spectral and electrochemical characterization of novel 2-(fluoroanilino)-1,4-naphthoquinones. J. Fluorine Chem. 132(2), 94-101 (2011). [ Links ]
19. Anastas, P.T. & Warner, J.C. Green Chemistry, theory and practice (Oxford University Press, New York, 1998). 152 págs. [ Links ]
20. Kharisov, I.B. & Ortiz, U. Uso del ultrasonido en procesos químicos. Ingenierías 2, 13-21 (1999). [ Links ]
21. Li, J.-T., Zhang, X.-H. & Lin, Z.-P. An improved synthesis of 1,3,5-triaryl-2-pyrazolines in acetic acid aqueous solution under ultrasound irradiation. Beilstein J. Org. Chem. 3(13) (2007). [ Links ]
22. Becerra, G., Plascencia, A., Luévanos, A., Domínguez, M. & Hernández, I. Mecanismo de resistencia a antimicrobianos en bacterias. Enf. Inf. Microbiol. 29(2), 70-76 (2009). [ Links ]
23. Javier-Zepeda, C.A. Resistencia de las bacterias a los antibióticos, Revista Médica Hondureña 66(2), 88-92 (1998). [ Links ]
24. Rodríguez, E., Gaitán, R., Méndez, D., Martelo, J. & Zambrano, R. Análogos de quinonas naturales con actividad antibacteriana. Scientia et Technica 33, 281-283 (2007). [ Links ]
25. Salmon-Chemin, L. et al. 2- and 3-Substituted 1,4-naphthoquinone derivatives as subversive substrates oftrypanothione reductase and lipoamide dehydrogenase from Trypanosoma cruzi: synthesis and correlation between redox cycling activities and in vitro cytotoxicity. J. Med. Chem. 44(4), 548-565 (2001). [ Links ]
26. Claessens, S., Jacobs, J., Van Aeken, S., Abbaspour Tehrani, K. & De Kimpe, N. Synthesis of benzo[f]isoindole-4, 9-diones. Them J. of Org. Chem. 73(19), 7555-7559 (2008). [ Links ]
27. Haraguchi, H., Yokoyama, K., Oike, S., Ito, M. & Nozaki, H. Respiratory stimulation and generation of superoxide radicals in Pseudomonas aeruginosa by fungal naphthoquinones. Arch Microbiol. 167(1), 6-10 (1997). [ Links ]
Información sobre los autores
Marlene Lariza Andrade-Guel
Marlene Lariza Andrade-Guel es estudiante de la Maestría en Ciencia y Tecnología Química de la Facultad de Ciencias Químicas perteneciente a la Universidad Autónoma de Coahuila. Actualmente, está realizando su tesis de maestría titulada "Estudio de reacciones superficiales empleando MWCM'S funcionalizados y sistemas aromáticos".
Es egresada de la Universidad Autónoma de Coahuila como Químico Farmacobiólogo en el año 2011, con el trabajo de tesis: "estudio sintético de devidados 2-amino- 1,4-naftoquinona y benzo [b]carbazol- 6,11 -diona, mediente diversas metodologías". Trabajo que ha sido presentado en congresos de carácter tanto regional, nacional, como internacional.
Lluvia Itzel López-López
Lluvia Itzel López-López estudió la licenciatura en Químico Farmacobiólogo en la Facultad de Ciencias Químicas de la Universidad Autónoma de San Luis Potosí. En la misma institución desarrolló sus estudios de posgrado graduándose en el 2008 como Doctor en Ciencias Químicas con el tema de tesis: "Síntesis y evaluación biológica de derivados de 1,4-naftodiona". De la cual derivan diversas ponencias en congresos regionales, nacionales e internacionales. Se incorporó como Profesora-investigadora en la Facultad de Ciencias Químicas Ciencias Químicas a partir del 2008 a la fecha en la Universidad Autónoma de Coahuila, ha dirigido dos tesis de licenciatura, una de maestría y están en proceso dos tesis de licenciatura, una de maestría y dos de doctorado. Pertenece al Cuerpo Académico de Química Orgánica con investigaciones sobre la síntesis de compuestos con actividad biológica utilizando los postulados de los postulados de la Química Verda. Cuenta con publicaciones indexadas a nivel internacional y con arbitraje. Actualmente tiene el perfil PROMEP y el reconocimiento como Candidato al SNI a partir de enero del 2012.
Aidé Sáenz-Galindo
Aidé Sáenz-Galindo estudió la licenciatura en Química en la Facultad de Ciencias Químicas en la ciudad de Saltillo, Coah., posteriormente realizó sus estudios de doctorado en el Centro de Investigación en Química Aplicada (CIQA), en el programa de Doctorado Directo en Ciencia y Tecnología de los Polímeros. Donde estudio la química del rutenio para la obtención de catalizadores del tipo organometálicos, con actividad en Polimerización Radicálica Controlada por Transferencia de Átomo (ATRP) empleando como monómeros vinílicos: estireno, derivados del estireno con grupos activantes y desactivantes, metilmetacrilato y metacrilato de glicidilo. Realizó una estancia posdoctorado en el CIQA en el departamento de Materiales Avanzados, desarrollando el proyecto de funcionalización de nanotubos de carbono de pared múltiple (MWCNT's), empleando diferentes grupos funcionales. Para después iniciar como Profesora-Investigadora en la Facultad de Ciencias Químicas de la Universidad Autónoma de Coahuila, donde ha dirigido tres tesis de licenciatura, una tesis de maestría y actualmente dirige dos tesis de doctorado. Forma parte del Cuerpo Académico de Química Orgánica trabajando bajo la línea de generación y aplicación del conocimiento "Química Verde en Síntesis Orgánica". Todos los proyectos de investigación donde participa como responsable o colaboradora están sujetos a la Química Verde. Cuenta con publicaciones en revistas indexadas de reconocimiento internacional, así como la participación en congresos a nivel local, nacional e internacional. Actualmente cuenta con el reconocimiento al perfil PROMEP y pertenece al SNI, nivel "C", desde el año 2008 a la fecha.














