Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.14 no.1 Ciudad de México jun. 2011
Artículo original
Teoría de la regioquímica en la nitración con nitrato de acetilo y con ácido nítrico
Regiochemistry theory in acetyl nitrate and nitric acid nitrations
Francisco Sánchez-Viesca*, Ma. Reina Gómez y José Ma. García
Facultad de Química, Departamento de Química Orgánica, División de Estudios de Posgrado, UNAM. Ciudad Universitaria, C.P. 04510. *México, D.F. E-mail: franviesca@yahoo.com
Artículo recibido el 17 de marzo de 2011;
Aceptado el 24 de mayo de 2011.
Resumen
Aun cuando las estructuras de los productos de nitración obtenidos con diferentes reactivos son bien conocidas, no se tiene una teoría completa de la regioquímica. Aunque los grupos funcionales han sido debidamente clasificados en cuanto a la orientación que ejercen en las reacciones de sustitución electrofílica, no se ha explicado en diferentes casos la preponderancia existente en la formación de uno de los isómeros posibles.
Por otra parte, es conocida la preferente orientación a la posición orto cuando se emplea nitrato de acetilo como agente nitrante. Sin embargo, no se ha dado una explicación causal de este fenómeno.
En la presente comunicación se da una teoría de la regioquímica en la nitración de la acetanilida, tanto al emplear mezcla sulfonítrica como cuando se usa nitrato de acetilo. La teoría propuesta se confirmó al comparar con los resultados experimentales descritos, en este mismo tipo de reacciones, al emplear tanto tolueno como anisol.
Palabras Clave: Mecanismos de reacción, nitración, nitrato de acetilo, regioquímica, teoría química.
Abstract
Although the structures of the reaction products obtained with different nitrating reagents are well known, a complete theory regarding the regiochemistry is missing. Even though the functional groups have been grouped according the exerted orientation in electrophilic substitution reactions, in many cases there is no explanation about the preponderance of one of the expected isomers.
On the other hand, the preferent ortho orientation of acetyl nitrate in nitration reactions is well known. However, a causal explanation of this phenomenon has not been provided.
In this communication a regiochemistry theory in acetanilide nitration is presented, both when sulfonitric mixture or when acetyl nitrate are used. This theory was confirmed by comparison to the experimental results obtained when these reactions were run with toluene or with anisole.
Key words: Acetyl nitrate, chemical theory, nitration, reaction mechanisms, regiochemistry.
Introducción
El nitrato de acetilo, CH3CO-O-NO2, se obtiene al hacer reaccionar anhidrido acético con ácido nítrico1. Su composición y estructura es la de un anhidrido mixto, es decir, anhidrido acético-nítrico o acetonítrico. No solamente es un anhidrido correspondiente a 2 ácidos distintos, sino diferentes por su origen: uno orgánico y el otro inorgánico, lo cual lo hace un anhidrido doblemente mixto. Como se ve, la reacción de su formación es una metátesis, desplazando el ácido más fuerte, el nítrico, al más débil, el acético. Este último queda como disolvente. Se ha hecho hincapié en que el ácido nítrico es el reactivo que se va adicionando lentamente sobre exceso de anhidrido acético. De lo contrario, se forma una mezcla peligrosa, muy sensible al choque2. Tampoco se debe rebasar los 40° C durante la adición, ya que es potencialmente explosivo. Su punto de ebullición a presión reducida es de 295 K a 0.09 atm3,4.
Hay 2 formas de representar la estructura de este reactivo. Una fórmula emplea, además de las covalencias, una valencia de coordinación o valencia dativa, I. Es una estructura muy neutra. La otra, por el contrario, muestra un dipolo, II. A nuestro entender, esta última, aun cuando eléctricamente neutra, es de mayor utilidad al tratar de explicar la reactividad del compuesto y también la regioquímica. Nótese en ambas fórmulas el grupo funcional de anhidrido mixto -CO-O-NO-.
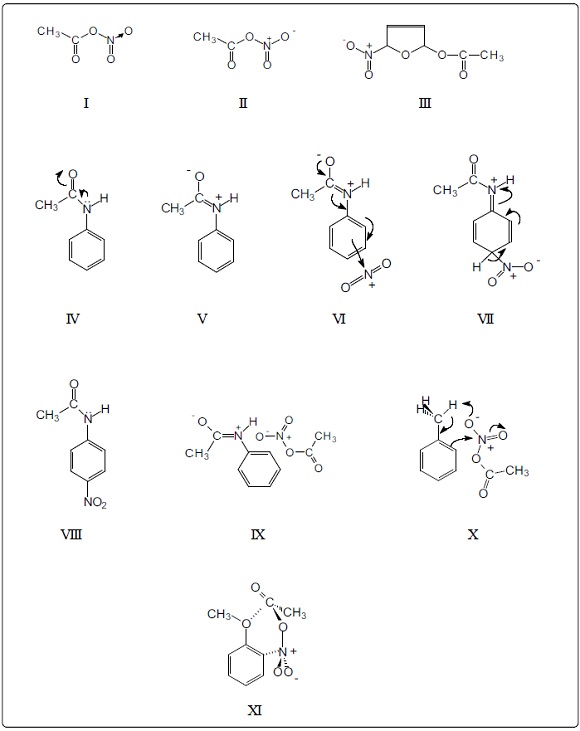
La molécula de nitrato de acetilo posee 2 grupos electrófilos: el carbonilo y el grupo nitro. La tendencia de polarización del primero va del carbono (grupo IV) al oxígeno (grupo VI). La doble ligadura -N=O tiene menor tendencia de polarización, del nitrógeno (grupo V) al oxígeno (grupo VI). Sin embargo, el dipolo adicional N+-O- contribuye decisivamente a que la molécula acepte electrones en el grupo nitro, en vez de en el carbonilo. Por lo anterior, este reactivo no introduce grupos nitrato y acetilo. Un ejemplo muy claro de la reactividad del nitrato de acetilo es la reacción con furano5-7 en la cual se forma 2-acetoxi-5-nitro-2,5-dihidrofurano, III, lo cual indica que ha reaccionado como acetato de nitronio. Si hay ionización previa a la reacción se aclarará al observar la reacción del nitrato de acetilo con acetanilida, como se verá más adelante. El que en el caso del furano no se obtenga directamente el producto de sustitución, el 2-nitrofurano, sino el compuesto de adición 1,4 al sistema diénico (aducto 1,4), se debe a la baja aromaticidad del anillo furánico, resultante de la poca disponibilidad electrónica del átomo de oxígeno para formar un sexteto electrónico de tipo aromático como ocurre en el caso del pirrol y mejor aún con el tiofeno, con heteroátomos menos electronegativos que el oxígeno, en este orden.
Parte teórica
Cuando la acetanilida o antifebrina8 se nitra con mezcla sulfonítrica se obtiene como producto prácticamente único (90 %) p-nitroacetanilida, incolora, y 10% del isómero orto. Puede usarse ácido acético como disolvente9,10 o bien, ácido sulfúrico11. Esta selectividad, la orientación a para, podría explicarse, de primer intento, que es debida al impedimento estérico existente en la posición orto, producido por el grupo acetamido. Sin embargo, cuando la acetanilida se nitra con nitrato de acetilo, se obtiene o-nitroacetanilida, amarilla, como producto principal y p-nitroacetanilida como producto secundario12-15. El nitrato de acetilo debe reaccionar sin formar previamente iones nitronio, ya que de ser así, se tendría la misma especie reactiva y se obtendría el mismo producto de reacción con este reactivo que con la mezcla sulfonítrica, lo cual no es el caso. Esto nos indica que el nitrato de acetilo debe reaccionar tal cual, sin disociación previa. Por tanto, si debe reaccionar la molécula íntegra de nitrato de acetilo, y si el compuesto principal es el orto-derivado, esto descarta que haya impedimento estérico en la nitración de la acetanilida con mezcla sulfonítrica. El grupo acetamido está curvado, como muestra el modelo molecular; esto causa impedimento estérico, pero en una sola posición orto, quedando libre la otra.
La reactividad de la acetanilida, tanto con ácido nítrico como con nitrato de acetilo, no ha sido explicada con anterioridad, por lo cual se presenta la teoría de la regioquímica en ambas reacciones. En primer término, se debe considerar la resonancia de amida en el anílido IV: debido al efecto electroatractor del carbonilo, se recorre el par libre del nitrógeno, pasando el nitrógeno de hibridación sp3 a hibridación sp2 en el ión dipolar formado, V. Esta resonancia es la causante de que una amida no reaccione como nucleófilo, como las aminas. Por tanto, no debe proponerse que el grupo acetamido done electrones a las posiciones orto y para con anterioridad a la acción de un electrófilo en el resto de la molécula. La resonancia debe ocurrir en la cadena alifática, sin alterar de antemano la aromaticidad del anillo, el cual es más estable. Podría pensarse que el nitrógeno positivo en el ión dipolar V fuera un grupo orientador a meta, como en las sales de amonio. Sin embargo, se debe tener en cuenta que solamente es una estructura resonante, la cual se neutraliza fácilmente, sin provocar atracción electrónica fuerte al sexteto electrónico del benceno. El ión nitronio, al acercarse al anillo bencénico, forma un complejo π en la doble ligadura más alejada al nitrógeno cuaternario, positivo, evitando la repulsión eléctrica entre cargas positivas, VI. Dicha repulsión es impedimento eléctrico para la reacción en orto. El corrimiento electrónico que se genera, VI, es del tipo push-pull, participando, en forma coordinada, el efecto electrodonador del enolato, activado por el grupo imonio, y el efecto electrocaptor del complejo π. Esto da origen a una estructura de semiquinona, con conjugación cruzada, VII. El ión nitronio pasa de una estructura lineal de 180° (nitrógeno con hibridación sp), a una estructura sp2 en el grupo nitro, con ángulos de 120°. La neutralización del grupo imonio, vía eliminación de un protón, da lugar a la recuperación de la aromaticidad. De esta manera queda explicada la formación de p-nitroacetanilida, VIII, en esta reacción.
Queda por explicar la regioquímica en la reacción del nitrato de acetilo con acetanilida; es decir, porqué el nitrato de acetilo reacciona en posición orto al grupo acetamido. Como se mencionó antes, el nitrato de acetilo debe reaccionar sin disociación previa. Por tanto, se debe postular la hipótesis de formación de un complejo 'reactivo-sustrato'. Esto se sustenta si se encuentra el tipo de unión entre estas moléculas. A este efecto, las atracciones eléctricas entre cargas positivas y negativas, existentes en la acetanilida polarizada y en el nitrato de acetilo, hacen el papel de pinzas, o quelas, capaces de formar un quelato. Esto explica satisfactoriamente el cambio regioquímico respecto a la reacción anterior. En el quelato mencionado hay 5 átomos a distancia de una ligadura, como se indica en la estructura IX y en la figura a color 1, en la cual se indica, con líneas punteadas, la aproximación del reactivo por la parte superior al plano del anillo bencénico. El desplazamiento de electrones va del enolato en la acetanilida hasta la posición orto y de ahí al nitrógeno positivo del nitrato de acetilo, dando lugar al producto mayoritario, la 2-nitroacetanilida. Dicho desplazamiento, debido a un impulso eléctrico, resulta configurativo. La o-nitroacetanilida, a diferencia del isómero en para, es un compuesto raro, caro16,17 y se envasa en frascos de 5 y 25 g.

Cuando no ocurre el acomodo electrostático antes señalado, el nitrato de acetilo puede formar un complejo π en las otras 2 dobles ligaduras. Sin embargo, el complejo formado en la ligadura C3-C4 puede recibir electrones provenientes del enolato, formándose la 4-nitroacetanilida como producto secundario. El complejo π formado entre los átomos C5-C6 no da lugar a un producto de reacción, ya que, esta doble ligadura no queda conjugada con el aporte electrónico de la cadena, ya esté neutra o en forma de dipolo.
La explicación de la orientación selectiva a para, en la nitración de la acetanilida con mezcla sulfonítrica, se sustenta al comparar los resultados obtenidos en la nitración del tolueno en las mismas condiciones. En el tolueno no hay estructura resonante de amida, y por tanto, presencia de un ión imonio que rija la regioquímica, orientando a para. Por esto, se obtienen cantidades importantes de los isómeros nitrados en orto y para (58 y 37 %), las cuales varían según el método experimental que se emplee18-20, 66% del isómero para si la nitración se lleva a cabo con puro ácido nítrico.
Por otra parte, la nitración del tolueno con nitrato de acetilo da 90% del orto-nitro derivado18,20. En este caso, operan las cargas eléctricas parciales en el metilo y la hiperconjugación o efecto Baker-Nathan21, como se indica en la fórmula X, corroborando la idea de una formación previa de un complejo σ 'reactivo-sustrato' que induce la reacción en orto. La figura a color 2, estructura 3D (stereo view), corresponde al intermediario en la formación del 2-nitrotolueno. Muestra un metileno exocíclico, resultante de la migración de un protón al oxígeno negativo del nitrato, y el carbono sp3 de la posición orto. Como puede observarse, el nitrato de acetilo se aproximó por un plano inferior al anillo aromático y se ha unido por abajo.
Otro caso que se ha considerado es la nitración del anisol. Con mezcla sulfonítrica se obtienen los isómeros orto y para, 35 y 65 %, respectivamente22, en tanto que con nitrato de acetilo la nitración ocurre en orto. En esta última reacción se postula la interacción del oxígeno etéreo con el carbonilo del anhidrido acetonítrico, XI, induciendo la nitración en la posición orto con 90% de rendimiento23. La estructura a color del intermediario, 3, muestra un ión oxonio conjugado con un anillo de ciclohexadieno, y la posición orto con un carbono sp3 en donde se ha fijado el reactivo.
Partiendo de la parte experimental, los razonamientos aducidos en esta comunicación permitieron deducir y presentar una adecuada teoría de la regioquímica observada en las 6 reacciones consideradas en este estudio.
Conclusiones
De lo expuesto anteriormente se puede concluir lo siguiente:
• La estructura dipolar resultante de la resonancia de amida en la acetanilida sirve para explicar la reactividad de este anílido, tanto con mezcla sulfonítrica como con nitrato de acetilo.
• El grupo acetamido no aporta electrones al anillo aromático sino hasta después que, al emplear mezcla sulfonítrica, el ión nitronio haya formado el complejo π más alejado a la cadena (complejo π orientado).
• El nitrato de acetilo, sin disociarse, forma un complejo precursor con la acetanilida mediante atracción electrostática entre átomos con cargas eléctricas. Esta oxifilia (oxyphilic interaction), resultante de interacción entre polos desiguales, es la causa de la orientación a orto, debido a que implica un corrimiento electrónico sólo hasta esta posición, dadas las estructuras que intervienen.
• Al nitrar tolueno con mezcla sulfonítrica se obtienen derivados mononitrados en orto y en para debido a la ausencia del ión imonio, existente en el compuesto anterior.
• Al hacer reaccionar tolueno con nitrato de acetilo, intervienen las cargas eléctricas parciales (δ) existentes en el metilo, siendo éste el sitio inicial de reacción. La posición orto se nitra mediante un mecanismo concertado de 6 miembros, interviniendo el efecto de hiperconjugación.
• Al emplear anisol y mezcla sulfonítrica, a diferencia de la acetanilida, se obtienen ambos isómeros nitrados por las razones antes expuestas. Con nitrato de acetilo es posible la formación de un complejo 'cadena-reactivo', de tipo electrostático, dando origen a la nitración en la posición orto.
• Como se ve, la teoría propuesta puede explicar satisfactoriamente la regioquímica observada en 6 reacciones de nitración diferentes.
Referencias
1. Fieser, L. F. & Fieser, M., Reagents for Organic Synthesis, p. 13 (J. Wiley, Nueva York, 1967). [ Links ]
2. UK Chemical Reaction Hazards Forum, http://www.crhf.org.uk/incident16.html. [ Links ]
3. Buckingham, J. & Donaghy, S. M., Dictionary of Organic Compounds, 5ª ed., vol. I (Chapman-Hall, Nueva York, 1982). [ Links ]
4. National Institute of Standards and Technology (NIST), http://webbook.nist.gov/cgi/cbook.cgi?ID=C591093&Units=SI&Mask=FFF [ Links ]
5. Clauson-Kaas, N. & Fakstorp, J. The Structure of Marquis' Nitroacetin. Acta Chem. Scand., 1, 210-215 (1947). [ Links ]
6. Michels, J. G. & Hayes, K.J. Conversion of the Nitration Intermediate Derived from Furfural into 5-Nitro-2-furfural Diacetate. J. Am. Chem. Soc., 80, 1114-1116 (1958). [ Links ]
7. Balina, G., Kesler, P., Petre, J., Pham, D. & Vollmar, A. Nitronium Acetate Adducts of Furan Derivatives. J. Org. Chem., 20, 3811-3818 (1986). [ Links ]
8. Martínez-Crespo, C., Síntesis Industrial de Medicamentos, p. 258 (Dossat, Madrid, 1957). [ Links ]
9. Vogel, A. I., Textbook of Practical Organic Chemistry, 5a ed., pp. 919, 920 (Longman Scientific & Technical, Londres, 1989). [ Links ]
10. Mann, F. G. & Saunders, B. C., Practical Organic Chemistry, 4a ed., p. 165 (Longmans, Londres, 1962). [ Links ]
11. Cumming, W. M., Hopper, I. V. & Wheeler, T. S., Systematic Organic Chemistry, 4a ed., p. 280 (Constable, Londres, 1950). [ Links ]
12. Giral, F. & Rojahn, C.A., Productos Químicos y Farmacéuticos, Vol. II, pág. 705 (Atlante, México D.F., 1956). [ Links ]
13. Menke, J. B., Nitration of organic compounds. British Patent 235,698 (1924), Chem. Abstr., 20, 916-917 (1926). [ Links ]
14. Menke, J. B., Nitrieren mit Nitraten, Rec. trav. chim., 44, 141-149 (1925). [ Links ]
15. Bahadur, K. & Patwardhan, W. D., Preparation of o-Nitro-acetanilide. Curr. Sci., 37, 492 (1968). [ Links ]
16. Cole-Palmer General Catalog, 2009/10, Nos. EW-88324-77y -78 (Cole-Palmer, Vernon Hills, Ill., 2009). [ Links ]
17. Alfa Aesar Catalog, 2008/09, No. A16677 (Alfa Aeser, Ward Hill, MA., 2008). [ Links ]
18. Referencia 12, págs. 752 a 755.
19. Royals, E. E., Advanced Organic Chemistry, p. 434 (Prentice-Hall, Englewood Cliffs, N. J., 1961). [ Links ]
20. Fuson, R. C., Advanced Organic Chemistry, p. 278 (J. Wiley, Nueva York, 1958). [ Links ]
21. Smith, M. B. & March, J., March's Advanced Organic Chemistry: reactions, mechanisms and structure, 6a ed., pp. 95-98 (J. Wiley, Hoboken, NJ, 2007). [ Links ]
22. Carey, F. A. & Sundberg, R. J., Advanced Organic Chemistry, 5ª ed., p. 786 (Springer, Nueva York, 2007). [ Links ]
23. Referencia 12, págs. 801 y 802.
Información sobre los autores
Francisco Sánchez-Viesca
Francisco Sánchez-Viesca estudió el doctorado en el Instituto de Química, UNAM y obtuvo el grado de Doctor en Ciencias Químicas. Es Profesor Fundador de la División de Estudios de Posgrado de la Facultad de Química, UNAM, en la cual labora como Profesor de Carrera Titular "C" y es miembro del programa PRIDE. Fue nombrado Investigador Nacional desde el inicio del Sistema Nacional de Investigadores. Ha publicado 66 trabajos de investigación original en revistas internacionales y nacionales, en las áreas de Productos Naturales, Compuestos Aromáticos, Análisis Orgánico, Compuestos de Interés Farmacéutico y Compuestos Heterocíclicos. Ha publicado 8 artículos de investigación original sobre puentes de hidrógeno intramoleculares en la serie tiazólica, 3 de ellos en revistas internacionales de alto impacto.
Ma. Reina Gómez
Ma. Reina Gómez es Química egresada de la Facultad de Química de la UNAM. Es Jefa en el Departamento de Química Orgánica, y tiene a su cargo la coordinación de 22 grupos de laboratorio. Es profesora de Química Orgánica, tanto de teoría como de laboratorio. Ha participado en numerosas investigaciones originales, y publicado 26 artículos en revistas científicas, nacionales e internacionales.
José Ma. García
José Ma. García estudió la carrera de Químico en la Escuela Nacional de Ciencias Químicas, UNAM. Realizó su tesis de Licenciatura en el Instituto de Química, bajo la dirección del Dr. Humberto Estrada Ocampo. En la Facultad de Química desarrolló el proyecto de Ciencia Básica. Es profesor titular, por oposición, de Química Orgánica, en diferentes niveles. Pertenece al Departamento de Química Orgánica y se ha especializado en Presentación Audiovisual, con técnicas de animación, usando software Microsoft Power.














