Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.14 no.1 Ciudad de México jun. 2011
Artículo original
Actividad fermentativa de Saccharomycodes ludwigii y evaluación de la síntesis de compuestos de importancia sensorial durante la fermentación de jugo de manzana
Fermentative activity of Saccharomycodes ludwigii and evaluation of the synthesis of compounds of sensory importance during fermentation of apple juice
Waldir Estela-Escalante1,3, Mojmír Rychtera1, Karel Melzoch1, Beatriz Hatta-Sakoda2, Zulema Ludeña-Cervantes3, Víctor Sarmiento-Casavilca3, Guadalupe Chaquilla-Quilca3
1 Department of Fermentation Chemistry and Bioengineering, Faculty of Food and Biochemical Engineering. Institute of Chemical Technology Prague. Technická 5, 166 28. Praha 6, Dejvice. Czech Republic. Waldir.Desiderio.Estela.Escalante@vscht.cz
2 Facultad de Ingeniería de Industrias Alimentarias, Universidad Nacional Agraria La Molina., Lima, Perú.
3 Laboratorio de Biotecnología Agroindustrial, Escuela de Ingeniería Agroindustrial, Universidad Nacional Micaela Bastidas de Apurímac, Apurímac, Perú.
Artículo recibido el 07 de marzo de 2011;
Aceptado el 16 de mayo de 2011.
Resumen
Se ha estudiado la actividad fermentativa de Saccharomycodes ludwigii RIVE 16-1-5 con la finalidad de evaluar su importancia en los procesos fermentativos. Los resultados mostraron que fermenta bien monosacáridos y además sucrosa y maltosa. Su actividad fermentativa no es inhibida a concentraciones de hasta 200 mg/L de metabisulfito de sodio en el medio. Además, produce etanol hasta 6.88±0,1% v/v. La agitación del medio de cultivo incrementa la producción de alcoholes superiores (843.7 mg/L) y por el contrario disminuye la producción de glicerol (0.18±0.2g/L) y ácido acético (56.0±8.5 mg/L). La producción de etil acetato en cultivo agitado (130.0±8.0mg/L) fue mayor que en cultivo estático (sin agitación). Durante el cultivo batch en biorreactor a condiciones aireadas la tasa de crecimiento p alcanzó el valor de 0.11 h-1. La concentración de oxígeno en el medio afectaría su metabolismo, así cantidades insuficientes de oxígeno provocan un metabolismo respirofermentativo con la producción de etanol, alcoholes superiores, ésteres y ácido acético. El control de la aireación durante la fermentación es una herramienta importante para controlar el balance entre la actividad respiratoria y fermentativa. Finalmente, los mejores resultados en calidad sensorial en lo referente al aroma, sabor y olor se obtuvieron en cultivo estático.
Palabras Clave: alcoholes superiores, cultivo por lote, etil acetato, fermentación alcohólica, Saccharomycodes ludwigii.
Abstract
The fermentative activity of Saccharomycodes ludwigii RIVE 16-1-5 was studied in order to evaluate its importance in fermentation processes. The results demonstrated that the strain ferments monosaccharides very well, and also sucrose and maltose. Its fermentative activity was not inhibited even at sodium metabisulphite concentrations of 200 mg/L in the culture medium. Furthermore, it was able to produce ethanol up to 6.88±0.1% (v/v). Agitation of the culture medium enhances the production of higher alcohols (843.7mg/L), but diminishes the production of glycerol (0.18±0.2 g/L) and acetic acid (56.0±8.5 mg/L). In addition, synthesis of ethyl acetate in shaken culture (130.0±8.0 mg/L) was higher compared to that in static culture (without agitation). During batch cultivation carried out under aerated conditions, the growth rate p reached a value of 0.11 h-1. The oxygen concentration in the medium would affect the yeast metabolism, thus insufficient amounts of oxygen would provoke a respiro-fermentative metabolism with production of ethanol, higher alcohols, esters and acetic acid. Aeration control during fermentation is an important tool to control the balance between the respiratory and fermentative activity. Finally, the best results of sensory quality related to aroma, flavor and smell were obtained in static culture.
Key Words: higher alcohols, batch cultivation, ethyl acetate, alcoholic fermentation, Saccharomycodes ludwigii.
Introducción
Saccharomycodes ludwigii es una levadura no-Saccharomyces considerada muchas veces contaminante en la producción de alimentos y bebidas fermentadas, como en el caso de los vinos1,2. Estas levaduras habitan lugares donde hay fuentes de azúcares fermentables y sustancias nutritivas que les permita crecer, como por ejemplo en jugos de fruta, frutas dañadas, néctar de flores y en la superficie de los equipos utilizados en la producción de vino3,4.
Las levaduras no-Saccharomyces durante la fermentación natural convierten los azúcares en etanol, dióxido de carbono y en un sin número de compuestos volátiles y no volátiles que contribuyen a la composición química y sensorial de las bebidas que fermentan5,6,7,8. Estas levaduras forman parte de la microflora que predomina durante los primeros 2-3 días de la fermentación alcohólica espontánea, sin embargo, debido a su sensibilidad al etanol (5-6%v/v) su crecimiento declina rápidamente y mueren9-11. Subsecuentemente, levaduras como Saccharomyces cerevisiae que son más resistentes al etanol toman el control de la fermentación y completan el proceso, la fermentación continúa hasta el agotamiento de los azúcares o hasta que algún componente esencial para el crecimiento se agote o hasta que aparezca el efecto inhibidor de los metabolitos producidos durante la fermentación6,10,12. En general, se considera que las levaduras no-Saccharomyces cumplen un rol importante en la definición del perfil sensorial de vinos y también de otras bebidas fermentadas5,13.
Metabolismo de azúcares en Saccharomycodes ludwigii
Los azúcares fermentables son la fuente de energía más importante en el metabolismo de levaduras. Saccharomycodes ludwigii al igual que las demás levaduras utiliza vías metabólicas comunes para la degradación de azúcares. Los azúcares para ser utilizados deben ser transportados hacia el interior de la célula mediante mecanismos de transporte específicos14-16. La velocidad de utilización de azúcares está influenciada por la concentración y el tipo de azúcar, la concentración de oxígeno disuelto en el medio, la temperatura de fermentación y el pH, entre otros factores17-19.
Una vez dentro de la célula, el azúcar es fosforilado y así entra a la vía de la glucólisis, la cual termina en la formación de piruvato, proceso llevado a cabo en el citosol20. Luego, el piruvato formado puede ser incorporado, bien al metabolismo respiratorio o al fermentativo, dependiento de la concentración de azúcar (glucosa) y oxígeno disuelto en el medio17,21-23.
Existen pocas investigaciones desarrolladas sobre la actividad fermentativa de Saccharomycodes ludwigii, sin embargo, se le considera una levadura "Crabtree negativo" en correlación a su carácter "petite negativo"24-26. Por otro lado, ha sido reportado que manifiesta una deficiencia respiratoria dependiendo de la concentración de oxígeno en el medio27. Las levaduras "Crabtree negativas" presentan un metabolismo respiratorio aún cuando la concentración de azúcar (glucosa) en el medio es relativamente alta25. Esta característica ha servido para denominarlas levaduras oxidativas.
En estas levaduras cultivadas en medios con altas concentraciones de azúcar y en condiciones aerobias, el piruvato se metaboliza preferentemente vía piruvato deshidrogenasa hasta acetil-CoA y luego éste entra al ciclo de Krebs para su oxidación completa17,28; esto se debe a que presentan bajos niveles de piruvato descarboxilasa y una alta actividad de enzimas respiratorias como la piruvato deshidrogenasa, acetaldehído deshidrogenasa y acetil-CoA sintetasa29. La ausencia de oxígeno en el medio es crucial y conduce a la cesación del crecimiento de las levaduras "Crabtree negativas"17,24. Sin embargo, ha sido reportado que a condiciones anaerobias, Saccharomycodes ludwigii es capaz de crecer, comportamiento similar a lo observado en Saccharomyces cerevisiaê3. Esta característica explicaría el por qué esta levadura es habitualmente encontrada al final de la fermentación31.
Algunas investigaciones han reportado además la producción de acetato, glicerol y etanol por estas levaduras; esto se debería a una baja actividad de las enzimas respiratorias especialmente la piruvato deshidrogenasa, acetaldehído deshidrogenasa y la acetil-CoA sintetasa como resultado de la limitación de oxígeno en el medio17, lo que a la vez conduce a una disminución de la tasa de respiración y a la estimulación del metabolismo respirofermentativo.
Así mismo, la producción de glicerol en medios con alta concentración de azúcar, estaría conectado a un mecanismo de adaptación que utiliza la levadura frente al estrés osmótico y así prevenir su deshidratación. La formación de glicerol está acoplado a la oxidación de NADH a NAD+, lo que causa un desbalance redox en el citosol (NADH:NAD+), el cual es corregido con la producción de ácido acético cuya síntesis reconvierte nuevamente NAD+ a NADH32,33.
En la Figura 1 se presenta en forma general el metabolismo respiratorio y respirofermentativo en levaduras "Crabtree negativas" para la degradación de glucosa y/o fructosa, adaptado de Fredlund et al.34,35 y van Dijken et al.17

A condiciones de limitación de oxígeno se estimularía el metabolismo respirofermentativo17, así entonces el piruvato es convertido en acetaldehído por la piruvato descarboxilasa y luego puede ser reducido bien a etanol por la alcohol deshidrogenasa18,36, u oxidado a ácido acético por la acetaldehído deshidrogenasa NADP-dependiente37. El acetaldehído funciona como receptor terminal de electrones cuya reducción por el NADH genera etanol18,38. En levaduras "Crabtree negativas" en presencia de oxígeno, el acetaldehído es preferentemente oxidado a acetato por la acetaldehído deshidrogenasa y luego convertido en acetil CoA por la acetil-CoA sintetasa39,40. Sin embargo, la acumulación de ácido acético bajo condiciones de limitación de oxígeno resultaría de la insuficiente actividad de la acetil-CoA sintetasa requerida para la oxidación completa del acetato39. Por otro lado, la producción de glicerol estaría también ligada a la necesidad de reoxidar el NADH generado durante la glucólisis41.
Efecto del etanol y sulfito en Saccharomycodes ludwigii
El etanol inhibe la viabilidad de las células, la tasa de crecimiento específico y la tasa específica de fermentación42-44. Se considera que el etanol provoca la disminución del contenido de esteroles en la membrana celular y esto afecta el transporte de azúcares. Así mismo, se considera que el etanol tendría un efecto inhibidor sobre la actividad del sistema hexoquinasa, enzimas responsables de transferir grupos fosfato de una molécula a otra en la glucólisis44-46.
En general, la tolerancia al etanol depende en la habilidad de la célula de levadura para exportar el etanol producido hacia el exterior, un proceso que depende de la composición y fluidez de la membrana citoplasmática47. Estudios han reportado la capacidad de Saccharomycodes ludwigii de tolerar altas concentraciones de etanol38,48. Tan es así que se ha observado la producción de etanol en concentraciones de hasta 12-14% v/v49.
El dióxido de azufre se ha utilizado desde hace mucho tiempo como agente antimicrobiano durante la elaboración de vinos y otras bebidas fermentadas. Este compuesto inhibe el crecimiento de bacterias y ciertas levaduras, entre ellas las no-Saccharomyces50,51. La capacidad inhibitoria del SO2 está influenciada por el pH del medio. El pH determina el equilibrio entre tres compuestos, el SO2, HSO-3, y SO=3. El SO2 es el responsable del efecto tóxico y su concentración en medio acuoso es favorecido por valores bajos de pH, ya que provoca el desbalance del equilibrio hacia este compuesto52.
Los sulfitos tienen actividad a nivel del metabolismo energético, afectan la glucólisis. Bajas concentraciones conducen a una rápida reducción del contenido de ATP en las células de levadura a pH bajos. Las enzimas más afectadas serían la gliceraldehído-3-fosfato deshidrogenasa y la alcohol deshidrogenasa53,54. Así mismo, el sulfito sería responsable de la inhibición de la alcohol deshidrogenasa, enzima responsable de la reducción del acetaldehído a etanol durante la fermentación54.
Producción de compuestos de importancia sensorial por Saccharomycodes ludwigii
Las condiciones de cultivo que conducen al metabolismo respirofermentativo en levaduras resultan en la producción de compuestos de importancia sensorial, los cuales dependiendo de sus concentraciones pueden influir positiva o negativamente en la calidad organoléptica de las bebidas fermentadas. Estos compuestos incluyen, el etanol, glicerol, ácido acético y además un sin número de compuestos volátiles. Por ejemplo, de los 1000 compuestos volátiles encontrados en vinos, 400 aproximadamente son producidos por la actividad de levaduras55. Entre los compuestos volátiles producidos están los ésteres, alcoholes superiores, cetonas, aldehídos y ácidos orgánicos, entre otros. La síntesis de ésteres es de mayor interés, ya que su presencia determina el sabor, olor y aroma frutal de las bebidas fermentadas56,57. Los ésteres representan el mayor grupo de componentes aromáticos en bebidas alcohólicas fermentadas58,59; son producidos mediante reacción enzimática dentro de la célula de levadura, la enzima que cataliza la reacción es la acetiltransferasa y/o la éster sintasa60-62. Los alcoholes superiores, por otra parte, son formados a partir de α-cetoácidos, éstos pueden derivar de los correspondientes aminoácidos (valina, leucina, isoleucina, fenilalanina, etc.), por desaminación a través de la vía de Ehrlich o a partir del metabolismo de la glucosa como precursores en la síntesis de aminoácidos63,64. Estudios realizados con Saccharomycodes ludwigii reportaron una elevada producción de isobutanol, isoamil alcohol, etil acetato y ácido acético13,31,48,49.
Concentraciones de alcoholes superiores sobre 400 mg/L contribuyen negativamente a la calidad organoléptica, especialmente en vinos65. A excepción de 2-feniletanol el cual presenta aroma floral66, y cuyo valor umbral de percepción es 10 mg/L67, los demás alcoholes superiores imparten características sensoriales desagradables65,66,68.
El presente estudio se realizó con la finalidad de contribuir al entendimiento de la actividad fermentativa de Saccharomycodes ludwigii RIVE 16-1-5 y su relación con la concentración de oxígeno en el medio. Además, se discute la producción de compuestos químicos de importancia sensorial como un potencial, el cual puede ser ventajoso y aprovechable para la producción de bebidas fermentadas con características sensoriales particulares, en este caso, a partir de jugo de manzana.
Materiales y Métodos
Microorganismo
Todos los experimentos se realizaron utilizando la cepa de levadura Saccharomycodes ludwigii RIVE 16-1-5 adquirido de la colección de levaduras del Instituto de Investigación de Viticultura y Enología, Bratislava-República Eslovaca, y fue mantenido en agar extracto de malta a 7ºC, con renovación periódica cada 3 meses.
Fermentación de azúcares
En los ensayos de fermentación de azúcares se utilizó caldo tipo Saboraud 2% como medio de cultivo base en el cual se sustituyó sólo la fuente de carbono. La actividad fermentativa se determinó visualmente mediante la producción de gas con la técnica de tubos de Durham. Los ensayos se realizaron por triplicado a 28ºC durante 96 horas.
Tolerancia al etanol y al metabisulfito de sodio
Los ensayos de tolerancia al etanol y al metabisulfito de sodio se realizaron utilizando medio sintético de la siguiente composición: glucosa 50.0 g/L; KH2PO4 5,0 g/L; MgSO4.7H2O 0,4 g/L; (NH4)2SO4 2.0 g/L y extracto de levadura 1.0 g/L. La tolerancia al etanol se determinó mediante la capacidad de fermentar glucosa a diferentes concentraciones de etanol en el medio de cultivo, para ello se utilizó la técnica de tubos de Durham y se observó visualmente la producción de CO2. El etanol se adicionó asépticamente en concentraciones de 2.0% v/v; 4.0% v/v; 6.0% v/v; 8.0% v/v; 10.0% v/v y 12.0% v/v luego de la esterilización de los medios. Las fermentaciones se realizaron durante 72 horas, el pH del medio fue ajustado a 4.5. La tolerancia al metabisulfito de sodio (Na2S2O5) se determinó mediante la capacidad de fermentar glucosa a diferentes concentraciones de Na2S2O5 en el medio. El metabisulfito de sodio se adicionó de acuerdo al pH del medio: 100 mg/L al medio de pH 3.3; 150 mg/L al medio de pH 3.65 y 200 mg/L al medio de pH 4.24. En la evaluación de la fermentación se utilizaron tubos de Durham y se observó visualmente la producción de CO2 hasta las 72 horas. Todos los ensayos se realizaron a 28ºC y por triplicado.
Producción de etanol
Para los ensayos de producción de etanol se adquirió jugo de manzana concentrado, esterilizado por ultrafiltración y aroma removido, de Severofrukt a.s., Terezin, República Checa. La remoción del aroma se realizó durante el proceso de concentrado en un evaporador provisto de una columna de separación de volátiles. El jugo concentrado así como el aroma obtenido fue entregado por separado al grupo de investigación. El jugo concentrado se reconstituyó hasta una concentración de azúcares totales de 12.8% w/w y pH 3.8 para utilizarlo como medio de fermentación. Las ensayos se realizaron en frascos Erlenmeyer de 1 L conteniendo 0.5 L de medio de cultivo. Las fermentaciones se llevaron a cabo en cultivo estático y agitado a 16ºC y 28ºC, respectivamente. Las fermentaciones en cultivo agitado se realizaron en frascos agitados a 200 min-1 en un agitador orbital. Las fermentaciones en cultivo estático se consideraron terminadas cuando no se observó producción de CO2 y aquéllas en cultivo agitado, el tiempo de cultivo fue el equivalente al tiempo utilizado durante la fermentación en cultivo estático.
El inóculo se propagó utilizando medio de cultivo de la misma composición. Los frascos Erlenmeyer se agitaron a 200 min-1, durante 48 horas, la temperatura de cultivo fue 28ºC. El medio de fermentación se inoculó con 14.0% v/v de inóculo. Finalmente, el contenido de etanol producido se determinó mediante picnometría. Todos los ensayos se realizaron por triplicado.
Síntesis de compuestos de importancia sensorial
Preparación de inóculo y condiciones de fermentación
El jugo de manzana reconstituido y el aroma removido (explicado anteriormente) se han utilizado como medio de fermentación. Las fermentaciones se realizaron en cultivo agitado y estático en frascos Erlenmeyer de 0.5 L conteniendo 250 mL de medio. En las fermentaciones en cultivo agitado los frascos se agitaron a 200 min-1 durante 8 días y en aquéllos en cultivo estático el tiempo de fermentación fue de 15 días. Los experimentos se realizaron a 28ºC.
La propagación del inóculo se llevó a cabo en 100 mL de jugo de manzana estéril a 28ºC durante 24 horas, los frascos se agitaron a 200 min-1 en un agitador orbital. Las células se separaron por centrifugación (3000 min-1 durante 10 minutos) y se lavaron tres veces con solución fisiológica estéril. Los medios de fermentación se inocularon con 1.0±0.1 g de células en peso húmedo.
Análisis sensorial y estadístico
Se evaluaron atributos como sabor, aroma y olor usando una escala hedónica de 5 puntos (1=me desagrada extremadamente, y 5=me gusta mucho). Las muestras fueron evaluadas por un panel entrenado conformado por 10 jueces hombres de entre 25 y 30 años de edad. La evaluación sensorial se realizó de acuerdo a Meilgaard et al.69 Las puntuaciones de los panelistas se presentaron como promedios aritméticos. Luego se utilizó la prueba t-Student estándar para determinar la significancia estadística (P<0.01) de las diferencias observadas entre los resultados de los dos tipos de fermentación. El análisis estadístico se realizó ayudado por el software Statistica v. 8.0.
Cultivo batch en biorreactor
Como medio de cultivo se utilizó jugo de manzana variedad Rubin con un contenido de azúcares totales de 13% en peso y un pH de 3.8. Las manzanas fueron adquiridas de la distribuidora de frutas y hortalizas Fruit-CZ, Praga, República Checa. Luego de la extracción, el jugo se vertió en envases estériles de 10 L y se pasteurizó en un termostato a 65-70ºC durante 12 horas (incluyendo el tiempo de enfriado) con la finalidad de eliminar la flora microbiana y además todos los compuestos volátiles varietales70,71. El jugo de manzana se suplementó con KH2PO4 1.2 g/L y (NH4)2SO4 1.2 g/L como fuente de fósforo y amonio para promover el crecimiento de la levadura. Los cultivos se realizaron en un biorreactor (BIOSTAT-B. Braun International, Alemania) de 2 L conteniendo 1.5 L de medio de cultivo. El biorreactor estuvo conectado a una unidad de regulación y medición micro-DCU-300 y además estuvo equipado con un agitador, medidor de pH, termómetro y un electrodo de medición de oxígeno disuelto. Los parámetros considerados en el cultivo los cuales fueron mantenidos constantes a lo largo del proceso fueron: temperatura 18ºC, frecuencia de agitación 300 min-1 y flujo de aire 25 L/h (0.2 moles O2/h). El tiempo de cultivo se dejó hasta el incremento de la concentración de oxígeno disuelto en el medio a su valor inicial.
El inóculo se propagó en 80 ml de medio sintético de la siguiente composición: glucosa 8.0 g/L; peptona 10.0 g/L; KH2PO4 1.2 g/L; (NH4)2SO4 1.2 g/L y extracto de levadura 10,0 g/L, el pH se ajustó a 3,6. La propagación de células se llevó a cabo en un agitador orbital a 150 min-1 durante 48 horas a 28ºC. Las células se separaron por centrifugación (3000 min-1 durante 10 minutos), se lavaron tres veces con solución fisiológica estéril y, finalmente, las células obtenidas se inocularon en el biorreactor.
Métodos analíticos
Los compuestos volátiles producidos durante la fermentación (alcoholes superiores y ésteres) se analizaron en un cromatógrafo de gas (Hewlett-Packard 5890II), equipado con una columna HP5 (30 m x 0.32 mm) y un detector FID.
Las muestras fermentadas por triplicado se centrifugaron y filtraron en una membrana de microfiltración de 0.45 mm de porosidad, luego se extrajeron los compuestos volátiles mediante el método de microextracción con diclorometano69. Finalmente, 1 μl de cada extracto se inyectó en el cromatógrafo.
El ácido acético, succínico, málico, etanol, glicerol, fructosa y glucosa se analizaron en un HPLC (Pump LCP 4000), equipado con una columna Watrex250x 8mm (Ostion LGKS 0800H+) y un detector RID. En el análisis se utilizaron 0.005 M de H2SO4 como fase móvil a una tasa de flujo de 1 mL/min. Las muestras fermentadas por triplicado, luego de ser filtradas y centrifugadas, se diluyeron con agua desmineralizada (1:3) y se inyectaron al equipo.
La biomasa celular se determinó mediante gravimetría. Las células se separaron por centrifugación a 3000 min-1 durante 10 minutos, se lavaron 3 veces con agua destilada luego se secaron a 110°C durante 2 horas y, finalmente, se pesaron. El coeficiente global de rendimiento de biomasa YX/S y la tasa de crecimiento (p) se determinaron de acuerdo a Van Hoek et al.73
Resultados y discusión
Fermentabilidad de azúcares, tolerancia al etanol y metabisulfito de sodio
Las levaduras difieren en su capacidad de fermentar azúcares, esta característica es fundamental para definir su utilidad en procesos fermentativos. Como se muestra en la Tabla I, Saccharomycodes ludwigii RIVE 16-1-5 es capaz de fermentar glucosa, fructosa y manosa. Estos azúcares generalmente están presentes en los jugos de fruta. La fermentación de sucrosa y maltosa es una característica importante, ya que indica que esta cepa puede ser utilizada para fermentar mostos que contengan estos azúcares, como por ejemplo, aquéllos preparados a base de cereales.
El etanol tiene actividad inhibitoria, afecta la integridad y estabilidad de la membrana citoplasmática y la actividad de ciertas enzimas de la glucólisis44-46. Los resultados obtenidos (Tabla I) muestran que Saccharomycodes ludwigii RIVE 16-15 es capaz de fermentar a concentraciones de etanol exógeno de 8% v/v, lo que sugiere que puede producir etanol en cantidades equivalentes. Sin embargo, la actividad inhibitoria del etanol exógeno es menor que el etanol producido por la célula, debido a que el carácter impermeable de la membrana citoplasmática impide que el etanol pueda penetrar fácilmente hacia el interior de la célula74. La evaluación de la tolerancia al etanol es importante, ya que nos indica el potencial de tolerancia y producción de etanol de la cepa.

La capacidad inhibitoria del SO2 está influenciada por el pH del medio52. Como se observa en la Tabla I, la actividad fermentativa de Saccharomycodes ludwigii RIVE 16-1-5 no ha sido afectada, inclusive a concentraciones de metabisulfito de sodio (precursor de SO2) de hasta 200 mg/L. Los resultados de tolerancia al Na2S2O5 encontrados en este experimento concuerdan con lo reportado por Stratford et al.75, quienes manifestaron que Saccharomycodes ludwigii es capaz de crecer en medio sintético ajustado a pH 4, conteniendo concentraciones de Na2S2O5 por encima de 500 mg/L.
La utilización de dióxido de azufre (SO2), en el caso de la producción de vinos, está regulado debido a los posibles efectos tóxicos que produce. La OIV (Organización Internacional de la Viña y el Vino) recomienda dosis entre 150-400mg/L de sulfito, dependiendo del tipo de vino76. La persistencia de esta levadura en mostos sulfitados se debería a su capacidad de tolerar altas concentraciones de este agente antimicrobiano.
Producción de etanol
Las levaduras oxidativas cultivadas bajo limitación de oxígeno tienden a producir etanol debido a la interrupción de su actividad respiratoria. La respiración y la fermentación suceden al mismo tiempo, la concentración de oxígeno en el medio de fermentación determina el balance entre el metabolismo respiratorio y respirofermentativo. Sin embargo, en un metabolismo mixto la generación de energía disminuye, y como resultado también la tasa de crecimiento, para dar paso a la formación de compuestos típicos de la fermentación alcohólica. En la Tabla II se muestran las concentraciones de etanol producido por Saccharomycodes ludwigii RIVE 16-1-5. Se ha observado una mayor producción de etanol en cultivo estático (6.88%v/v) a 28ºC. La agitación del medio parece influir en la disminución de la producción de etanol al menos en cultivos realizados a 28ºC. Así mismo, la diminución de la temperatura no afectó sustancialmente la producción de etanol en cultivo agitado, por el contrario esto no sucedió en cultivo estático donde la producción de etanol disminuyó de 6.88 a 4.44%. Si bien esta cepa produjo como máximo 6.88%v/v de etanol, que es una cantidad suficiente para producir bebidas con contenido medio de etanol (por ejemplo sidras), aún así no produjo mayores cantidades, como fue reportado por Ciani y Maccarelli49 y Granchi et al.48. Además, este resultado confirma que una cepa de levadura tolera la cantidad de etanol que es capaz de producir (ver Tabla I). La disminución de producción de etanol en cultivo agitado (al menos a 28ºC) se debería al efecto del oxígeno incorporado al medio durante la agitación. Esto explica que Saccharomycodes ludwigii RIVE 16-1-5 prefiere oxidar la glucosa en presencia de oxígeno antes que fermentarla.
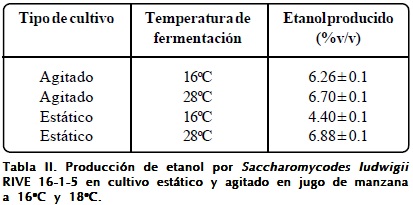
La temperatura juega un rol importante en la producción de etanol y compuestos secundarios durante la fermentación. En la producción de vinos blancos y cervezas, por ejemplo, se prefieren temperaturas bajas de fermentación, ya que influyen positivamente en la síntesis de componentes sensoriales57. En ambos tipos de cultivo se observó una disminución de la producción de etanol a 16ºC. Para casos prácticos, la producción de etanol podría ser controlada mediante la tasa de agitación (aireación) y la temperatura.
Síntesis de compuestos de importancia sensorial
La variación de parámetros de cultivo que dan origen al metabolismo fermentativo en levaduras, conducen a la producción de etanol y otros compuestos químicos de importancia sensorial. En la Tabla III se muestran las concentraciones de los compuestos producidos por Saccharomycodes ludwigii RIVE 16-1-5 durante cultivo estático y agitado, así mismo se citan los resultados obtenidos por otros autores con fines de comparación. La mayor producción de glicerol se observó en cultivo estático (3.5±0.2 g/L), comparado con el cultivo agitado (0.18±0.2 g/L). Esta disminución se debe en parte a que el metabolismo aerobio promueve la respiración celular, disminuyendo así la producción de glicerol. La concentración de glicerol (3.5±0.2 g/L) determinado en este estudio resultó ser menor a lo observado por Granchi et al.48. Una mayor producción de glicerol sería favorable para el perfil sensorial de la bebida fermentada, ya que impartiría un ligero sabor dulce77.

Con respecto a la producción total de alcoholes superiores se observa que en cultivo agitado se produjo mayor cantidad (843.7 mg/L) comparado al cultivo estático (568.5 mg/L), la mayor producción se debería al efecto del oxígeno incorporado al medio durante la agitación. El oxígeno promueve el metabolismo respiratorio y, como consecuencia, un mayor flujo de glucosa y aminoácidos, cuya degradación produce compuestos intermediarios (cetoácidos) de la síntesis de alcoholes superiores78,79,80. Otros factores que incrementan la producción de alcoholes superiores incluyen la clarificación del mosto, la madurez de la fruta, la variedad entre una misma especie de fruta y la temperatura de fermentación, entre otros79,81-83. Estudios realizados anteriormente por el autor también reportaron la influencia de la aireación del medio en el incremento de alcoholes superiores por especies de levaduras no-Saccharomyces84,85. Nuestros resultados concuerdan con los obtenidos por Granchi et al.48 y Romano et al.11, quienes reportaron que Saccharomycodes ludwigii produce altas concentraciones de 2-metil-propanol (isobutanol) y 3-metil-butanol (isoamil alcohol), sin embargo, comparando con los resultados obtenidos por Romano et al.13,31, concluimos que la producción de alcoholes superiores depende grandemente de la cepa y del tipo de jugo de fruta utilizado en la fermentación31.
Los ésteres imparten el aroma frutal en las bebidas fermentadas, por esta razón su presencia determina en parte la calidad sensorial. El etil acetado es el éster de mayor importancia por su concentración. Como se muestra en la Tabla III, la mayor producción de etil acetado por Saccharomycodes ludwigii RIVE 16-1-5 se observó en cultivo agitado (130.0±8.0mg/L). La tasa de formación de etil acetato estaría relacionado con la disponibilidad de ácido acético, etanol y, además, de la actividad de la enzima necesaria para su formación86. Por otro lado, la concentración de ácido acético en cultivo agitado resultó ser bajo (56.0±8.5mg/L), lo que indicaría que la tasa de formación de etil acetato ha sido suficientemente alta para convertir el ácido acético en etil acetato.
Lo contrario se ha observado en cultivo estático donde la concentración de ácido acético es relativamente alta (303.0±10.0 mg/L), mientras que la concentración de etil acetato llegó hasta 24.0±5.0 mg/L. En general, se considera que el oxígeno afecta de manera inversa la síntesis de ésteres, desde que promueve la formación de acetil CoA (co-substrato), la cual es utilizada en la síntesis de componentes celulares91-93. Esto es razonable en el caso de levaduras "Crabtree negativas" desde que no presentan represión del crecimiento por la glucosa. Sin embargo, la mayor formación de etil acetado en cultivo agitado con Saccharomycodes ludwigii RIVE 16-1-5 involucraría otros factores propios de la cepa. Por otra parte, se ha observado una deficiencia en la producción de ésteres diferentes a etil acetato en ambos tipos de cultivo, lo que representaría una desventaja para su aplicación en la producción de bebidas fermentadas. Cepas con baja producción de etil acetato (<50 mg/L) fueron también reportadas por Romano et al.31.
Así mismo, se ha observado la formación de ácido succínico tanto en cultivo agitado (0.99±0.10 mg/L) como estático (0.8±0.15 mg/L). Este ácido contribuye a la acidez total de la bebida. En presencia de oxígeno, el ácido succínico se produce normalmente como un intermediario del ciclo de Krebs o bien por la actividad de las enzimas relacionadas al ciclo de Krebs cuya síntesis no sería inducida por el oxígeno94.
Los cultivos agitados en frascos Erlenmeyer presentan limitaciones en la transferencia de oxígeno95,96, esto provocaría un metabolismo respirofermentativo mixto en Saccharomycodes ludwigii RIVE 16-1-5, con la consecuente variabilidad en la producción de productos de la fermentación. Los factores que influyen en la transferencia de oxígeno incluyen la relación volumen del frasco Erlenmeyer/volumen del medio de cultivo, diámetro del cuello del frasco e inclusive el tipo y las características del tapón97.
El análisis estadístico de los resultados de aroma, sabor y olor reportaron diferencia significativa (P<0.01) entre los dos tipos de bebidas fermentadas. Además, los resultados de los jueces han descrito a la bebida fermentada en agitación de inferior calidad sensorial. En términos generales se ha descrito a la bebida fermentada estáticamente como más aromática relacionándola como "característico a manzana" y a "plátano maduro", probablemente debido a la presencia de etil decanoato. Además, se ha descrito como más suave y ligeramente ácido comparado a la bebida fermentada en agitación. Sin embargo, a esta última se le relacionó como muy "picante" y de sabor "medicinal", debido probablemente a la proporción de alcoholes superiores y etil acetato, y en la mayoría de los puntajes se definió como "2=me disgusta".
Cultivo batch en biorreactor
En la Figura 2 se muestran los resultados del transcurso del consumo de oxígeno, el crecimiento celular y la variación del pH durante 6.6 días de cultivo de Saccharomycodes ludwigii RIVE 16-1-5. El oxígeno es el factor más importante que determina el balance entre la actividad respiratoria y respirofermentativa en esta levadura. A concentraciones inferiores a la concentración crítica, la tasa de respiración depende de la concentración de oxígeno, por el contrario a concentraciones superiores es independiente98. En presencia de oxígeno como subtrato, la relación entre la tasa de crecimiento y concentración de oxígeno en el medio sigue la cinética de Michaelis Menten98. La concentración crítica de oxígeno para levaduras es muy baja, en el orden de 0.12 mg/L a 20ºC.

Como se observa en la Figura 2 luego de la 30va hora la concentración de oxígeno disuelto en el medio cayó a cero y así permaneció hasta la 280va hora. Esto significa que el oxígeno transferido al medio es consumido en su totalidad, sin embargo, este valor no da información de la tasa de consumo de oxígeno. El oxígeno es poco soluble en agua pura (9.1 mg/L a 20ºC) y a medida que la temperatura y la viscosidad del medio incrementa la solubilidad disminuye. La tranferencia de oxígeno al medio es crucial y depende de muchos factores, entre ellos, el flujo de aire, la velocidad de agitación, la composición del medio y la geometría del biorreactor, entre otros. El oxígeno consumido es utilizado mayormente en la oxidación de glucosa, pero también en vías no respiratorias como en la síntesis de esteroles y ácidos grasos insaturados que son componentes esenciales de la membrana celular99.
El agotamiento rápido del oxígeno indica que esta cepa manifiesta un intenso metabolismo aerobio, pero que probablemte experimenta limitación de oxígeno, en este caso se recomienda trabajar a concentraciones de saturación o exceso de oxígeno si se desea bloquear al máximo la actividad fermentativa. En este caso la producción de etanol se acercaría a cero.
En la Figura 2 se observa un incremento gradual de biomasa alcanzando un valor de 15.6 g/L al final del cultivo (Tabla IV). Estequiométricamente este valor es inferior a lo esperado, esto sugiere que la fuente de carbono no solamente habría sido utilizado para el crecimiento, sino en algún otro proceso como en "maintenance"100, o en la formación de productos de la fermentación. Sin embargo, en los compuestos residuales (Tabla IV) al final del cultivo no reporta etanol, y bajos niveles de glicerol (0.21±0.05 mg/L) y ácido acético (0.10±0.03 mg/L). Hay evidencia de que el metabolismo no ha sido enteramente oxidativo, ya que hay presencia de compuestos volátiles (1-propanol, propil acetato, etil acetato) típicos de la fermentación alcohólica y, además, por la baja producción y rendimiento de biomasa (0.12 g de biomasa/ g de azúcar). Probablemente, el etanol producido durante el cultivo habría servido como fuente de carbono al agotarse los azúcares fermentables. Al final del cultivo, el incremento del porcentaje de oxígeno disuelto estaría relacionado con el agotamiento de la fuente de azúcar que afectaría la actividad metabólica de la población microbiana.
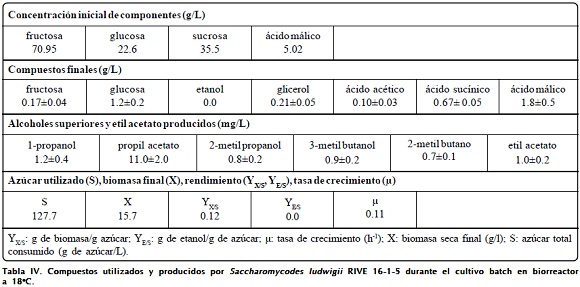
Así mismo, no se ha observado una variación significante del pH (de 3.62 a 3.46) al final del proceso. La variación del pH está asociado con el proceso de crecimiento celular y la actividad metabólica como la principal causa del intercambio de protones en el medio. Otra característica importante es la disminución considerable del contenido de ácido málico bajo estas condiciones (desde 5.02 g/L hasta 1.8±0.5 g/L). Desde el punto de vista práctico, ser deben evitar concentraciones de oxígeno que conducen principalmente al metabolismo respiratorio, por la baja producción de etanol y componentes volátiles. Adicionalmente, se ha realizado el análisis sensorial al producto final, los jueces la definieron como una bebida desagradable y sin cualidades aromáticas.
Conclusiones
Saccharomycodes ludwigii RIVE 16-1-5 presenta una gran capacidad para fermentar monosacáridos y disacáridos comúnmente encontrados en jugos de frutas, característica que la hace ventajosa y aprovechable para la producción de bebidas fermentadas. Su tolerancia al SO2 es particularmente interesante, ya que concentraciones de hasta 200 mg/L no afectan su actividad fermentativa. También sería útil considerar esta característica para su aislamiento. Así mismo, su capacidad de producir etanol hasta 6.88% v/v la hace adecuada para producir bebidas con contenido alcohólico bajo y medio. Sin embargo, la producción de etanol puede ser controlada mediante la tasa de agitación y la temperatura.
Por otro parte, la aireación promueve una mayor producción de alcoholes superiores (843.7 mg/L) y etil acetato (130.0±8.0 mg/L) y una disminución de glicerol (0.18±0.20 g/L). La deficiencia en la producción de otros ésteres diferentes a etil acetato es una desventaja. Debido a esta característica se recomienda controlar la tasa de agitación (aireación) para optimizar y balancear la producción de compuestos sensoriales. La naturaleza de la cepa, así como el tipo de fruta y el proceso tecnológico utilizado en la obtención del jugo, también influyen en la producción de compuestos de importancia sensorial.
El suministro constante y controlado de oxígeno (0.2 moles/h) desvía el metabolismo respirofermentativo hacia el respiratorio, sin embargo, el oxígeno disuelto bajo estas condiciones no provoca un metabolismo enteramente oxidativo. La concentración de oxígeno es el factor clave que determina la formación de compuestos en la fermentación alcohólica al menos en esta cepa de levadura. Finalmente, desde el punto de vista sensorial, la fermentación en cultivo estático con Saccharomycodes ludwigii RIVE 16-1-5 es la mejor alternativa para producir una bebida fermentada a partir de jugo de manzana de mejor aceptación y calidad sensorial.
Agradecimientos
Los autores agradecen a la colección de levaduras del Instituto de Investigación de Viticultura y Enología, Bratislava, República Eslovaca, por proporcionarnos la cepa de levadura estudiada.
Referencias
1. Thomas, D.S. Yeasts as spoilage organisms in beverages. In: The Yeasts, Vol. 5 (eds. Rose, A. H. & Harrison, J. S.) 517-561 (Academic Press, New York, 1993). [ Links ]
2. Beech, F.W. Yeasts in cider-making. In: The Yeasts, Vol. 5. (eds. Rose, A. H. & Harrison, J. S.) 169-213 (Academic Press, New York, 1993). [ Links ]
3. Combina, M., et al. Yeasts associated to Malbec grape berries from Mendoza, Argentina. Journal of Applied Microbiology 98, 1055-1061 (2005). [ Links ]
4. Polsinelli, M., Romano, P., Suzzi, G. & Mortimer, R. Multiple strains of Saccharomyces cerevisiae on a single grape vine. Letters in Applied Microbioliology 22, 1-5 (1996). [ Links ]
5. Jolly, N.P., Augustyn, O.P.H. & Pretorius, I.S. The role and use of non-Saccharomyces yeasts in wine production. South African Journal of Enology and Viticulture 27(1), 15-39 (2006). [ Links ]
6. Fleet, G.H. & Heard, G.M. Yeasts-growth during fermentation. In: Wine Microbiology and Biotechnology (ed. Fleet, G.H.) 2754 (Harwood Academic Publishers, Camberwell, 1992). [ Links ]
7. Lambrechts, M.G. & Pretorius, I.S., Yeast and its importance to wine aroma-a review. South African Journal of Enology and Viticulture 21, 97-129 (2000). [ Links ]
8. Swiegers, J.H. & Pretorius, I.S., Yeast modulation of wine flavour. Advances in Applied Microbiology 57, 131-175 (2005). [ Links ]
9. Regueiro, L.A., Costas, C.L. & Rubio, J.E.L. Influence of viticultural and enological practices on the development of yeast populations during winemaking, American Journal of Enology and Viticulture 44, 405-408 (1993). [ Links ]
10. Fleet, G.H. & Heard, G.M. Yeasts-growth during fermentation. In: Wine Microbiology and Biotechnology (ed. Fleet, G.H.) 27-54 (Harwood Academic Publishers, Switzerland, 1993). [ Links ]
11. Querol, A., Jiménez, M. & Huerta, T. A study on microbiological and enological parameters during fermentation of must from poor and normal grape harvest in the region of Alicante (Spain). Journal of Food Science 55, 1603-1606 (1990). [ Links ]
12. Schutz, M. & Gafner, J. Dynamics of the yeast strain population during spontaneous alcoholic fermentation determined by CHEF gel electrophoresis. Letters of Applied Microbiology 19, 253-257 (1994). [ Links ]
13. Romano, P., Fiore, C., Paraggio, M., Caruso, M. & Cepece, A. Function of yeast species and strains in wine flavour. International Journal of Food Microbiology 86, 169-180 (2003). [ Links ]
14. Van Urk, H., Postma, E., Scheffers, W.A. & van Dijken, J.P. Glucose transport in Crabtree-positive and Crabtree-negative yeasts. Journal of General Microbiology 135, 2399-2406 (1989). [ Links ]
15. Kruckeberg, A.L. The hexose transporter family of Saccharomyces cerevisiae. Archives of Microbiology 166, 283-292 (1996). [ Links ]
16. Flores, C.L., Rodríguez, C., Petit, T, & Gancedo, C. Carbohydrate and energy-yielding metabolism in non-conventional yeasts. FEMS Microbiology Reviews 24, 507-529 (2000). [ Links ]
17. van Dijken, J.R., Weusthuis, R.A. & Pronk, J.T. Kinetics of growth and sugar consumption in yeasts. Antonie van Leeuwenhoek 63, 343-352 (1993). [ Links ]
18. Bisson, L.F., Yeasts metabolism of sugars. In: Wine Microbiology and Biotechnology (ed. Fleet, G.H.) 55-57 (Harwood Academic Publishers, Chur, Switzerland, 1993). [ Links ]
19. Goffrini, P., Ferrero, I. & Donnini, C. Respiration-dependent utilization of sugars in yeasts: A determinant role for sugar transporters. Journal of bacteriology 184(2), 427-432 (2002). [ Links ]
20. Entian, K.D. & Barnett, J.A. Regulation of sugar utilization by Saccharomyces cerevisiae. Trends in Biochemical Sciences 17, 506-510 (1992). [ Links ]
21. Kresze, G.B. & Ronft, H. Pyruvate dehydrogenase complex from Baker's yeast. 1. Properties and some kinetic and regulatory properties. European Journal of Biochemistry 119, 573-579 (1981a). [ Links ]
22. Kresze, G.B. & Ronft, H. Pyruvate dehydrogenase complex from Baker's yeast. 2. Molecular structure, dissociation, and implications for the origin of mitochondria. European Journal of Biochemistry 119, 581-587 (1981b). [ Links ]
23. Gailiusis, J., Rinne, R.W. & Benedict, C.R. Pyruvate-oxaloacetate exchange reaction in Baker's yeast. Biochimica et Biophysica Acta 92, 595-601 (1964). [ Links ]
24. Bulder, C.J.E.A. Induction of petite mutation and inhibition of synthesis of respiratory enzymes in various yeasts. Antonie van Leeuwenhoek 30, 1-9 (1964). [ Links ]
25. De Deken, R.H. The Crabtree effect and its relation to the petite mutation. Journal of Genetic Microbiology 44, 157-165(1966). [ Links ]
26. Middelhoven, W.J. & Kurtzman, C.P. Relation between phylogeny and physiology in some ascomycetous yeasts. Antonie van Leeuwenhoek 83, 69-74 (2003). [ Links ]
27. Nagai, S., Kane, N., Ochi, S., Kawai, K. & Yamazaki, T. Hereditary respiration deficiency in Saccharomycodes ludwigii. Antonie van Leeuwenhoek 42(4), 493-502 (1976). [ Links ]
28. Gancedo, C. & Serrano, R. Energy yielding metabolism. In: The Yeasts (eds. Rose, A.H. & Harrison, J.S) 205-259 (Academic Press, London, 1989). [ Links ]
29. Postma, E., Verduyn, C., Scheffers, W.A. & Van Dijken, J.P. Enzymic analysis of the Crabtree effect in glucose-limited chemostat cultures of Saccharomyces cerevisiae. Applied and Environmental Microbiology 55, 468-477 (1989). [ Links ]
30. Visser, W., Scheffers,W.A., Batenburg-Van Der Vegte, W.H. & Van Dijken, J.P. Oxygen requirements of yeasts. Applied and Environmental Microbiology 56(12), 785-3792 (1990). [ Links ]
31. Romano, P., Marchese, R., Laurita, C., Saleano, G. & Turbanti, L. Biotechnological suitability of Saccharomycodes ludwigii for fermented beverages. World Journal of Microbiology and Biotechnology 15, 451-454 (1999). [ Links ]
32. Blomberg, A. & Alder, L. Physiology of osmotolerance in fungi. Advances in Microbial Physiology 33, 145-212 (1992). [ Links ]
33. Remize, F., Roustan, J.L. Sablayrolles, J.M., Barre, P. & Dequin, S. Glycerol overproduction by engineered Saccharomyces cerevisiae wine yeast strains leads to substantial changes in byproduct formation and to a stimulation of fermentation rate in stationary phase. Applied and Environmental Microbiology 65,143-149 (1999). [ Links ]
34. Fredlund, E., Blank, L.M., Sauer, U., Schnurer, J. & Passoth, V. Oxygen and glucose dependent regulation of central carbon metabolism in Pichia anomala. Applied and Environmental Microbiology 70, 5905-5911 (2004). [ Links ]
35. Fredlund, E., Broberg, A., Boysen, M.E., Kenne, L. & Schnurer, J. Metabolite profiles of the biocontrol yeast Pichia anomala J121 grown under oxygen limitation. Applied Microbiology and Biotechnology 64, 403-409 (2004). [ Links ]
36. Lutstorf, U. & Megnet, R. Multiple forms of alcohol dehydrogenase in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics 126, 933-944 (1968). [ Links ]
37. Jacobson, M. K. & Bernofsky, C. Mitochondrial acetaldehyde dehydrogenase from Saccharomyces cerevisiae. Biochimica et Biophysica Acta 350, 277-291 (1974). [ Links ]
38. Boulton, B., Singleton, V.L., Bisson, L.F. & Kunkee, R.E. Yeast and biochemistry of ethanol fermentation. In: Principles and Practices of Winemaking (eds. Boulton, B., Singleton, B.L., Bisson, L.F. & Kunkee, R.E.) 139-172 (Chapman and Hall Publishers, New York, 1996). [ Links ]
39. Van Urk, H., Voll, W.S.L., Scheffers, W.A. & van Dijken, J.P. Transient-state analysis of metabolic fluxes in Crabtree-positive and Crabtree-negative yeasts. Applied and Environmental Microbiology 56, 281-287 (1990). [ Links ]
40. Remize, F., Andrieu, E. & Dequin, S. Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae: Role of the cytosolic Mg2+ and mitochondrial K(+) acetaldehyde dehydrogenases Ald6p and Ald4p in acetate formation during alcoholic fermentation. Applied and Environmental Microbiology 66, 3151-3159 (2000). [ Links ]
41. Prior, B.A. & Hohmann, S. Glycerol production and osmoregulation. In: Yeast Sugar Metabolism (eds. Zimmermann, F.K. & Entian, K.D.) 313-337 (Technomic Publishing, Lancaster, 1997). [ Links ]
42. Sa-Correia, I. & Van Uden, N. Temperature profiles of ethanol tolerance: Effects of ethanol on the minimum and maximum temperature for growth of Saccharomyces cerevisiae and Kluyveromyces fragilis. Biotechnology and Bioengineering 25, 1665-1667(1983). [ Links ]
43. Pina, C., Couto, J.A. & Hogg, T. Inferring ethanol tolerance of Saccharomyces and non- Saccharomyces yeasts by progressive inactivation. Biotechnology Letters 26, 1521-1527 (2004). [ Links ]
44. Ricci, M., Martini, S., Bonechi, C., Trabalzini, L., Santucci, A. & Rossi, C. Inhibition effects of ethanol on the kinetics of glucose metabolism by S. cerevisiae: NMR and modelling study. Chemical Physics Letter 387(4-6), 377-382 (2004). [ Links ]
45. D'Amore, T., Panchal, C.J., Russell, I. & Stewart, G.G. Ethanol tolerance in yeasts. Critical Reviews in Biotechnology 9, 287-304 (1990). [ Links ]
46. Nagodawithana, T.W., Whitt, J.T. & Cutaia, A.J. Study of the feedback effect of ethanol on selected enzymes of the glycolytic pathway. Journal of the American Society of Brewing Chemist 35, 179-193 (1977). [ Links ]
47. Nagodawithana, T.W. & Steinkraus, K. Influence of the rate ethanol production and accumulation on the viability of Saccharomyces cerevisiae in rapid fermentation. Applied and Environmental Microbiology 31, 158-162 (1976). [ Links ]
48. Granchi, L., Ganucci, D., Messini, A. & Vincenzini, M. Oenological properties of Hanseniaspora osmophila and Kloeckera corticis from wines produced by spontaneous fermentations of normal and dried grapes. FEMS Yeast Research 2, 403-407 (2002). [ Links ]
49. Ciani, C. & Maccarelli, F. Oenological properties of non-Saccharomyces yeasts associated with wine-making. World Journal of Microbiology and Biotechnology 14, 199-203 (2002). [ Links ]
50. Beech, F.W., Burroughs, L.F., Timberlake, C.F. & Whiting, G.C. Current progress in the chemical aspects and antimicrobial effects of sulphur dioxide (SO2). Bulletin de L'O.I.V52, 10011022 (1979). [ Links ]
51. Hammond, S.M. & Carr, J.G. The antimicrobial activity of SO2- with particular reference to fermented and non-fermented fruit juices. In: Inhibition and Inactivation of Vegetative Microbes (ed. Skinner, F.A. & Hugo, W.B.) 89-110 (Academic Press, London, 1976). [ Links ]
52. Jarvis, B. & Lea, A.G.H. Sulphite binding in ciders. International Journal of Foof Science and Technology 35, 113-127 (2000). [ Links ]
53. Hinze, H. & Holzer, H. Effect of sulfite or nitrite on the ATP content and the carbohydrate metabolism in yeasts. Zeitschrift für Lebensmitteluntersuchung und Forschung A 181, 87-91 (1985). [ Links ]
54. Maier, K., Hinze, H. & Leuschel, L. Mechanism of sulfite action on the energy metabolism of Saccaromyces cerevisiae. Biochimica et Biophysica Acta 848, 120-130 (1985). [ Links ]
55. Nykanen, L. Formation and occurrence of flavour compounds in wine and distilled alcoholic beverages. American Journal of Enology and Viticulture 37, 84-96 (1986). [ Links ]
56. Berry, D.R. & Watson, D.C. Production of organoleptic compounds. In: Yeast Biotechnology (eds. Berry, D.R., Russell, I. & Stewart, G.G.) 345-368 (Allen & Unwin., London, 1987). [ Links ]
57. Torija, M.J., et al. Effects of fermentation temperature and Saccharomyces species on the cell fatty acid composition and presence of volatile compounds in wine. International Journal of Food Microbiology 85, 127-136 (2003). [ Links ]
58. Yoshioka, H. & Hashimoto, N. Ester formation by alcohol acetyl transferase from brewer's yeast. Agricultural and Biological Chemistry 45, 2183-2190 (1981). [ Links ]
59. Suomalainen, H. Yeast esterase and aroma esters in alcoholic beverages. Journal of the Institute of Brewing 87, 296-300 (1981). [ Links ]
60. Malcorps, P., Cheval, J.M., Jamil, S. & Dufour, J.P. A new model for the regulation of ester synthesis by alcohol acetyltransferase in Saccharomyces cerevisiae during fermentation. Journal of the American Society of Brewing Chemists 49, 47-53 (1991). [ Links ]
61. Yoshioka, K. & Hashimoto, N. Acetyl-CoA of brewer's yeast and formation of acetate esters. Agricultural and Biological Chemistry 48, 207-209 (1984). [ Links ]
62. Mason, A.B. & Dufour, J.P. Alcohol acetyltransferases and the significance of ester synthesis in yeast. Yeast 16(4), 1287-1298 (2000). [ Links ]
63. Ouchi, K., Yamamoto, Y., Takagishi, M. & Akiyama, H. Regulation of isoamyl alcohol formation via Ehrlich pathway in Saccharomyces cerevisiae. Journal of Fermentation Technology 58, 301-309 (1980). [ Links ]
64. Mauricio, J.C., Moreno, J., Zea, L., Ortega, J.M. & Medina, M. The effects of grape must fermentation conditions on volatile alcohols and esters. Journal of the Science of Food and Agriculture 75, 155-160 (1997). [ Links ]
65. Rapp, A. & Mandery, H. New progress in wine and wine research. Experientia 42(8), 873-884 (1987). [ Links ]
66. Ribereau-Gayon, P., Dubourdieu, D., Doneche, B. & Lonvaud, A. Biochemistry of alcoholic fermentation and metabolic pathways of wine yeasts. In: Handbook of Enology. The Microbiology of Wine and Vinifications, (2nd edition) 74-77 (John Wiley and Sons, Ltd. The Atrium, Southern Gate, Chichester, England, 2006). [ Links ]
67. Guth, H. Quantitation and sensory studies of character impact odorants of different white wine varieties. Journal of Agricultural and Food Chemistry 45, 3027-3032 (1997). [ Links ]
68. Rous, C.V., Snow, R. & Kunkee, R.E. Reduction of higher alcohols by fermentation with a leucine-auxotrophic mutant of wine yeast. Journal of the Institute of Brewing 89(4), 274-278 (1983). [ Links ]
69. Meilgaard, M., Civille, G.V. & Carr, B.T., 1999. Sensory Evaluation Techniques. Chapter III, (3rd edition) 22-35 (CRC Press, Boca Raton, New York, 1999). [ Links ]
70. Su, S.K. & Wiley, R.C. Changes in apple juice flavor compounds during processing. Journal of Food Science 63(4), 688-691 (1998). [ Links ]
71. El-Nemra, S.E., Ismaila, I.A. & Askar, A. Aroma changes in mango juice during processing and storage. Food Chemistry 30(4), 269-27 (1988). [ Links ]
72. Ortega C., López, R., Cacho, J. & Ferreira, V. Fast analysis of important wine volatile compounds: Development and validation of a new method based on gas chromatography-flame ionization detection analysis of dichloromethane micro extracts. Journal of Chromatography A 923, 205-214 (2001). [ Links ]
73. Van Hoek, P., Van Dijken, J.P. & Pronk, J.T. Effect of specific growth rate on fermentative capacity of Baker's yeast. Applied and Environmental Microbiology 64(11), 4226-4233 (1998). [ Links ]
74. Novak, M., Strehaiano, P., Morena, M. & Goma, G. Alcoholic fermentation: On the inhibitory effect of ethanol. Biotechnology and Bioengineering 23, 201-211 (1981). [ Links ]
75. Stratford, M., Morgans, P. & Rose, A.H. Sulphur dioxide resistance in Saccharomyces cerevisiae and Saccharomycodes ludwigii. Journal of General Microbiology 133, 2173-2179 (1987). [ Links ]
76. Ribereau-Gayon, P., Dubourdieu, D., Doneche, B. & Lonvaud, A. The use of sulfur dioxide in must and wine treatment. In: Handbook of Enology. The Microbiology of Wine and Vinifications, (2nd edition) 193-197 (John Wiley and Sons, Ltd. The Atrium, Southern Gate, Chichester, England, 2006). [ Links ]
77. Nieuwoudt, H.H., Prior, B.A., Pretorius, I.S. & Bauer, F.F. Glycerol in South African table wines: an assessment of its relationship to wine quality. South African Journal of Enology and Viticulture 23, 22-30 (2002). [ Links ]
78. Ribereau-Gayon, J., Peynaud, E., Ribereau-Gayon, P. & Sudraud, P. Traite d'oenolgie: Sciences et techniques du vin (Paris: Dunod, 1975). [ Links ]
79. Mangas, J.J., Cabranes, C., Moreno, J. & Gomís, D.B. Influence of cider making technology on cider taste. Lebensmittel und Wissenschaft Technologie 27, 583-586 (1994). [ Links ]
80. Valero, E., Moyano, L., Millán, M.C., Medina, M. & Ortega, J.M. Higher alcohols and esters production by Saccharomyces cerevisiae. Influence of the initial oxygenation of the grape must. Food Chemistry 78, 57-61 (2002). [ Links ]
81. Ough, C.S., Guymon, J.F. & Crowell, E.A. Formation of higher alcohols during grapejuice fermentation at various temperatures. Journal of Food Science 31, 620-625 (1966). [ Links ]
82. Blanco, D., et al. Biochemical study of the ripening of cider apple varietes. Zeitschrift-fuer-Lebensmittel-Untersuchung und Forschung 194(1), 33-37 (1992). [ Links ]
83. Vidrih, R. & Hribar, J. Synthesis of higher alcohols during cider processing. Food Chemistry 67, 287-294 (1999). [ Links ]
84. Estela, W., et al. Study and analysis of metabolites of sensorial importance produced by non-Saccharomyces yeasts. In: 27th World Congress on Vine and Wine and 82nd General Assembly of the International Office of Vine and Wine-OIV (Bratislava, Slovak Republic, 24-28 June 2002). [ Links ]
85. Estela, W., Rychtera, M., Melzoch, K. & Egoavil, E. Synthesis of compounds of sensory importance by Saccharomyces and non-Saccharomyces yeast during cider fermentation. In: 6º Simposio internacional de alcoholes y levaduras (Bogotá, Colombia, 20-22 Junio 2007). [ Links ]
86. Verstrepen, K.J., et al. Flavor-active esters: Adding fruitiness to beer. Journal of Bioscience and Bioengineering 96(2), 110-118 (2003). [ Links ]
87. Suárez Valles, B., etal. Analytical differentiation of cider inoculated with yeast (Saccharomyces cerevisiae) isolated from Asturian (Spain) apple juice. LWT-Food Science and Technology 38, 455-461 (2005). [ Links ]
88. Picinelli, A., et al. Chemical characterization of Asturian cider. Journal of Agricultural and Food Chemistry 48, 3997-4002(2000). [ Links ]
89. Jarvis, B., Foster, M.J. & Kinsella, W.P. Factors affecting the development of cider flavour. Journal of Applied Bacteriology 79, 5S-18S (1995). [ Links ]
90. Wang, L., Xu, Y., Zhao, G. & Li, J. Rapid analysis of flavor volatiles in apple wine using Headspace Solid-Phase microextraction. Journal of the Institute of Brewing 110(1), 57-65 (2004). [ Links ]
91. Thurston, P.A., Quain, D.E. & Tuhh, R.S. Lipid metabolism and the regulation of volatile synthesis in Saccharomyces cerevisiae. Journal of the Institute of Brewing 88, 90-94 (1982). [ Links ]
92. Fujii, T., Kobayashi, O., Yoshimoto, H., Furukawa, S. & Tamai, Y. Effect of aeration and unsaturated fatty acids on expression of the Saccharomyces cerevisiae alcohol acetyltransferase gene. Applied and Environmental Microbiology 63(3), 910-915 (1997). [ Links ]
93. Saerens, S.M.G., et al. Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation. Appliedand Environmental Microbiology 74(2), 454-461 (2008). [ Links ]
94. Arikawa, Y., et al. Effect of gene disruptions of the TCA cycle on production of succinic acid in Saccharomyces cerevisiae. Journal of Bioscience and Bioengineering 87(1), 28-36 (1999). [ Links ]
95. Gupta, A. & Rao, G.A. Study of oxygen transfer in shake flasks using a non-invasive oxygen sensor. Biotechnology and Bioengineering 84(3), 351-358 (2003). [ Links ]
96. Tolosa, L., Kostov, Y., Harms, P. & Rao, G. Noninvasive measurement of dissolved oxygen in shake flasks. Biotechnology and Bioengineering 80(5), 594-597 (2002). [ Links ]
97. Nikakhtari, H. & Hill, G. Closure effects on oxygen transfer and aerobic growth in shake flasks. Biotechnology and Bioengineering 95(1), 15-21 (2006). [ Links ]
98. Johnson, M.J. Aerobic microbial growth at low oxygen concentrations. Journal of Bacteriology 94(1), 101-108 (1976). [ Links ]
99. Rosenfeld, E. & Beauvoit, B. Role of the non-respiratory pathways in the utilization of molecular oxygen by Saccharomyces cerevisiae. Yeast 20, 1115-1144 (2003). [ Links ]
100. Beeftink, H.H., Van der Heijden, R.T.J.M. & Heijnen, J.J. Maintenance requirements: Energy supply from simultaneous endogenous respiration and substrate consumption. FEMS Microbiology Letters 73(3), 203-209 (1990). [ Links ]
Información sobre los autores
Waldir Estela-Escalante
Waldir Estela-Escalante es Ingeniero de Alimentos, egresado de la Universidad Nacional del Callao, Lima, Perú. Realizó estudios de Maestría en Biotecnología Microbiana en la Facultad de Alimentos y Tecnología Bioquímica de la Universidad de Tecnología Química, Praga, República Checa. Obtuvo el grado PhD en Bioquímica y Biotecnología Microbiana (2004) en la Universidad de Tecnología Química, Praga, República Checa. Actualmente realiza una estancia de investigación en la Facultad de Ingeniería de Biociencias de la Universidad Católica de Lovaina, Bélgica. Es profesor permanente en la Facultad de Ingeniería Agroindustrial de la Universidad Nacional Micaela Bastidas de Apurímac, Perú. Profesor visitante en la Facultad de Biología de la Universidad Nacional Mayor de San Marcos, Perú. Docente en la Escuela de Postgrado de la Universidad Nacional San Antonio Abad del Cusco, Perú. Su línea principal de investigación está orientada a los procesos de fermentación por levaduras Saccharomyces y no-Sciccharomyces y por bacterias lácticas. En los últimos años muchas de sus actividades de investigación han estado dedicadas al estudio de enterobacterias y su relación con la actividad de descomposición de alimentos. Ha participado en numerosas conferencias nacionales e internacionales, es autor de varios artículos científicos relacionados al área de Tecnología de la Fermentación y Alimentos.
Mojmír Rychtera
Mojmír Rychtera es graduado de la Universidad de Tecnología Química en Praga en el área de Química de la Fermentación y Tecnologia. Recibió el grado de PhD en la Facuitad de Alimentos y Tecnologia Bioquímica en la misma Universidad. Trabajó en el Departamento de Química de la Fermentación y Bioingeniería como Profesor adjunto y después como profesor asociado. Al terminar sus estudios de PhD realizó investigación en la Universidad de Birmingham, Departamento de Ingeniería Química, UK. En 1992 fue designado como profesorpara el área de Química de la Fermentación y Bioingeniería. Su actividades de investigación están orientadas a varios procesos microbianos continuos y discontinuos (fermentación de levaduras, ácidos cítrico, itacónico, láctico y succínico, aplicación de microorganismos termofilicos en el tratamiento de aguas residuales), en los últimos años muchas de sus actividades están dedicadas a las materias primas renovables y su explotación para la producción de biocombustibles (etanol, butanol y biogas). Es autor y coautor de más de 140 artículos científicos.
Karel Melzoch
Karel Melzoch es graduado de la Universidad de Tecnología Química en Praga en el área de Química de la Fermentación y Tecnología. Recibió el grado de PhD en la Facultad de Alimentos y Tecnología Bioquímica en la misma Universidad. Trabajó en el Departamento de Química de la Fermentación y Bioingeniería como Profesor adjunto y, posteriormente, como profesor asociado (1997). Al terminar sus estudios de PhD realizó varias estancias de investigación en el Departamento de Biotecnología Industrial del Instituto de Tecnología Química de Moscú (Rusia), Departamento de Microbiología de la Universidad de Amsterdam (Holanda) y,enelINETI Lisboa (Portugal). En 2007 fue designado profesor principal en el área de Química de la Fermentación y Bioingeniería. Actualmente es Decano de la Facultad de Alimentos y Tecnología Bioquímica de la Universidad de Tecnología Química, Praga. Su línea de investigación está orientada a procesos biotecnológicos de producción de bioetanol, butanol, ácido láctico, biomasa microbiana, ergosterol y antibióticos. En los últimos años muchas de sus actividades han estado dedicadas a la explotación de desechos de la agricultura y de la industria alimentaria para la producción de biocombustibles. Es autor y coautor de muchos artículos científicos y conferencista nacional e internacional.
Beatriz Hatta-Sakoda
Beatriz Hatta-Sakoda, obtuvo el título de Ingeniero en Industrias Alimentarias y el Grado de Magister en Tecnología de Alimentos. Tiene cursos de especialización en Viticultura y Enología en el Rancho La Merced-Jerez de la Frontera (2000) y en el Instituto de Investigación y Tecnología Agraria y Alimentaria-Madrid (2002). Es Profesora Principal del Depto. Académico de Tecnología de Alimentos y Productos Agropecuarios-Facultad de Industrias Alimentarias y Profesora de la Especialidad de Tecnología de Alimentos de la Escuela de Postgrado de la Universidad Nacional Agraria La Molina-Lima-Perú.
Realiza labores de consultoría y asistencia técnica en el campo de la agroindustria, con especialización en el sector vitivinícola. Dentro de las labores de capacitación se encuentran los cursos impartidos a productores de vid y pisco de la provincia de Cañete (Lima), a través del Instituto Regional de Desarrollo Costa de la UNALM, ubicado en Cañete, del cual fue su Directora desde octubre de 2007 hasta febrero del 2010. Además, es miembro consultivo del Comité Técnico de Normalización de Bebidas Alcohólicas de INDECOPI-Perú.
Zulema Ludeña-Cervantes
Zulema Ludeña-Cervantes es Ingeniero de Industrias Alimentarias de la Universidad Nacional San Agustín de Arequipa, Perú. Obtuvo el grago de MSc. en Ciencia y Tecnología de Alimentos en la Universidad Nacional San Antonio Abad del Cusco, Perú. Es docente en la Universidad Nacional Micaela Bastidas de Apurímac, Perú en el área de Biotecnología Agroindustrial y Microbiología Agroindustrial. Ha participado en numerosos congresos nacionales. Su investigación se enfoca al área de Fermentación de Levadurasy Tecnología de Alimentos.
Víctor Sarmiento-Casavilca
Víctor Sarmiento-Casavilca es Ingeniero en Industrias Alimentarias egresado de la Universidad Nacional San Cristóbal de Huamanga-Perú, tiene el grado académico de Maestro en el área de Tecnología de Alimentos en la Universidad Nacional Agraria La Molina - Perú y en la actualidad es candidato al grado de PhD en Ingeniería y Ciencias Biológicas, en la mención de Biotecnología, en la misma Universidad. Actualmente es jefe del laboratorio de Biotecnología Agroindustrial de la Universidad Nacional Micaela Bastidas de Apurímac-Perú, donde es docente universitario, actualmente su investigación enfoca a la Fermentación por adhesión a superficies: biopelículas para la producción de enzimas y la aplicación de éstos en el campo alimentario.
Guadalupe Chaquilla-Quilca
Guadalupe Chaquilla-Quilca es Ingeniero Agroindustrial egresada de la Universidad Nacional del Altiplano Puno-Perú, obtuvo el título de Maestro en Ciencia y Tecnología de Alimentos en la Universidad Autónoma de Chihuahua, Chih. México. Ha participado como ponente en varios congresos nacionales y publicado un artículo en la RESPYN de la UANL, actualmente es Investigadora de la Universidad Nacional Micaela Bastidas de Apurímac, Abancay, Perú en las líneas de Tecnología y Biotecnología de Alimentos, fue asesora de tesis de pregrado y licenciatura.














