Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.13 no.2 Ciudad de México dic. 2010
Artículos de revisión
Regulación neuroendocrinológica de la función inmunitaria: el papel de la hipófisis y los esteroides sexuales
Neuroendocrine regulation of the immune response: the role of the pituitary and sex steroids
Rosalía Hernández-Cervantes, Ana Gabriela Sánchez-Acosta, Ricardo Ramírez-Nieto y Jorge Morales-Montor
Departamento de Inmunología, Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México, Apdo. Postal 70228, México, D.F. C.P. 04510, México. E-mail: jmontor66@biomedicas.unam.mx, jmontor66@hotmail.com
Artículo recibido el 07 de septiembre de 2010.
Aceptado el 05 de octubre de 2010.
Resumen
Los sistemas inmunológico y neuroendocrino integran una compleja red fisiológica, en la cual citocinas, hormonas peptídicas, hormonas esteroides y neuropéptidos regulan y modifican la respuesta inmune, manteniendo de manera conjunta la homeostasis del organismo. Dos de los principales componentes de esta red son los ejes hormonales hipotálamo-hipófisis-adrenales (HPA) e hipotálamo-hipófisis-gónadas (HPG). Las interacciones entre el sistema inmunológico y los ejes hormonales HPA y HPG repercuten de manera trascendental en el inicio y activación de la respuesta al estrés, misma que a su vez posee funciones inmunomoduladoras, importantes en la prevención de una excesiva respuesta inmune. Además, las funciones de ambos ejes inciden en la adaptación y mantenimiento de la homeostasis durante procesos patológicos severos, como los provocados por virus, bacterias, parásitos o enfermedades autoinmunes, por citar algunos. Un aspecto importante de la comunicación celular, que ha surgido como resultado del estudio de las interacciones neuroinmunoendocrinas, es la redundancia en el uso de una gran cantidad de mensajeros químicos. Como un ejemplo de este papel redundante están las neurotrofinas, presentes en el sistema nervioso, que son también expresadas y secretadas por células inmunológicas y endocrinas, modificando en última instancia la función de los dos sistemas representados. De esta manera, "la pérdida de la exclusividad" en el uso de mensajeros químicos por sistemas orgánicos específicos puede ser una regla más que una excepción. Sin embargo, aunque una gran cantidad de evidencias experimentales sugieren que: 1) células neuronales, endocrinas e inmunológicas producen neurotransmisores, neurohormonas, hormonas peptídicas y esteroideas, así como citocinas, y aunque 2) las mismas células sintetizan y expresan los receptores para esas moléculas, aún queda por esclarecer el papel de estas interacciones y su papel durante la salud y diversas enfermedades, particularmente en la red de comunicación entre la hipófisis y el sistema inmunológico.
Palabras Clave: Enfermedad, enfermedades parasitarias, esteroides sexuales, hipófisis, red neuroinmunoendocrina, regulación inmunitaria, salud.
Abstract
The immune and neuroendocrine systems comprise a complex physiological network, in which cytokines, peptide hormones, steroid hormones and neuropeptides regulate and modify the immune response, jointly maintaining the homeostasis of the organism. Two of the main components of this network are the hypothalamus-pituitary-adrenal (HPA) and hypothalamic-pituitary-gonadal (HPG) axes. The interactions among the immune system and HPA/HPG axes are trascendental in the initiation and activation of the stress response, which in turn has immunomodulatory functions that are very important in preventing excessive immune responses. In addition, the functions of both axes affect the adaptation and maintenance of homeostasis during severe pathological processes, such as those caused by viruses, bacteria, parasites or autoimmune diseases, to name a few. An important aspect of cellular communication, which has emerged as a result of studying the neuroimmunoendocrine interactions is the redundancy in the use of a large number of chemical messengers. As an example of this redundant role, neurotrophins are mainly present in the nervous system, but are also expressed and secreted by immune and endocrine cells, ultimately regulating the function of the systems named. In this way, the loss of exclusivity in the use of chemical messengers by specific organ systems can be a rule rather than an exception. However, although a large amount of experimental evidence suggests that 1) neuronal, endocrine and immune cells produce, neurotransmitters, neurohormones, steroid and peptide hormones as well as cytokines, and although 2) all of these cell types also express receptors to all these molecules, it still remains to clarify the role of these interactions on the neuroimmunoendocrine network, particularly the one played by the pituitary gland, during health and in various diseases.
Key Words: Disease, parasitic diseases, sex steroids, pituitary, neuroimmunoendocrine network, immune regulation, health.
Introducción
La homeostasis es un rasgo distintivo de todos los organismos vivos, caracterizado por el mantenimiento del equilibrio interno con respecto al medio exterior. Claude Bernard (1813-1878), eminente médico y biólogo teórico, considerado como el padre de la fisiología moderna, postuló en 1865 este término, poniendo especial énfasis en los distintos sistemas dinámicos que un organismo posee, con la finalidad de preservar una condición fisiológica estable, capaz de auto-ajustarse y llevar al organismo a un nuevo estado homeostático. En vertebrados superiores, particularmente mamíferos, existen diversos mecanismos homeostáticos que regulan múltiples aspectos fisiológicos, como la temperatura corporal, el balance electrolítico, el intercambio de gases (oxígeno) y diversos procesos anabólico-catabólicos, entre otros. Sin embargo, estos mecanismos se encuentran regulados a su vez, a través de sistemas homeostáticos más complejos, entre los cuales destacan por su importancia el sistema nervioso central (SNC), el sistema endocrino (SE) y el sistema inmunológico (SI).
El SNC está constituido por el encéfalo y la médula espinal. Su función principal es la de recibir estímulos internos y externos, interpretarlos y coordinar una respuesta precisa por medio de distintos órganos efectores. El encéfalo se compone principalmente por dos tipos celulares, neuronas y células gliales. Las principales funciones de las células gliales, también conocidas como neuroglia, son las de proveer soporte y nutrición a las neuronas, así como la generación de nuevos cuerpos neuronales. Las neuronas por su parte, están a cargo de la recepción de estímulos tanto internos como externos y la pronta orquestación de una respuesta a través de la transmisión del impulso nervioso por medio de potenciales de acción y neurotransmisores. A través de cientos de conexiones axonales, las neuronas se comunican entre sí, formando una compleja pero eficiente red de procesamiento de información que regula y mantiene la homeostasis del organismo.
El SE constituye otro de los sistemas homeostáticos más importantes de los mamíferos. Su función principal es la de comunicar a las distintas células, tejidos, órganos y sistemas de un organismo a través de la secreción de hormonas o mensajeros químicos. Las hormonas, de naturaleza química esteroide o proteínica, son sintetizadas y liberadas por células especializadas en respuesta a un estímulo. Estas células se concentran en glándulas endocrinas, como son el hipotálamo y la hipófisis en el SNC, la glándula tiroides y paratiroides, las adrenales, ovarios y testículos, entre las más importantes. Estas hormonas son depositadas en el torrente circulatorio, a través del cual pueden ser transportadas y encontrar a su célula blanco, aun en órganos sumamente alejados de la glándula donde originalmente se sintetizó la hormona. El efecto de las hormonas depende proporcionalmente de su concentración, así como de la presencia de receptores específicos para éstas en las células blanco.
Las hormonas esteroideas (17ß-estradiol, progesterona, dehidroepiandrosterona, testosterona, aldosterona y cortisol) y proteínicas (hormona liberadora de corticotropina, hormona luteinizante, hormona folículoestimulante, tiroxina, prolactina, oxitocina, y hormona del crecimiento) mantienen una permanente comunicación entre los sistemas nervioso y endocrino, constituyendo al sistema neuroendocrino (SNE), de bien sabida importancia en procesos como el crecimiento, la diferenciación y la reproducción1.
El SI constituye un sistema vital en el mantenimiento de la homeostasis interna de un organismo, particularmente cuando ésta se ve amenazada por un agente invasor como pueden ser virus, bacterias, y parásitos (intra y extracelulares), entre otros. Los primeros estudios realizados por investigadores tan eminentes como Elie Metchnikoff (1845-1916) o Paul Ehrlich (1854-1915), dejaron ver que el SI no sólo se encarga de la defensa del organismo, sino que éste es capaz de discriminar entre lo propio y lo extraño, una función sumamente dinámica a niveles moleculares y celulares que mantiene el equilibrio fisiológico intrínseco de un individuo y se ve interrumpido durante un proceso patogénico.
El SI está conformado por una gran variedad de tipos celulares, entre los cuales destacan los linfocitos T (colaboradores Th, T citotóxicos CD8, o los T γ/δ) y B (células plasmáticas), así como células presentadoras de antígenos (APC: macrófagos y células dendríticas) y otros tipos de granulocitos (eosinófilos, basófilos, mastocitos y neutrófilos). En su conjunto, todos estos tipos celulares constituyen la respuesta inmunológica que, dependiendo del estímulo antigénico, puede ser innata o adaptativa.
Las células del sistema inmune se comunican principalmente a través de citocinas. Las citocinas son mensajeros químicos de origen proteínico, capaces de estimular receptores específicos de membrana y regular de esta manera la respuesta inmune contra un patógeno, así como procesos de proliferación celular, quimiotaxis, producción de anticuerpos, fagocitosis, entre otros.
Paradójicamente, se consideraba anteriormente que el SI era regulado de forma autónoma, dejando de lado la trascendental comunicación multidireccional que este sistema posee con el SNC. De hecho, los distintos componentes del SI no son regulados exclusivamente por el mismo sistema. Así lo indicaron los primeros estudios realizados por Calzolari en 18982 y Chiodi en 19403, en donde se observó que el tamaño del timo era mayor en conejos castrados y que la restitución de estos animales con andrógenos exógenos revertía la hipertrofia tímica2,3. Además, la tasa de producción de anticuerpos es mayor en mujeres que en hombres, debido a que los estrógenos son capaces de estimular la respuesta de células B. Este efecto tiene consecuencias directas sobre el advenimiento de distintas enfermedades autoinmunes (esclerosis múltiple, artritis reumatoide, lupus eritematoso sistémico, enfermedad de Addison, síndrome de Sjögren, entre otros), de bien sabida mayor incidencia en mujeres que en hombres4.
Adicionalmente, se sabe que diversas citocinas como IL-1 ß e IL-6, además del MIF (macrophage migration inhibitory factor, por sus siglas en inglés), poseen múltiples efectos sobre neuronas de hipocampo e hipofisiarias5. Estas estructuras cerebrales producen a su vez neuropéptidos como el VIP (péptido intestinal vasoactivo), la somatostatina y la sustancia P (SP), todos ellas con importantes repercusiones en la regulación de la inflamación sistémica y de mucosas6.
Por otro lado, esta misma respuesta inflamatoria puede ser suprimida por la administración de glucocorticoides en dosis suprafisiológicas y farmacológicas, debido al efecto que estas hormonas esteroides poseen sobre la expresión de interferón gamma (IFN-γ)7. De esta manera, se puede apreciar que el SI no está exento de una macro-regulación sistémica, por el contrario, forma parte de ella, regulando diversas respuestas en el SNC y el SE, y de manera recíproca, siendo regulado por ambos. El resultado de esta comunicación multidireccional entre el sistema nervioso central, endocrino e inmune, es una compleja red de interacciones neuroinmunoendocrinas (NIE) con una función preponderante, preservar la homeostasis del organismo durante procesos de salud y enfermedad (Figura 1).
El objetivo de esta revisión es abordar el estudio de la red de interacciones NIE de manera integrativa, con ejemplos prácticos en donde se aprecie la participación individual y colectiva del SNC, SE y SI, en infecciones humanas y en modelos experimentales. Los alcances de este tipo de estudios son muy promisorios, ya que si conocemos con profundidad los componentes del sistema NIE que interactúan entre sí durante una infección parasitaria, podremos diseñar estrategias terapéuticas con la finalidad de prevenir, controlar y curar estas graves zoonosis humanas y veterinarias. Basados en este conocimiento y dado el auge de la biología molecular y otras modernas herramientas biotecnológicas, es posible diseñar nuevos fármacos que potencien el sistema NIE. Por último, el advenimiento de nuevas pandemias y otros factores que alteran la red de interacciones NIE, nos insta a tratar de entender de manera integral los sistemas homeostáticos involucrados en la defensa dinámica del organismo, sin dejar de lado los beneficios que el uso y las posibles aplicaciones de la red NIE puede traer a la salud humana.
Papel de la hipófisis y las hormonas hipofisiarias en la regulación inmunológica
La glándula pituitaria, o hipófisis, es llamada la glándula "maestra" del sistema endocrino, debido a que controla las funciones de varias otras glándulas endocrinas (Figura 2). La glándula pituitaria es del tamaño de un chícharo, está situada en la base del cerebro, unida al hipotálamo (una parte del cerebro que afecta la glándula pituitaria) por las fibras nerviosas. Está formada por tres secciones anatómicas muy claras: el lóbulo anterior o adenohipófisis (Figura 2), el lóbulo intermedio y el lóbulo posterior o neurohipófisis.
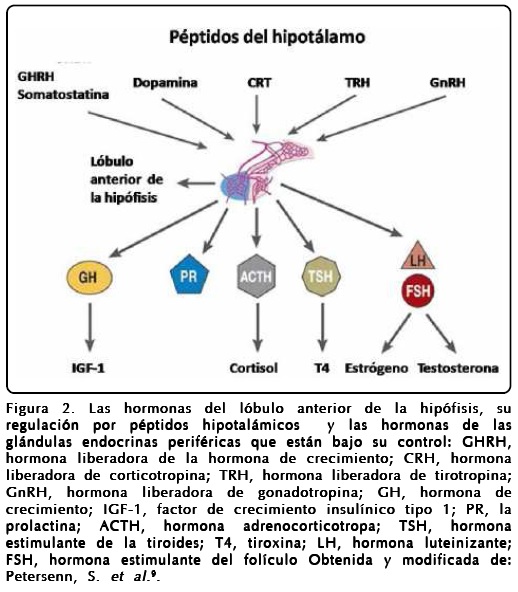
Cada lóbulo de la glándula pituitaria produce ciertas hormonas. La adenohipófisis produce la hormona del crecimiento (GH), la prolactina (PRL), la hormona adenocorticotrópica (ACTH), la hormona estimulante de la tiroides (TSH), la hormona folículo-estimulante (FSH), la hormona luteinizante (LH); el lóbulo intermedio produce principalmente a la melatonina (hormona estimulante de melanocitos); mientras que la neurohipófisis almacena arginina vasopresina (AVP o también conocida como la vasopresina) y oxitocina, que son producidas en el hipotálamo.
Las enfermedades de la glándula pituitaria pueden conducir a la disfunción de los distintos ejes hormonales y de las manifestaciones clínicas correspondientes. La disfunción hipofisaria puede ser causada por una gran variedad de enfermedades que afectan a la glándula hipófisis y el hipotálamo y pueden producir manifestaciones clínicas principales, incluyendo coma pituitario. Los adenomas hipofisiarios son probablemente mucho más comunes que como antes se suponía, su prevalencia es aproximadamente de 1 por 1000 personas8. Las causas conocidas de disfunción de la hipófisis incluyen tumores, hemorragia, cirugías y radioterapia. En los últimos años el déficit de los distintos ejes de la hipófisis después de un traumatismo en la cabeza ha llegado a ser reconocido como un problema clínicamente relevante9.
Debido a esta entidad recientemente apreciada, la prevalencia de la disfunción de la hipófisis es probable que sea mucho más alta que la estimada previamente de 0.5 por cada 1000 habitantes10. Una vez que los déficits hormonales han sido diagnosticados, pueden ser tratados por suplementación, de modo que la calidad de vida del paciente se vuelve casi normal9. Los adenomas hipofisiarios son neoplasias benignas asociadas con una morbilidad considerable debido a los efectos de masas, la sobreproducción hormonal y la insuficiencia hipofisiaria. En adenomas hipofisiarios no funcionanles (NFMAs), la morbilidad es causada por los efectos de masa del tumor que conducen a defectos del campo visual, disminución de la agudeza visual y la insuficiencia hipofisiaria en la mayoría de los pacientes. En funcionalidad de los adenomas de hipófisis, la morbilidad es causada por la sobreproducción hormonal, además de los efectos de masa tumoral en los casos de macroadenomas. En la enfermedad de Cushing, el exceso de cortisol causa obesidad central, resistencia a la insulina, hipertensión, hiperlipidemia y osteoporosis. Por otra parte, la sobreproducción de cortisol se asocia con mayor riesgo cardiovascular, continúa incluso después de la remisión de la enfermedad11.
Hormonas, citocinas y factores de crecimiento
Las citocinas son proteínas dotadas de actividad biológica capaces de ejercer acciones sobre la misma célula secretora (acción autocrina) o sobre blancos celulares distantes (acción paracrina). Estos efectos están mediados por la interacción con receptores específicos e implican la transducción ulterior de la señal al núcleo de las células efectoras. Esta definición operacional hace que la distinción entre citocinas, factores de crecimiento y hormonas resulte frecuentemente imprecisa. En un sentido general, aunque el concepto de citocinas y factores de crecimiento es en esencia similar, se considera citocinas a las moléculas involucradas en mecanismos inmunológicos que actúan sobre los leucocitos, mientras que las moléculas que actúan sobre otras células somáticas son descritas como factores de crecimiento. La diferencia resulta más evidente cuando se trata de hormonas y citocinas: las citocinas actúan fundamentalmente a nivel local, ejerciendo sus acciones principales en el sitio mismo de producción, mientras que su tiempo de vida media resulta limitado en la circulación general (un buen ejemplo es la presentación antigénica entre macrófagos y células T). En contraste, las hormonas se diseminan por el torrente sanguíneo a través del organismo y actúan a distancia sobre un amplio rango de órganos diana12.
Papel de las hormonas pituitarias en la red neuroinmunoendocrina
Hormonas de la adenohipófisis
El hipopituitarismo es la insuficiencia parcial o total de la secreción de hormonas del lóbulo anterior de la hipófisis y puede deberse a una enfermedad hipotalámica o hipofisiaria. Hay una incidencia reportada de 12-42 nuevos casos por millón, cada año, y una prevalencia de 300 a 455 por millón. Las manifestaciones clínicas dependen del grado de la deficiencia de la hormona y no pueden ser específicas, tales como fatiga, hipotensión, intolerancia al frío o pueden ser más indicativos como el retraso del crecimiento, en el caso a una deficiencia de GH. Un número de enfermedades inflamatorias, granulomatosas o neoplásicas, así como traumáticas o lesiones debidas a radiaciones involucran la región hipotálamo-hipófisis. Inexplicables disfunciones gonadales, anomalías del desarrollo craneofacial, el síndrome de la silla vacía y la hemorragia asociada al embarazo o los cambios de la presión arterial pueden estar asociados con un funcionamiento defectuoso de la adenohipófisis. El diagnóstico del hipopituitarismo se basa en la medición de la secreción basal y la estimulación de hormonas de la adenohipófisis, además de que la RMN de la región hipotálamo-hipofisiaria puede proporcionar información esencial13.
♦ Hormona del crecimiento (GH)
La GH es una hormona hipofisiaria importante que participa principalmente en el crecimiento corporal y el metabolismo. En los mamíferos, el control del parasitismo por Trypanosoma cruzi en la fase aguda de la infección se considera extremadamente dependiente de la activación de los macrófagos por las citocinas directas. Un experimento con ratas Wistar machos tratadas con GH mostró una reducción significativa de tripomastigotes en sangre durante la fase aguda de la infección en comparación con los animales no tratados. Las observaciones histopatológicas de tejido cardiaco revelaron que la administración de GH también resultó en una menor carga de amastigotes, así como de menor tamaño. Estos resultados mostraron que la GH puede ser considerada como una sustancia inmunomoduladora para controlar la replicación del parásito, y en combinación con el fármaco comúnmente utilizado puede representar en el futuro una nueva herramienta terapéutica para reducir los efectos nocivos de la enfermedad de Chagas14.
♦ Prolactina (PRL)
La PRL fue originariamente identificada como una hormona neuroendocrina de origen pituitario entre 1931 y 1934. Durante los cuarenta años siguientes se consideró que su función primaria estaba limitada a la glándula mamaria y no fue sino hasta 1974 cuando el pleotropismo funcional de esta hormona con respecto a funciones tan distantes como reproducción, osmorregulación y comportamiento comenzó a ser reconocido15. Además de controlar el desarrollo de la glándula mamaria, regular las secreciones de las glándulas reproductoras y la actividad osmótica, la PRL participa de una asombrosa variedad de procesos fisiológicos en numerosas especies de vertebrados y en los mamíferos ejerce una marcada actividad inmunorregulatoria12.
La PRL mantiene una marcada interacción bidireccional con el sistema inmunológico: estimula la proliferación linfocitaria, estimulando de este modo la respuesta inmune, mientras que sus propias acciones biológicas se hallan bajo el control de citocinas capaces de modificar la concentración plasmática de PRL. Estos efectos recíprocos implican la presencia de receptores específicos para PRL, presentes en la membrana celular de numerosas clases de linfocitos y accesorias16,17. La unión de PRL a estos receptores estimula la síntesis y secreción de citocinas linfocitarias y es un factor de crecimiento esencial para al menos una línea celular linfoide y células accesorias. También se ha demostrado la presencia del mensajero correspondiente a PRL en el citoplasma de linfocitos estimulados por mitógenos y se ha documentado la secreción efectiva de PRL por células linfoides. La PRL actúa sobre las células NK induciendo su diferenciación hacia células killer activadas por PRL (células PAK) de un modo dosis-dependiente (activación a concentraciones fisiológicas e inhibición de la citotoxicidad a concentraciones 10 veces superiores). Además de actuar como un factor de diferenciación de células PAK, la PRL parece modular el efecto promotor de células LAK de la IL-2 y es un potente inductor de la síntesis de IFN-γ e IL-2, lo que sugiere su participación en la génesis de respuestas Th1. Este repertorio de propiedades inmunológicas hace que la PRL sea actualmente considerada como una citoquina y su participación en la respuesta inmune normal y en numerosos procesos patológicos plantea un importante espectro de potenciales aplicaciones terapéuticas12. La existencia de nexos entre los sistemas nerviosos, endocrino e inmunológico ha sido sostenida desde 1930, cuando se descubrió por primera vez el fenómeno de involución tímica post-hipofisectomía en ratas. Al respecto, resulta muy interesante que la hipofisectomía cause una profunda inmunodeficiencia18,19, lo que demuestra que las hormonas "pituitarias" producidas por células inmunológicas en los órganos linfoides resultan insuficientes para contrarrestar los efectos inmunosupresores de la hipofisectomía, y por lo tanto no están destinadas a funcionar como una "reserva" endocrina. Por el contrario, el hecho de que estas hormonas son producidas por diversas poblaciones celulares sugiere un rol en la inmunorregulación, probablemente mediante acciones autocrino-paracrinas12.
La hipofisectomía suprime la hematopoyesis y la proliferación celular del sistema inmunológico en las ratas, causando atrofia de los órganos linfoides y un deterioro progresivo de las funciones inmunológicas. Nagy y Berczi demostraron que las ratas hipofisectomizadas sufren un deterioro de la respuesta inmune humoral y celular17, el cual revierte mediante la administración de PRL o de hormona de crecimiento12. La expresión del gen de la PRL y la presencia de una proteína inmunorreactiva similar a la PRL de 14-kilodaltons (kDa) en el sistema hipotálamo-neurohipofisiario de la rata plantearon la posibilidad de que las variantes de PRL se liberan desde las terminales neurohipofisiarias en la sangre20. La actividad de las neuronas magnocelulares que sintetizan vasopresina y oxitocina en los núcleos paraventricular y supraóptico del hipotálamo puede ser modulada por la liberación local de neuromediadores dentro de los núcleos. Entre los péptidos bioactivos que pueden jugar un papel autócrino o parácrino en este sistema es la PRL. Las neuronas paraventricular y supraópticas expresan RNAm a PRL y contienen y secretan proteínas similares a la PRL de 23 y 14 kDa. Se investigó la localización de los receptores de PRL en las neuronas magnocelulares vasopresinérgicas y oxitocinérgicas con inmunofluorescencia de doble marcaje y los resultados demuestran que tanto la vasopresina y la oxitocina de las células endoteliales de los núcleos paraventricular y supraóptico contienen el receptor de PRL. Los resultados muestran que la PRL y un fragmento de 16 kDa N-terminal de la hormona que es análoga al fragmento neurohipofisiario de 14-kDa de la PRL estimula la liberación de vasopresina. En conjunto, estos resultados apoyan la hipótesis de que las neuronas vasopresinérgicas y oxitocinérgicas del sistema de secreción magnocelular son regulados directamente por diferentes isoformas de PRL a través de mecanismos autocrinos/paracrinos21.
♦ El papel de la PRL en enfermedades parasitarias
La elevación de los niveles séricos de la PRL (hiperprolactinemia) se produce en ambos sexos, aunque es más frecuente entre mujeres en edad reproductiva. Las principales causas de hiperprolactinemia patológica son: tumores hipofisiarios (prolactinomas), hipotiroidismo primario, enfermedad hipotalámica, insuficiencia renal crónica, cirrosis y la ingestión de fármacos que bloquean el efecto inhibidor de la dopamina sobre la secreción de PRL22. La toxoplasmosis es una zoonosis parasitaria producida en todo el mundo por el protozoario intracelular Toxoplasma gondii, el cual es un agente importante de enfermedades de animales y humanos relacionadas con defectos congénitos del nacimiento e inmunosupresión. En estas circunstancias es incapaz de controlar la multiplicación del parásito, que a menudo resulta en aborto o trastornos neurológicos y patologías oftálmicas23. Por el contrario, en individuos inmunocompetentes, T. gondii induce una infección crónica, generalmente asintomática22. Katarzyna y cols. mencionan que un alto nivel de PRL puede ser uno de los factores importantes para prevenir la infección por T. gondii en las mujeres22.
♦ Hormona adenocorticotrófica (ACTH)
El eje hipotálamo-pituitario-adrenal (HPA) desempeña un importante papel en el mantenimiento de la homeostasis del estrés. El hipotálamo controla la secreción de la ACTH de la hipófisis anterior, que a su vez estimula la secreción de glucocorticoides de la corteza suprarrenal. Los glucocorticoides, los finales efectores del eje HPA, regulan un amplio espectro de funciones fisiológicas esenciales para la vida y ejercen sus efectos a través de sus receptores intracelulares que están ubicados por doquier24. Las alteraciones en la actividad del eje HPA pueden presentarse con signos y síntomas de la deficiencia o el exceso de glucocorticoides. Una evaluación endocrinológica detallada es de vital importancia para determinar el diagnóstico y/o etiología de la condición subyacente (Figura 3).
El término síndrome de Cushing se refiere a cualquier forma de exceso de glucocorticoides. La enfermedad de Cushing se refiere a un hipercortisolismo debido al aumento de la secreción de ACTH por la hipófisis anterior, mientras que el trastorno de origen no hipofisiario se denomina síndrome de Cushing ectópico. El síndrome de Cushing iatrogénico se refiere a un hipercortisolismo debido a la administración de dosis suprafisiológicas de ACTH o corticoides25,26. El síndrome de Cushing es poco frecuente en la infancia y los síntomas pueden variar, sin embargo, el diagnóstico debe ser considerado en cualquier niño con aumento de peso y falta de crecimiento. Los primeros signos de un exceso de glucocorticoides incluyen el aumento de apetito, aumento de peso y detención del crecimiento, sin un concomitante retraso en la edad ósea, mientras que el exceso crónico de glucocorticoides causa la típica facies cushingoide (la cara se ve más redonda, la piel se aprecia más fina y eritematosa, es frecuente observar mayor cantidad de vellos y lesiones de acné), aunque la joroba de búfalo y la distribución centrípeta de la grasa corporal puede sólo ser percibida en una enfermedad sin diagnosticar de larga duración24. Adiposidad progresiva, dermopatía (atrofia, estrías, equimosis, hirsutismo), miopatía, hipertensión, resistencia a la insulina, hiperlipidemia, osteoporosis, disfunción gonadal y tiroidea y la desaceleración de crecimiento en niños son las manifestaciones clásicas27.
♦ Hormona estimulante de la tiroides (TSH)
Jailer & Holub postularon en 1960 que un tumor pituitario podría ser responsable de cantidades excesivas de tirotropina (TSH) y de tirotoxicosis. Durante los 20 años siguientes a esta publicación, los informes de tumores pituitarios secretores de TSH fueron escasos28. El diagnóstico y tratamiento de estos tumores raros han evolucionado considerablemente en las últimas dos décadas, debido a la difusión del concepto de secreción inadecuada de TSH, los métodos ultrasensibles para la medición de TSH, la mejora de la imagen de la hipófisis que conducen a un mejor reconocimiento de los microadenomas hipofisiarios y, por último, a la disposición de análogos de la somatostatina29.
Esteroides Sexuales
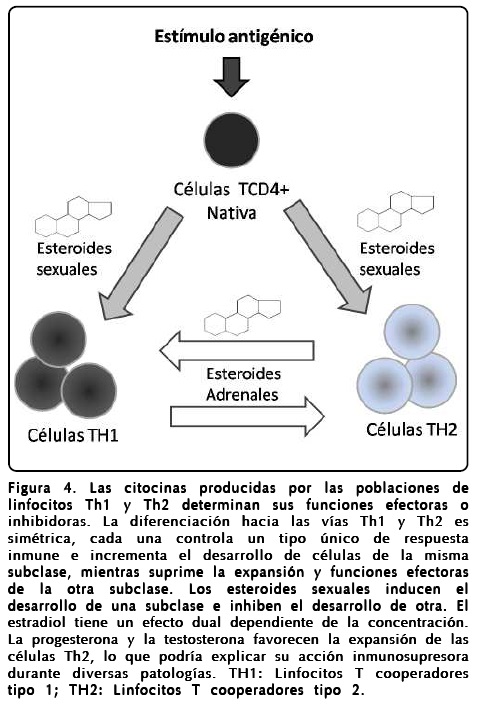
Se ha demostrado que el sexo, y los esteroides asociados a éste, son factores que influyen, de manera significativa, en varios aspectos del sistema inmune (Figura 4). Una gran cantidad de trabajos sobre la interacción entre el sistema inmune y el sistema neuroendocrino indican que diversas hormonas son capaces de afectar funciones inmunológicas de diversa índole y que entre ambos sistemas existe una conexión directa y bidireccional1. Las hormonas, además de las de naturaleza proteínica, incluyen tanto a los glucocorticoides, cuyo efecto anti-inflamatorio se conoce desde hace décadas, como a los esteroides sexuales estradiol (E2), progesterona (P4) y testosterona (Te). A lo largo de su vida los machos y las hembras presentan diferencias basadas en la producción, secreción y concentraciones circulantes de estas hormonas. La base de estas diferencias se encuentra principalmente en la función y desarrollo del eje hipotálamo-pituitaria-gónadas (HPG). Las interacciones entre las hormonas producidas por el eje HPG y otras hormonas, además de productos de genes independientes del sexo, producen un fenotipo de macho o de hembra. Aunque existe una gran variación entre individuos, el fenotipo de hembra se caracteriza típicamente por elevaciones cíclicas de estrógenos y progesterona y bajos niveles de andrógenos. En contraste, el fenotipo hormonal de macho se caracteriza por bajos niveles de estrógenos y progesterona y altos niveles de andrógenos. De lo anterior, se deduce que una diferencia en niveles de esteroides sexuales entre un sexo y otro, también puede determinar la diferencia entre la respuesta inmune de uno u otro sexo al mismo estímulo antigénico o determinar funciones inmunológicas diferentes entre ambos sexos.
La importancia de la interacción de los sistemas inmune y endocrino se ve reflejada durante fenómenos como el embarazo, las enfermedades autoinmunes y algunas enfermedades infecciosas. En todos los casos existen evidencias de que los esteroides sexuales tienen un papel importante como inmunorreguladores. Aunque todavía falta mucho por esclarecer, actualmente se sabe que dichas hormonas son capaces de regular diferentes procesos implicados en la respuesta inmune, incluyendo la maduración y selección de timocitos, el tránsito celular, la expresión de moléculas y receptores del complejo mayor de histocompatibilidad clase II, la proliferación de linfocitos y la producción de citocinas. Para llevar a cabo estas acciones, posee un repertorio de células altamente especializadas que llevan a cabo distintas funciones con precisión y eficacia. Estas células son delicadamente reguladas por moléculas secretadas por los componentes propios del sistema inmune, pero también son susceptibles a la regulación por parte de hormonas, neurohormonas y/o neurotransmisores, aparentemente lejanos de lo inmunológico. Así, originalmente se creía que este sistema era autorregulado en un grado considerable, sin embargo, cada vez es más claro que, junto con el sistema neuroendocrino, ambos sistemas forman una interconexión directa y bidireccional1. De esta manera, los sistemas fisiológicos que integran a los organismos complejos interactúan entre sí formando redes de mutuo control que favorecen el cumplimiento correcto de sus funciones específicas y las más generales del organismo entero30.
En 1979 se publicaron los primeros reportes describiendo la presencia de receptores de esteroides sexuales en timo3. En 1940 Chiodi descubrió que la castración en conejos incrementaba significativamente el peso del timo2. Estos hallazgos, junto con los trabajos posteriores sobre la presencia de receptores de esteroides sexuales en timo3 sugirieron que los cambios observados en el peso del timo después de la castración fueron mediados por estos receptores. La observación adicional de que la restitución con esteroides sexuales revirtió la hipertrofia tímica inducida por la castración indicó que estos esteroides fueron los mediadores de este efecto. Las hormonas sexuales parecen jugar un papel importante en las diferencias de susceptibilidad asociadas al sexo en ciertas enfermedades infecciosas y autoinmunes4. Se sabe que las hembras de diferentes especies producen niveles más altos de inmunoglobulinas circulantes y presentan una respuesta inmune de tipo humoral más pronunciada en contra de la infección. La producción de una variedad de anticuerpos autorreactivos también es más frecuente en las hembras. Se ha comprobado que los estrógenos incrementan la respuesta de células B tanto in vivo como in vitro, mientras los andrógenos y la progesterona disminuyen la producción de anticuerpos. Existen evidencias de que las hormonas sexuales, además, son capaces de modular una gran cantidad de procesos implicados en la respuesta inmune, incluyendo la maduración y selección de timocitos, el tránsito celular, la proliferación linfocitaria, la expresión y adhesión de moléculas y receptores del complejo mayor de histocompatibilidad clase II y la producción de citocinas. Sin embargo, los mecanismos por los que estas hormonas tienen efecto en estos procesos no se conocen del todo. De acuerdo con estas observaciones, se sugiere que los estrógenos potencian la inmunidad mediada por células B y suprimen algunos aspectos dependientes de células T. La testosterona parece suprimir tanto la respuesta mediada por células T como la mediada por células B31-34. Ahora se sabe que de toda la gama de hormonas que conforman el sistema neuroendocrino, los esteroides son moduladores importantes de la función inmune. Entre otros aspectos, se reconoce que estas hormonas tienen efectos sobre la maduración, la diferenciación y las funciones efectoras de las células del sistema inmune. Una población de estas células, los linfocitos T colaboradores (CD4+), es la encargada de orquestar una respuesta inmune apropiada contra un reto antigénico particular mediante la polarización de la respuesta inmune. Las dos principales subclases de células T colaboradoras, designadas como TH1 y TH2, poseen diferentes patrones de producción de citocinas y, como consecuencia, juegan diferentes papeles durante la respuesta inmune. Estas subclases se describieron originalmente con base en el patrón de producción de citocinas por parte de células T de ratón35, pero el concepto también ha encontrado aplicación en células humanas36-38. Las células TH1 secretan IL-2 e IFN-γ, mientras que las células TH2 producen principalmente IL-4, IL-6 e IL-10. Cada subclase controla una serie de funciones inmunes coordinadas muy efectivamente para controlar a algunos patógenos y padecimientos en particular, pero puede ser inefectiva, o hasta patológica, en respuesta a otros tipos de retos inmunológicos36,39. Además de los diferentes factores inmunes implicados en la regulación de la compleja red de citocinas, existen evidencias de que el género es un factor importante en determinar el patrón de secreción de estas proteínas4, lo que sugiere que los esteroides sexuales pueden ser los responsables de estas diferencias. Para que estas hormonas puedan ejercer un efecto sobre las células del sistema inmune, se requiere la presencia de receptores de hormonas en dichas células. Aunque existen evidencias de que las hormonas esteroides ejercen sus efectos en parte también mediante mecanismos no genómicos, actuando sobre receptores de superficie celular y desencadenando cascadas de señalización, actualmente se acepta que la ruta principal de actividad biológica se lleva a cabo mediante receptores nucleares (NR) específicos, los cuales funcionan como factores de transcripción y coordinan, después de la unión con su ligando, la expresión de genes blanco. Los siguientes NR son mediadores de estos efectos: receptores de estrógenos (ER), ERa y ERß, cada uno codificado por un gen individual, su ligando predominante es el 17ß-estradiol (E2); receptor de progesterona (PR), con las variantes A y B que son generadas del mismo gen mediante splicing alternativo, su ligando principal es la progesterona (P4) y receptor de andrógenos (AR), codificado por un solo gen, sus ligandos son la testosterona (Te) y la DHT. Uno de los efectos de los esteroides que resulta clave en la regulación y funciones efectoras del sistema inmune, que no ha sido completamente explorado, es su acción en la producción de citocinas y la proliferación de linfocitos.
Agradecimientos
Apoyo financiero: Donativo # IN-208103 del Programa de Apoyo a Proyectos de Investigación e Inovación Tecnológica (PAPIIT) de la Dirección General de Asuntos del Personal Académico (DGAPA), UNAM, para Jorge Morales-Montor. Rosalía Hernández-Cervantes tiene una Beca de Licenciatura de la DGAPA, y una Beca del Sistema Nacional de Investigadores (SNI) como ayudante de Investigador. Ana Gabriela Sánchez -Acosta tiene una beca de ayudante de Investigador del SNI.
Referencias
1. Besedovsky, H.O. & Del Rey, A. Immune-neuro-endocrine interactions: facts and hypotheses. Endocr. Rev. 17(1), 64-102 (1996). [ Links ]
2. Chiodi, H. The relationship between the thymus and the sexual organs. Endocrinol. 26, 107 (1940). [ Links ]
3. Grossman, C.J., Sholiton, L.J. & Nathan, P. Rat thymic estrogen receptor. I. Preparation, location, and physiochemical properties. Steroid Biochem. 11(3), 1233-1240 (1979). [ Links ]
4. De León-Nava, M.A. & Morales-Montor, J. Dimorfismo sexual inmunitario: pueden los esteroides sexuales polarizar el perfil de citocinas Th1/Th2? Rev. Invest. Clin. 58(2), 161-169 (2006). [ Links ]
5. Tonelli, L.H. & Postolache, T.T. Tumor necrosis factor alpha, interleukin-1 beta, interleukin-6 and major histocompatibility complex molecules in the normal brain and after peripheral immune challenge. Neurol. Res. 27(7), 679-684 (2005). [ Links ]
6. Agro, A. & Stanisz, A.M. Neuroimmunomodulation: classical and non-classical cellular activation. Adv. Neuroimmunol. 5(3), 311-319 (1995). [ Links ]
7. Elenkov, I.J. Glucocorticoids and the Th1/Th2 balance. Ann. N. Y. Acad. Sci. 1024, 138-146 (2004). [ Links ]
8. Daly, A.F., Burlacu, M.C., Livadariu, E. & Beckers, A. The epidemiology and management of pituitary incidentalomas. Horm. Res. 68(Suppl 5), 195-198 (2007). [ Links ]
9. Petersenn, S. et al. The Rational Use ofPituitary Stimulation Tests. Dtsch. Arztebl. Int. 107(25), 437-443 (2010). [ Links ]
10. Schneider, H.J., Aimaretti, G., Kreitschmann-Andermahr, I., Stalla, G.K. & Ghigo, E. Hypopituitarism. Lancet 369,1461-1470 (2007). [ Links ]
11. Dekkers, O.M. et al. Mortality in Patients Treated for Cushing's Disease Is Increased, Compared with Patients Treated for Nonfunctioning Pituitary Macroadenoma. J. Clin. Endocrinol. Metab. 92(3), 976-981 (2007). [ Links ]
12. Montero, A., Giovannoni, A.G. & Sen, L. Propiedades inmunológicas de la prolactina. Medicina (Buenos Aires) 60, 515-520 (2000). [ Links ]
13. Ascoli, P. & Cavagnini, F. Hypopituitarism. Pituitary 9(4), 335-342 (2006). [ Links ]
14. Frare, E.O. et al. Growth hormones therapy in immune response against Trypanosoma cruzi. Res. Vet. Sci. 88(2), 273-278 (2009). [ Links ]
15. Nicoll, C.S. Physiological actions of Prolactin (Handbook of Physiology, Washington, D.C., 1974). [ Links ]
16. Sandoval, C., Fonseca, M.E. & Ochoa, R. The transcendence of prolactin and its relation to the immune response. Ginecol. Obstet. Mex. 65, 148-151 (1997). [ Links ]
17. Clevenger, C.V., Freier, D.O. & Kline, J.B. Prolactin receptor signal transduction in cells of the immune system. Review J. Endocrinol. 157, 187-197 (1998). [ Links ]
18. Nagy, E. & Berczi, I. Hypophysectomized rats depends on residual prolactin for survival. Endocrinology 128, 2776-2784 (1991). [ Links ]
19. Berczi, I. & Nagy, E. Immune system effects on neural and endocrine processes and behavior: Effects of hypophysectomy on immune function. In: Psychoneuroimmunology II (Ader, R., Felten, D.L. & Cohen, N. eds.) 339-375 (Academic Press, 1991). [ Links ]
20. Torner, L. et al. A 14-kilodalton prolactin-like fragment is secreted by the hypothalamo-neurohypophyseal system of the rat. Endocrinology 136(12), 5454-5460 (1995). [ Links ]
21. Mejía, S. et al. Prolactin and 16K prolactin stimulate release of vasopressin by a direct effect on hypothalamo-neurohypophyseal system. Endocrine 20(1-2), 155-162 (2003). [ Links ]
22. Dzitko, K., Malicki, S. & Komorowski, J. Effect of hyperprolactinaemia on Toxoplasma gondii, prevalence in humans. Parasitol. Res. 102, 723-729 (2008). [ Links ]
23. Kodjikian, L. et al. Ocular manifestations in congenital toxoplasmosis. Graefe Arch. Clin. Exp. Ophthalmol. 244, 14-21 (2006). [ Links ]
24. Chrousos, G.P., Kino, T. & Charmandari, E. Evaluation of the Hypothalamic-Pituitary-Adrenal Axis Function in Childhood and Adolescence. Neuroimmunomodulation 16, 272-283 (2009). [ Links ]
25. Batista, D.L., Riar, J., Keil, M. & Stratakis, C.A. Diagnostic tests for children who are referred for the investigation of Cushing syndrome. Pediatrics 120, e575-e586 (2007) [ Links ]
26. Savage, M.O. et al. Advances in the management of paediatric Cushing's disease. Horm. Res. 69, 327-333 (2008) [ Links ]
27. Tsigos, C. Differential diagnosis and management of Cushing's syndrome. Annu. Rev. Med. 47, 443-461 (1996). [ Links ]
28. Jailer, J.W. & Holub, D.A. Remission of Grave's disease following radiotherapy of a pituitary neoplasm. Am. J. Med. 28, 497-500 (1960). [ Links ]
29. Socin, H.V. et al. The changing spectrum of TSH-secreting pituitary adenomas: diagnosis and management in 43 patients. Eur. J. Endocrinol. 148, 433-422 (2003). [ Links ]
30. Morales-Montor, J. et al. Host gender in parasitic infections of mammals: an evaluation of the female host supremacy paradigm. J. Parasitol. 90(3), 531-546 (2004). [ Links ]
31. Grossman, C.J. Possible underlaying mechanism of sexual dimorphism in the immune response, fact and hypothesis. J. Steroid Biochem. 34(1-6), 241-251 (1989). [ Links ]
32. Bebo, B.F.Jr., Schuster, J.C., Vandenbark, A.A. & Offner, H. Androgens alter the cytokine profile and reduce encephalitogenicity of myelin-reactive T cells. J. Immunol. 162(1), 35-40 (1999). [ Links ]
33. Da Silva, J.A. Sex hormones and glucocorticoids: interactions with the immune system. Ann. N.Y. Acad. Sci. 876, 102-118 (1999). [ Links ]
34. Olsen, N.J. & Kovacs, W.J. Effects of androgens on T and B lymphocyte development. Immunol. Res. 23(2-3), 281-288 (2001). [ Links ]
35. Mosmann, T.R., Cherwinski, H., Bond, M.W., Giedlin, M.A. & Coffman, R.L. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J. Immunol. 136, 2348-2357 (1986). [ Links ]
36. Abbas, A.K., Murphy, K.M. & Sher, A. Functional diversity of helper T lymphocytes. Nature 38, 787-793 (1996). [ Links ]
37. Lucey, D.R., Clerici, M. & Shearer, G.M. Type 1 and type 2 cytokine dysregulation in human infectious, neoplastic, and inflammatory diseases. Clin. Microbiol. Rev. 9(4), 532-562 (1996). [ Links ]
38. Mosmann, T.R. & Sad, S. The expanding universe of T-cell subsets: Th1, Th2 and more. Immunol. Today 17, 138-146 (1996). [ Links ]
39. Mosmann, T.R. & Coffman, R.L. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu. Rev. Immunol. 7, 145-173 (1989). [ Links ]
Información sobre los autores
Rosalía Hernández-Cervantes
Rosalía Hernández-Cervantes es pasante de la carrera de Químico Farmacéutico Biólogo, de la Facultad de Estudios Superiores Cuautitlán, UNAM y tiene el título de técnico a nivel medio superior como "Laboratorista Químico".
Actualmente realiza su tesis de licenciatura en el Depto. de Inmunología, del Instituto de Investigaciones Biomédicas. UNAM. Ha asistido a un congreso y un simposio.
Ana Gabriela Sánchez-Acosta
Ana Gabriela Sánchez-Acosta es pasante de la carrera de Químico Farmacéutico Biólogo, de la Facultad de Química de la UNAM y tiene el título de técnico a nivel medio superior como "Laboratorista Químico".
Tiene una participación como ponente en un congreso nacional. Ha realizado estancias cortas en la Facultad de Química, UNAM. Ha asistido a un curso, un seminario y un simposio.
Ricardo Ramírez-Nieto
Ricardo Ramírez-Nieto es estudiante de licenciatura de la carrera de Químico Farmacéutico Biólogo, en la Facultad de Química, UNAM. Ha realizado estancias cortas en la Facultad de Química. UNAM. Ha asistido a un curso, un seminario y un simposio.
Cuenta con experiencia en el manejo de equipo instrumental básico de laboratorio químico y conocimientos técnicos básicos de computación.
Jorge Morales-Montor
Jorge Morales-Montor estudió la Licenciatura en Biología en la Facultad de Estudios Superiores Iztacala, UNAM. Obtuvo el grado de Doctor en Investigación Biomédica Básica en la UNAM. Realizó una estancia posdoctoral en el Department of Cellular Biology en la Universidad de Georgia, USA. Actualmente es Investigador Titular'-C" Definitivo en el Depto. de Inmunología del Instituto de Investigaciones Biomédicas. UNAM y es miembro del SNI con nivel III. Su área de especialización está enfocada a la inmunología y parasitología, así como el uso de viejos fármacos, hormonas y antihormonas como terapia antiparasitaria.
Ha recibido varios premios como el Lola e Igo Flisser PUIS por su tesis doctoral, el Premio Miguel Alemán Valdésen el Arcade Salud. Distinción Universidad Nacional para Jóvenes Académicos en el área de Investigación en Ciencias Naturales, el Premio CANIFARMA Veterinario y el Premio Heberto Castillo Martínez. Recibió una beca de la Fogarty Foundation.
Ha publicado 65 artículos en revistas indizadas de alto impacto y ha sido invitado a editar volúmenes especiales de revistas de circulación internacional. Es miembro del Comité Editorial de revistas especializadas en su área de trabajo, como Parasite Immunology y The Open Parasitology Journal, entre otras. Es Presidente de la Sociedad Mexicana de Parasitología y Presidente y fundador de la Sociedad Mexicana de Neuroinmunoendocrinología.
Pertenece a la Academia Mexicana de Ciencias (2005) y a la Academia de Ciencias de América Latina.














