Introducción
En México, la industria tequilera es de gran importancia, el continuo aumento en la demanda del tequila propicia la producción de millones de litros de dicha bebida cada año.
Se estima que se requieren entre 6 a 8 kg de agave para producir un litro de tequila, concretamente de las denominadas “piñas” (puesto que las pencas se quedan en el campo tras el jimado), ésta es la base del tallo rica en carbohidratos que se cosecha como materia prima de fermentación. (Cámara Nacional de la Industria Tequilera, 2020; Davis et al., 2011; Méndez et al., 2010).
Esto genera alrededor de 7 a 12 L de vinazas (Díaz et al., 2021; Espinoza et al., 2008) y de 1.4 a 2.0 kg de bagazo (base 60 % de humedad) por litro de tequila producido (40 % vol. de alcohol) (López et al., 2010; Cedeño, 2003), siendo estos los principales residuos relacionados con la producción del destilado.
Datos del Consejo Regulador del Tequila (2020), señalan que durante el año 2019 se requirieron 1,342.6 mil toneladas de agave para la producción del tequila, con los cuales se elaboraron 351.7 millones de litros de tequila con un 40 % vol. de alcohol (Consejo Regulador del Tequila, 2020). Por consiguiente, la generación del bagazo alcanzó aproximadamente 335.6 mil toneladas.
Ambos desechos representan un impacto ambiental considerable, a pesar de la presión de organismos reguladores. Los residuos generados (bagazo y vinazas) siguen siendo tratados de manera inadecuada, situación que se convierte en un problema ambiental y económico para la industria tequilera.
Existen diversos residuos durante la producción del tequila como lo son hojas, residuos de fibras, raíces, tallos y semillas que son utilizados como resinas termoplásticas, cepillos, tejidos, ropa, accesorios ornamentales y diversos tipos de decoraciones. Estos residuos también son utilizados en la industria química, farmacéutica y de medicamentos, en la industria del papel como productos de celulosa, entre muchos otros, (Pérez et al., 2020; Nava et al., 2014). Todos estos son usos en volúmenes pequeños, lo que incentiva la costumbre de dejarlos en el campo después de la cosecha de las piñas.
El bagazo de agave es el material fibroso residual obtenido después de que las cabezas de agave son trituradas, cocidas, molidas y los azúcares extraídos para la producción de tequila, dicho residuo representa aproximadamente un 40 % del peso total del procesamiento del agave molido en peso húmedo (Álvarez et al. 2021; Iñiguez et al., 2014; Liñán et al., 2013; Cedeño, 2003).
El bagazo de agave está compuesto de 41-45 % de celulosa, de 19-25 % de hemicelulosa, de 15-20 % de lignina y de 6-7 % de cenizas. (Palacios et al., 2019; Corona et al., 2016; Iñiguez et al., 2014; Liñán et al., 2013; Alonso & Rigal, 1997).
Por otro lado, el bagazo de agave es utilizado como fertilizante orgánico mediante composteo (Virgen et al., 2020; Iñiguez et al., 2014; Crespo et al., 2013), como combustible en calderas (Durán et al., 2019) y alimentos para aves y ganado (Aleman et al., 2018; Iñiguez et al., 2011), entre otros.
Dado lo anterior, se demuestra la necesidad de encontrar usos con un valor agregado más alto a dichos residuos. Específicamente, el bagazo de agave se puede aprovechar de manera alternativa como materia prima para la producción de biocombustibles, ya que, al ser un residuo, no compite con la industria alimentaria para consumo humano, como lo son la caña de azúcar y el maíz, además de que se encuentra disponible durante todo el año.
Los azúcares presentes en el bagazo de agave pueden digerirse anaerobiamente para la producción de biogás o hidrolizarse y fermentarse para producir bioetanol, sin embargo, por tratarse de biomasa lignocelulósica se requiere un pretratamiento para aumentar su biodegradabilidad y en especial incrementar el rendimiento de los azúcares que son compuesto clave para la digestión anaerobia y la fermentación y de esta manera tener un mejor aprovechamiento.
La tasa de degradación enzimática de los materiales lignocelulósicos es baja, debido a factores como la baja biodegradabilidad de la celulosa. Esto último se debe a, la estructura cristalina de la celulosa y la barrera física que forma la lignina que rodea al polímero de celulosa (Aguirre et al., 2020; Saucedo et al., 2011). La biodegradabilidad del bagazo de agave sin un pretratamiento en la digestión anaerobia es lenta, lo que conlleva a tener rendimientos bajos de metano.
Por este motivo, es indispensable realizar un pretratamiento al material lignocelulósico para poder romper la estructura formada por la lignina y de esta manera mejorar la susceptibilidad del material lignocelulósico a la actividad enzimática.
Saucedo et al. (2011) y Bruni et al. (2010) consideran que un pretratamiento eficaz para los residuos con fines de obtener biogás incluye la reducción del contenido de lignina, una disminución en la cristalinidad de la celulosa y el aumento de la superficie para las reacciones enzimáticas.
La degradación de la hemicelulosa da como resultado la desintegración de la estructura de la pared formada por la lignina y un aumento de tamaño de poro, lo que permite un ataque enzimático acelerado y la conversión en metano durante el proceso de biogás (Bruni et al., 2010).
Con la finalidad de obtener una mayor cantidad de biogás y bioetanol una combinación de pretratamientos e hidrólisis enzimática puede resultar favorable (Kumari & Singh, 2018; Tolan 2002). Se ha reportado que la explosión de vapor es un método eficiente y rentable para tratar la biomasa lignocelulósica, puesto que no es necesario añadir algún tipo de catalizador o reactivos (Scherzinger & Kalttschmitt, 2021; Ballesteros et al., 2002).
El pretratamiento de explosión de vapor consiste en calentar la biomasa lignocelulósica a altas temperaturas y presiones en presencia de agua, seguida de una ruptura mecánica de las fibras de la biomasa por una rápida caída de presión (explosión) (Horn et al., 2011; Ramos, 2003).
Durante este proceso el vapor degrada la hemicelulosa, modificando la estructura de la pared por la desintegración de la lignina, produciendo un material oscuro color marrón, del cual se obtienen hemicelulosas que se encuentran parcialmente hidrolizadas (Ramos, 2003).
De acuerdo con Kumar et al. (2009), la explosión de vapor es uno de los procesos más rentables para los residuos agrícolas. Los factores más importantes y que afectan al pretratamiento son: el tiempo de residencia, la temperatura, el tamaño de la viruta y el contenido de humedad (Kumar et al., 2009; Ballesteros et al., 2002).
Por otro lado, la hidrólisis enzimática es un proceso catalizado por un grupo de enzimas denominadas celulasas (producidas principalmente por hongos, bacterias y protozoos), las cuales llevan a cabo una mezcla de reacciones enzimáticas, cuya acción permite la degradación de la celulosa (Houfani et al., 2020; Almenares et al., 2011).
El objetivo de la hidrólisis enzimática es desintegrar la estructura de la celulosa dependiendo si es cristalina o amorfa, las enzimas actúan provocando reacciones hidrolíticas con velocidades específicas y alterando su estructura (Kumar et al., 2009).
La presencia de lignina y hemicelulosa hace que la accesibilidad de enzimas celulasas a la celulosa sea difícil, reduciendo la eficiencia del proceso de hidrólisis, pero dicho proceso puede ser mejorado significativamente mediante la separación de estos polímeros, reduciendo la cristalinidad de la celulosa y aumentando la porosidad (Kumar et al., 2009).
Antes de la fermentación (para producir bioetanol) los materiales lignocelulósicos deben pretratarse e hidrolizarse con ácidos y enzimas, los cuales hacen que los carbohidratos sean accesibles para los microorganismos fermentadores (Negro et al., 2003).
Durante el proceso de hidrólisis, los azúcares se liberan rompiendo las cadenas de carbohidratos antes de que se fermenten para producir bioetanol.
La hidrólisis enzimática es un tratamiento ampliamente utilizado para descomponer la celulosa en azúcares, además de que es el método más común para producir etanol a partir de biomasa lignocelulósica (Kumar et al., 2009).
En este trabajo de investigación se evaluó la efectividad de la producción de biogás y bioetanol mediante el pretratamiento de explosión de vapor y una hidrólisis enzimática subsecuente.
Metodología
Balance de masas y energía
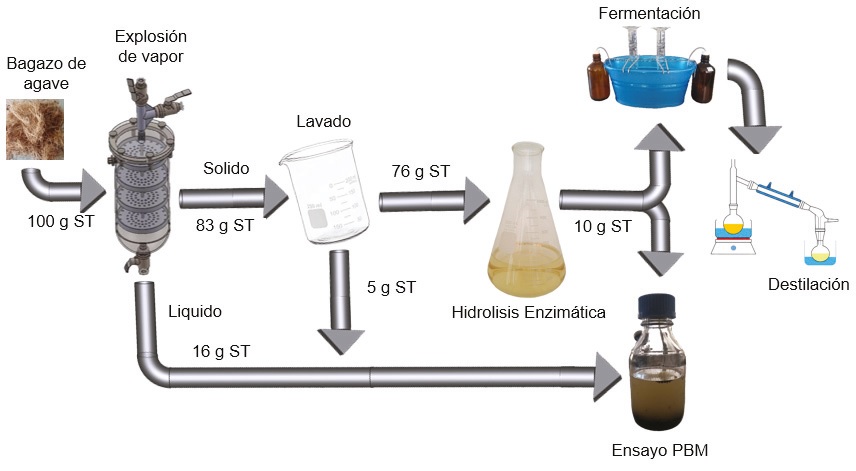
La combinación de los procesos hidrotérmicos y enzimáticos permiten reducir la masa y volumen del residuo, además de formar una fase líquida que tiene un beneficio energético. Por lo tanto, es necesario realizar un balance másico para determinar la pérdida de masa seca del material sólido en cada etapa de los procesos empleados. Para esto, se determinó la humedad y cenizas del bagazo en cada etapa, de acuerdo con los métodos NREL/TP-510-42621 y NREL/TP-510-42622, respectivamente. El contenido energético del bagazo se cuantificó en un calorímetro de combustión de la marca Parr modelo 6200, a partir de una muestra previamente secada a 105 °C, arrojando el poder calorífico superior. Por medio de adsorción del agua de combustión a zeolita se logró determinar el poder calorífico inferior, un parámetro que tiene mayor importancia para el diseño técnico.
Con la excepción de la liberación de gas en cantidades marginales a través del pretratamiento, la materia orgánica e inorgánica se transfiere a las diferentes fases líquidas como muestra la Figura 1. Las fases líquidas se destinan a los procesos de conversión respectivos. Para el caso de la digestión anaerobia se consideran ambos hidrolizados y para la fermentación alcohólica solo el hidrolizado enzimático. Mientras que los minerales parcialmente disueltos en el hidrolizado no tienen aporte al contenido energético, solo tienen potencial de fungir como nutrientes en etapas de conversión biológicas subsecuentes. Únicamente la materia orgánica aporta al contenido energético, su determinación puede ser cuantificada por calorimetría a partir del contenido seco, pero es más apropiado basarse en la Demanda Química de Oxigeno (DQO) de los hidrolizados, debido a que se conoce el potencial teórico de formación de metano (CH4) a partir de 1 g de DQO que es 0.35 mL CH4. Con la ayuda de la entalpía de formación del metano, el contenido energético es determinable en la fase líquida por medio de la determinación de la DQO en muestras previamente centrifugadas. La determinación de DQO, se llevó a cabo con viales preparados para análisis de la marca HACH de rango alto (21259 VL BLM) haciendo una dilución adecuada con agua destilada. El contenido de azúcares totales se determinó de acuerdo con el método propuesto por DuBois et al. (1956), el cual sirve como indicador del contenido energético, sobre todo en la etapa de hidrólisis enzimática.
Como productos secundarios en los hidrolizados se encuentran fenoles, furfural, hidroximetilfurfural (HMF) y ácidos orgánicos como el ácido acético, que se presenta comúnmente en mayor proporción. Mientras que estos compuestos causan efectos inhibitorios en conversiones biológicas (Barakat et al., 2012; Kumar et al., 2009), el ácido acético es intermediario en la cadena de metanización, clasificándose, como benéfico a concentraciones moderadas. Es por ello que se determinó este compuesto y otros ácidos orgánicos volátiles, por el método de destilación de vapor a partir de una muestra previamente acidificada en un destilador de arrastre de vapor Büchi K-355 y determinación de la acidez del condensado por medio de titulación con NaOH a 0.1 molar.
Los productos finales, biogás y bioetanol, se cuantificaron de acuerdo con los procesos descritos más adelante.
Fuente de bagazo
El bagazo de agave se obtuvo de una fábrica de tequila, la cual está ubicada en el municipio de Amatitán, Jalisco. Previamente a las pruebas, el bagazo se secó en un túnel solar para disminuir la degradación natural durante el periodo de almacenaje. El túnel tenía las dimensiones de 3 a 6 m y se colocaba un lecho de bagazo con una altura de 0.4 m. Dependiendo de las condiciones climáticas el tiempo de secado fue de aproximadamente 2 semanas. El bagazo acondicionado para su uso en los experimentos de conversión hidro-térmica se caracterizó de contener 27.6 % de extractives, 23.5 % de hemicelulosa, 38.4 % de celulosa, 10.5 % de lignina y 3.5 % de cenizas (Weber et al., 2020).
Pretratamiento de explosión de vapor
El recipiente en el cual se realizó la explosión de vapor con 4 platos para recibir la biomasa se puede apreciar en la Figura 1. Se siguió el método descrito por Weber et al. (2019), en donde se analizó el efecto de la presión y el número de despresuraciones realizadas sobre el rendimiento de la DQO. En el presente trabajo se emplearon las mejores condiciones encontradas que fueron: 0.98 MPa de presión absoluta que por condiciones saturadas originaron una temperatura de 179 °C, durante un tiempo de 22 min y una liberación súbita de la presión hacia un tanque de condensación durante 2 min seguidos. La válvula inferior del recipiente permite el drenado de la biomasa y captura el lixiviado. Una segunda fracción de la misma composición se obtiene en una deshidratación mecánica. Después de la caracterización de los productos líquidos y sólidos obtenidos en tres replicas, se juntaron de nuevo para destinarlo a la hidrólisis enzimática, la cual requería más material para el ensayo.
Acondicionamiento del bagazo de agave pretratado
Se procedió a lavar el material sólido en agua destilada en una relación de 1:20 (p/v, en peso seco) para diluir los solubles adheridos, bajo agitación manual (5 minutos). La separación de la fase solida del agua de lavado se efectuó con un tamiz malla 18. El criterio para repetir las etapas de lavado fue que la DQO en la fase líquida se redujera hasta un 10 % de la concentración presente después del primer lavado. Después de los lavados el material se secó en un horno a 60 °C por un día.
Hidrólisis enzimática
El procedimiento de la hidrólisis enzimática se realizó de acuerdo con lo reportado por Láinez et al. (2018) el cual consiste en llevar a cabo por triplicado una combinación de enzimas Celluclast 1.5 L y Viscozyme L a pH de 3.5 usando un buffer de citratos a una concentración de 50 mM (6.2 g de ácido cítrico y 20.6 g de citrato de sodio). La hidrólisis se llevó a cabo a 40 °C con una agitación de 120 rpm durante 12 h en una incubadora LSI-3016R (Lab-Tech Instruments, Corea).
Una vez que terminó la reacción de hidrólisis enzimática se sacaron los matraces de la incubadora. El hidrolizado (líquido) se separó de las fibras de bagazo de agave pretratadas filtrándolas a través de un tamiz malla 18. Para la determinación de la Demanda Química de Oxigeno soluble (DQOs) y azúcares totales (AT) las muestras se centrifugaron a 4000 rpm durante 15 min, se recuperó el sobrenadante, el cual se congeló para su posterior determinación y procesamiento.
Determinación del potencial bioquímico de metano (PBM)
La eficiencia de bioconversión en biogás de los diferentes hidrolizados se determinó mediante pruebas de lotes de acuerdo con VDI4630 en botellas de vidrio estándar de 500 mL. El ensayo se inició con una relación inóculo/sustrato de 2:1 a 36 °C, cada tratamiento se realizó por triplicado y se ajustó a una concentración de DQO de 5 g L-1.
Las muestras del blanco, control negativo y el control positivo (papel filtro de celulosa) solo contenían inóculo y medio basal. Como inóculo se utilizó lodo granular de un digestor anaerobio que trataba los efluentes de una cervecería. El lodo granular contenía una concentración total de sólidos totales de 90 g L-1, se aclimató durante 3 días antes de iniciar la prueba, se ajustó el pH con un valor entre 7.0 y 8.5 a una alcalinidad mínima de 3 g L-1 mediante la adición de carbonato de sodio (Holliger et al., 2016). El control de la temperatura y la agitación horizontal a 90 rpm se realizaron en una incubadora LSI-3016R (Lab-Tech Instruments, Corea).
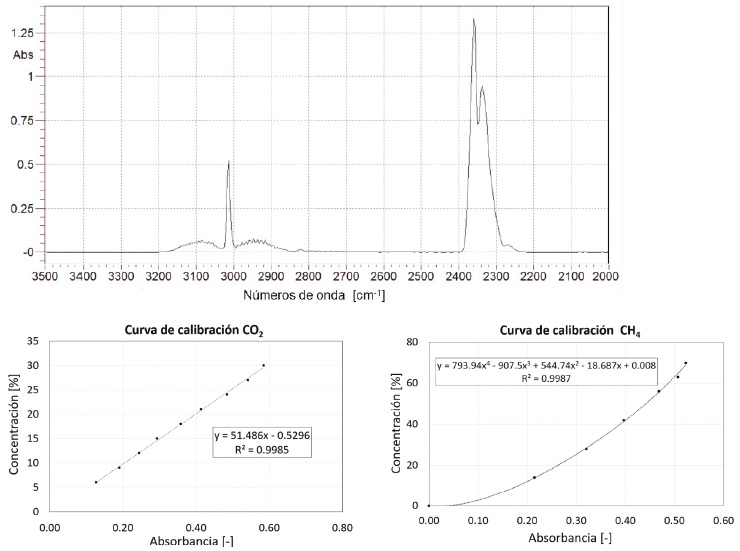
Para la caracterización del biogás se empleó un método alternativo a la cromatografía de gases que comúnmente es utilizado. Debido a fuertes absorbancias de ondas infrarrojas que tienen los gases CH4 y CO2 que son de 3012.8 y 2360.7 cm-1, respectivamente, es posible determinar la composición de estos compuestos con una buena exactitud y con una muestra de 10 mL, la cual fue inyectada a una celda de gas (con un volumen total de 65 mL) montada en el espectrómetro FTIR (Shimadza IR Prestige).
La Figura 2, muestra un espectro para ambos gases, las curvas de calibración se caracterizan por un R2 >0.99, se observa que el CO2 tiene una correlación lineal entre absorbancia y concentración mientras que el CH4 se describe bien con una función polinómica.
Una de las ventajas de este método es que no requiere de consumibles adicionales, con la excepción de los gases puros para su calibración, la cual es recomendable se realice una vez al mes. Además, el método se realiza en un lapso menor a 5 min, del cual gran parte de este se requiere para purgar la celda con un flujo forzado de aire, clasificándose como un método rápido.
El potencial bioquímico de metano (PBM) permite determinar la biodegradabilidad anaerobia y el rendimiento máximo de metano (CH4) de diferentes sustratos, los cuales pueden estar en forma líquida o solida obtenible en condiciones específicas (Koch et al., 2020; Owen et al., 1979). La prueba puede ser considerada como concluida (en el caso de sustratos líquidos) cuando la producción diaria de CH4, por tres días consecutivos ha sido inferior a 1 % del volumen acumulado de CH4 (Holliger et al., 2016, Angelidaki et al., 2009). Después de concluida la prueba se pesaron los frascos y posteriormente se abrieron para el control del pH y la determinación de la DQO en el digestato.
Fermentación alcohólica y destilado
La fermentación alcohólica de los hidrólizados se llevó a cabo en frascos herméticos con una trampa de agua a temperatura ambiente. A la muestra de 300 mL se agregó como inóculo levadura Saccharomyces cerevisiae, adaptada para la producción de cerveza. Como muestra control se utilizaron 200 g de malta molida, a la cual se le adicionaron 750 mL de agua con un pH de 5.50, y se dejó macerar por aproximadamente 1 h a una temperatura entre 65-69 °C. Después de ese tiempo el macerado fue filtrado. Posteriormente se colocaron 300 mL del residuo liquido en un frasco hermético y se le adicionaron 2 g de levadura Saccharomyces cerevisiae.
Dichos hidrolizados y la muestra control se dejaron fermentar por aproximadamente 72 h, durante este tiempo se observó la liberación de CO2 con una manguera conectada a una trampa de agua.
Debido a la presencia de azúcares residuales en el jugo fermentado, la determinación de alcohol con un aerómetro tiene como pre-requisito una destilación del jugo fermentado de acuerdo con los métodos 920.57 (alcohol en vinos) y 935.21 (alcohol por volumen en cerveza) de AOAC (Horwitz, 2000). Como la concentración de alcohol en el jugo fermentado es baja se destiló hasta obtener dos tercios de destilado a partir del jugo fermentado. A 20 °C se determinó la concentración volumétrica de alcohol con un aerómetro de 0 a 7 %.
Resultados
Liñán et al. (2013) reportan en sus estudios el poder calorífico del bagazo de agave que es de 16.4 kJ g-1 un valor inferior al determinado para el sustrato investigado en el calorímetro Parr 6200 que resultó en 16.9 kJ g-1. El poder calorífico marca el potencial energético de biomasas con el cual se puede estimar la efectividad los procesos de conversión. La transferencia de masas durante las diversas etapas se resume en la Figura 1 y los valores correspondientes en DQO y energía se resumen en la Tabla 1. Para esto se toma en cuenta que 1 g de DQO equivalen a un potencial teórico de 350 mLN CH4 g-1 que a su vez tiene un poder calorífico de 39.6 J mL-1.
Tabla 1 Balance de DQO y balance de energía para sustrato y productos obtenidos a partir de diferentes pretratamientos y conversiones biológicas
| Balance de DQO para 100g ST | Balance de Energía para 1 g ST | |||||
| Sólido | Líquido | Gaseoso | Sólido | Líquido | Gaseoso | |
| [g DQO] | [g DQO] ([g C2H5OH]) |
[g DQO] ([mLN CH4]) |
[kJ g-1] PCS (PCI) | |||
| Bagazo de agave sin tratamiento | 132.0** | - | 18.4 (16.9) | |||
| Explosión de vapor | 21.5 | 3.0 | ||||
| Biometano fase liquida explosión de vapor | 3.9 | 18.1 (63.3) | 2.5 | |||
| Hidrólisis Enzimática | 10.9 | 1.5 | ||||
| Bioetanol y Biometano | 6.1 (2.9)* | 18.1 (63.3) | 0.9 | 2.5 | ||
| Biometano Total fase líquida | 4.5 | 27.8 (97.5) | 3.8 | |||
* La DQO solo representa el bioetanol. El residual del ensayo de biogás es 1.6 g DQO
** El valor se obtuvo a través del cálculo sobre el análisis elemental
Tras el primer tratamiento de explosión de vapor las mejores condiciones encontradas fueron de 0.98 MPa con un tiempo de reacción total de 24 min, formándose dos fases: sólida y líquida. Bajo estas condiciones se logró transferir 16.0 ± 2.2 g de DQO por 100 g de fibra original a la fase líquida que se forma en este proceso. La DQO está formado principalmente por los azúcares residuales en la superficie de la fibra y la descomposición de la hemicelulosa. El tratamiento resultó en la formación de 0.9 ± 0.1 g de ácidos grasos volátiles por 100 g de fibra original derivada de la liberación de grupos acetilo tras la degradación de la hemicelulosa. La formación baja de ácidos grasos volátiles indica que la severidad del tratamiento aún no induce reacciones secundarias resultando en la formación de ellos.
Debido a que parte de los hidrolizados quedan adheridos a la biomasa sólida se sometieron a un proceso de lavado, para removerlos y transferirlos también a la fase líquida (Figura 1) obteniéndose 5.0 ± 0.2 g de DQO adicionales por 100 g de bagazo. Se puede suponer que la composición de esta fase liquida es la misma que se obtiene como primera fracción. A mayor escala la etapa de lavado quizás no se requiera, ya que el hidrolizado adherido al bagazo contiene azúcares que puedan ser fuente de sustrato para la producción de bioetanol. Sin embargo, debido a que el tratamiento de explosión de vapor hidroliza la hemicelulosa, el hidrolizado contendrá pentosas que las levaduras no pueden fermentar. Para fines de obtener fracciones bien separadas en etapas de laboratorio este lavado es recomendable. Posteriormente se siguió con la hidrólisis enzimática del material sólido residual. En el tratamiento con una duración de 12 h se logra generar una nueva fase liquida rica en azúcares. La aportación de azucares totales al DQO es de 51 % y el resto es debido a la presencia del buffer de citratos. La ganancia de DQO restando el citrato llega a 10.9 g por 100 g de bagazo inicial y la aportación del citrato no fue considerado en los balances de masa y energía.
La concentración de AT en el hidrolizado enzimático fue de 9.03 g L-1. De manera comparativa Láinez et al., (2018), obtuvo una concentración de glucosa de 49.76 g L-1, pero con un periodo de incubación de 48 h. Cabe mencionar que, debido a los pretratamientos alcalinos y ácidos seleccionados en ese experimento, las hemicelulosas se habían removido en su totalidad antes.
El propósito de producir biogás y bioetanol a través de las diversas fases líquidas se verificó en las subsecuentes fermentaciones en lote: a) Producción de biogás a partir del hidrolizado obtenido en el proceso de explosión de vapor e hidrolizado enzimático, b) Producción de bioetanol a partir del hidrolizado enzimático.
De acuerdo con la Figura 1 una masa inicial de 100 g se reduce a 83 g/ 76 g tras el primer proceso por generar cantidades respectivas en las fases liquidas. El tratamiento bajo las condiciones establecidas resultó en una tasa de recuperación de masas en fase sólida y líquida de 88 ± 5.7 % por lo que se aplicó un ajuste en los balances de masa y energía de acuerdo con Weber et al. (2020).
La producción de biogás en una prueba PBM a partir del hidrolizado derivado de la explosión de vapor fue de 553 ± 26 mLN g-1 DQO. Durante el ensayo se liberó de manera constante una relación de los gases CH4:CO2 de 54:46 v/v por lo que se puede considerar como el valor promedio de producción. La biodigestión en lote resultó en una tasa de conversión de 81.0 ± 1.8 % de conversión dejando un DQO soluble residual de 915 mg L-1 en el digestato. Dicho DQO residual se compone principalmente de ácidos grasos volátiles con una concentración de 720 mg L-1.
La producción de biogás a partir del hidrolizado enzimático se muestra en la Figura 3 junto con la aportación que tiene el buffer de citratos, y el control positivo, el cual fue la celulosa. A los 32 días se cumplió el criterio de finalización del ensayo. El control positivo (la celulosa) dio 532 ± 12 mLN g-1 DQO, que equivale al 87 % de la producción teórica del sustrato un poco inferior al criterio de calidad establecido en el lineamiento VDI 4630. El hidrolizado enzimático llegó a una producción específica de 578 ± 4 mLN g-1 DQO, un valor muy cercano a la celulosa, lo que explica que ambos sustratos están basados en carbohidratos. La Figura 3 nos muestra una metabolización del sustrato más lenta para la celulosa debido a que la biomasa debe producir las enzimas necesarias para la hidrólisis del polímero, mientras que el hidrolizado se conforma de monómeros. El control de buffer de citratos, así como el hidrolizado muestran una disminución de la velocidad de producción a partir del día 4 que probablemente es a causa de una acidificación. Sin embargo, la producción no se detiene, solo sigue con una velocidad reducida, además durante el periodo del día 4 al día 13 no se notó una afectación a la concentración de metano en el biogás, la cual se promedia en un 54 %. El análisis del digestato posterior al experimento mostró una concentración de ácidos grasos volátiles de 410 mg L-1 en el ensayo del hidrolizado. Beneficioso para el balance de masas y energía es que la producción del buffer de citrato fue practicamente igual que el hidrolizado, lo que permite basarse únicamente en el rendimiento de DQO y AT obtenido durante la hidrólisis enzimática.
La fermentación de los hidrolizados hacia bioetanol es otra alternativa. Sin embargo, con las levaduras tradicionales dicha vía de conversión se queda reservada para las hexosas. Como se encontró una concentración de alcohol en el jugo fermentado de 3.5 g L-1 y una concentración de azúcares residuales en el jugo fermentado de 2.3 g L-1 se confirma la imposibilidad de la levadura cervecera Saccharomyces cerevisiae de aprovecharse como sustrato basado en pentosas. Las pentosas se originaron por la hidrólisis de hemicelulosas residuales después del tratamiento de explosión de vapor que mostraban un valor de todavía 21 % en el material sólido (dato aún no publicado).
El producto bioetanol como energético obtenido a la concentración especificada en el fermentado equivale a una ganancia de 2.9 g de etanol por 100 g de bagazo de agave o 90 kJ/100 g un valor menor al que se obtiene a través de la metanización con un valor de 120 kJ/100 g. Se puede suponer que en una fermentación alcohólica de los hidrolizados obtenidos en la etapa de explosión de vapor resultaría en ganancias similares a lo obtenido con el hidrolizado enzimático.
En conclusión, la metanización de los sustratos fermentados resulta en una mayor ganancia del energético ennoblecido.
Conclusiones
Los resultados demuestran la factibilidad de obtener bioenergéticos ennoblecidos de forma líquida o gaseosa a partir del bagazo de agave que comúnmente se emplea para producir composta, y otros productos de poco valor comercial. Las condiciones empleadas en los pretratamientos y bioconversiones llegaron a ganancias equivalentes de un 20.8 % del contenido energético del bagazo con base en su poder calorífico. Mientras que para la producción del biogás está comprobada su factibilidad económica a pequeña escala, la producción de bioetanol obedece a un régimen de economía de escala, en relación con la inversión y los requerimientos energéticos, los cuales son mayores a pequeña escala por lo que se observa una tendencia de construir plantas en un tamaño de 50 a 400 millones de litros al año (Hennings, 2007). Sin embargo, la industria del tequila ya domina la fermentación y destilación de alcohol.
De manera adicional, el bioetanol se considera como químico de plataforma y la industria tequilera ya cuenta con canales de distribución por la venta de alcoholes no comestibles llamados “cabezas” y “colas”. La escasez de alcohol etílico originado por el uso de desinfectantes durante la pandemia ha demostrado la importancia de tener esquemas eficientes de producción y distribución de este producto.
Por las alternativas que se ofrecen para la conversión de bagazo de agave por la vía de biogás o bioetanol insertándose en diferentes etapas del proceso, se puede tener la posibilidad de encontrar soluciones optimizadas para una planta productora de tequila en específico y cumplir con el objetivo de tener un mejor aprovechamiento del residuo.











 nueva página del texto (beta)
nueva página del texto (beta)