Introducción
El alto índice poblacional en el mundo ha generado un aumento en la explotación de los recursos hídricos, por lo que la disponibilidad anual promedio de agua para consumo representa solo 2.5 % del agua total y un tercio de esta se encuentra contaminada. México se caracteriza por tener un alto número de empresas en el sector textil, las cuales generan importantes volúmenes de aguas residuales con presencia de colorantes. Aproximadamente una décima parte de los efluentes contaminados reciben un tratamiento previo a la descarga. Los colorantes empleados en la industria textil (colorantes azoicos) tienen un alto impacto en la flora, fauna y microorganismos, así como en la salud humana (Forgacs, 2004). Los colorantes azoicos son perceptibles tanto en los efluentes como en los cuerpos acuáticos receptores debido a su alta solubilidad (Stavropoulos & Zabaniotou, 2005). Así mismo, los cuerpos de agua pueden contener elementos metálicos y otros compuestos orgánicos tóxicos capaces de conferir color (McKay, 1996). Los principales efluentes contribuyentes de color a los cuerpos de agua naturales son las descargas de aguas residuales, las cuales son producto de la industria del teñido y alimentarias. La mayoría de los compuestos generadores de contaminación, pueden ser eliminados por métodos fisicoquímicos, más no así la presencia de color (Torres et al., 2008). Algunos colorantes que no son solubles en agua se pueden eliminan por medio de tratamientos físicos (floculación), o biológicos, ya que pueden ser adsorbidos sobre la biomasa. Los colorantes solubles en agua (colorantes reactivos) no son tan fácilmente biodegradables y los procesos fisicoquímicos convencionales de coagulación/floculación no han tenido los mejores resultados (Torres et al., 2008).
El Rojo Núm.40 (R40) es un colorante monoazoico, se emplea como aditivo alimentario y presenta coloración roja (Badui, 2006). La Tartrazina (A5) es un colorante sintético monoazoico. Este se emplea como aditivo, presenta coloración amarilla-naranja. Se ha observado que la ingesta de Tartrazina y Rojo Allura, entre otros colorantes, han afectado la salud de los consumidores y a largo plazo se puede desarrollar un cáncer (Maekawa et al., 1987).
Los tratamientos aplicados a los efluentes no han sido favorables totalmente, ya que solo se puede remover 50 % de la concentración de colorantes azoicos en las descargas debido a su resistencia a la degradación; presentan altos pesos moleculares y estructuras químicas complejas, por lo tanto, diariamente cientos de toneladas de colorantes se dirigen a los cuerpos acuáticos, incluso los efluentes provenientes de un tratamiento fisicoquímico siguen presentado coloración posterior al tratamiento (Torres et al., 2008). Procesos de tratamiento avanzado como la adsorción de colorantes azoicos con carbón activado han cobrado interés debido a la nula generación de moléculas secundarias (Prahas et al., 2007). Varias investigaciones han empleado carbón activado (CA) preparado a partir de varios materiales lignocelulósicos, demostrando su eficacia como material adsorbente (Cagnon et al., 2009, Ioannidou & Zabaniotou, 2007). La lignocelulosa, es un heteropolímero conformado por celulosa, hemicelulosa y lignina (Cagnon et al., 2009). La propiedad adsorbente del CA la confiere la lignina. Los CAs que presentan una alta capacidad de sorción se obtienen de precursores con alta concentración de lignina, como son las cascarillas de almendras, cáscara de coco, semillas de árbol, cáscara de avellanas, huesos de ciruela, tallos de algodón, cáscara de arroz, de pistacho, de nuez y madera. No obstante, los carbones activados comerciales tienen un alto costo, ya que son fabricados a partir de recursos naturales y son activados químicamente (Bharanthi & Ramesh, 2013, Torres et al., 2012).
Se ha observado que los CA’s obtenidos a partir de cáscara de nuez y cacahuate presentan capacidad adsorbente para colorantes. Se han comenzado a implementar nuevos precursores carbonosos (Torres et al., 2012) como algunos subproductos agrícolas (cacahuate, piña, entre otros) mediante activación física (vapor de agua).
Chihuahua es el principal estado mexicano productor de nuez pecanera, estimando que la producción anual es de alrededor de 8 5000 toneladas. La producción genera residuos (cáscara de nuez), los cuales se clasifican como materia agroindustrial de manejo especial, por lo que son susceptibles de ser revalorizados mediante la producción de carbón activado (Torres et al., 2007). El beneficio del empleo de residuos agrícolas en la producción de CA, es que la materia prima es de muy bajo costo. Por otra parte, la cáscara de nuez pecanera presenta una composición química rica en lignina y celulosa que la hace idónea para la obtención de materiales carbonosos alternativos.
El presente estudio tuvo como objetivo evaluar la capacidad de sorción de un carbón activado preparado de cáscara de nuez para eliminar Tartrazina (A5) y Rojo Allura (R40) en un medio acuoso con y sin presencia de iones interferentes. Los resultados del presente estudio representan alternativa promisoria para la implementación de técnicas de sorción de azocolorantes provenientes de efluentes alimentarios y textiles en aguas residuales, mediante la revalorización de residuos agrícolas, y con ello, reducir los costos en los procesos de tratamiento avanzado de agua contaminada.
Desarrollo
Preparación del carbón activado a partir de cáscara de nuez
Se colocaron 50 g de cáscara de nuez pecanera previamente deshidratados dentro de un horno con reactor de cuarzo (Carbolite®, mod. HTR 11/75). La carbonización se realizó en presencia constante de nitrógeno (1 mL min-1), aumentando la temperatura con una rampa de calentamiento de 10 °C min-1 hasta alcanzar 850 °C (Torres et al., 2012). El proceso de carbonización se mantuvo durante 80 minutos, agregando 0.5 mL min-1 de agua destilada (activación). El carbón activado (CA) preparado se almacenó en una estufa a 100 ± 5 °C durante 24 h (Torres, 2012). El CA se trituró y fue tamizado para obtener dos tamaños de partícula diferentes; uno con diámetro entre 1 y 0.425 mm (CACN), y otro menor a 0.425 mm (CAP) (Torres et al., 2012).
Determinación del pH de equilibro del carbón activado (pHEQ)
El CACN se colocó dentro de un reactor de plástico (250 mL) con agua destilada. El pH inicial se midió y posteriormente fue monitoreado cada 24 h, decantando la fase acuosa y agregando nuevamente agua destilada. La muestra se colocó en agitación constante sobre un orbital de placa (Barnstead-Line lab®, mod. 156487) a 150 rpm. El análisis se llevó a cabo durante 8 días, tiempo en que el valor de pH de la fase acuoso se mantuvo constante (Torres et al., 2012).
Determinación del pH de carga nula (pHPZC)
La determinación del pHPZC se realizó preparando soluciones de 50 mL de NaCl 0.01 M (99 %, Sigma Aldrich®) ajustando con HCl (ACS 37 %, Sigma Aldrich®) y NaOH (99 %, Sigma Aldrich®) 0.1 M los valores de pH a 2, 4, 6, 8, 10 y 12 y posteriormente colocando 0.5 g de CAP. Las muestras se prepararon por duplicado y fueron colocadas en agitación constante sobre un orbital de placa a 150 rpm durante 8 días posterior a los cuales se midió el valor de pH con un potenciómetro marca Hanna®.
Cinéticas de sorción
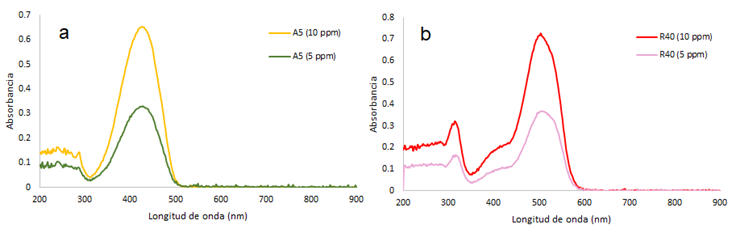
Se prepararon soluciones de Tartrazina (A5) y Rojo Allura (R40) a 10 mg L-1 en un volumen de 500 mL de agua destilada (MD) y agua con presencia de iones (Ca2+, Mg2+, HCO-3, SO-24, Cl-) (MI). De cada una de las soluciones se tomaron 2 mL con una micropipeta, analizando el máximo de absorción (barrido) en un equipo espectrofotométrico UV-Visible (Jenwey®, mod. 7315). El máximo de absorción obtenido fue a 452 y 505 nm para A5 y R40, respectivamente. En un reactor se colocaron 250 mL de A5 con 0.025 g de CACN y se colocó sobre un agitador orbital de placa a 150 rpm. Se tomaron alícuotas de 2 mL, y mediante la técnica espectrofotométrica UV-Visible, se obtuvo concentración inicial, y después cada hora se determinó de nuevo la concentración en el medio acuoso hasta un total de 6 mediciones; posteriormente, se tomó otra medición de la concentración cada 24 h durante un periodo de 8 días. Este mismo procedimiento se llevó a cabo para el colorante R40. Los volúmenes sometidos a la determinación analítica de la concentración mediante la técnica destructiva fueron reintegrados a cada uno de los reactores para no alterar el volumen del sistema. En la Figura 1 se muestra el barrido espectrofotométrico UV-Visible de 200 a 900 nm de la solución de A5 y R40 antes (10 mg g-1) y después del proceso de sorción (5 mg g-1), en la cual se observa que no existe desplazamiento de las bandas de absorción; con ello se puede asegurar que después de la remoción del colorante por los materiales adsorbentes la molécula permaneció con la misma estructura molecular y solo hubo disminución en la intensidad (absorbancia) de las bandas debido a la propia disminución de la concentración de cada colorante.
Cinética de sorción en sistema bicomponente Tartrazina (A5)-Rojo Allura (R40)
Se preparó una solución bicomponente con la presencia de A5-R40 (10 mg L-1) a un volumen de 250 mL de agua destilada (MD) y agua con presencia de iones (MI), colocando 125 mL de A5 y R40, respectivamente, con 0.025 g de CACN. Las concentraciones utilizadas fueron considerando valores por encima de lo encontrado en efluentes de aguas contaminadas con colorantes para asegurar la correcta determinación de dichas concentraciones en el medio acuoso. Se obtuvo el máximo de absorción para el sistema bicomponente (430 nm). Se tomaron alícuotas de 2 mL cada hora durante las primeras 6 horas y después cada 24 h durante un periodo de 8 días y se midió la absorbancia para determinar la concentración de colorante. Posteriormente se llevó a cabo un ensayo empleando carbón activado comercial (CAC). Los iones presentes en el medio iónico empleado fueron los siguientes: Ca2+ (80 mg L-1), Mg2+ (26 mg L-1), K+ (1 mg L-1), Si4+ (15 mg L-1), HCO- 3 (360 mg L-1), SO-2 4 (12.6 mg L-1) y Cl- (6.8 mg L-1). Los estudios de cinéticas de sorción para A5, R40 y el sistema bicomponente A5-R40 (MI y MD) se llevaron a cabo por triplicado. Los reactores empleados para los respectivos análisis se colocaron sobre un agitador orbital de placa a 150 rpm. Los resultados experimentales fueron ajustados a la ecuación cinética de primer orden, también conocido como la ecuación de Lagergren y que se utiliza para describir la sorción de un soluto en solución acuosa sobre una superficie sólida (Ho & McKay, 1996) (Ecuación 1). Cuando el ajuste se da al modelo de primer orden, el material adsorbente posee una superficie homogénea, donde la sorción se lleva acabo de manera similar sobre toda la superficie del material carbonoso (Torres et al., 2012).
Donde:
qt = masa de colorante retenido respecto al tiempo (mg g-1)
qo = masa de colorante retenido al alcanzar el equilibrio de sorción (mg g-1)
k1 = constante cinética de dicho modelo (h-1)
t = tiempo de contacto (Ho & McKay, 2000).
El modelo de pseudo-segundo orden es aplicado cuando la tasa de sorción es dependiente de grupos funcionales del adsorbente como lo son grupos polares como hidroxilos, aldehídos, cetonas, fenoles, entre otros; observando dicha relación en función de la Ecuación 2.
Donde:
t = tiempo de reacción
qt = cantidad de soluto sorbido en la superficie a cualquier tiempo (mg g-1)
k = constante de sorción de pseudo-segundo orden (g mg-1 h-1)
qe = capacidad de sorción en equilibrio (mg g-1) (Ho & McKay, 2000).
Isoterma de sorción del sistema bicomponente Tartrazina (A5)-Rojo Allura (R40) en medio iónico (MI)
Las isotermas de sorción se realizaron mediante el contacto de 0.05 g de CACN con 50 mL de un sistema A5-R40 a diferentes concentraciones (10, 20, 30, 40, 50, 60, 70, 80, 90 y 100 mg/L) en medio iónico (MI). Las muestras se colocaron a agitación constante sobre un agitador orbital (Fisher Scientific®) a 150 rpm durante 72 h. Las muestras se prepararon por duplicado. Pasadas las 72 h, se prepararon disoluciones, tomando 0.2 mL de cada una de las soluciones en 1.8 mL de agua en medio destilado (MD). Se midió la concentración mediante espectrofotometría UV-Visible a 430 nm (Torres et al., 2012). El modelo de isoterma de Langmuir describe el proceso de sorción sobre una superficie perfecta con centros de adsorción uniforme (Ecuación 3), se asume que la sorción ocurre en una capa en la que los sitios activos de la superficie son independientes unos de otros y que no hay transmigración de adsorbato sobre la superficie (Vargas et al., 2011).
Donde:
qe = concentración de colorante retenida por el adsorbente (mg g-1)
Ce = concentración de colorante en la fase líquida (mg L-1)
1 = la dependencia de la ecuación a una temperatura equivalente a la unidad
KL = constante de equilibrio (Foo & Hamed, 2012).
Por otro lado, la isoterma de Freundlich aplica para superficies heterogéneas y considera la variación de energías entre los centros activos de la superficie (Ecuación 4) (Levine, 2004).
De la ecuación anterior:
qe = concentración de colorante en el sólido (mg g-1)
KF = constante de Freundlich relacionada con la capacidad de sorción
Ce = concentración en equilibrio en fase líquida (mg L-1)
1/nf = intensidad de adsorción (Levine, 2004).
La constante nf se conoce como el factor de heterogeneidad e indica según su linealidad el tipo de proceso de sorción del que se trata. Cuando el valor de nf es menor a 1 se trata de un proceso de sorción de tipo químico y cuando es mayor favorece una sorción de tipo física (Vargas et al., 2011).
Espectroscopia Infrarroja por Transformada de Fourier (FTIR)
La determinación de grupos funcionales sobre la superficie de los materiales preparados se llevó a cabo con FTIR, caracterizando el CACN, así como las respectivas muestras saturadas con los colorantes azoicos de estudio en medio iónico y destilado. Los análisis se llevaron a cabo a una resolución de 4 cm-1, con un barrido de 24 veces, en el intervalo de 400 y 4000 cm-1 en un equipo Bruker Optics® Fourier Transform Infrared Spectrometers mod. Alpha T.
Discusión y análisis de resultados
Determinación del pH de equilibro (pHEQ)
Se observó una disminución del valor del pH del carbón activado granular preparado de cáscara de nuez (CACN) hasta alcanzar el pH de equilibrio a las 192 h con un valor de 9.8 (Figura no mostrada). De esta manera, sobre la superficie del adsorbente quedan moléculas hidrófobas, tales como fenoles, grupos carboxilo y carbonilo, lactonas y grupos hidroxilo (Aguayo et al., 2017; Toles et al., 1999), es decir, el CACN presentó un carácter hidrofóbico. Wartell & Marshall (2001) realizaron en un estudio previo del análisis de cáscara de nuez, encontrando que, por cada gramo de biomasa, 0.56 % corresponde a materia inorgánica (ceniza). El material carbonoso obtenido en el presente estudio demostró impurezas superficiales (materia inorgánica), por lo que el valor de pH inicial fue de 12.4. Dichas impurezas fueron altamente solubles (moléculas hidrofílicas) por lo que, a las 120 h de lavados continuos y mediciones, el valor pH de equilibrio (pHeq) para el material preparado (CACN) fue de 10.
pH de carga nula (pHPZC)
El pH de carga nula (pHpzc) del CAP después de 192 h fue de 8.2, siendo así un parámetro fisicoquímico que indica el pH en que la carga neta del material carbonoso es igual a cero. Los grupos funcionales sobre la superficie del material carbonoso estuvieron desprotonados, perdiendo así las propiedades de interacción adsorbente-adsorbato, por ello, valores de pH entre 7 y 9 no son óptimos para procesos de sorción con CACN (Regti et al., 2017). El contenido de oxígeno en CACN es el factor que determina el pH de carga nula del material; el pH de carga nula aumenta a medida que disminuye el contenido de oxígeno en la biomasa, siendo así que Aguayo et al. (2013) mostraron que la cáscara de nuez presentó un 43.9 % de oxígeno por gramo de biomasa, porcentaje mayor que otros materiales como la cáscara de nuez de Brasil (43.5 %), cáscara de almendra (41.6 %) y cáscara de avellana (40.2 %) (Demirbas, 2006). El CACN presenta un pHPZC menor a las biomasas antes mencionadas. En el caso del pHeq (9.8) fue mayor que el pHPZC (8.2), por lo que al cumplir la relación pHeq ˃ pHpzc la superficie de la matriz carbonosa se encontró cargada negativamente y por arriba del pHpzc, de esta manera presenta afinidad por moléculas catiónicas (carga positiva) (Aguayo, 2013; Wartelle & Marshall 2001).
Cinéticas de sorción
El CACN presentó la misma afinidad tanto por el colorante A5 que el R40, ya que la remoción durante las primeras 6 h fue de aproximadamente de 4 y 7 mg L-1, respectivamente, para el sistema bicomponente y hasta alcanzar el equilibrio de sorción (72 h). El CACN mostró una remoción de 95 % para cada uno de los colorantes partiendo de 10 mg L-1. Wartelle & Marshall (2001), reportaron que una cantidad importante de celulosa (33.2 g 100 g-1), hemicelulosa (9.6 g 100 g-1) y lignina (48.3 g 100 g-1) confiere la capacidad de adsorción a los materiales carbonosos. La capacidad adsorbente (mg g-1) de distintas matrices carbonosas sobre la Tartrazina, ha sido determinada en varios materiales adsorbentes, tal es el caso del aserrín (4.71 mg g-1) (Banerjee & Chattopadhyaya, 2013) y suelo rumano (1.82 mg g-1) (Caliman et al., 2009). En comparación, en el presente estudio el CACN mostró mayor capacidad de sorción al equilibrio (10 mg g-1) debido a que presenta mayor porcentaje de lignina-celulosa-hemicelulosa que otros materiales lignocelulósicos. Las Figuras 2 y 3 presentan ajustes a modelos cinéticos de sorción de los colorantes A5 y R40, respectivamente sobre CACN. Se graficó qt (concentración de colorante adsorbido) y t (tiempo) y se presenta el coeficiente de correlación (R2).

Figura 2: Ajuste de resultados experimentales del proceso de sorción de A5 sobre CACN a las ecuaciones cinéticas de: a) primer orden y b) pseudo segundo orden
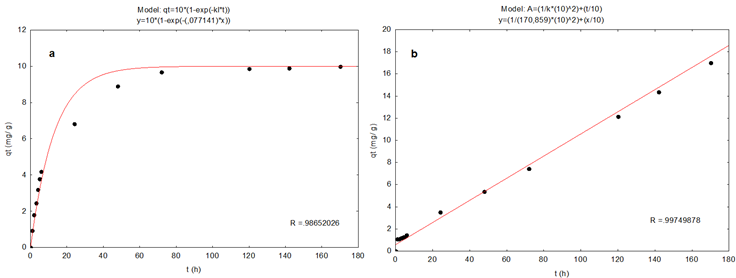
Figura 3: Ajuste de resultados experimentales del proceso de sorción de R40 sobre CACN a las ecuaciones cinéticas de: a) primer orden y b) pseudo segundo orden
El sistema CACN-A5 presentó ajuste al modelo cinético de pseudo segundo orden (R2= 0.9880) (Figura 1b), logrando remover 9.67 mg g-1. El sistema CACN-R40 presentó mejor ajuste al modelo de pseudo segundo orden, con un R2= 0.9950 (Figura 4b), logrando remover 9.5 mg g-1 de colorante. La ecuación cinética de pseudo segundo orden indica una superficie de sorción preferentemente heterogénea (Aguayo et al., 2017). Cuando se presenta ajuste de los datos experimentales al modelo de pseudo segundo orden implica que el proceso de sorción se llevó a cabo mediante el mecanismo mencionado con anterioridad.
Cinética de sorción en sistema bicomponente (Tartrazina-Rojo Allura)
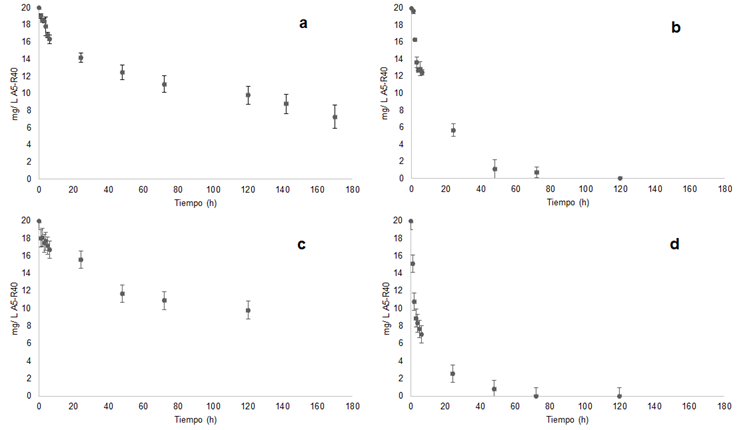
En la Figura 4 se observan los resultados obtenidos para las cinéticas de sorción en el sistema bicomponente A5-R40 en medio iónico (MI) y destilado (MD), donde se empleó CACN y carbón activado comercial (CAC). El equilibrio de sorción con el material (a) CACN-MD comenzó a partir de las 72 h (9 mg L-1), logrando una saturación total a las 170 h de tiempo de contacto (13 mg L-1). Para el material (b) CAC-MD la saturación comenzó a las 48 h (19 mg L-1), logrando una saturación total a las 120 h (20 mg L-1). El material (c) CACN-MI presentó una saturación a partir de las 48 h (8 mg L-1), la saturación total fue a las 120 h (10 mg L-1). La saturación del material (d) CAC-MI comenzó a las 48 h (19 mg L-1), logrando una saturación total a las 120 h (20 mg L-1). Por lo tanto, la capacidad de sorción en los materiales adsorbentes se llevó a cabo de manera favorable de la siguiente manera (a) ˂ (c) y (b) = (d).
El proceso de sorción (a) CACN-MD presentó un tiempo de equilibrio (170 h) mayor a los de los sistemas simples de A5 y R40 (72 h); lo anterior se debió a la competencia entre ambos colorantes por los sitios de sorción sobre el carbón activado. Un estudio similar fue reportado por Regti et al. (2017), donde se emplearon carbones activados obtenidos a partir de cáscara de Persea americana y Ziziphus mauritina, utilizando los colorantes Azul Básico 41 y Amarillo Básico 28, demostrando que las afinidades de los adsorbatos por los adsorbentes afectan en los procesos de adsorción y que los sistemas bicomponentes (dos colorantes) demuestran procesos de remoción más prolongados respecto a los monocomponentes (un colorante).
El CACN presentó una carga superficialmente negativa al valor de pH del medio acuoso, lo que indica afinidad por cationes presentes en el medio (Ca2+ ˃ Mg2+ ˃ K+), (Aguayo et al., 2013). Un estudio similar fue reportado por Dastgheib & Rockstraw (2002), en el cual se muestra un posible mecanismo de interacción adsorbente-catión-colorante, de esta manera el proceso de sorción CACN-MI (c), presenta mayor velocidad de sorción que el proceso de sorción CACN-MD (a).
La sorción al equilibrio para CAC fue mayor que CACN, esto se debió a la diferencia de activaciones, siendo química para el carbón comercial y solo física para el carbón preparado en la presente investigación. La activación química produce macroporos y procesos de sorción más rápidos como es el caso de carbones activados comerciales. Por ello, los materiales carbonosos activados químicamente generalmente presentan mejores resultados, ya que producen una superficie de contacto (0.2-0.4 m2 g-1) mayor que los carbones activados físicamente (0.1 y 0.2 m2 g-1) (Wartell & Marshall, 2001). En la Tabla 1 se presentan los parámetros cinéticos obtenidos de los ajustes de los datos experimentales a modelos cinéticos de sorción para CACN y CAC, tanto en MD como en MI. El CACN-MD mostró un ajuste favorable al modelo de pseudo segundo orden (R2= 0.8411) en un tiempo de 170 h, lo que indicó que el proceso de sorción fue de manera heterogénea donde los sitios activos sobre el material carbonoso se encontraron distribuidos de esa manera. El CAC-MD mostró tendencia por el modelo de primer orden (R2= 0.9663), es decir, la sorción del colorante se llevó a cabo de manera homogénea, donde la remoción fue total (20 mg L-1) en un periodo de 48 h; indicando así que los sitios de sorción en el adsorbente se encontraron distribuidos de manera uniforme.
Tabla 1: Parámetros cinéticos de primer y pseudo-segundo orden obtenidos del proceso de sorción de A5 y R40 en sistema bicomponente
| Material | Primer orden | Pseudo-segundo orden | ||
|---|---|---|---|---|
| K1 g mgh-1 | R2 | K2 g mgh-1 | R2 | |
| CACN-MD | 0.0070 | 0.8363 | 144.93 | 0.8409 |
| CAC-MD | 0.0817 | 0.9662 | 750.78 | 0.7838 |
| CACN-MI | 0.0084 | 0.7152 | 178.95 | 0.7152 |
| CAC-MI | 0.2243 | 0.9557 | 3900.75 | 0.9986 |
Nota: CACN-MD (carbón activado cáscara de nuez medio destilado), CAC-MD (carbón activado comercial medio destilado), CACN-MI (carbón activado cáscara de nuez medio iónico), CAC-MI (carbón activado comercial medio iónico
Por otro lado, el CACN-MI mostró ajuste aceptable a ambos modelos, tanto de primer orden como de pseudo segundo orden donde los iones presentes en la solución provocaron cierto efecto superficial del material carbonoso (Aguayo et al., 2013), es decir, el material presentó carga neta negativa (pHeq ˃ pHpzc), tuvo afinidad por los cationes, interactuó con los colorantes aniónicos (A5 y R40), presentó la relación adsorbente-catión-colorante, y mostró una remoción máxima de la solución de 10 mg L-1 en 120 h, 50 h menos respecto al sistema CACN-MD (13 mg L-1 en 170 h).
Aguayo et al. (2017) explican que la proporción de remoción (adsorbente-catión-adsorbato) se lleva a cabo dependiendo del tipo de catión, mono o divalente de Ca2+, Mg2+ y K+ (iones utilizados en el presente estudio), en una proporción 1:1:1 ó 1:2:2. Comparando los sistemas de sorción, el CACN-MI removió 3 mg L-1 menos que CACN-MD, debido a la competencia de los iones y los colorantes del medio por los sitios activos del material carbonoso (Figura 4). De esta manera, la constante de primer orden o de Lagergren (K 1 ) de CACN-MD es menor a la de CACN-MI, indicando así que el proceso de sorción fue más rápido para el material en medio iónico (MI). Comparando R2 tanto de CACN-MD como MI, no guardan una relación, ya que el medio iónico afectó el proceso de sorción con CACN. El CAC-MI mostró ajuste de pseudo segundo orden, indicando que hubo modificación de superficie por el medio iónico, donde se llevó a cabo el mismo mecanismo anteriormente descrito (CACN-MI), alcanzando un equilibrio de sorción de 20 mg L-1 en 48 h de tiempo de contacto. De esta manera el parámetro K 1 tanto para CAC-MD como CAC-MI no son comparables, debido a que cada uno de los materiales presentó ajuste a un modelo cinético específico (primer orden y pseudo segundo orden, respectivamente). En el caso de los materiales que presentaron un mejor ajuste al modelo cinético de primer orden el mecanismo de sorción se realizó sobre una superficie homogénea en cuanto a la distribución de los sitos activos; por el contrario, para los materiales donde se obtuvo un mejor ajuste al modelo cinético de pseudo segundo orden, el proceso de sorción se llevó a cabo sobre una superficie adsorbente con alta heterogeneidad en cuanto a la distribución de poros y muy posiblemente en sitios de sorción con diferente energía (Torres et al., 2012).
Isoterma de sorción del sistema bicomponente Tartrazina(A5)-Rojo Allura (R40) en medio iónico (MI)
En la Tabla 2 se presentan los parámetros cinéticos obtenidos del ajuste de las ecuaciones de isotermas de adsorción para el sistema A5-R40 en MI y MD. Las isotermas de sorción permiten describir el mecanismo de interacción entre adsorbente y adsorbato. Los materiales CACN-MD y MI presentaron mejor ajuste al modelo de Freundlich (R2= 0.9667 y R2= 0.9730, respectivamente).
Tabla 2: Ajuste de resultados a modelos matemáticos de isotermas de sorción
| Material | Langmuir | Freundlich | |||
|---|---|---|---|---|---|
| KL | R2 | KF | nf | R2 | |
| CACN-MD | 0.4041 | 0.9166 | 23.4842 | 0.5399 | 0.9667 |
| CACN-MI | 0.1369 | 0.7948 | 5.8844 | 0.8998 | 0.9730 |
Nota: CACN-MD (carbón activado cáscara de nuez medio destilado), CACN-MI (carbón activado cáscara de nuez medio iónico), K (constante de sorción), R2 (coeficiente de correlación)
La isoterma de Freundlich aplica generalmente para superficies heterogéneas y considera la variación de energías entre los centros activos de la superficie (Levine, 2004). Los materiales CACN-MD y CACN-MI presentaron un ajuste adecuado al modelo cinético de pseudo segundo orden (superficie heterogénea), y al mismo tiempo también un ajuste al modelo de isoterma de Freundlich, es un indicativo de que la sorción se realizó de forma multimolecular (Aguayo et al., 2013). Cuando el valor de n f (intensidad de sorción) es menor a 1 se trata de un proceso de sorción de tipo químico y cuando es mayor favorece una sorción de tipo física (Vargas et al., 2011). CACN-MD presentó un n f 0 ˂ 0.5399 ˂ 1, y CACN-MI presentó un n f 0 ˂ 0.8998 ˂ 1 indicando así un proceso de sorción químico (quimisorción) para ambos materiales. Es decir, se formó una sola capa sobre la superficie del material, donde las fuerzas químicas que permitieron la adhesión del adsorbato sobre el adsorbente fueron interacciones covalentes, lo que implicó el reordenamiento de electrones de los grupos funcionales del adsorbente y los electrones de moléculas o iones adsorbato (Levine, 2004). El mecanismo de sorción fue un proceso exotérmico que requirió de elevada energía de activación. Se observó también que la velocidad de sorción de CACN-MD respecto a CACN-MI fue mayor (K= 23.4842 ˃ K= 5.8844, respectivamente), debido a que los iones presentaron afinidad por los sitios activos del adsorbente (Aguayo et al., 2017) interfiriendo con la remoción de los colorantes A5-R40.
Análisis mediante espectroscopia Infrarroja por Transformada de Fourier (FTIR)
En la Figura 5a se presenta el espectro infrarrojo (IR) del carbón activado a partir de cáscara de nuez (CACN). La mejor resolución de bandas se observa entre 0.14 y 0.16 de unidades arbitrarias (u.a.) de absorbancia, y la mayor parte de los grupos funcionales se encuentran entre 1550 y 3000 cm-1. Los grupos funcionales presentes entre las resoluciones y los números de ondas anteriormente mencionados son los que actuaron en los procesos de adsorción con CACN, sin embargo, debido a las características heterogéneas y amorfas del adsorbente los espectros FTIR no se encuentran bien definidos.
La caracterización de los grupos funcionales en los adsorbentes permite conocer el tipo de interacciones moleculares (adsorbente-adsorbato) (Aguayo et al., 2013). En la Figura 5a, a 1367 cm-1 es un estiramiento S=O, característico de sulfóxidos, sulfatos y sulfoamidas, a 1550 cm-1 representa grupos funcionales oxigenados en sistemas conjugados y no conjugados (estiramientos vibracionales de nitro compuestos orgánicos), (Sócrates, 2001), a 1620 cm-1 son estiramientos C=C de anillos aromáticos y estiramiento asimétricos, característicos de nitro compuestos orgánicos (nitritos) (Suárez et al., 2002; Sócrates, 2001), entre 2000 y 2280 cm-1 indica la literatura la existencia de estiramientos de grupos funcionales con doble enlaces (Sócrates, 2001). De esta manera, los resultados obtenidos del análisis de FTIR, corresponden con los obtenidos por Aguayo et al. (2017) y Regti et al. (2017). El CACN presenta carácter hidrófobo debido a los grupos fenólicos, carboxílicos y carbonilo e hidroxilos (Toles et al., 1999).
En la Figura 5b se presenta el espectro FTIR después de la sorción de los colorantes sobre los carbones activados, denominados CACN-A5 y CACN-R40 (materiales saturados con A5 y R40, respectivamente). La mejor resolución de bandas se observa entre 0.16 y 0.14 unidades arbitrarias (u.a.) de absorbancia. Entre los números de onda 1225 y 2511 cm-1 se encuentran los grupos funcionales característicos de cada uno de los colorantes, A5 y R40, indicando así que se llevó a cabo un proceso de sorción. La banda localizada en número de onda 1225-1310 cm-1 indica estiramientos C-O-C, grupos éteres, grupo funcional presente en R40 (gfpR40), a 1422 cm-1 son flexiones tipo H-C-H, como son los grupos metilos y metilenos (gfpR40), a 1595 cm-1 se llevan a cabo estiramientos de tipo C=C (sistema de anillos aromáticos), grupos funcionales presentes en A5 (gfpA5) y gfpR40. A números de onda 2180-2500 cm-1 la literatura indica la presencia de estiramientos de triple enlace, como los grupos azo (-N=N-), enlace característico de los colorantes azoicos, indicativo de la presencia de los colorantes en el material saturado (Torres et al., 2012). Así mismo, las bandas alrededor de 1422 cm-1 representan la presencia de grupos carboxílicos provenientes de los colorantes azoicos y del proceso de sorción de los mismos sobre la superficie del carbón activado. Los hallazgos anteriores se conjugan con los obtenidos de los experimentos de sorción (isotermas) indicando así que el mecanismo de sorción fue químico para ambos materiales. La baja intensidad de las bandas de absorción se debe en mayor parte a que la masa de colorante presente en la superficie de los materiales es insuficiente para obtener bandas bien definidas considerando los límites de detección del instrumento utilizado.
Conclusiones
Mediante el proceso de carbonización/activación física del precursor agrícola (cáscara de nuez), se logró obtener un material carbonoso alternativo con propiedades adsorbentes. Los resultados del presente estudio indicaron que los valores de pH óptimos para el empleo de carbón activado a partir de CACN para tratar agua contaminada es aquel menor a 7 y mayor a 9. La capacidad máxima de sorción de los sistemas CACN-A5 y CACN-R40 en medio destilado (MD) fue de 95 % (9.50 mg L-1 en 72 h) a partir de una concentración de 10 mg L-1. Ambos sistemas presentaron mayor ajuste para la ecuación cinética de pseudo segundo orden, lo que indicó una superficie de adsorción heterogénea. El proceso de sorción sobre el material CACN-MD en el sistema bicomponente A5-R40 demostró una capacidad de sorción del material de 50 % (10 mg L-1 en 120 h) a partir de una concentración inicial de 20 mg L-1, presentando menor capacidad de sorción que el tratamiento CACN-MI (medio iónico) (13 mg L-1 en 170 h). El CACN-MI presentó un mejor ajuste a los modelos de primer orden y pseudo segundo orden, presentando una superficie de sorción modificada por los cationes presentes en el medio. El material CACN-MI presentó un mejor ajuste de los datos experimentales a la isoterma de Freundlich, indicando un proceso de sorción multimolecular (adsorción tipo químico). Los espectros FTIR demostraron los tipos de moléculas superficiales que interaccionaron con los adsorbatos en los procesos de sorción, indicando que la remoción de los analitos se llevó a cabo y que los iones no afectaron las propiedades fisicoquímicas de los colorantes (degradación), indicando que estos quedaron retenidos sobre la superficie de la matriz carbonosa.
De esta manera, fue posible obtener un material adsorbente eficaz en la remoción de concentraciones importantes de colorantes, ya sea en un sistema mono y bicomponente en un tiempo de contacto relativamente corto. Siendo así que el CACN puede emplearse en los tratamientos de aguas residuales (tratamiento avanzado) contaminadas con colorantes azoicos (A5 y R40).











 nueva página del texto (beta)
nueva página del texto (beta)