Introducción
El interés en el estudio de la acetilación de aminas radica en su importancia dentro de la industria química (Caglieri y Macaño, 2016), por la utilidad de las amidas, productos de dicha reacción, como materia prima para la síntesis de bactericidas e insecticidas (Naik and Chikhalia, 2007) además de que dicha reacción proporciona un medio eficiente para la protección del grupo amino en un proceso sintético como la síntesis de péptidos (Montalbetti y Falque, 2005).
La acetilación de aminas con anhídrido acético es una reacción de sustitución nucleofílica sobre carbono insaturado, donde el nucleófilo es la propia amina. El aumento de la velocidad de reacción se puede conseguir con el agregado de un catalizador, como una base (Yadav et al., 2001), un ácido de Brönsted (Xie et al., 2011) o un ácido de Lewis (Farhadi y Panahandehjoo, 2010). En búsqueda de procesos alternativos, ambientalmente favorables, se han llevado a cabo estudios experimentales de la acetilación de aminas empleando iones metálicos como ácidos de Lewis (Brahmachari et al., 2010), SiO2-Co(acac)2 y SiO2-Cu(acac)2 (Kour-Sodhi et al., 2013), CoCl2 en acetilación de alcoholes (Mulla et al., 2012) y estudios computacionales de dicha reacción, empleando AlCl3 y el método DFT (Tong et al., 2012).
Dada la importancia de la acetilación de aminas y con el objetivo de aportar nuevos datos a dicha reacción en particular y a la Química Orgánica en general, se presenta un estudio teórico comparativo de la acetilación de etilamina y anilina, catalizada por diferentes iones metálicos M2+: Zn2+; Co2+, Mn2+; Cu2+ y Ni2+, a través del análisis de los correspondientes intermediarios de reacción. Se completa el estudio con un análisis de la influencia de diferentes solventes polares en la acetilación de ambas aminas en ausencia de catalizador.
Desarrollo
Para estudiar la reacción de acetilación de anilina y etilamina catalizada por diferentes iones metálicos, actuando como ácidos de Lewis, se empleó el método UFF-Universal Force Field, que es útil para sistemas inorgánicos y se utilizó el modelo IEFPCM o PCM (Polarizable Continuum Model) para llevar a cabo el estudio de la influencia de los diferentes solventes en la acetilación de ambas aminas. Cabe aclarar que todos los cálculos se realizaron empleando el programa Gaussian´09 (Frisch et al., 2009).
Se modelaron y optimizaron las estructuras de todas las especies que intervienen en ambas acilaciones, determinándose los parámetros geométricos óptimos correspondientes, calculando además las energías mínimas de todos los compuestos, reactivos y productos que participan en las reacciones, así también como los parámetros geométricos y energías de los respectivos intermediarios. Para realizar los cálculos mencionados se utilizó el método DFT basado en la teoría de funcionales de densidad (Parr y Yang, 1989) y dentro de este se empleó el B3LYP (Becke, 1997). Se usaron dos conjuntos de base 3-21G* y 6-31G*, que indicaron que se utilizan tres o seis funciones gaussianas para representar los orbitales atómicos internos, mientras que los externos, capa de valencia, se representan mediante dos o tres funciones para la parte contraída y una para la parte difusa, más una función de polarización para átomos pesados, indicada mediante el *, que representa el efecto de los orbitales tipo d, respectivamente.
Este método se ha empleado para calcular las energías de activación de la acetilación de diferentes aminas en ausencia de catalizador y solventes (Caglieri y Macaño, 2016) y para calcular las energías de activación de la hidrólisis de diferentes amidas, donde esta reacción también es una sustitución nucleofílica sobre carbonilo (Caglieri y Pagnan, 2013).
Discusión y análisis de resultados
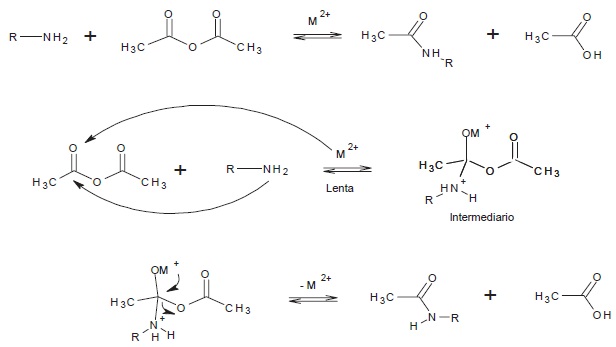
La Figura 1 muestra la reacción general y el mecanismo de reacción de la acetilación de etilamina (R=C2H5) y anilina (R=C6H5) con anhídrido acético, catalizada con MCl2 donde M muestra diferentes metales, cuyos productos de reacción son: ácido acético y las amidas Netilacetamida y N-fenilacetamida, respectivamente.
Se observa en el mecanismo de reacción a los iones metálicos actuando como ácidos de Lewis catalizando la acetilación, debido a la formación de un complejo con el oxígeno del carbonilo, facilitando la polarización del mismo y favoreciendo de esta manera el ataque del agente nucleofílico (amina) al carbono del carbonilo.
Los resultados obtenidos se reportan en las Tablas 1 y 2 para la etilamina y anilina, respectivamente.
Tabla 1 Efecto de los iones metálicos en la acetilación de etilamina
| M | r (M -O) Å | θ (M-O-C) º | Ea- Kcal/mol | Ei - Kcal/mol |
|---|---|---|---|---|
| Zn2+ | 1.84 | 108.32 | 9.59 | 57.82 |
| Cu2+ | 1.85 | 110.44 | 10.93 | 59.11 |
| Ni2+ | 1.87 | 110.97 | 14.18 | 62.38 |
| Co2+ | 1.92 | 114.16 | 14.85 | 63.12 |
| Mn2+ | 1.93 | 121.59 | 17.45 | 66.42 |
Tabla 2 Efecto de los iones metálicos en la acetilación de anilina
| M | r (M -O) Å | θ (M-O-C) º | Ea- Kcal/mol | Ei - Kcal/mol |
|---|---|---|---|---|
| Zn2+ | 1.84 | 108.32 | 19.26 | 72.69 |
| Cu2+ | 1.85 | 109.38 | 20.46 | 73.84 |
| Ni2+ | 1.87 | 109.58 | 21.34 | 74.75 |
| Co2+ | 1.92 | 109.91 | 21.63 | 75.10 |
| Mn2+ | 1.93 | 110.97 | 23.22 | 77.38 |
donde
M |
= metal |
r (M-O) |
= distancia en Å, entre el metal y el oxígeno del carbonilo |
θ (M-O-C) |
= ángulo en °, formado entre el metal y el grupo carbonilo |
Ea y Ei |
= energía de activación de la acetilación y energía del intermediario de reacción en Kcal/mol |
Las Tablas 1 y 2 reportan un aumento de las energías de activación de ambas acetilaciones a medida que aumenta la distancia Metal-Oxígeno, observándose el siguiente orden creciente de reactividad para los iones metálicos: Zn2+ > Cu2+ > Ni2+ > Co2+ > Mn2+, ácidos de Lewis, empleados como catalizadores en ambas reacciones. Trabajos sobre acetilación de aminas indican un orden de reactivad Co > Mn (Kour Sodhi et al., 2013) y un orden de reactivad Cu > Co > Mn (Jeyakumar y Chand, 2006) para la acetilación de aminas.
El orden de reactividad observado se puede asociar al hecho de que a medida que disminuye el radio atómico del metal, la distancia de enlace M-O disminuye, esto implica un enlace más fuerte, debido a un menor impedimento estérico, que se traduce en una mayor estabilidad del intermediario de reacción y en una menor energía de activación de la acetilación.
Por tanto, nuestros estudios indican que el Zn arrojó ser el metal más eficiente para la acetilación de etilamina y anilina, mientras que el Mn resultó ser el menos eficiente para ambas reacciones, coincidiendo con estudios experimentales (Jeyakumar y Chand, 2006).
En la Figura 2 se describen las etapas a través de las cuales se lleva a cabo la reacción de acetilación de etilamina (R=C2H5) y anilina (R=C6H5) con anhídrido acético, en ausencia de catalizador, cuyos productos de reacción son: ácido acético y las amidas N-etilacetamida y N-fenilacetamida, respectivamente.
El mecanismo de la reacción de acetilación consiste en una primera etapa del ataque nucleofílico de la amina al carbono del carbonilo del anhídrido acético, gracias a la polarización que sufre dicho grupo, formando el intermediario tetraédrico, indicado entre corchetes en la Figura 2. Posteriormente, se restablece el doble enlace carbono-oxígeno y se elimina el anión acetato como grupo saliente que actúa como base sustrayendo un protón de la amida protonada, generando de esta manera la amida producto de reacción (Caglieri y Macaño, 2016).
Para llevar a cabo el estudio de la influencia del solvente empleando el modelo PCM se consideraron los siguientes solventes polares próticos: metanol y etanol y los siguientes solvente polares apróticos: acetonitrilo y acetona.
Las Tablas 3 y 4 reportan los valores de energías en Hartree de los reactivos (Er) de la acetilación y de los intermediarios tetraédricos (Ei) de cada una de las reacciones motivo de estudio para los diferentes solventes polares próticos y apróticos, valores obtenidos de la aplicación de los métodos indicados.
Tabla 3 Energías de reactivos
| DFT(B3LYP) | Etilamina | Anilina | Anhídrido Acético |
|---|---|---|---|
| 3-21G* - metanol | -134.43004 | -286.02822 | -379.62824 |
| 6-31G* - metanol | -135.13472 | -287.54045 | -381.60966 |
| 3-21G* - etanol | -134.42996 | -286.02807 | -379.62811 |
| 6-31G* - etanol | -135.13464 | -287.54032 | -381.60949 |
| 3-21G* - acetonitrilo | -134.43006 | -286.02826 | -379.62828 |
| 6-31G* - acetonitrilo | -135.13475 | -287.54049 | - 381.60971 |
| 3-21G* - acetona | -134.42989 | -286.02794 | -379.62800 |
| 6-31G* - acetona | -135.13456 | -287.54021 | -381.60935 |
Tabla 4 Energías intermediarios de reacción
| DFT(B3LYP) | Etilamina | Anilina |
|---|---|---|
| 3-21G* - metanol | -514.04268 | -665.62476 |
| 6-31G* - metanol | -516.72934 | -669.11894 |
| 3-21G* - etanol | -514.04137 | -665.62418 |
| 6-31G* - etanol | -516.72784 | -669.11803 |
| 3-21G* - acetonitrilo | -514.04304 | -665.62514 |
| 6-31G* - acetonitrilo | -516.72963 | -669.11940 |
| 3-21G* - acetona | -514.04009 | -665.62224 |
| 6-31G* - acetona | -516.72646 | -669.11632 |
Se observa en la Tabla 4, que el intermediario tetraédrico libera mayor energía en acetonitrilo en ambas acetilaciones y para los dos conjuntos de base empleados, lo que se traduce en una mayor estabilización del intermediario de reacción cuando se emplea dicho solvente.
Los disolventes polares se caracterizan por elevadas constantes dieléctricas, las mismas y los correspondientes valores de energías de activación en kcal/mol (Ea = Ei - E) de la acetilación de etilamina y anilina en presencia de los diferentes solventes, se reportan en las Tablas 5 y 6, respectivamente, calculadas empleando los métodos indicados, donde Ei es la energía del intermediario tetraédrico y E la suma de las energías del anhídrido acético y la amina correspondiente. Conversión 1 Hartree equivale a 627.51 kcal/mol.
Tabla 5 Energías activación acetilación etilamina
| Solventes | Constante | Ea - DFT(B3LYP) | Ea - DFT(B3LYP) |
|---|---|---|---|
| Dieléctrica a 25 ⁰C | 3-21G* | 6-31G* | |
| Acetonitrilo | 37.5 | 9.60 | 9.30 |
| Metanol | 33 | 9.79 | 9.44 |
| Etanol | 24 | 10.48 | 10.22 |
| Acetona | 20.7 | 11.17 | 10.95 |
Tabla 6 Energías activación acetilación anilina
| Solventes | Constante | Ea- DFT(B3LYP) | Ea - DFT(B3LYP) |
|---|---|---|---|
| Dieléctrica a 25 ⁰C | 3-21G* | 6-31G* | |
| Acetonitrilo | 37.5 | 19.70 | 19.32 |
| Metanol | 33 | 19.89 | 19.56 |
| Etanol | 24 | 20.08 | 19.94 |
| Acetona | 20.7 | 21.15 | 20.86 |
Las Tablas 5 y 6 reportan un aumento de las energías de activación a medida que disminuye la constante dieléctrica y polaridad de los diferentes disolventes empleados para la acetilación de etilamina y anilina, respectivamente. Esto puede asociarse a que un aumento de la polaridad del disolvente, estabiliza en mayor medida el intermediario tetraédrico de la reacción y, por lo tanto, se traduce en una disminución de la energía de activación de la acetilación.
El método DFT (B3LYP) con el conjunto de base 6-31G* reportó los valores más bajos de energía y la etilamina presentó la mayor reactividad frente a la acetilación.
La menor reactividad de la anilina frente a esta reacción, para todos los solventes empleados, en comparación con la etilamina, se puede asociar al reemplazo de un grupo etilo por un grupo fenilo. Este último permite una deslocalización, en el anillo aromático de los electrones no enlazados del nitrógeno de la anilina, disminuyendo su carácter nucleofílico. Mientras que el nitrógeno de la etilamina dispone más los electrones no enlazados, gracias al efecto inductivo por diferencia de electronegatividad, de cesión de electrones ejercido por el carbono del grupo etilo al nitrógeno de la amina, aumentando su carácter nucleofílico.
Además se reportó una menor energía de activación al emplear metanol y etanol, en comparación con el uso de acetona, solvente polar aprótico. Esto se asocia a que ambos alcoholes son solventes polares próticos que estabilizan el intermediario tetraédrico mediante puentes de hidrógeno más fuertes que las fuerzas intermoleculares dipolo-dipolo, ejercidas por la acetona.
El acetonitrilo, debido a su elevada constante dieléctrica y polaridad, resultó ser el solvente óptimo para la acetilación por la reducción en la energía de activación, tanto de la etilamina como de la anilina, coincidiendo con estudios de acetilación de anilinas en diferentes solventes, donde se reporta el mayor rendimiento de dicha reacción con el empleo de acetonitrilo (Praveen et al., 2011).
La anilina frente a la acetilación es más reactiva en acetonitrilo que en metanol, coincidiendo con estudios experimentales de acetilación de 4-cloroanilina con una conversión de la misma de 98 % y 85 % en acetonitrilo y metanol respectivamente (Habibi et al., 2013).
Conclusiones
De acuerdo con los resultados y discusión presentados en este trabajo, se pueden obtener las siguientes conclusiones:
Mediante nuestros cálculos teóricos se encontró que la etilamina presentó una mayor reactividad frente a la acetilación catalizada por los diferentes iones metálicos. Estos resultados son comparables a estudios experimentales de la reactividad de diferentes aminas alifáticas y aromáticas frente a la acetilación.
El Zn2+ resultó ser el ion metálico más reactivo, reportando los valores más bajos de energía.
La etilamina reportó una mayor reactividad frente a la acetilación en presencia de todos los solventes estudiados, en comparación con la anilina.
El acetonitrilo resultó ser el solvente ideal para ambas acetilaciones.
El método DFT (B3LYP) con el conjunto de base 6-31G* reportó, en todos los casos, los valores más bajos de energía.
La existencia de una concordancia entre los resultados teóricos obtenidos por este estudio y los datos experimentales descritos ampliamente en la literatura consultada, valida el empleo de los métodos Mechanics-UFF y DFT- IEFPCM como herramientas para el estudio de sistemas que involucran enlaces carbono-metal y de la influencia de solventes en la acetilación de aminas, respectivamente.











 text new page (beta)
text new page (beta)