1. Introducción
Por definición, la Diabetes Mellitus tipo 1(DM1) es una enfermedad crónica del páncreas en la que se destruyen las células productoras de insulina [1]. La insulina es una hormona que se fabrica en el páncreas, el cual actúa como una llave para abrir las células y permite que la glucosa sea utilizada como fuente de energía para ayudar a las células a completar su función preestablecida por el sistema inmunológico. Es importante canalizar esfuerzos adicionales para la atención de la diabetes en la sociedad dado que no existe una cura segura, fácil o eficaz para la DM1, además de ser una enfermedad hereditaria [2,3]. En México, desde el año 2000, la DM1 ha sido la primera causa de muerte entre las mujeres y la segunda entre los hombres; y en 2010 causó la muerte de cerca de 83,000 personas en el país [4]. En un estudio por la Encuesta Nacional de Salud y Nutrición de Medio Camino (ENSANUT MC 2016) [5], se concluye que solo el 87.8% de los adultos con diagnóstico médico previo de diabetes reciben algún tratamiento para controlar su enfermedad y se prevé que, en el año 2050 la situación puede ser aún más alarmante [6]. Las consecuencias de no realizarse medidas preventivas para control de la diabetes, puede llegar a desencadenar serios e irrevocables daños a la salud de la persona. Es por ello, que los nuevos avances tecnológicos en el tema sugieren técnicas para administrar de manera controlada el tratamiento de insulina, esto es buscando opciones menos invasivas, i.e., por vía oral [7]. Estos avances son posibles debido a la continua investigación en torno al tema y una estrategia para estudiar al DM1 es por medio de la biología matemática, donde se plantea la posibilidad de estudiar un modelo no lineal que describe la diabetes [8]. En la literatura, se han presentado análisis matemáticos para la DM1 enfocándose en diseñar un controlador robusto para la glucosa en la sangre [9], o en aplicar el método de lógica difusa para regular el nivel de la misma [10].
Otra estrategia para estudiar la DM1 es generando un modelo lineal a partir de datos clínicos para diseñar un controlador en lazo cerrado de la glucosa [11], sin embargo, se establece que todo modelo de diabetes presenta propiedades no lineales y en específico caos [12]. También se han presentado las predicciones de niveles de glucosa por medio de control lineal, donde el objetivo de la investigación fue conocer que factores influencian en la creación y/o inhibición de la insulina para diferenciar entre un nivel de glucosa adecuado y uno no favorable [13]. Adicionalmente una primera comparación entre el oscilador de Van der Pol con la dinámica de la DM1 se estudió con el propósito de evidenciar que el modelo biológico es no lineal y es sensible a las condiciones iniciales [14]. Este antecedente permite discernir que una estrategia para estudiar o analizar la DM1 es implementando técnicas de control no lineal.
El estado del arte reporta aportaciones relacionadas a aplicaciones en sistemas embebidos para monitoreo mediante métodos no invasivos basados en FPGA, dadas las capacidades de reconfiguración y prototipado para beneficio de la salud [15,16]. En este trabajo se desarrolla un sistema reconfigurable capaz de evidenciar la dinámica matemática de la insulina con respecto a la glucosa considerando un sistema biológico no lineal donde a través de un observador basado en la variable células beta se estiman el comportamiento a largo plazo de la relación insulina-glucosa, el sistema es implementado en una tarjeta de desarrollo FPGA como forma de evidenciar que el modelo biológico es escalable para sistemas embebidos.
Las aplicaciones en sistemas embebidos basados en FPGA reportan diseños de controladores mediante lógica difusa para pacientes con DM1 donde continuamente se monitorean los niveles de glucosa en la sangre y se establece un parámetro de control para la dosificación de insulina [17], también se recolectan datos reales para entrenar la red neuronal y detectar una anomalía o cambios bruscos en relación al nivel de glucosa en la sangre [18].
Actualmente, la estrategia clínica para medir el nivel de glucosa en el organismo es la prueba del Péptido C [19]. El péptido C es una cadena de aminoácidos que forma parte de la proinsulina y es producido en el páncreas en la misma cantidad que las células beta. La razón por la que no existe una prueba clínica de células beta es debido a que existen factores (que pudieran ser las células inmunológicas auto-reactivas (insulitis) o las proteínas Fas y su ligando (FasL) que terminan por destruir dichas células induciendo así los síntomas de un cuadro clínico de DM1. Implicando que solo se puede llegar a estimar u aproximar una concentración de células beta indirectamente.
El definir una región o una concentración de células beta es un reto en la actualidad, dado que considerando una tolerancia de las muestras tomadas con base en la experiencia se define un cuadro médico respecto a la diabetes [20]. Existen propuestas no clínicas que buscan contribuir en brindar una solución al problema de concentración poblacional de células beta mediante un algoritmo efectivo en el procesamiento imágenes, identificando y comparando ciertos patrones de células [21]. En dicho trabajo se evidencia una estrategia efectiva para la detección de núcleos celulares basada en la idea de simetría de fase isotrópica.
Las células beta son un factor clave para comprender la evolución de la diabetes [22], por lo que una estrategia aplicada es a nivel in vivo, donde en el trabajo de investigación [23], se evalúa la posibilidad de generar células productoras de insulina a partir de células exocrinas de rata adultas cultivadas en presencia de factores de crecimiento. También se documenta la observabilidad para un sistema de diabetes mínimo del modelo de Bergams, siendo esto un primer acercamiento matemático, sin embargo, el modelo no contempla a la variable de células beta [24].
La aportación de esta investigación es el diseño de un observador no lineal donde midiendo la variable representativa de las células beta, se estime el comportamiento a largo plazo de la glucosa e insulina.
Posteriormente basado en un FPGA, se programa un sistema embebido, que se concibe como una herramienta precisa de bajo consumo de potencia y reconfigurable, la cual servirá para emular la relación glucosa-células beta a largo plazo sin necesidad de recolectar datos diariamente para un paciente y mejorar su calidad de vida.
Este trabajo de investigación se organiza de la siguiente manera, en la sección 2 se presenta el modelo matemático DM1. En la sección 3 se muestra el diseño del observador. En la sección 4 muestra la implementación en hardware de las relaciones, glucosa-células beta e insulina, así como la implementación del observador y la discusión de los resultados obtenidos. Finalmente, se presentan las conclusiones de este trabajo.
2. Modelo matemático de DM1
Un modelo no lineal que describe la relación insulina-glucosa por medio de un sistema de ecuaciones diferenciales ordinarias fue propuesto en [8]. El cual interviene tres variables de estado: insulina, glucosa y células beta. Básicamente. El modelo matemático que describe dichas interacciones se presenta a continuación:
donde la primera variable de variable de estado x1 representa la insulina, x2 representa la glucosa y x3 representa las células beta. En la Tabla 1 se muestran los parámetros involucrados con sus respectivos valores numéricos normalizados. Las ecuaciones (1-3) fueron obtenidas a través de un análisis con sentido biológico tomando como base los datos clínicos in vitro [8].
Tabla 1 Definición de parámetros
| Parámetro | Concepto biológico |
Valor |
|---|---|---|
| 𝑟1 | Tasa de estimulación para el crecimiento de glucosa |
0.2 |
| 𝑟2 | Tasa de decaimiento en insulina en presencia de células-𝛽 |
0.1 |
| 𝑟3 | Tasa de producción para la estimulación de células-𝛽 |
0.1 |
| 𝑟4 | Tasa de decaimiento en insulina en presencia de glucosa |
0.1 |
| 𝑟5 | Concentración de células-𝛽 debido a glucosa basal |
0.1 |
| 𝑟6 | Tasa de crecimiento de células-𝛽 |
0.1 |
| 𝑟7 | Tasa de decaimiento de las células-𝛽 |
0.05 |
|
|
Diferencia entre el nivel de glucosa ideal y su concentración basal |
1.24 |
|
|
Densidad de células-𝛽 | 2.0 |
| 𝑐1 | Tasa de estimulación de insulina en ausencia de glucosa e insulina |
0.1 |
| 𝑐2 | Tasa de estimulación de glucosa |
0.1 |
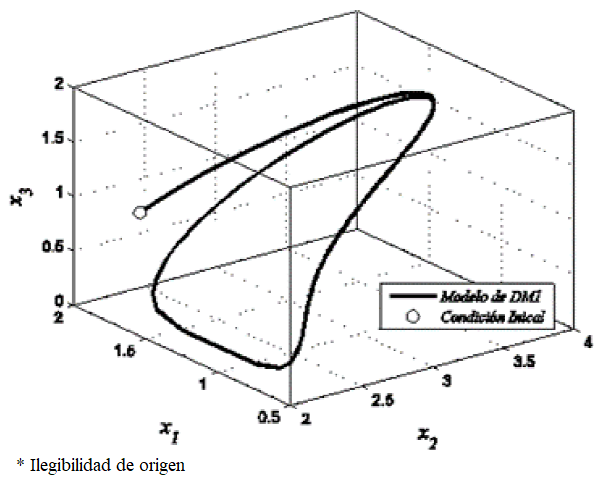
En la Figura 1, se muestra diagrama a bloques en Simulink de las ecuaciones (1-3) utilizando los valores numéricos presentados en Tabla 1, ello da origen a un ciclo límite que se observa en la Figura 2, donde la variable que representa a la insulina se identifica como x1, glucosa como x2, y las células beta se identifican como x3. Como se observa, en la Figura 2, considerando una condición inicial y dado un tiempo suficientemente largo, se aprecia la convergencia de la trayectoria hacia una órbita periódica.

Fig. 1 Orbita Periódica diseño en Simulink de las ecuaciones (1-3), utilizando las condiciones iniciales de x_1 (0)=2.897, x_2 (0)=1.745, x_3 (0)=0.9198, y los valores de la Tabla 1
La relación celular entre insulina, glucosa y células beta se encuentra fundamentada a nivel experimental y se pueden aproximar a un modelo lineal [25]. Sin embargo, recientemente se ha publicado que algunos modelos biológicos pueden presentar propiedades no lineales debido a la complejidad de las interacciones a nivel celular de las variables que intervienen [26,27].
3. Diseño del observador
Un observador es un sistema que permite conocer información de los estados no medibles de un sistema dinámico, a partir de la información obtenida de los estados medible [28].
El diseño de observadores ha permitido resolver el problema de monitoreo y/o estimación de sistemas biológicos [29,30].
A continuación se presenta el diseño de un observador de orden reducido para el sistema (1)-(3), considerando como salida de sistema la variable x3(t). El observador propuesto tiene la siguiente forma:
Si se define el error de estimación como:
entonces, la dinámica del error queda definida como:
donde el origen es un equilibrio del sistema.
Para demostrar convergencia del observador (4-5) hacia las trayectorias d el sistema (1-3), se hará uso del teorema de estabilidad de Lyapunov [31]. Considere la siguiente función candidata de Lyapunov:
La derivada temporal a lo largo de las trayectorias de (8 y 9) está dada por:
Para demostrar estabilidad asintótica se hará uso del teorema de Lasalle [31]. Primeramente, se define un conjunto:
Posteriormente, se procede a determinar el conjunto invariante más grande en
Ω. Es decir, las trayectorias
se satisface, por lo tanto e2 = 0. De esta manera, se tiene que la única trayectoria que iniciando en n permanece dentro de este conjunto es:
el cual es un equilibrio del sistema. Por lo tanto, el origen del sistema (8) y (9) es estable de manera asintótica. Y consecuentemente, se garantiza que las trayectorias del observador convergerán a las trayectorias del sistema (1-3) de manera asintótica.
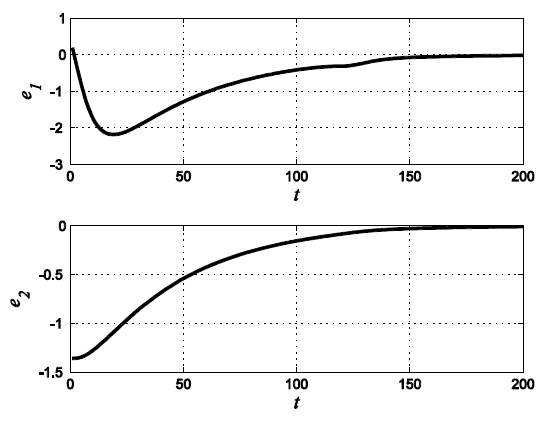
En la Figura 3, se observa la comparación entre el observador con y la dinámica real del modelo en el plano insulina-glucosa, en este caso la variable x2 representa la variable de estimación para la insulina y la variable z2 representa la estimación para la glucosa. Como se aprecia, bajo distinta condición inicial, el observador alcanza la trayectoria real. En la Figura 4, se muestra que para un tiempo aproximado de 150 seg. el observador sigue la trayectoria inicial de la variable de estado correspondiente.
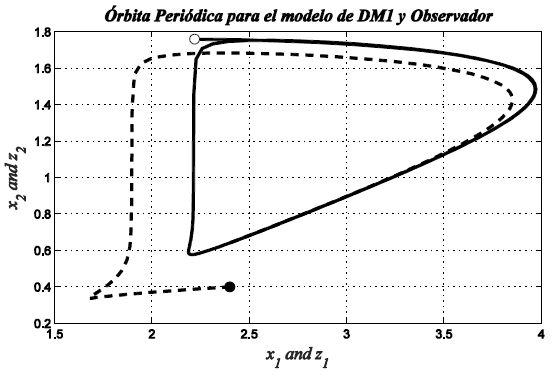
Fig. 3 Órbita periódica para el modelo de DM1 (línea solida) y observador propuesto (línea punteada)
En la Figura 5, se aprecia las gráficas del error, donde el e1 representa la diferencia entre el variable insulina y su estimación, así mismo, e2 representa la diferencia entre el variable glucosa y su estimación.
4. Implementación en hardware
El modelo y la transmisión de la variable observada se realiza en una tarjeta de desarrollo Cyclone V de Altera con una resolución de 14 bits en los convertidores digital a analógico (DAC)s y en los convertidores analógico a digital (ADC)s mediante la tarjeta de adquisición High Speed Mezzanine Card (HSMC). El sistema implementado provee una herramienta precisa y de bajo costo con un control completo de las variables involucradas dada una condición inicial.
En la Figura 6, se observa la estructura desarrollada para la cadena de implementación mediante software, en este caso se utilizó la herramienta DSP Builder, la cual genera los a rchivos VHDL y los comandos de programación que se implementarán para el proceso de análisis, síntesis y ajuste que se emulará en hardware finalmente en el software Quartus II Prime.

Fig. 6 Diagrama general desarrollado para la implementación en hardware mediante la herramienta de desarrollo DSP Builder
Se muestran dos cadenas de implementación basadas en DAC donde se muestra que la relación entre las variables de insulina, células beta y glucosa que representan al sistema (1-3). La condición inicial que se asigna en el algoritmo para cada una de las variables de estado representa en el sentido biológico un determinado momento o concentración celular de dichas variables, implicando que el valor numérico existe para un t = 0.
La Figura 7 muestra la implementación de la relación insulina-glucosa con una resolución de 14 bits, es decir, el nivel de precisión representa que la señal muestreada puede ser dividida hasta en 16384 partes y puede ser muestreada con el reloj interno de la tarjeta de 150 MHz.
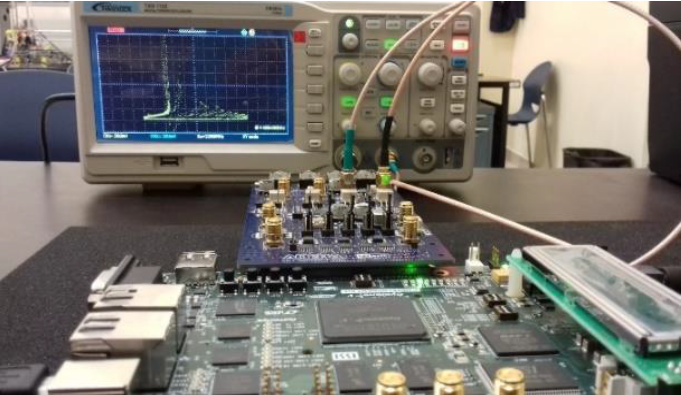
Fig. 7 Vista general de la implementación mediante los 2 DACs en la tarjeta de desarrollo FPGA Cyclone V
La Figura 8 muestra el plano de fase para las variables de insulina y glucosa.
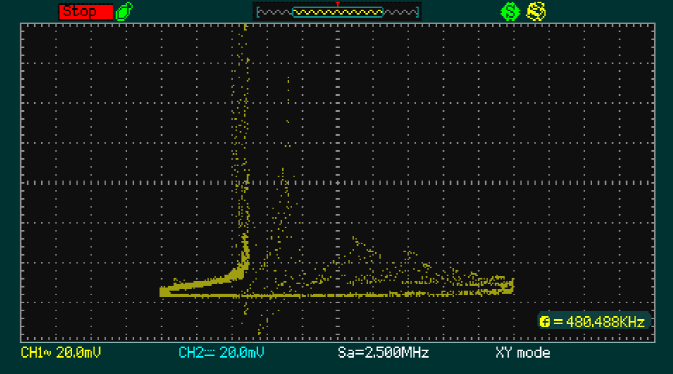
Fig. 8 Plano de fase de la implementación de la relación Insulina-Glucosa en la tarjeta de desarrollo FPGA Cyclone V
La Figura 9 muestra el plano de fase para la relación de glucosa-células beta, mientras que en la Figura 10 se evidencia insulina-células beta. Estas gráficas indican que la dinámica obtenida en Simulink corresponde con las obtenidas en la tarjeta FGPA.
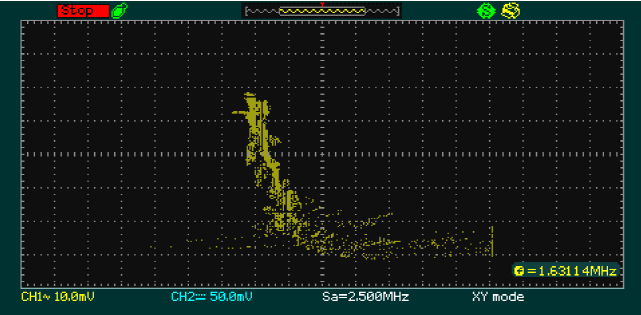
Fig. 9 Plano de fase de la implementación de la relación glucosa-células beta en la tarjeta de desarrollo FPGA Cyclone V
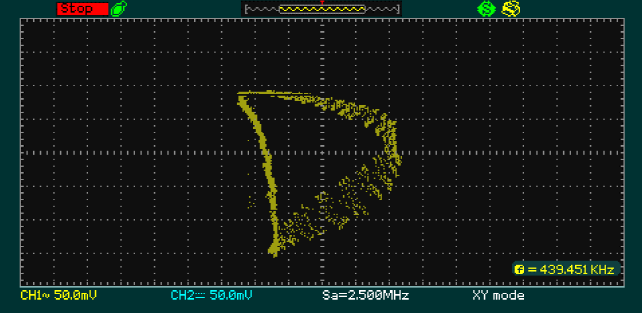
Fig. 10 Plano de fase de la implementación de la relación insulina-células beta en la tarjeta de desarrollo FPGA Cyclone V
Esta implementación se utilizará para emular las dinámicas que presentaría un paciente real. Control expresadas como una señal periódica y visualizar su comportamiento en tiempo.
En la Figura 8 se muestra la implementación de la relación de las variables insulina-glucosa lo que demuestra que se tiene un modelo biológico caótico, es decir que bajo una condición inicial asignada representa una concentración de glucosa en la sangre.
En la Figura 9 se muestra la implementación en hardware de la relación de las variables glucosa-células beta y de la misma forma en la Figura 10 la implementación el plano de fase de la relación de las variables Insulina-células beta.
Para corroborar que la implementación se puede hacer a través de un sistema embebido fue necesario se transmitió la variable x3 mediante un DAC de 14 bits, el propósito es recibir la señal en el ADC de una cadena de implementación y comprobar que el observador es capaz de estimar las variables x1 y x2.
Para este caso la señal es dividida en 16383 partes relacionadas a la capacidad 214 del sistema de transmisión-recepción de la tarjeta HSMC en la tarjeta de desarrollo Cyclone V 5CEFA7F31I7 de ALTERA. En la Figura 11 se muestra el enlace realizado del DAC con el ADC, cabe indicar que el sistema es escalable para diversos sistemas embebidos y de la misma forma se puede manipular entre diferentes tarjetas de desarrollo FPGA con el mismo tipo de entrada SMA.

Fig. 11 Implementación del observador a través de la conexión DAC-ADC en el puerto de salida de la tarjeta de adquisición de datos HSMC
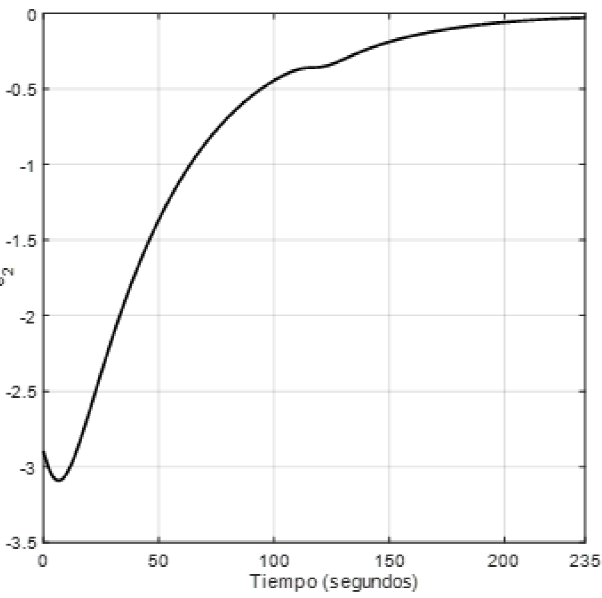
En la Figura 12 se muestra el error obtenido de variable x1 y la estimación z1, el cual converge a cero conforme el tiempo tiende a infinito. En la Figura 13 se muestra el error entre la variable x2 y su estimada z2. Dicho error es aproximadamente cero en un tiempo de 237 segs.
Las diferencias de error entre el sistema previo al proceso de implementación en un dispositivo embebido donde el error obtenido es de -0.000987 en 310 segs. para la interacción entre x1 y z1, y un error absoluto de 0.000996 en un tiempo de 273 segs.
Para la interacción de las variables x2 y z2 es relativamente lógica dada la resolución de la tarjeta de desarrollo, es decir, la capacidad de 214 bits puede muestrear con plena exactitud un valor de hasta 5 decimales, sin embargo en este caso los resultados a trasmitir contienen hasta 15 decimales.
En la Figura 14 se muestra la implementación en hardware de la señal x1 y la señal z1 en este caso la variable estimada sigue la dinámica después de un tiempo de 2.56 μsegs. para obtener un error de -0.0177, el muestreo de la señal se realiza mediante el reloj interno de la tarjeta de desarrollo que es de 150 MHz.

Fig. 14 Implementación en la tarjeta de desarrollo Cyclone V-ALTERA de la variable x1 y su estimación z1
En la Figura 15 se observa la implementación en hardware de la señal x2 y la señal z2, la variable estimada sigue la dinámica en un tiempo de 2.56 jusegs. para obtener un error de -0.0072, en este caso la concentración de células beta indica el nivel de glucosa del sistema biológico propuesto.

Fig. 15 Implementación en la tarjeta de desarrollo Cyclone V-ALTERA de la variable x_2 y su estimación z_2
En la Tabla 2 se muestran los resultados de los recursos utilizados por la tarjeta de desarrollo Cyclone V 5CEFA7F3117 de Altera, en este caso la implementación de la relación de las variables de insulina, glucosa y células beta requieren menos del 1% de los recursos lógicos disponibles al utilizar solamente 346 de las 56,480 unidades lógicas del dispositivo embebido, de la misma forma los enlaces internos al analizar los niveles de transferencia de registro (RTL) utiliza el 8% de los pines disponibles y un bajo consumo del consumo de bloques de memoria.
Tabla 2 Recursos utilizados de la tarjeta de desarrollo FPGA de los tres planos de fase
| Unidades lógicas utilizadas |
346/56480 (<1%) |
| Total de pines utilizados |
40/480(8%) |
| Total de bloques de memoria |
43,008/7024640 (<1%) |
| Total de PLLs | 1/7 (14%) |
En la Tabla 3 se reportan los recursos utilizados para la transmisión de la variable de células beta mediante un DAC y su recepción para el proceso de estimación de las variables insulina y glucosa del sistema biológico propuesto, en este caso el sistema cuenta con recursos disponibles al utilizar solamente 396 unidades lógicas, 68 pines al analizar los bloques RTL y menos del 1% de los bloques de memoria.
Tabla 3 Recursos utilizados de la tarjeta de desarrollo FPGA de las variables células beta para estimar el nivel de insulina y glucosa
| Unidades lógicas utilizadas |
396/56480 (<1%) |
| Total de pines utilizados |
68/480(14%) |
| Total de bloques de memoria |
50,176/7024640 (<1%) |
| Total de PLLs | 1/7 (14%) |
4.1. Discusión de resultados y trabajos futuros
En este trabajo se diseñó un observador no lineal de orden reducido para el modelo no lineal DM1. Se plantea como posible trabajo a futuro diseñar algún controlador en relación a la variable de estado de insulina con el propósito de estimar como serían los niveles de glucosa en un determinado periodo sin necesidad de estar recolectando datos continuamente.
Se implementa un observador de orden reducido considerando la medición de las células beta, dado que es una variable de estado compleja de medir y de estimar en la vida real debido a su funcionalidad biológica.
Se utiliza la herramienta de simulación DSP Builder y Signal Analyzer para la cadena de transmisión mediante la tarjeta de adquisición HSMC del sistema de desarrollo flexible basado en FPGA en las simulaciones dado que se requiere de una programación a bloques para pasar a la plataforma de una tarjeta programable, en este caso es de importancia estimar el comportamiento de la glucosa por medio de una medición de células beta.
La implementación en hardware la tarjeta de desarrollo Cyclone V 5CEFA7F31I7 de Altera mediante la herramienta de diseño DSP Builder y la cantidad de recursos mínimos utilizados, muestra una opción viable para considerar el desarrollo de un prototipo que permita el monitoreo y control de la variable glucosa e indicar la dosis requerida de insulina por un paciente. Esta implementación en hardware es la primera etapa, previa al desarrollo de un prototipo para el control y monitoreo de la glucosa en la sangre.
Los errores obtenidos de -0.0177 de 240 segundos y de -0.0072 en 237 segundos, estos errores se podrán reducir si se emigra el sistema a una etapa de adquisición mayor de 14 bits, esta condición está limitada por la tarjeta en la que se realizó la implementación de hardware.
5. Conclusiones
En este trabajo se propone un observador de un sistema biológico capaz de predecir los niveles de glucosa e insulina presentados por un paciente dado la concentración de células beta. El propósito de lograr la estimación de dichas variables se logró satisfactoriamente. Se propone la implementación de hardware en la tarjeta de desarrollo Cyclone V 5CEFA7F31I7 de Altera como medio para comprobar que el sistema es escalable para otros sistemas embebidos, en este caso la resolución de la tarjeta HSMC de 14 Bits permite obtener un error de -0.0177 en un tiempo de 240 segundos y de - 0. 0072 en 237 segundos para las estimaciones de los niveles de insulina y glucosa. El sistema desarrollado mediante la herramienta DSP Builder como herramienta de diseño permite la generación de los archivos de lenguaje de descripción de hardware de Simulink a un ambiente de implementación en un sistema flexible como el FPGA. El éxito de la implementación en FPGA garantiza que el sistema es escalable para desarrollar un dispositivo embebido capaz de predecir el comportamiento de los niveles de insulina y glucosa a partir de la concentración de células beta.











 text new page (beta)
text new page (beta)