Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencia forestal en México
Print version ISSN 1405-3586
Rev. Cien. For. Mex vol.34 n.106 México Jul./Dec. 2009
Nota técnica
Anatomía de la interacción Cladocolea loniceroides (Van Tieghem) Kuijt – Salix bonplandiana Kunth
Dionicio Alvarado–Rosales1, Luz de Lourdes Saavedra–Romero1 y Elizabeth Cárdenas–Soriano1
1 Instituto de Fitosanidad. Colegio de Postgraduados. Correo–e: saavedraluz@yahoo.com.mx.
Fecha de recepción: 02 de octubre de 2006.
Fecha de aceptación: 04 de septiembre de 2009.
RESUMEN
Pocas son las plantas parásitas que provocan enfermedades de importancia en los bosques; en México son la tercera causa de daño y generan pérdidas por más de 2 millones de metros cúbicos de madera. Cladocolea loniceroides es un muérdago hemiparásito que afecta aproximadamente a 15 especies arbóreas, tan sólo en la Ciudad de México, además de ser uno de los principales agentes de deterioro de la salud de numerosos arbustos. En la zona chinampera de Xochimilco C. loniceroides ha ocasionado cuantiosos daños al ahuejote (Salix bonplandiana), árbol representativo de esta emblemática área lacustre del Distrito Federal. Debido a que el muérdago infecta al tronco y a las ramas, el vigor y la estética del arbolado se han visto seriamente impactados, incluso, cuando su incidencia es muy intensa, los individuos llegan a morir. Como en la actualidad no existen estudios sobre los problemas histopatológicos que origina dicha parásita en el ahuejote o sauce, la presente investigación tuvo como objetivo principal estudiar la anatomía de la interacción C. loniceroides – Salix bonplandiana. Las observaciones realizadas permiten determinar que al sistema endofítico de C. loniceroides es un haustorio simple o primario en forma de cuña. Su penetración no provoca necrosis, pero sí un desplazamiento de las células xilemáticas del hospedante y en consecuencia, una modificación de su fisiología.
Palabras clave: Cladocolea loniceroides, haustorio, hospedante, muérdago verdadero, Salix bonplandiana, sistema endofítico.
ABSTRACT
Few are the parasite plants responsible of important forest deseases; they are the third cause of harm and they produce the loss of more than 2 million square meters of wood. Cladacolea loniceroides is a hemiparasitic mistletoe that affects about 15 species of trees just in Mexico City, and it is one of the major decline agents of the health of many shrubs. At the lake site of Xochimilco, this species has caused many problems to Salix bonplandiana, which is the most representative tree of this emblematic lake zone of Distrito Federal. Since this mistletoe produces an infection on the trunk and branches, the vigour and aesthetics of the trees has been seriously affected, which, when very intense, can induce death. As there are no results about the histhopathological problems that this parasite generates upon the willow, the main purpose of the actual research was to study the anatomy of the C. loniceroides–S. bonplandiana interaction. Observations made it possible to determine that the endophytic system of C. Loniceroides is made up of a simple or primary haustorium with a wedge shape. Its penetration does not generate necrosis, but it does produce xilematic cell displacement of the host, and, consecuently, a modification of its physiology.
Key words: Cladocolea loniceroides, haustorium, host, mistletoe, Salix bonplandiana, system endophytic.
Algunos vegetales superiores que producen semilla son parásitos y causan enfermedades (Calder y Bernhardt, 1983). Se calcula que de aproximadamente 2,500 especies de este tipo, pocas son las que provocan problemas de salud de importancia en los bosques (Salinas–Quinard, 1982; Agrios, 1988; Hawksworth y Wiens, 1996; Tainter y Baker, 1996). En México, de acuerdo al censo de la SARH de 1991 y 1992, son la tercera causa de daño a las masas forestales. En conjunto, generan pérdidas por más de 2 millones de metros cúbicos de madera, sin considerar la muerte del arbolado y la predisposición a otros agentes patógenos, como insectos y hongos (Vázquez y Cibrián, 1996).
Las plantas parásitas poseen estructuras especializadas, semejantes a raíces denominadas haustorios, los cuales penetran los tejidos del hospedante y extraen agua y nutrimentos (holoparásitas). Lo anterior origina desórdenes fisiológicos graduales, dependiendo de la severidad de la infección (Cházaro et al., 2005). Otra clase de plantas parásitas, comúnmente conocidas como muérdagos, injertos (Kuijt, 1975), secapalos (Santiago–Felipe, 2003) o matapalos (Geils et al., 2002) tienen hojas verdaderas y, por lo tanto, producen sus propios carbohidratos a través de la fotosíntesis (hemiparásitas); a pesar de ello, su grado de dependencia del hospedante es alto al extraer agua y sales minerales (Lamont, 1983; Calder y Bernhardt, 1983).
Dentro de los muérdagos hemiparásitos Cladocolea loniceroides (Van Tieghem) Kuijt, incide sobre árboles y arbustos. Se sabe que afecta aproximadamente 15 especies arbóreas, tan solo en la Ciudad de México (Alvarado–Rosales y Saavedra–Romero, 2005; De la Paz et al., 2006). Su presencia ha sido correlacionada con las condiciones de sitios pobres, específicamente con la alta compactación y baja fertilidad del suelo, factores que favorecen su frecuente aparición (Cid–Villamil y Bye, 1998). De acuerdo a Cházaro et al. (2005), el género Cladocolea es de alta especificidad por sus hospederos: C. grahami Kuijt y C. microphylla (H.B.K.) Kuijt parasitan sólo a encinos (Quercus spp.), mientras que C. cupulata se desarrolla mejor en pináceas (Pinus jaliscana Pérez de la Rosa y P. lumholtzii Robins & Ferns.) (Geils y Vázquez, 2002), lo que no sucede con C. loniceroides.
C. loniceroides se identificó por primera vez en el Valle de México sobre truenos (Ligustrum spp.) traídos del estado de Morelos (Cházaro et al., 2005). En la actualidad, es uno de los principales agentes de deterioro del ahuejote (Salix bonplandiana Kunth) en la zona chinampera de Xochimilco, al sur del Distrito Federal, donde este árbol desempeña un papel fundamental por los beneficios ecológicos y estéticos que proporciona, entre ellos: protección de cultivos, retención de suelo y la belleza que otorga a los canales que año con año atraen la atención de miles de turistas. También se ha observado infectando otras especies arbóreas, tales como: Acer negundo L., Alnus jorullensis HBK. Fraxinus uhdei (Wenzig) Lingelsh, Populus alba L., P. deltoides W. Bartram ex Marshall, P. tremuloides Michx., Prunus domestica L., P. serotina Ehrth., Salix babylonica L., S. humboldtiana Willd., Schinus molle L. y S. terebenthifolius Raddi, por mencionar algunas (Alvarado–Rosales y Saavedra–Romero, 2005; Cid–Villamil, 2006; De la Paz et al., 2006).
En México se carece de estudios que evalúen el impacto de C. loniceroides sobre sus hospedantes, pero en general, al igual que otros muérdagos verdaderos, los daños más evidentes que ocasiona en el ahuejote son: engrosamiento de ramas, cambios en la arquitectura de la copa y en ocasiones la muerte, resultado de los altos niveles de infección. En áreas como la chinampera de Xochimilco, se tienen registros de infestaciones que van de ligeras a severas en 46% de los 11,527 árboles de ahuejote evaluados, con 80% de incidencia (Alvarado et al., 2003a; Alvarado et al., 2003b; Alvarado et al., 2005).
Los estudios existentes sobre el género Cladocolea en el territorio nacional se han enfocado, principalmente, a su taxonomía (Kuijt, 1975; Calderón, 2001; Calderón y Rzedowski, 2001); a las condiciones ambientales que favorecen su presencia (Cid–Villamil y Bye, 1998); la histología de la germinación (Cid–Villamil y Ponce, 2001); embriogénesis y desarrollo del fruto (Cid–Villamil et al., 2001). Aunque son pocos los relacionados con el proceso de infección y de las alteraciones anatómicas que ocasiona a sus hospederos (Cid–Villamil et al., 2007; Alvarado et al., 2007).
La ausencia de información sobre la relación C. loniceroides – S. bonplandiana y la necesidad de realizar un manejo fitosanitario mediante podas, después de conocer el desarrollo de C. loniceroides dentro de los tejidos de S. bonplandiana, motivaron la realización de la presente investigación. Por lo tanto, el objetivo consistió en estudiar la anatomía de la interacción C. loniceroides – S. bonplandiana.
El trabajo se llevó a cabo dentro del área conocida como zona chinampera de Xochimilco, ubicada al sur de la Cuenca de México, aproximadamente a 23 km del centro de la Ciudad de México, entre las coordenadas 19o15'11'' y 19o19'15" latitud norte y 99o00'58" y 99o07'08" longitud oeste, a una altitud de 2,240 m (CONANP, 2004).
La zona de Xochimilco tiene cuatro microclimas. Tres de ellos se clasifican como templados suhúmedos, característicos del Valle de México, los cuales cubren alrededor del 98% de la superficie del norte y hasta 2,800 msnm, cerca de San Francisco Tlalnepantla. De este sitio hacia las partes más altas, el clima llega a ser frío y húmedo. Los suelos predominantes son el feozem, caracterizados por poseer abundante materia orgánica y el histosol de elevada fertilidad y comúnmente saturado de agua. Ambos cubren casi la mitad del territorio (SMA, 2008).
Se recolectaron 30 ramas de ahuejote de 0.4 a 3.0 cm de diámetro y 20 cm de longitud. Diez sanas y 20 enfermas que presentaban la infección inicial en el centro. A partir de éstas, se obtuvieron 20 piezas de tejido de 1 cm2 de grosor en sentido transversal y 20 en forma longitudinal, que se colocaron en líquido fijador CRAF III durante 24 h. Una vez fijadas, las muestras se lavaron con agua corriente durante 30 min; enseguida se deshidrataron con alcohol etílico (50, 60, 70 y 100%), una mezcla de alcohol al 100% (1:1), para remover el agua de los tejidos.
Se utilizó un cambiador automático de tejidos (Sakura Fingtechnical, Tissue Tek II, mod. 4640B) programado en períodos de 6 a 8 h por reactivo y por último, se realizó la inclusión en paraplast (Sigma). Así, se obtuvo un bloque de parafina sólido con el material a seccionar orientado en sentido transversal o longitudinal; se dejaron solidificar a temperatura ambiente y se montaron en soportes de madera.
Los cortes se practicaron con un microtomo rotatorio (American Optical, Modelo 820) con un grosor de 10 μm; se pusieron, inmediatamente, en un baño de flotación (agua y grenetina) a una temperatura de 65 ± 1°C y se colocaron sobre portaobjetos (Valdovinos, 1999; Zamora et al., 2001). El material se desparafinó y tiñó con la técnica diferencial safranina–verde rápido y se montaron en resina sintética (Johansen, 1940). Las observaciones y la toma de fotografías se hicieron en un microscopio Carl Zeiss.
Los muérdagos están constituídos por una parte aérea y otra incluída en el hospedero por medio de la cual existe un flujo nutrimental (Kuijt, 1969). Al inicio de la germinación se observó la formación de una base redondeada (enforma de disco) (Knutson, 1983; Bello–González, 1984), que se adhiere fuertemente a la peridermis del hospedero (Figura 1). De acuerdo a los estudios de Cid–Villamil (2006), los tejidos que conforman este disco son la viscina, el endospermo y el embrión. En el presente trabajo, la viscina se advirtió como una secreción transparente y viscosa en la periferia del disco, que contribuye a la adhesión del muérdago con el hospedero. A continuación, las células del embrión se alargan y mediante una fuerza mecánica; además de la secreción de compuestos químicos, se estimula el reconocimiento parásito–hospedante (Kuijt, 1969). En la interacción bajo estudio se detectó que las células de la peridermis del hospedero sufren una necrosis y el tejido se fractura para facilitar la entrada.
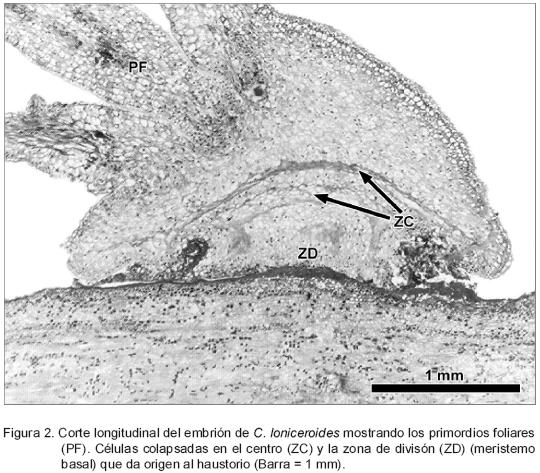
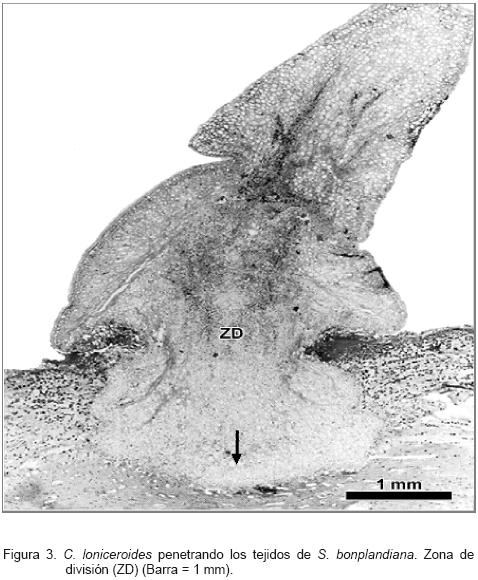
En el extremo opuesto del embrión inician los primordios foliares (Figura 2). El haustorio se forma a partir de una zona de división (meristemo basal), localizada debajo de una porción de células colapsadas que se produce, posiblemente, por el crecimiento y la presión que ejerce el haustorio para penetrar; esta última estructura continúa su desarrollo (Figura 3). En en el interior de los tejidos del hospedante se identificaron células parenquimatosas redondas orientadas en dirección paralela a la peridermis, con su núcleo bastante evidente y abundantes granos de almidón (Figura 4). Las células más próximas a la zona de inserción presentaron mayor cantidad de dicho carbohidrato.

Se determinó que el haustorio de C. loniceroides se ramifica de manera diferente a como ocurre con los muérdagos enanos (Arceuthobium sp.) o el de Struthanthus quercicola (Schltdl. & Cham.) Blume, otro muédago verdadero de la familia Loranthaceae (Santiago–Felipe, 2003); ya que adquiere una forma de cuña. Conforme este penetra, se abre paso a través de la corteza y el floema, desplazándolos mecánicamente de su sitio original (Figura 5). En ramas con diámetro de 3 cm, el haustorio puede llegar hasta la médula del hospedante. No se observó tejido especializado para el transporte de agua y sales minerales dentro de la planta parásita y el ahuejote, como sucede en el muérdago enano.
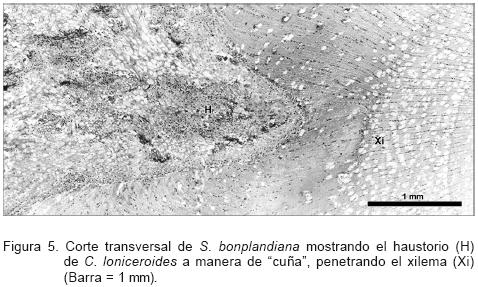
No se detectaron tejidos necrosados en la zona de contacto y hacia la parte más externa (próxima a la peridermis del hospedante); el haustorio presenta haces de esclereidas que utiliza como células de soporte y numerosos vasos. Sin embargo, no se observó una extensión de dichos vasos hacia el xilema del hospedante. Conforme la planta continúa su invasión, el xilema del hospedante cambia de posición; en consecuencia, su fisiología podría verse afectada (Figura 5).
De acuerdo a Kuijt (1975), sólo en cinco especies de aproximadamente 19, se ha podido reconocer la base de la planta del muérdago, entre ellas, Cladocolea gracilis Kuijt, C. inconspicua (Benth.) Kuijt, C. inorna (Robbins. & Greenm.) Kuijt, C. loniceroides y C. oligantha (Standl. & Steyernm.) Kuijt; además, con excepción de la primera, las restantes carecen de brotes epicorticales y su haustorio primario es muy simple, se le conoce como injerto (Kuijt, 1975).
De todo lo anterior se concluye que Cladocolea loniceroides tiene un sistema endofítico, forma un solo haustorio o haustorio primario en forma de cuña; que los tejidos del hospedante son desplazados mecánicamente de su sitio original, finalmente, la penetración del haustorio no causa hiperplasia, hipertrofia, ni muerte celular.
REFERENCIAS
Agrios G. N. 1988. Plant pathology. Academic Press. San Diego, CA. USA. 803 p. [ Links ]
Alvarado R., D., A. Equihua M., E. Estrada V., V. Franco M., U. González M. and L. de L. Saavedra R. 2003a. The Cladocolea genus in the Mexican City Basin and its management. In: 1st Joint Meeting of the 12th National Symposium on Forest Parasites and the 54th Western Forest Insect Work Conference (WFIWC). November 3–6. Guadalajara, Jal. (Abstract). pp. 10. [ Links ]
Alvarado R. D., A. Equihua M., E. Estrada V., V. Franco M., U. González M. and L. de L. Saavedra R. 2003b. Impact and true mistletoe management in the ahuejotes of the chinampas zone of Xochimilco, D. F. In: Pan American Plant Disease Conference. April 5–10. South Padre Island, Texas, USA. (Abstract). pp. 146. [ Links ]
Alvarado–Rosales D. y L. de L. Saavedra–Romero. 2005. El género Cladocolea (Loranthaceae) en México: muérdago verdadero o injerto. Revista Chapingo 11(1): 5–9. [ Links ]
Alvarado R., D., L. de L. Saavedra R. y T. D. Cibrián. 2007. Muérdago Cladocolea/ Cladocolea mistletoes. Género/Genus Cladocolea Van Thiegem (Loranthaceae). In: Cibrián T., D., D. Alvarado R. y D. S. García (Eds.): Enfermedades forestales en México. Universidad Autónoma Chapingo; CONAFOR–SEMARNAT, México. Forest Service USDA, USA; NRCAN Forest Service, Canadá y Comisión Forestal de América del Norte, COFAN, FAO. Universidad Autónoma Chapingo. Chapingo, Edo. de Méx. México. pp. 430–433. [ Links ]
Bello–González M. A. 1984. Estudio de muérdagos (Loranthaceae) en la región Tarasca, Michoacán. Boletín Técnico 102. INIF. México, D. F. México. 62 p. [ Links ]
Calder M. and P. Bernhardt (Eds.). 1983. The biology of mistletoes. Academic Press. Sidney, Australia. 348 p. [ Links ]
Calderón R., G. 2001. Loranthaceae. In: Flora fanerogámica del Valle de México. J. Rzedowski y G. Calderón (Eds.). CECSA. México. pp. 98–102. [ Links ]
Calderón R., G. y J. Rzedowski. 2001. Flora fanerogámica del Valle de México. Instituto de Ecología CONABIO. México, D. F., México. 1406 p. [ Links ]
Comisión Nacional de Áreas Naturales Protegidas (CONANP). 2004. Zona chinampera. http://ramsar.conanp.gob.mx/documentos/fichas/50.pdf. (18 de agosto de 2009). [ Links ]
Cházaro B., M. J., H. Oliva R., F. Ramón F. y J. A. Vázquez G. 2005. Cladocolea oligantha (Loranthaceae) un nuevo registro para Veracruz, México y datos generales sobre este taxón. Polibotánica 20: 1–15. [ Links ]
Cid–Villamil R. M. 2006. Biología del desarrollo de Cladocolea loniceroides (Van Tieghem) (Kuijt), Loranthaceae. Tesis de Doctorado. Facultad de Ciencias. Universidad Nacional Autónoma de México. México, D. F. México. 175 p. [ Links ]
Cid–Villamil R. M. and R. A. Bye 1998. Site conditions of an urban wooded area of Mexico City that hosts Cladocolea loniceroides Van Tieghem (Loranthaceae). Selbyana 19(2): A 272. [ Links ]
Cid–Villamil R. M., G. Murguía S. y M. Ponce S. 2001. Estructura e histoquímica del desarrollo del fruto de Cladocolea loniceroides Van Tieghem. In: Memorias de Resúmenes del XV Congreso de Botánica. Octubre 14–19. Querétero, Qro. México. 816 p. [ Links ]
Cid–Villamil R. M. y M. Ponce S. 2001. Germinación de Cladocolea loniceroides (Van Tieghem) Loranthaceae. In: Memorias del XXV Congreso Nacional de Histología. Octubre 24–26. Taxco, Gro. México. pp. 23–24. [ Links ]
De la Paz P. O., C., J. Ceja R. y G. Vela R. 2006. Árboles y muérdagos: una relación que mata. Contactos Revista de Educación en Ciencias e Ingeniería 59: 28–34. [ Links ]
Geils, B. W., J. Cibrián T. and B. Moody (Tech. Coords). 2002. Mistletoes of North American Conifers. Department of Agriculture, Forest Service, Rocky Mountain Research Station. Golden, CO, USA. 123 p. [ Links ]
Geils, B. W. and I. Vázquez C. 2002. Loranthaceae and Viscaceae in North America. In: Geils, B. W., J. Cibrián T. and B. Moody (Tech. Coords.). Mistletoes of North American Conifers. Department of Agriculture, Forest Service, Rocky Mountain Research Station. Golden, CO. USA. pp. 1–8. [ Links ]
Hawksworth, F. G. and D. Wiens. 1996. Dwarf mistletoes: biology, pathology and sistematics. US. Department of Agriculture, Forest Service, Washington, DC. USA. 410 p. [ Links ]
Johansen, D. A. 1940. Plant microtechnique. McGraw Hill Co. New York, NY. USA. 503 p. [ Links ]
Knutson, D. M. 1983. Physiology of parasitism and disease response in host. In: Calder, M. and P. Bernhardt (Eds.). The biology of mistletoes. Academic Press. Sidney, Australia. pp. 295–316. [ Links ]
Kuijt, J. 1969. The biology of parasitic flowering plants. University of California Press. Los Angeles, CA. USA. 246 p. [ Links ]
Kuijt, J. 1975. The genus Cladocolea (Loranthaceae). Journal of the Arnold Arboretum 56(3): 265–335. [ Links ]
Lamont, B. 1983. Mineral nutrition of mistletoes. In: The biology of mistletoes. Calder, M. and P. Berhardt (Eds.). Academic Press. Sidney, Australia. pp. 185–204. [ Links ]
Salinas–Quinard, R. 1982. Enfermedades forestales en México. Revista Ciencia Forestal 7(35): 21–30. [ Links ]
Santiago–Felipe, M. 2003. Efecto del "secapalo" (Struthanthus quercicola (Schlechten. & Cham.) Blume) sobre naranjo valencia (Citrus sinensis (L.) Osbeck) en Alamo, Veracruz. Tesis de Licenciatura. Departamento de Fitotecnia. Universidad Autónoma Chapingo. Chapingo, Edo. de Méx. México. 67 p. [ Links ]
Secretaría de Agricultura y Recursos Hidráulicos (SARH). 1991–1992. Inventario nacional forestal de gran visión. Reporte principal. Subsecretaría Forestal. México, D. F. México. 53 p. [ Links ]
Secretaría del Medio Ambiente (SMA). 2008. Tipo de suelo. CORENADER. Gobierno del Distrito Federal. http://www.sma.df.gob.mx/corenader/sc.htm (noviembre, 2008). 2 p. [ Links ]
Tainter, F. H. and F. A. Baker. 1996. Principles of forest pathology. John Wiley and Sons, Inc. New York, NY. USA. 832 p. [ Links ]
Valdovinos P., G. 1999. Histopatología e histoquímica foliar de los cultivares de banano FHIA 01 y enano gigante y su relación con la resistencia a la Sigatoka negra (Mycosphaerella fijiensis Morelet). Tesis de Maestría. Colegio de Postgraduados. Montecillo, Edo. de Méx. México. 74 p. [ Links ]
Vázquez C., I. y J. Cibrián T. 1996. Guía para evaluar rodales infestados por muérdago enano Arceuthobium spp. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. México, D. F. México. Agenda Técnica 1: 1–12. [ Links ]
Zamora M., T., E. Cárdenas S., J. F. Cajuste B. y M. T. Colinas L. 2001. Anatomía del daño por rozamiento y por Colletotrichum gloesporioides Penz. en fruto de aguacate "Hass". Agrociencia 35(2):237–244. [ Links ]














