Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletín de la Sociedad Geológica Mexicana
versão impressa ISSN 1405-3322
Bol. Soc. Geol. Mex vol.63 no.3 Ciudad de México Dez. 2011
Artículos
Análisis geoquímico (elementos mayores, menores, traza, δ13C, δ18O y tierras raras) de microbialitas selectas provenientes de la Formación San Casiano (Triásico Medio – Superior, NE de Italia)
Geochemical analyses (major, minor and trace elements, δ18O, and rare earths) of selected microbialites from the San Casiano Formation (Upper Triassic, NE Italy)
Francisco Sánchez–Beristain1,*; Laura López–Esquivel Kranksith2
1 Museo de Paleontología, Facultad de Ciencias, UNAM, Av. Universidad 3000, Circuito Exterior s/n, Ciudad Universitaria, 04510 Coyoacán, México, D.F., México.*sanchez@ciencias.unam.mx.
2 Instituto de Ciencias Nucleares, UNAM, Av. Universidad 3000, Circuito Exterior s/n, Ciudad Universitaria, 04510 Coyoacán, México, D.F., México.
Manuscrito recibido: Febrero 24, 2011.
Manuscrito corregido recibido: Agosto 30, 2011.
Manuscrito aceptado: Septiembre 1, 2011.
Resumen
Se presentan los resultados del análisis geoquímico de 28 elementos (mayores, menores, traza y tierras raras), así como de isótopos de carbono y oxígeno aplicado a 17 muestras microbialíticas provenientes de la Formación San Casiano (NE de Italia). Dicho análisis ha permitido caracterizar la composición de las microbialitas como calcitas magnesianas (> 4.00 % mol Mg), determinar su buen estado de preservación y detectar la presencia de sedimentación siliciclástica fina durante su crecimiento. Asimismo, ha permitido inferir las condiciones rédox del paleoambiente y comparar sus señales geoquímicas con los componentes esqueléticos, alomicritas y cementos en busca de relictos metabólicos y/o de actividad biológica a partir de ciertos elementos traza.
Para efectuar este análisis se utilizaron dos métodos: la Espectrometría de Plasma–Masa Inductivamente Acoplada por Ablación Láser (LA–ICP–MS), y espectrometría de masas para la medición de isótopos estables de carbono y oxígeno. Las muestras presentan un contenido medianamente alto de silicio y aluminio. Dichos elementos reflejan la sedimentación de arcillas durante el crecimiento de las microbialitas. No existe una correlación entre los valores de Mn/Sr y δ18O o entre δ13C y δ18O, indicando así una ausencia de efectos de diagénesis meteórica. Las concentraciones de hierro y manganeso exhiben correlaciones medias con el azufre, lo que permite ligar el origen de estos elementos con fenómenos diagenéticos tempranos, mismos que se pueden constatar por medio del alto contenido de estroncio y de los valores de δ18O. Las microbialitas están enriquecidas con una amplia gama de elementos menores y traza. Se corrobora la ausencia de implicación biológica conocida para algunos elementos (Rb, Ti, Zr, Nb y Th), que se encuentran asociados con algunos elementos mayores, reiterando su origen terrigénico (r2 con Si >0.5). Otros (Zn, Sb, Cr, V, Sn, Ni, Co) no presentan asociación alguna con silicio o aluminio, pero tampoco pueden ser considerados como relictos metabolismo microbiano debido a su enriquecimiento en fases abióticas. En cambio, algunos de estos elementos (Cr, V, Ni, Co) son útiles para determinar las condiciones rédox del paleoambiente de la Formación San Casiano como ligeramente disóxico. Solamente el cobre y el molibdeno están relacionados a un origen microbiano. El molibdeno sirve adicionalmente para reiterar las condiciones rédox inferidas. Los resultados del análisis de Tierras Raras no son conclusivos, toda vez que las concentraciones de fósforo, silicio y aluminio alteran significativamente la precipitación de las mismas. Debido a la excelente preservación del material estudiado, es posible interpretar las señales geoquímicas obtenidas como primarias.
Palabras clave: Microbialitas, Carniano, Triásico, Formación San Casiano, análisis de elementos, LA–ICP–MS.
Abstract
The results of the geochemical analysis of 28 major, trace and rare earth elements, as well as carbon and oxygen isotopes, are presented for 17 microbialite samples from the St. Cassian Formation (NE Italy). These results have allowed the characterisation of the mineralogical composition of the microbialites as high–Mg calcite (>4.00 % mol Mg), the determination of their good state of preservation, and the detection of the influence of fine siliciclastic sedimentation during their growth. Furthermore, redox conditions of the palaeoenvironment were determined with the aid of these analyses. Finally, it was possible to compare the geochemical signals of the microbialites with that of skeletal components, allomicrites and cements in order to find possible metabolical relicts and/or evidence of biological activity using trace elements. Two methods were used to perform these analyses: Laser Ablation Inductively Coupled Plasma–Mass Spectrometry (LA–ICP–MS), and mass spectrometry to obtain carbon and oxygen isotope values. Microbialitic samples show medium to high contents of silicon and aluminium. These elements reflect the sedimentation of clays during the growth of microbialites. There is no correlation between the values of Mn/Sr and δ18O or between δ13C and δ18O, indicating the absence of meteoric diagenesis. Iron and manganese concentrations show a medium correlation with sulfur, which links the origin of these elements to early diagenetic processes. These processes can be confirmed by the high strontium content and the δ18O values. The microbialites are enriched with a vast array of minor and trace elements. Some elements of unknown biological importance (Rb, Ti, Zr, Nb and Th) are associated with certain major elements (r2 with Si > 0. 5), confirming their terrigenous origin. Other elements (Zn, Sb, Cr, V, Sn, Ni and Co) show no association with silicon or aluminium, yet they cannot be considered as metabolic residues due to their enrichment in non–biological phases. Instead, some of these elements (Cr, V, Ni and Co) were useful in determining the redox conditions of the palaeoenvironment of the St. Cassian Formation as slightly disoxic. Only copper and molybdenum are associated with a microbial origin, and the latter is also useful in determining redox conditions. Rare Earth Element analyses are not conclusive, since phosphorus, silicon and aluminium can significantly alter their precipitation processes. Due to the exceptional preservation of the studied material, it is possible to interpret all geochemical signals of the studied material as primary.
Keywords: Microbialites, Carnian, Triassic, St. Cassian Formation, element analysis, LA–ICP–MS.
1. Introducción
La Formación San Casiano (San Cassiano en italiano o St. Kassian en alemán; von Hauer, 1858) del Ladiniano tardío – Carniano medio (NE de Italia) es muy conocida por su fauna diversa y excepcionalmente preservada, especialmente en las localidades de Alpe di Specie o Seelandalpe y Misurina (Figura 1; Fürsich y Wendt, 1977). Toma su nombre del pueblo de San Cassiano, en el Tirol del Sur (Bosellini, 1991). Comprende depósitos de cuenca (margas intercaladas con flujos ocasionales de turbiditas fundamentalmente de origen volcánico) situados entre arrecifes y áreas post–arrecifales locales, todos ellos depositados a su vez de manera concordante sobre la Formación Wengen del Ladiniano, rica en lutitas y en material vulcanoclástico (Fürsich y Wendt, 1977). La Formación San Casiano consiste en dos miembros, un Miembro Inferior (depositado durante el final del Ladiniano y hasta el final del Cordevoliano a principios del Carniano) y un Miembro Superior, depositado durante el Juliano, a mediados del Carniano (Figura 2; Bosellini, 1991; Russo et al., 1997; Sánchez–Beristain et al., 2011). Los dos miembros poseen una litología muy similar, ambos presentando estratos constituidos por una alternancia de calizas y margas, que son ricos en fósiles (Fürsich y Wendt, 1977; Wendt y Fürsich, 1980; Russo et al., 1997). La preservación de estos fósiles es extraordinaria, pues una gran parte de los fósiles descritos conservan su mineralogía original (Reitner, 1987). Ciertas localidades donde esta formación aflora son consideradas como Lagerstätte fósiles (Fürsich, 2000).
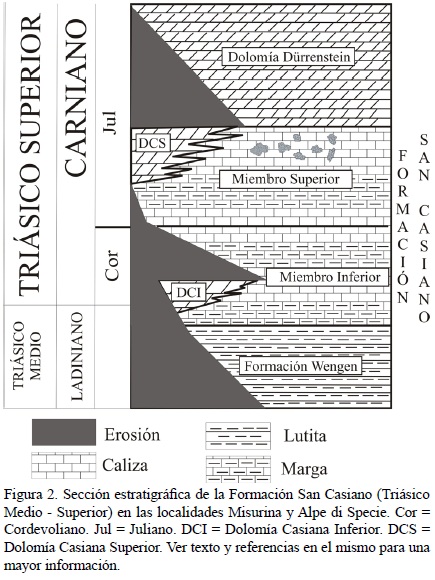
El estudio de la estratigrafía no es un objeto de este trabajo, razón por la cual se recomienda a los lectores consultar las abundantes referencias a este respecto (e.g. Fürsich y Wendt, 1977; Bizzarini y Braga, 1978; Wendt y Fürsich, 1980; Müller Wille y Reitner, 1993). Sin embargo, consideramos necesario continuar puntualizando algunos aspectos estratigráficos importantes. Los depósitos de la Formación San Casiano se extienden desde las Dolomitas Occidentales hasta los Álpes Cárnicos y hacia el Sur, hasta Valsugana (Bosellini, 1991). La Formación San Casiano constituye el equivalente de cuenca de las plataformas de la llamada "Dolomía Casiana", dividida informalmente en Dolomía Casiana inferior y Dolomía Casiana superior (Bosellini, 1991), con las cuales se encuentra frecuentemente interdigitada (Wendt y Fürsich, 1980). El espesor máximo de la Formación San Casiano oscila entre los 400 y 500 m (Bizzarini y Braga, 1978). Se encuentra cubierta por la Dolomía Dürrenstein, depositada durante el Juliano (etapa media del Carniano; Fürsich y Wendt, 1977; Wendt y Fürsich, 1980; Figura 2).
El grado de preservación es máximo en las llamadas "calizas de Cipit" (topónimo modificado del arroyo Tschapit; von Richthofen, 1860) que son olistolitos en su mayoría derivados de las plataformas casianas (Russo et al., 1997). Estas plataformas fueron sujetas a procesos de emersión y karstificación (Biddle, 1981). Dichos procesos propiciaron el deslizamiento de las calizas de Cipit desde los márgenes de la plataforma hacia la cuenca casiana. (Biddle, 1981; Russo et al., 1997). Estos olistolitos proceden en su totalidad del Miembro Superior de la Formación San Casiano. Las facies dominantes en ellos son microbialitas (hasta en un 75 %), alomicritas (hasta en un 50 %), componentes esqueléticos (hasta en un 50 %) y cementos (hasta en un 10 %). Generalmente, las microbialitas y los componentes esqueléticos son mutuamente excluyentes, es decir, no codominan (Russo et al., 1997; Sánchez–Beristain, 2010).
Las calizas de Cipit han sido objeto de estudio desde diversas perspectivas. Entre ellas resaltan los enfoques taxonómicos (Reitner, 1987; Reitner y Engeser, 1989), diagenéticos (Scherer, 1977), y más recientemente, geoquímicos y biogeoquímicos (Nützel et al., 2009; Sánchez–Beristain et al., 2011).
El objetivo del presente estudio es profundizar en la caracterización geoquímica de las microbialitas provenientes de calizas de Cipit selectas de la Formación San Casiano, dando énfasis en la importancia biológica de los elementos analizados.
2. Área de estudio
El área de trabajo de donde procede el material estudiado consiste en dos localidades en las Dolomitas, provincia autónoma de Bolzano–Alto Adigio (Tirol del Sur, NE de Italia). La localidad de donde procede la mayoría de las muestras es Misurina (46° 35' 0" N; 12° 15' 89" E). La otra localidad donde el material fue colectado es el Alpe di Specie o Seelandalpe (46° 38' 29" N 12° 11' 44" E), una de las más conocidas dentro de las localidades arrecifales triásicas (Russo et al., 1991; Figura 1). En ambas localidades aflora el Miembro Superior de la Formación San Casiano, que es de donde proceden las calizas de Cipit (Figura 2).
3. Materiales y métodos
3.1. Materiales
Cuarenta calizas de Cipit fueron colectadas. Se obtuvieron láminas delgadas de cada caliza en formato 10 x 15 cm y 7.5 x 10 cm, a modo de determinar su preservación petrográficamente por medio de análisis de microfacies y catololuminiscencia fría. Como mínimo se obtuvo una lámina delgada por caliza y como máximo 14. De 150 láminas se seleccionaron las siete que mostraron la mejor preservación denotada por una luminiscencia nula y microestructuras aragoníticas inalteradas (Cas12, FSSA001, FSSA58, MI6, MV3, MXXI, MXXXII).
Las contrapartes pulidas de estas siete láminas delgadas fueron finalmente seleccionadas para análisis geoquímicos, y contienen en su totalidad 17 muestras de microbialitas (Cas12–M1, Cas12–M2, Cas12–M3, Cas12–M4, FSSA001–1, FSSA001–2, FSSA001–3, FSSA001–4, FSSA58–1, FSSA58–2, MI6–M1, MI6–M2, MX–2, MXXI–M1, MV3–M1, MV3–M2, MXXXII–M1); cuatro alomicritas (Cas12–A1, Cas12–A2, FSSA58–A1, MXXXII–A1); dos braquiópodos tecideidos (MXXXII–B1, MXXXII–B2); una esponja aragonítica (Cas12–S1); una esponja calcítica (Celyphia, MXXXII–S1); dos corales (Margarosmilia, FSSA58–K1 y un taxón no identificado, MXXXII–2) y tres cementos secundarios (Flügel, 2004; Cas12–Z1, MXXI–Z1, MXXXII–Z1). Las muestras fueron denominadas de acuerdo a la lámina delgada a la cual corresponden y el tipo de facies a analizar (Tabla 1).
3.2. Métodos
3.2.1. LA–ICP–MS
La Espectroscopía de Plasma–Masa Inductivamente Acoplada (ICP–MS por sus siglas en inglés) es un método de alta resolución que permite la detección de concentraciones de elementos en el orden de partes por millón (Schäfer, 2006; Kamber y Webb, 2007). El acoplamiento de este equipo con un sistema de ablación por láser permite analizar todo tipo de muestras sin una dilución previa. Es de especial importancia notar que este método tiene una alta resolución espacial, siendo posible realizar ablaciones muy localizadas, que a su vez proporcionan sublimados consistentes en fases únicas. Por lo tanto, este método es adecuado para el análisis de muestras de rocas consistentes en numerosas fases de tamaño diminuto (Kamber y Webb, 2007).
La ablación por láser fue realizada utilizando un equipo Excimer 193 nm COMPEX 110 equipado con un mejorador de forma de rayo óptico GEOLAS aproximadamente cada 3 J/cm2 con diámetro de láser de 120 µm. La muestra fue transportada al equipo ICP–MS DRC II por medio de gas argón. Las mediciones fueron realizadas con el método de Kamber y Webb (2007) primeramente en tres secciones pulidas con el fin de probar la eficiencia del método en el material seleccionado. Las siguientes variables para las series temporales fueron tomadas en cuenta: 28 isótopos fueron analizados con tiempos de retención de 20 ms. Las series de tiempo de ablación tuvieron una duración de 165 s, que incluyeron 402 puntos de lectura (PL). Las mediciones dieron inicio después de 30 s de precalentamiento y terminaron 10 s antes del fin de la macro, sin embargo sólo se consideraron las mediciones incluidas entre 10 y 130 s (280 PL en total) después del inicio de la ablación. Separadamente, las 13 tierras raras fueron analizadas para un estudio piloto en la muestra FSSA001–M2. Esta muestra presenta las menores concentraciones de silicio y aluminio (Tabla 1, Tabla 2).

La cuantificación de un barrido sencillo, que tiene un tiempo de retención de 20 ms, tiene errores muy altos. Sin embargo, si cinco o más barridos producen los mismos resultados, el error medio desciende dramáticamente. La estandarización y cuantificación fue realizada tomando el estándar NBS610. El isótopo interno utilizado fue 43Ca. Para la normalización con 43Ca se consideraron las diferentes valores obtenidos por medio de análisis con microsonda para la concentración de este elemento en estudios anteriores (Rech, 1998; Sánchez–Beristain, 2010; Sánchez–Beristain et al., 2011): 390000 ppm para fósiles aragoníticos, braquiópodos y cementos secundarios; 350000 ppm para alomicritas /sedimentos alóctonos, y 360000 ppm para las microbialitas.
El procedimiento para obtener las muestras consistió en permitir al láser penetrar en un punto fijo de la muestra sin desplazamiento del rayo (método puntual, Schäfer, 2006). Esto produce una menor variación entre los valores individuales de cada PL, en contraste con la ablación de una muestra por medio de una línea continua a través del mismo tipo de facies (Schäfer, 2006). En un intento previo de aplicar el método de la línea continua se observó una variación considerable, comparable a las observaciones de Kamber y Webb (2007). Ellos atribuyeron esta variación a la contaminación proveniente de la sección pulida y recomendaron descontinuar el uso de este método.
Una vez que se probó la eficiencia del método puntual por medio de errores medios casi nulos en las series de tiempo de cada ablación (no mostrado), se procedió con el mismo método pero en las cuatro secciones pulidas restantes. Sin embargo, en esta ocasión se midieron 24 isótopos en lugar de los 28 originales. El tantalio no fue considerado debido a sus bajas concentraciones. Adicionalmente, tanto el itrio como las tierras raras de referencia (La y Ce) fueron también removidas para este análisis, debido a que los resultados provistos en la muestra más óptima (FSSA001–M2) no fueron lo suficientemente satisfactorios en el sentido de una interpretación paleoambiental (Van Kranendonk et al., 2003; Tabla 1).
Comparativamente, la ablación por láser tiene una mayor resolución que los métodos de dilución en el uso de técnicas ICP–MS, dado que éstos requieren de una mayor cantidad de material, lo que implicala mezcla de facies (Delecat, 2005).
Los experimentos fueron realizados por triplicado, de modo que los valores mostrados en la Tabla 1 son un promedio de tres mediciones.
3.2.2. Espectrometría de masas para la medición de isótopos estables (δ13C, δ18O)
El muestreo para estos análisis fue realizado con un microtaladro dental directamente de las secciones pulidas. Para un análisis confiable se requiere una cantidad mínima de 60 µg por análisis. Los puntos de muestreo fueron determinados con previa ayuda de observación microscópica de las láminas petrográficas correspondientes. La reproductibilidad de los experimentos fue asegurada por medio de estándares de laboratorio. El valor máximo de desviación estándar (σ) fue de 0.029 para ambos isótopos.
Diez mediciones fueron realizadas utilizando un espectrómetro Kiel IV, en el Departamento de Geoquímica de la Universidad de Göttingen bajo la dirección del Dr. Andreas Pack. Todos los valores están expresados con relación al estándar PDB. La conversión de VSMOW a VPDB se realizó siguiendo el protocolo del Laboratorio de Espectrometría de Masas del Departamento de Geoquímica de la Universidad de Göttingen, de acuerdo a la fórmula empleada por Wiedner (2004):
δ18OVPDB = 0.97006VSMOW – 29.94
4. Resultados
4.1. Magnesio
El contenido de Mg en todas las microbialitas oscila entre 12620 ppm (Cas12–M2) y 22473 ppm (MV3–M1), con un valor medio de 16982 ppm (Tabla 1) indicando en principio una mineralogía original de calcita alta en Mg (Prasada Rao, 1996). Estos resultados son acordes con los valores obtenidos por Rech (1998) y por Sánchez–Beristain et al. (2011) por medio de la microsonda, que oscilan entre 4.00 % y 6.76 % mol Mg siendo así mayores o iguales que el valor mínimo aceptado de 4.00 % mol. para esta mineralogía (Morse y McKenzie, 1990; Flügel, 2004). Las microbialitas con una mineralogía de calcita alta en Mg han sido ampliamente reportadas en la literatura (e.g. Reitner, 1993; Zankl, 1993; Schäfer, 2006). Estudios realizados con espectroscopía Raman apoyan estos hallazgos, además de mostrar remantentes de materia orgánica (Sánchez–Beristain et al., 2011).
En fósiles aragoníticos, la concentración de Mg alcanza 592 ppm como máximo (Tabla 1), estando asimismo en concordancia con resultados previos de microsonda (Sánchez–Beristain et al., 2011) y correspondiendo con valores normales para esta mineralogía (Morse y McKenzie, 1990). En el caso de los cementos secundarios, los valores alcanzan como máximo 4817 ppm (Tabla 1), correspondiendo a 1.67 % mol Mg y por lo tanto siendo conferidos a una mineralogía de calcita baja en Mg (Veizer, 1983; Morse y McKenzie, 1990; Russo et al., 1997; Flügel, 2004).
El contenido de Mg en la esponja talámida Celyphia submarginata es de 568 ppm, lo que correspondería a una mineralogía de calcita baja en Mg. La concentración de este elemento en las micritas alóctonas es considerablemente mayor que en las microbialitas (Tabla 1).
4.1.1. Discusión
El análisis del contenido de Mg en las microbialitas por medio de LA–ICP–MS mostró una mineralogía que coincidió con mediciones por espectroscopía Raman (Sánchez–Beristain et al., 2011). La calcita alta en Mg, así como la aragonita, coinciden con la composición química propuesta para los océanos Triásicos (Sandberg, 1983; Lowenstein et al., 2001; Hühne, 2005). El contenido alto de Mg en alomicritas puede deberse a la presencia de pequeñas cantidades de cementos dolomíticos contenidos en ellas, mismos que fueron observados por medio de examinación petrográfica (Sánchez–Beristain et al., 2011). Dichas concentraciones altas de Mg en componentes alóctonos de facies principalmente microbialíticas en San Casiano han sido registradas, asimismo, con anterioridad por medio de espectroscopía ADS (Rech, 1998).
4.2. Estroncio
Las concentraciones de este elemento en microbialitas oscilan entre 603 ppm (Cas12–M1) y 1649 ppm (FSSA58–M2), con una media de 940 ppm. Por el contrario, los cementos secundarios muestran valores más bajos, en tanto que los esqueletos aragoníticos bien preservados de quetétidos y el coral Margarosmilia alcanzan más de 8000 ppm. Sin embargo, es importante enfatizar que se han obtenido valores ligeramente menores con ayuda de la microsonda (7800 ppm) especialmente en el centro del algunas esferulitas de otras esponjas aragoníticas (Laghi et al., 1984; Sánchez–Beristain et al., 2011). Para la esponja talámida Celyphia submarginata, los valores alcanzan 4063 ppm. Los valores en las alomicritas no pueden ser distinguidos de aquellos en las facies microbialíticas (Tabla 1). Por otra parte, no existe una correlación entre el Si o Al y el Sr (r2 Si–Sr = 0.05; r2 Al–Sr = 0).
4.2.1. Discusión
Los valores de las concentraciones de Sr corresponden con valores de otras microbialitas fósiles de calcita alta en Mg (Jasionowski, 2004; Wang et al., 2005). La correlación inexistente entre Si o Al y Sr (Figura 3a,b) excluye un origen proveniente de la corteza terrestre para este elemento, reflejando así la mineralogía original de las microbialitas de San Casiano.
Los altos valores de Sr en los fósiles aragoníticos respaldan la noción de una preservación excepcional en la mayoría de los fósiles de San Casiano (Scherer, 1977; Laghi et al., 1984; Russo et al., 1991, 1997; Sanchez–Beristain et al., 2011). En el caso de Celyphia submarginata, sin embargo, el valor relativamente bajo puede ser explicado debido a un alto valor de Fe (6348 ppm), indicando así un grado medio de preservación.
Las concentraciones de estroncio reflejan, por tanto, la mineralogía original de las microbialitas y de algunos fósiles, excluyendo así un aporte de corteza en estos valores. Las concentraciones elevadas en cementos secundarios apuntan a un origen diagenético tardío. (Russo et al., 1991, 1997).
4.3. Hierro, manganeso e isótopos de carbono y oxígeno
Las concentraciones de Fe en las facies microbialíticas oscilan entre 2986 (MV3–M1) y 15529 ppm (MXXI–M1), con un valor promedio de 5619 ppm (Tabla 1). El valor más elevado puede ser comparado con aquellos de las alomicritas, que varían entre 7903 y 15784 ppm. Por el contrario, los fósiles, con excepción de Celyphia submarginata (6348 ppm) poseen valores tan bajos como 68.26 ppm (braquiópodo tecideido) y no mayores que 356.44 ppm (coralita de Thecosmilia). Todos estos valores coinciden con resultados de microsonda (Russo et al., 1991; Sánchez–Beristain et al., 2011). Los valores de cementos secundarios oscilan entre 6061 y 7011 ppm.
Para el Mn, las concentraciones varían entre 202 ppm (MV3–M2) y 1744 ppm (MXXI–M1) en microbialitas (Tabla 1). Estos valores son ligeramente más bajos en promedio que aquellos de las alomicritas (984 a 1248 ppm). Los fósiles (con excepción de Celyphia submarginata, con 841 ppm) exhiben por lo general bajas concentraciones, de 10 ppm (braquiópodo) a 96 ppm (coralita de Margarosmilia). Los valores de cementos secundarios (915 y 1077 ppm) son comparables con los de la microbialita con un mayor contenido de manganeso así como de todas las alomicritas (Tabla 1). Los resultados concuerdan con las examinaciones mediante la microsonda (Sánchez–Beristain, 2010).
En el caso de los isótopos de carbono y oxígeno, se seleccionaron las 10 muestras microbialíticas que presentaron los menores valores en la relación Mn/Sr (Nagarajan et al., 2008). Los valores para δ13C oscilan entre 2.614 % (FSSA001 – M4) y 4.133 % (FSSA001 – M1), mientras que para δ18O, entre –3.35 % y –2.14 %.
4.3.1. Discusión
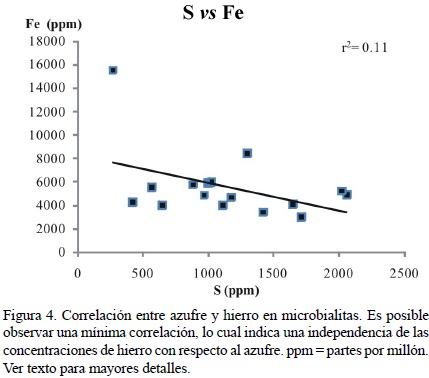
Russo et al. (1997) encontraron concentraciones de Fe para microbialitas de San Casiano en Punta Grohmann menores al límite de detección utilizando microscopía EDX. Por lo tanto, los valores de Fe en las microbialitas de este estudio indicarían en primera instancia un efecto diagenético. Sin embargo, ellos también citaron valores indetectables para el Sr. Por su parte, Rech (1998) encontró valores de hasta 9220 ppm en calcita alta en Mg para las microbialitas de la Formación San Casiano en Pralongia y Schäfer (2006) encontró valores de hasta 5435 ppm en microbialitas recientes. Las bajas concentraciones de Fe en esqueletos indican una preservación extraordinaria. Más aún, la tinción con el método de Dickson (1965) ha revelado una mineralogía de calcita para las microbialitas de la Formación San Casiano (Rech, 1998; Sánchez–Beristain et al., 2011). Por lo tanto, los altos valores para este elemento son muy probablemente una consecuencia de un ambiente reductivo (Berner, 1980; Schäfer, 2006; Jørgensen y Kasten, 2006), misma que se sustenta en observaciones previas de pirita en las microbialitas de San Casiano (Sánchez–Beristain, 2010; Sánchez–Beristain et al., 2011). Por desgracia, la correlación entre S y Fe es débil (r2 = 0.11; Figura 4), no siendo posible por este medio comprobar dicha aseveración.
En el caso del Mn, Schäfer (2006) encontró concentraciones en microbialitas recientes con valores de hasta 661 ppm. Rech (1998) obtuvo valores de hasta 853 ppm. En principio, estas cantidades apoyarían la teoría de la influencia diagenética meteórica (Haese, 2007). Sin embargo, estos valores pueden ser obtenidos también en ambientes reductivos (Pingitore 1978; Berner, 1980; Haese, 2007). Lamentablemente, la correlación entre S y Mn es baja (r2 = 0.02; Figura 5), como en el caso de S y Fe.

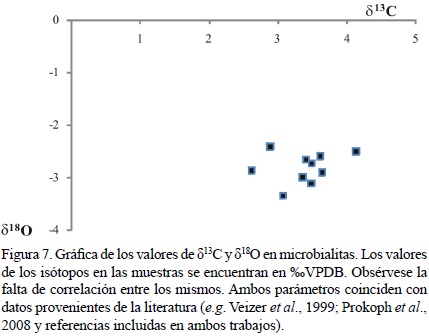
Dado a que el estudio de la diagénesis no formó parte de esta investigación, este tema no se abordará en lo subsecuente. Sin embargo, con el fin de determinar si las altas concentraciones de Mn puedan estar relacionadas a la diagénesis meteórica, la elaboración de una gráfica detallando la relación entre Mn/Sr con los valores de δ18O (Tabla 2) puede ser de gran utilidad. Para ello, se debe tener un valor como referente (Halverson et al., 2002). Los resultados en la Figura 6 muestran que todas las microbialitas están distribuidas en el cuadrante de la esquina inferior derecha, indicando poca influencia de diagénesis meteórica (e.g. Halverson et al., 2002; Yoshioka et al., 2003). Por otra parte, no existe una correlación entre los valores de δ13C y los de δ18O (Figura 7; Nützel et al., 2009). Además, los valores isotópicos de carbono y oxígeno (Figura 7, Tabla 2) se encuentran dentro del rango reportado ampliamente en la literatura para el Triásico (e.g. Veizer et al., 1999; Korte et al., 2005; Prokoph et al., 2008), lo cual respalda esta hipótesis.

Adicionalmente, la relación Mn/Sr en las muestras oscila entre 0.30 y 0.74 (Tabla 2) con la salvedad de la muestra MXXI – M1 (Mn/Sr = 2.99), lo cual indica un estado de buena preservación (Nagarajan et al., 2008). Por lo tanto es posible asumir que a pesar de la falta de correlación entre Mn y S, las concentraciones de Mn sumadas a la baja relación Mn/Sr (< 1), reflejan únicamente los efectos de diagénesis temprana relacionada muy probablemente a condiciones reductivas y no los efectos de diagénesis meteórica.
4.4. Azufre
Las concentraciones de S varían entre 268 ppm (MXXI – M1) y 2062 ppm (MI6–M1) en los carbonatos microbianos analizados, con una media de 1130 ppm. Todos ellos con excepción de M1 (268 ppm) tienen valores mayores que las alomicritas, que oscilan entre 575 y 962 ppm. En los cementos secundarios, los valores van de 227 a 680 ppm, mientras que en los esqueletos existen ciertas variaciones. La esponja quetétida tiene un valor de 288 ppm. Los corales poseen 834 ppm (Thecosmilia) y 854 ppm (Margarosmilia). Los braquiópodos tienen concentraciones de 452 y 502 ppm.
4.4.1. Discusión
El azufre es un elemento con una importancia biológica ampliamente conocida (Fraústro da Silva y Williams, 2001). Es fundamental en procesos como la sulforeducción (Valbuena et al., 2010), la mineralización abiótica en sulfatos (Beveridge y Hunter, 2006) y la oxidación de sulfuros (Kappler et al., 2000). Éstas pueden ser algunas de las causas de su enriquecimiento en las microbialitas con respecto a las alomicritas. Más aún, no existe una correlación entre Si o Al y S (0.04 y 0.09 respectivamente), lo cual refuta el posible origen del azufre a partir de la corteza terrestre.
No existe una correlación entre el S y el Ni (r2 = 0.01; Figura 8), lo cual podría respaldar un posible origen metabólico relacionado a actividades enzimáticas determinadas (Krüger et al., 2003; Schäfer, 2006). Por otra parte, las correlaciones entre el azufre y el hierro o el manganeso son muy bajas, lo que descarta a la diagénesis temprana como la única causa de las concentraciones del azufre. (e.g. Haese, 2007; Jørgensen y Kasten, 2006). Las concentraciones de éste elemento deben ser por ende el resultado de una mezcla de actividad diagenética temprana y de relictos de actividad biológica.

La presencia de altas concentraciones de S en las esponjas de la Formación San Casiano coinciden con los resultados de Laghi et al. (1984), quienes confirieron al azufre como un relicto de metabolismo bacteriano en las mismas y atribuyeron su hallazgo a la extraordinaria preservación de sus muestras.
4.5. Fósforo
Las concentraciones de este elemento en microbialitas tienen valores que van desde 101 ppm (MI6–M1) a 2710 ppm (FSSA58– M1), con un valor promedio de 370 ppm (Tabla 1). Todas las muestras, exceptuando la FSSA 58 M1 tienen concentraciones menores que las alomicritas, que varían de 789 a 1538 ppm.
Las esponjas están ligeramente más enriquecidas en este elemento que los corales, con 35 ppm (esponja quetétida) y 78 ppm (Celyphia submarginata) en comparación con 8 ppm (Thecosmilia) y 24 ppm (Margarosmilia). Los braquiópodos tecideidos muestran diferencias considerables en sus valores, con 5 y 116 ppm respectivamente. Los valores en los cementos secundarios oscilan entre 45 y 180 ppm, siendo más reducidos que las alomicritas o las microbialitas, incluso en un mayor grado que el S.
4.5.1. Discusión
El fósforo es un elemento esencial para la vida. Participa en la formación de bases nitrogenadas y membranas (Voet y Voet, 2010). Dado a que las concentraciones de P son mayores en alomicritas que en alguna otra facie, no es posible inferir un origen biológico. La correlación entre Si o Al y P son medias (0.19 y 0.25 respectivamente), lo cual respalda en cierta forma la contaminación con material proveniente de la corteza.
4.6. Silicio
Las concentraciones de Si en las microbialitas analizadas oscilan entre 823 ppm (FSSA001–M2) y 7591 ppm (MV3–M2) con una media de 3610 ppm (Tabla 1). No es posible observar una diferencia sustancial con respecto al contenido de este elemento en las alomicritas, que varían entre 4178 y 6878 ppm. Por el contrario, el contenido de Si es considerablemente bajo en otras facies. En los cementos secundarios, su valor no es mayor a 446 ppm, mientras que en componentes esqueléticos es ligeramente menor, alcanzando de 72 ppm (braquiópodo tecideido) a 474 ppm (esponja quetétida). Existe una correlación entre Si y Al que resulta significativamente alta (Tabla 1; r2 = 0.89).
4.6.1. Discusión
El contenido de Si en las microbialitas de la Formación San Casiano es mayor que en otros carbonatos microbianos fósiles y recientes (Webb y Kamber, 2000; Nothdurft et al., 2004; Olivier y Boyet, 2006), lo que impide, adicionalmente al contenido de P, la posibilidad de analizar patrones de tierras raras + itrio e.g. Bau y Dulski, 1996; Webb y Kamber, 2000; Nothdurft et al., 2004; ver sección 4.8.2). Las concentraciones de Si son más bajas en componentes esqueléticos, pues no se conoce efecto metabólico alguno para este elemento (Fraústro da Silva y Williams, 2001), si bien son parte fundamental en la construcción de espículas, testas y conchas de diversos organismos, como por ejemplo esponjas (Bergquist, 1978), radiolarios (Adl et al., 2005) y diatomeas (Norton et al., 1996). La correlación de Si con Al (Tabla 1) indica una procedencia del primer elemento a partir de siliciclásticos (Wedepohl, 1995) y no de un origen biológico, lo que justifica el uso de las correlaciones y los coeficientes r2 entre cada elemento analizado en este estudio y el Si.
4.7. Aluminio
Las concentraciones de Al varían entre 369 ppm (FSSA 58–M2) y 3030 ppm (FSSA 58–M1) en las microbialitas, siendo su valor medio 1548 ppm (Tabla 1). La mayoría de los valores son muy similares a los de las alomicritas, que van desde 1800 hasta 2828 ppm. Notoriamente, las concentraciones de este elemento son mucho más reducidas en componentes esqueléticos, con 0 y 10.50 ppm en braquiópodos tecideidos, 6 ppm en esponjas quetétidas, 10 y 23 ppm en corales, y 37 ppm en la esponja Celyphia submarginata.
4.7.1. Discusión
Los valores del contenido de Al en las microbialitas de la Formación San Casiano se comportan de una manera muy similar a los del Si. Dado a que no se conoce una importancia biológica para este elemento (Fraústro da Silva y Williams, 2001), y a su correlación con el Si (Tabla 1), se asume para él un origen proveniente de la corteza terrestre (Wedepohl, 1995).
4.8. Elementos traza
4.8.1. Elementos relacionados a la corteza terrestre (sin una importancia biológica conocida)
En el caso del zirconio y el rubidio es posible observar un enriquecimiento significativo en las muestras alomicríticas (Zr> 4.50 ppm y Rb >3.94) con respecto a las microbialitas (exceptuando la muestra FSSA 58 M1, donde Zr <3.91 ppm, y Rb < 2.86 ppm). Mientras que el contenido de Zr es reducido tanto en el cemento secundario como en los fósiles aragoníticos y braquiópodos, los valores de Rb en el cemento son mayores que en las microbialitas con los menores contenidos de este elemento (Tabla 1). En las facies aragoníticas, el contenido de Rb es despreciable. El contenido de Ti muestra características tanto del Zr como del Rb, puesto que la concentración de Ti en los esqueletos es baja, y en los cementos secundarios es similar a la de las microbialitas con los valores más reducidos. En el caso de las alomicritas, los valores de Ti son muy similares a las microbialitas con mayor concentración (Tabla 1).
Un subgrupo adicional de elementos sin importancia biológica conocida es constituido por el torio, niobio y hafnio. La distribución de estos elementos es importante, puesto que aparecen con mayores concentraciones en los cementos secundarios, mientras que en alomicritas es apenas mayor que en las microbialitas. En los esqueletos aragoníticos, las concentraciones son similares a las microbialitas. El Hf es el único elemento con concentraciones cercanas al límite de detección, por lo cual tiene los valores con mayores márgenes de error (ver sección 3.2.1).
El tantalio fue medido únicamente en 4 muestras microbialíticas y sus valores estuvieron siempre por debajo del límite de detección.
Se pueden observar valores muy altos de correlación (coeficiente r2) entre el Si y los siguientes elementos para todo el conjunto de las muestras microbialíticas: Rb = 0.85, Ti = 0.90, Zr = 0.78, Nb = 0.58 y Th = 0.73 (Figuras 9a–d, 10), como resultado de su alto contenido de silicatos. Algunas de las muestras tienen concentraciones de Zr tan altas como el 2 % con respecto a los valores aceptados para la corteza terrestre (Wedepohl, 1995), indicando un alto grado de aporte cortical en el material. Este aporte puede ser confirmado por medio de la relación Th/U en todas las muestras, especialmente en alomicritas y microbialitas (Tabla 1).

El intemperismo de silicatos ha sido considerado un factor importante para la formación de microbialitas en ambientes crípticos modernos en islas continentales (Reitner, 1993). Sin embargo, la causa principal del alto contenido de silicatos en las muestras de la Formación San Casiano puede estar relacionada a la naturaleza margosa de la misma Formación, reportada extensamente en la literatura (e.g. Wendt y Fürsich, 1980; Russo et al., 1991; Sánchez–Beristain et al., 2011).
4.8.2. Tierras raras e itrio (REE + Y)
Las tierras raras (REE, por sus siglas en inglés) incluyen a todos los elementos a partir del lantano (Z = 57) y hasta el lutecio (Z = 71). Su química los hace particularmente útiles en los estudios de química acuática como la determinación del estado de oxidación y la temperatura de un ambiente marino, dado a que todos poseen un radio iónico similar y la mayoría de ellos tienen un estado de oxidación trivalente (Elderfield y Greaves, 1982; Elderfield, 1988). Únicamente el cerio y el europio poseen estados rédox diferentes (Ce IV y Eu II, respectivamente), lo cual permite la determinación de parámetros ambientales con ayuda de ellos. Aún y cuando las REE son solubles, son relativamente resistentes al metamorfismo de bajo grado y a la alteración hidrotermal (Hühne, 2005).
Las abundancias naturales de los elementos que resultan de la nucleosíntesis muestran una variación rítmica con el número atómico. Sin embargo, esta variación puede ser corregida por medio de la normalización con ayuda de un estándar. Esta normalización produce los patrones de tierras raras ("REE patterns"). Elderfield (1988) propuso el primer patrón REE basado en la normalización de los valores de las concentraciones de REE en lutita con respecto a condrita. El itrio, si bien no pertenece a estos elementos, se comportan de una manera químicamente muy similar a la mayoría de las REE y puede ser insertado entre el Dy y el Ho, de acuerdo a su radio iónico (Byrne y Lee, 1993; Bau et al., 1997), generándose así los patrones REE + Y (o bien, REY).
Además de ser obtenidos para el agua marina (e.g. Elderfield y Greaves, 1982; German et al., 1991; Piepgras y Jacobsen, 1992; Bau et al., 1995; Bau et al., 1997), se han obtenido patrones REE/REY a partir de diferentes tipos de reservorios, tales como sistemas magmáticos (Bau, 1996), formaciones bandeadas de hierro (Bau y Dulski, 1996; Bolhar et al., 2004), fluidos hidrotermales (Michard y Albarède, 1986; Bau y Dulski, 1999), costras ferromagnesianas (Delecat, 2005), apatitas biogénicas (Grandjean–Lecuyer et al., 1993), y más recientemente, microbialitas (e.g. Webb y Kamber, 2000; Kamber y Webb, 2001; Van Kranendonk et al., 2003; Bolhar et al., 2004; Delecat, 2005; Olivier y Boyet, 2006; Kamber y Webb, 2007). Webb y Kamber (2000) fueron los primeros en determinar exitosamente la sistemática genuina de la distribución de las REE en un conjunto de microbialitas libres de siliciclásticos provenientes del la Gran Barrera de Coral en Australia. Esta ausencia de siliciclásticos es fundamental para un resultado confiable de REY (Webb y Kamber, 2000).
Los patrones REE o REY en microbialitas son usualmente normalizados con respecto al estándar de Lutitas Australianas Post–Arqueanas (PAAS, por sus siglas en inglés; McLennan, 1989). Al tratar de obtener un patrón REE/REY, es importante tomar en cuenta el concepto de "anomalía". Una anomalía puede ser entendida como cualquier desviación posterior a un proceso de normalización, de una línea recta, siendo el resultado de concentraciones más altas (anomalía positiva, valor > 1) o más bajas (anomalía negativa, valor < 1) de lo esperado.
Se intentó obtener patrones de REY para todas las microbialitas. Sin embargo, en todas las muestras analizadas en este estudio, los valores de Si, Al y todos los elementos traza relacionados a la corteza terrestre son mucho mayores en comparación con otras microbialitas discutidas en la literatura (Webb y Kamber, 2000; Van Kranendonk et al., 2003; Nothdurft et al., 2004; Olivier y Boyet, 2006). Por lo tanto, solamente el La, Ce e Y fueron analizados con propósitos de control en la mayoría de las muestras (Tabla 1), mientras que el conjunto total de REE + Y únicamente en la microbialita más libre de Si y Al (FSSA001 M2). El patrón REY obtenido en esta microbialita no se asemeja a ningún patrón REY normalizado a PAAS conocido para microbialitas (Tabla 3, Figura 11).
A pesar de la utilidad de los patrones REE/REY, las tierras raras son muy susceptibles a diferentes agentes en el agua marina, alterándose así su patrón original. Entre esos agentes pueden ser nombrados el aporte de material de la corteza terrestre y la contaminación por fosfatos. El aporte de la corteza puede allanar totalmente un patrón REY (Nothdurft et al., 2004), mientras que los fosfatos promueven el enriquecimiento de las tierras raras pesadas (HREE o Heavy REEs, por sus siglas en inglés; Byrne et al., 1996). Por ende, con el fin de obtener un patrón REY confiable que pueda conferir información sobre importantes parámetros del agua marina, es necesario contar con material relativamente libre de fosfatos y de contaminación proveniente de la corteza.
En altas concentraciones de Zr, las señales originales de REY pueden perderse (Bau y Dulski, 1996). Algunas de las muestras analizadas alcanzan concentraciones de Zr de hasta el 2 % con respecto de la corteza terrestre (Tabla 1; Wedepohl, 1995) indicando nuevamente un alto grado de material proveniente de la corteza en las mismas. Más aún, la concentración de Y en dos muestras de alomicrita (Cas12–A1 y Cas12–A2) es incluso mayor que la que existe en la corteza (Wedepohl, 1995).
A pesar de no existir correlación entre Si y La, Ce o Y, las elevadas concentraciones de los últimos tres elementos en alomicritas y microbialitas pueden ser interpretadas como indicadores de contaminación proveniente de la corteza en las muestras de la Formación San Casiano. Esta contaminación es corroborada por medio de la relación Th/U en todas las muestras, especialmente en alomicritas y microbialitas (Tabla 1). En caso de un grado considerable de contaminación siliciclástica, los patrones REY no serían confiables, pues no reflejarían los coeficientes de partición de las REE en el agua marina (Webb y Kamber, 2000; Van Kranendonk et al., 2003; Nothdurft et al., 2004). Por lo tanto, es altamente improbable encontrar patrones REY fidedignos en las microbialitas de San Casiano, dado a que un grado de contaminación siliciclástica de apenas 1 % enmascara las señales originales de REY (Van Kranendonk et al., 2003). Más aún, las concentraciones de P son relativamente altas en microbialitas (Tabla 1). Sería necesario contar con microbialitas libres de fósforo, ya que este elemento afecta la sistemática de las REE debido a procesos como co–precipitación (Byrne et al., 1996; Nothdurft et al., 2004).
Para la muestra FSSA001 M2, el valor positivo obtenido para la anomalía La (La/La* = 1282 de acuerdo a Bolhar et al., 2004) es extremadamente alto. Debido a la marcada diferencia observada entre este valor y otros reportados en la literatura (Webb y Kamber, 2000; Bolhar et al., 2004; Nothdurft et al., 2004) no es posible una aseveración conclusiva.
En el caso del cálculo de la anomalía de cerio (Ce/Ce*), que puede proveer información en torno al estado de oxidación y alcalinidad del agua (Bau y Dulski, 1996; Webb y Kamber, 2000; Hühne, 2005), se utilizó nuevamente el método de Bolhar et al. (2004), puesto que el método de Olivier y Boyet (2006) toma en cuenta la concentración de lantano. El valor obtenido de Ce/Ce* = 3.89 sería considerado como altamente positivo, mucho mayor aún que los valores de Ce/Ce* reportados para el agua marina (e.g. Nothdurft et al., 2004; Olivier y Boyet, 2006), y por lo tanto no debe ser considerado como un valor auténtico de condiciones originales de pH alto y ambiente reductivo (Bolhar et al., 2004). Con el fin de probar si existe una anomalía positiva de Ce, es necesario conocer el valor de la anomalía de praseodimio (Pr/Pr*). El valor de Pr/Pr* = 0.58 respaldaría anomalías positivas tanto de La/La* como de Ce/Ce* (Bau, 1996). Sin embargo, estas evidencias son refutadas a partir del coeficiente Y/Ho = 1, que es menor que el registrado para condritas y mucho menor que los reportados para el agua marina (Y/Ho = 44 – 74; Bau, 1996). Delecat (2005) encontró valores de Y/Ho muy similares para el Triásico de Adnet, en Austria y los atribuyó asimismo a los efectos de contaminación por siliciclásticos.
El valor negativo de Eu/Eu* = 0.87 tampoco debe ser considerado como fidedigno. Por una parte, el pico de europio en la Figura 9 en comparación con el samario podría ser considerado preliminarmente como una anomalía positiva de europio, típica de la presencia de aportes hidrotermales, como ocurre en la actualidad (Webb y Kamber, 2000). Sin embargo, la misma gráfica muestra un enriquecimiento significativo de gadolinio, que es un elemento necesario para calcular el valor de Eu/Eu*. Este pico de gadolinio produce entonces un valor negativo para Eu/Eu*.
Es posible observar un enriquecimiento de las Tierras Raras Pesadas (HREE) con respecto a las Tierras Raras Ligeras (LREE; NdSN / YbSN = 0.28) y de las Tierras Raras Medias (MREE, SmSN/YbSN = 0.31). Esta característica es típica de los ambientes marinos modernos (Webb y Kamber, 2000; Nothdurft et al., 2004), aunque dado a que los fosfatos tienden a aumentar las concentraciones de HREE con respecto de las MREE y LREE (Byrne et al., 1996; Nothdurft et al., 2004), esta señal no es confiable.
Por ende, a pesar de que la muestra analizada tiene los valores más bajos de Si, Al y elementos traza de corteza, el patrón REY obtenido para la muestra FSSA001 M2 no es considerado confiable, pues existen una gama de factores alterando la gráfica del patrón. Las señales obtenidas de REY son consideradas por tanto como afectadas por la presencia de fosfatos (Nothdurft et al., 2004; Byrne et al., 1996) y siliciclásticos (Van Kranendonk et al., 2003).
4.8.3. Elementos con un efecto biológico conocido
Algunos elementos con un posible efecto vital como el V (Robson et al., 1986), Cr (Congeevaram et al., 2007), Sn (Moser et al., 2009), Sb (Bentley y Chasteen, 2002), Zn (Sugarman, 1983), Cu (Mathews et al., 1999), Mo (Tucker et al., 1997; Dos Santos y Dean, 2008), Co (Hebbeln y Eitinger, 2004; Anthony et al., 2011) y Ni (Krüger et al., 2003; Hebbeln y Eitinger, 2004) presentan concentraciones significativas en todas las facies carbonatadas estudiadas (e.g. Kamber y Webb, 2007). En esta sección se discutirá si estas concentraciones reflejan fraccionamiento vital en las microbialitas.
Vanadio y cromo. No es posible observar variaciones significativas para el contenido de V y Cr entre corales, esponjas caetétidas, cementos secundarios y algunas de las microbialitas. Los braquiópodos tienen concentraciones muy bajas (Tabla 1).La muestra microbialítica Cas12–M2 posee concentraciones relativamente altas de V (10.53 ppm), pero dado su alto contenido de Si y Al, no es posible atribuir un efecto biológico para el V. Las alomicritas poseen los valores más altos para las concentraciones de V y Cr dentro de todo el conjunto muestral.
Todas las microbialitas muestran una correlación de baja a media entre el Si o Al y el V y Cr (r2 = 0.11 para Si– V y 0.07 para Al–V; 0.37 para Si–Cr y 0.30 para Al–Cr; Figura 12 a–d, Tabla 1), lo cual permite explicar el posible origen de sus concentraciones como consecuencia del aporte de siliciclásticos. Más aún, todas las muestras alomicríticas poseen valores mayores de V que las microbialitas; y en cuanto al Cr, que 10 de las microbialitas. Por lo tanto, no es posible conferir un rol biológico a estos elementos en el conjunto muestral de microbialitas.
Estaño, antimonio y zinc. Los patrones de estos elementos no son lo suficientemente claros. Los cementos secundarios están más enriquecidos en Sn y Sb que los esqueletos de corales, mientras que no es posible reconocer una diferencia entre las esponjas o los braquiópodos. Por su parte, existen variaciones muy fuertes en las concentraciones de estos elementos en muestras microbialíticas (Tabla 1), y las alomicritas se encuentran ligeramente enriquecidas, incluso más que en las muestras restantes exceptuando por Cas12–M3 con 2.12 ppm (Sn), Cas 12–M1, y FS–SA58 M2 (Sb = 6.85 y 3.19 ppm, respectivamente). Las concentraciones de Zn son similares en todas las muestras con la salvedad de las alomicritas, donde el contenido de este elemento es relativamente alto.
Aunque no existe una correlación significativa entre Si o Al y estos elementos (r2 para Si–Sn = 0.00, Al–Sn = 0.06; Si–Sb y Al–Sb = 0.16 ambos; Si–Zn = 0.01, Al–Zn = 0; Figura 13a–d, Figura 14a–b), no es posible concluir sobre la presencia de fraccionamiento vital de estos elementos en las microbialitas ya que solamente pocas de ellas muestran un enriquecimiento relativo respecto de otras muestras de un origen no biológico.
Cobre y molibdeno. Estos elementos se encuentran por lo general más enriquecidos en las microbialitas que en cementos secundarios, esponjas, braquiópodos, corales, e incluso alomicritas. No queda claro si el Cu o el Mo jugaron un papel importante y detectable en los organismos esqueléticos estudiados, pues las esponjas, corales y braquiópodos muestran normalmente concentraciones menores de estos elementos incluso que los cementos secundarios. A pesar del contenido medio a alto de siliciclásticos en las microbialitas, no existe una correlación entre el Si o Al con Cu o Mo (r2 para Si–Cu = 0.02, Al–Cu = 0; Si–Mo = 0.15, Al–Mo = 0.06; Tabla 1, Figura 15a–d). Las muestras Cas 12–M1 (Mo) y Cas 12–M4 (Cu) presentaron errores medios moderados durante la serie temporal del proceso de ablación (no se muestra), pero ello no parece haber afectado las gráficas desplegadas en la Figura 15.
Las concentraciones de Cu y Mo no están relacionadas con el aporte de la corteza en muestra alguna. Es ampliamente conocido que el cobre juega un papel fundamental en la estructura de ciertas enzimas transmembranales, como la citocromo c oxidasa (Mathews et al., 1999) y el molibdeno es crucial para las enzimas reductoras de molibdato contenidas en las bacterias reductoras de sulfato (Tucker et al., 1997). Aún y cuando la correlación entre S y Mo es baja (r2 = 0.27; Figura 16), las concentraciones de Cu y Mo en las muestras microbialíticas son posiblemente relictos de un metabolismo bacteriano original.

Cobalto y níquel. Las concentraciones de Co y Ni son apenas ligeramente más altas en las alomicritas que en las microbialitas, pero por otra parte la tendencia general es la misma que para el cobre y el molibdeno. El níquel, por su parte, está significativamente enriquecido en algunas de las microbialitas, incluso más que en las alomicritas. La muestra microbialítica más reducida en Si (FS–SA 001–M2) posee una alta concentración de Ni (33.57 ppm), siendo así más del doble que las alomicritas. En los cementos secundarios y restos esqueléticos, las concentraciones son mínimas en comparación con las alomicritas y microbialitas.
Aunque las correlaciones entre Si o Al vs Co o Ni son mínimas (Si–Co = 0.01, Al–Co = 0.02; Si–Ni = 0.03, Al–Ni = 0.05; Figura 17a–d), existe una correlación muy alta (r2 = 0.97) entre el Ni y el Co en las microbialitas (Figura 18), lo cual representaría una consecuencia de contaminación por siliciclásticos, ya que la correlación persiste cuando las alomicritas son incluidas (r2 = 0.94). El níquel y el cobalto se encuentran presentes en la corteza como arsenuros o sulfoarsenuros (Ertseva y Tsymbulov, 2002). Más aún, la relación Ni/Co en la corteza terrestre es cercana a ~2.3 (Wedepohl, 1995) y en el agua marina, cerca de 400. En la mayoría de las microbialitas estudiadas, la relación es de ~8.0 (Tabla 4), misma que se mantiene similar en las alomicritas e incluso en esponjas. Por ello, se concluye que las altas concentraciones de Ni y Co en las microbialitas son producto de la influencia de material proveniente de la corteza en lugar de evidencias de procesos biológicos. Más aún, con el fin de asociar las altas concentraciones de Ni en microbialitas a procesos metabólicos, sería necesario encontrar una correlación de media a alta entre el Ni y el S para el conjunto de muestras (Schäfer, 2006), misma que es inexistente.


4.9.4. Determinación de las condiciones rédox con ayuda de elementos traza seleccionados
La importancia de algunos elementos (Ni, Co, V, Mo y Cr) como indicadores de las condiciones rédox ha sido estudiado con anterioridad para ciertos ambientes de depósito ricos en lutitas (Hatch y Leventhal, 1992; Rimmer, 2004), rocas organosedimentarias (Lewan, 1984) y en mudstones (Jones y Manning, 1994). Jones y Manning (1994) proponen los valores de las relaciones Ni/Co > 1 y V/Cr > 2 como indicadores de condiciones reductivas. Por otra parte, Lewan (1984) y Jones y Manning (1994) sugieren el valor del proxy V/V+Ni > 0.5 como diagnóstico para inferir disoxia/anoxia. Sin embargo, Rimmer (2004) notó que el uso aislado de estas relaciones como proxies de condiciones rédox puede resultar contradictorio para una interpretación. Ante ello, propuso un sistema de graficación mixta en el que señala el valor de Ni/Co como más confiable (variable independiente). Otros proxies (V/V+Ni, V/Cr e incluso la concentración de molibdeno) son indicados como variables dependientes.
Los resultados del presente estudio son contradictorios. Si bien la relación Ni/Co en las microbialitas oscila entre 5.18 y 15.36 (promedio = 8.64, indicando así condiciones disóxicas/anóxicas), los valores de V/Cr (mín. = 0.20; máx. = 2.17; promedio = 0.55) y V/V+Ni (mín. = 0.04; máx. = 0.485; promedio = 0.269) indican condiciones óxicas. Por ello, se realizaron tres gráficas utilizando el método de Rimmer (2004) con Ni/Co vs V/Cr, V/V+Ni, y Mo (Tabla 4, Figura 19a–c). Dichas gráficas revelan condiciones mayormente disóxicas (Rimmer, 2004), lo cual es posible de confirmar por medio de la presencia de pirita en análisis de microfacies (Reitner, 1992; Rech, 1998; Sánchez–Beristain, 2010).
5. Conclusiones
Las microbialitas analizadas poseen una mineralogía original de calcita alta en Mg. Esto queda evidenciado por las altas concentraciones de este elemento. Las concentraciones de estroncio son asimismo consistentes con esta mineralogía.
Las muestras poseen un excelente estado de preservación. La ausencia de correlación entre la relación Mn/Sr y δ18O, así como entre δ13C y δ18O indican la ausencia de efectos de diagénesis meteórica. Más aún, los valores isotópicos coinciden con otros valores citados ampliamente en la literatura para muestras con estados excepcionales de preservación.
Las concentraciones de azufre, manganeso y hierro son pruebas de diagénesis temprana en las microbialitas.
El enriquecimiento de elementos como fósforo, silicio y aluminio en las microbialitas es resultado de la contaminación con terrígenos. En este tenor, no existen evidencias para asumir un origen biológico para ciertos elementos traza (Rb, Zr, Ti, Nb, TH). Estos elementos se incorporaron a las muestras a través de la sedimentación de arcillas durante el crecimiento de las microbialitas.
No es posible atribuir un origen biológico para elementos como el vanadio y cromo en las microbialitas, puesto que sus concentraciones se encuentran más elevadas en las alomicritas.
A pesar de no ser claros los patrones del estaño, antimonio y zinc y de presentar una baja correlación con elementos como silicio o aluminio, no es posible conferir una procedencia biológica para ellos dada la concentración ligeramente más elevada en las alomicritas.
El cobre y el molibdeno se encuentran significativamente enriquecidos en las microbialitas que en cualquieras otras facies. Adicionalmente, no existe correlación de estos elementos con silicio o aluminio, por lo que son relictos posiblemente de un metabolismo microbiano.
No existe correlación entre silicio o aluminio y cobalto o níquel. Además, la concentración de estos elementos es mayor en microbialitas que en sedimentos alóctonos. No obstante, existe una correlación muy fuerte entre ellos, lo cual es típico de compuestos provenientes de terrígenos como los arsenuros.
Elementos como el cromo, vanadio, níquel y cobalto permitieron inferir las condiciones rédox del paleoambiente como primordialmente disóxicas. Esto es consistente con estudios previos de microfacies realizados en algunas microbialitas de la Formación San Casiano.
El patrón REY para las microbialitas no refleja la química original del agua triásica, puesto que las concentraciones de estos elementos son muy susceptibles a ser afectadas por concentraciones altas de silicio, aluminio o fósforo.
Agradecimientos
Los autores deseamos agradecer al Dr. Klaus Simon (Centro de Geociencias, Universidad de Göttingen) por llevar a cabo los análisis con ayuda del equipo de LA–ICP–MS. Asimismo extendemos un agradecimiento al Prof. Joachim Reitner (Centro de Geociencias, Universidad de Göttingen) por la asesoría ofrecida durante los estudios de doctorado de uno de nosotros (FSB), quien agradece al Servicio Alemán de Intercambio Académico (DAAD) por el financiamiento otorgado para fines de manutención durante el período 2007 – 2010. Adicionalmente agradecemos a la Sociedad Mexicana de Paleontología y en especial a su presidente, el Dr. Francisco Sour Tovar (Museo de Paleontología, Facultad de Ciencias, UNAM) por el apoyo logístico y por la invitación a contribuir con una publicación a este número del Boletín. Por último, deseamos expresar nuestro agradecimiento a la Dra. Ofelia Morton Bermea (Instituto de Geofísica, UNAM) y a un revisor anónimo. Los comentarios y sugerencias de ambos contribuyeron de una manera muy importante al mejoramiento de este manuscrito.
Referencias
Adl, S.M., Simpson, A.G.B., Farmer, M.A., Andersen, R.A., Anderson, O.R., Barta, J.R., Bowser, S.S., Brugerolle, G., Fensome, R.A., Fredericq, S., James, T.Y., Karpov, S., Kugrens, P., Krug, J., Lane, C.E., Lewis, L.A., Lodge, J., Lynn, D.H., Mann, D.G., McCourt, R.M., Mendoza, L., Moestrup, Ø., Mozley–Standridge, S.E., Nerad, T.A., Shearer, C.A., Smirnov, A.V., Spiegel, F.W., Taylor, M.F.J.R., 2005, The new higher level classification of Eukaryotes with emphasis on the taxonomy of protists: Journal of Eukaryotic Microbiology, 52, 399–451. [ Links ]
Anthony, R., Sujith, P., Fernandes, S., Verma, P., Khedekar, V., Loka Bharathi, P., 2011, Cobalt immobilization by manganese oxidizing bacteria from the Indian Ridge System: Current Microbiology, 62, 840–849. [ Links ]
Bau, M., 1996, Controls on the fractionation of isovalent trace elements in magmatic and aqueous systems: evidence from Y/Ho, Zr/Hf, and lanthanide tetrad effect: Contributions to Mineralogy and Petrology, 123, 323–333. [ Links ]
Bau, M., Dulski, P., 1996, Distribution of yttrium and rare–earth elements in the Penge and Kuruman Iron–Formations, Transvaal Supergroup, South Africa: Precambrian Research, 79, 37–55. [ Links ]
Bau, M., Dulski, P., 1999, Comparing yttrium and rare earths in hydrothermal fluids from the Mid–Atlantic Ridge: implications for Y and REE behaviour during near–vent mixing and for the Y/Ho ratio of Proterozoic seawater: Chemical Geology, 155, 77–90. [ Links ]
Bau, M., Dulski, P., Möller, P., 1995, Yttrium and holmium in South Pacific seawater: Vertical distribution and possible fractionation mechanisms: Chemie der Erde, 55, 1–15. [ Links ]
Bau, M., Möller, P., Dulski, P., 1997, Yttrium and lanthanides in eastern Mediterranean seawater and their fractionation during redox–cycling: Marine Chemistry, 56, 123–131. [ Links ]
Bentley, R., Chasteen, T.G., 2002, Microbial methylation of metalloids: arsenic, antimony, and bismuth: Microbiology and Molecular Biology Reviews, 66, 250–271. [ Links ]
Bergquist, P.R., 1978, Sponges: Berkeley, California, E.U.A., University of California Press, 268 p. [ Links ]
Berner, R.A., 1980, Early diagenesis: A theoretical approach: Princeton, New Jersey, E.U.A., Princeton University Press, 245 p. [ Links ]
Beveridge, T., Hunter, R., 2006, Metal–bacteria interactions at both the planktonic cell and biofilm levels, en Sigel, A., Sigel, H., Sigel, R.K.O. (eds.), Biomineralization: From Nature to Application: Metal Ions in Life Sciences: Chichester, Reino Unido, John Wiley and Sons, 127–165. [ Links ]
Biddle, K.T., 1981, The basinal Cipit boulders: indicators of Middle to Upper Triassic buildup margins, Dolomite Alps, Italy: Rivista Italiana di Paleontologia e Stratigrafia, 86, 779–794. [ Links ]
Bizzarini, F., Braga, G., 1978, Upper Triassic new genera and species of fair and questionable Bryozoa Chaetetida from the S. Cassiano Formation of the Dolomites (eastern Italy): Bollettino della Societa Paleontologica Italiana, 17, 28–48. [ Links ]
Bolhar, R., Kamber, B.S., Moorbath, S., Fedo, C.M., Whitehouse, M.J., 2004, Characterisation of early Archaean chemical sediments by trace element signatures: Earth and Planetary Science Letters, 222, 43–60. [ Links ]
Bosellini, A., 1991, Geologia delle Dolomiti: Bolzano, Italia, Casa Editrice Athesia, 192 p. [ Links ]
Byrne, R.H., Lee, J.H., 1993, Comparative yttrium and rare–earth element chemistries in seawater: Marine Chemistry, 44, 121–130. [ Links ]
Byrne, R.H., Liu, X., Schijf, J., 1996, The influence of phosphate coprecipitation on rare earth distributions in natural waters: Geochimica et Cosmochimica Acta, 60, 3341 – 3346. [ Links ]
Congeevaram, S., Dhanarani, S., Park, J., Dexilin, M., Thamaraiselvi, K., 2007, Biosorption of chromium and nickel by heavy metal resistant fungal and bacterial isolates: Journal of Hazardous Materials, 146, 270–277. [ Links ]
Delecat, S., 2005, Porifera–microbialites of the Lower Liassic (Northern Calcareous Alps) – Re–settlement strategies on submarine mounds of dead Rhaetian reefs by ancestral benthic communities: Göttingen, Alemania, Georg–August–Universität Göttingen, tesis doctoral, 114 p. [ Links ]
Dickson, J.A.D., 1965, A modified staining technique for carbonates in thin section: Nature, 205, 587. [ Links ]
Dos Santos, P.C., Dean, D.R., 2008, A newly discovered role for iron–sulfur clusters: Proceedings of the National Academy of Sciences, 105, 11589–11590. [ Links ]
Elderfield, H., 1988, The oceanic chemistry of the rare–earth elements: Philosophical Transactions of the Royal Society of London A, 325, 105–126. [ Links ]
Elderfield, H., Greaves, M.J., 1982, The rare–earth elements in sea–water: Nature, 296, 214–219. [ Links ]
Ertseva, L.N., Tsymbulov, L.B., 2002, On transformations of iron, nickel and cobalt arsenides and sulfoarsenides under thermal treatment in various media: Russian Journal of Applied Chemistry, 75, 1547–1556. [ Links ]
Flügel, E., 2004, Microfacies of carbonate rocks. Analysis, interpretation and application: Berlin–Heidelberg, Germany, Springer, 976 p. [ Links ]
Fraústro da Silva, J.J.R., Williams, R.J.P., 2001, The Biological Chemistry of the Elements: Oxford, U.K., Clarendon Press, 575 p. [ Links ]
Fürsich, F.T., 2000, Die Cassianer Schichten, en Meischner, D., Pinna, G. (eds.), Europäische Fossillagerstätte: Berlin–Heidelberg, Alemania, Springer, 79–82. [ Links ]
Fürsich, F.T., Wendt, J., 1977, Biostratinomy and Palaeoecology of the Cassian Formation (Triassic) of the Southern Alps: Palaeogeography, Palaeoclimatology, Palaeoecology, 22, 257–323. [ Links ]
German, C.R., Holliday, B.P., Elderfield, H., 1991, Redox cycling of rare earth elements in the suboxic zone of the Black Sea: Geochimica et Cosmochmica Acta, 55, 3553–3558. [ Links ]
Grandjean–Lécuyer, P., Feist, R., Albarède, F., 1993, Rare earth elements in old biogenic apatites: Geochimica et Cosmochimica Acta, 57, 2507–2514. [ Links ]
Haese, R.R., 2007, The reactivity of iron, en Schulz, H.D., Zabel, M. (eds.), Marine Geochemistry: Berlin–Heidelberg, Alemania, Springer, 241–270. [ Links ]
Halverson, G.P., Hoffman, P.F., Schrag, D.P., Kaufman, A.J., 2002, A major perturbation of the carbon cycle before the Ghaub glaciation (Neoproterozoic) in Namibia: Prelude to snowball Earth?: Geochemistry, Geophysics, Geosystems, 3, 1035. [ Links ]
Hatch, J.R., Leventhal, J.S., 1992, Relationship between inferred redox potential of the depositional environment and geochemistry of the Upper Pennsylvanian (Missourian) Stark Shale Member of the Dennis Limestone, Wabaunsee County, Kansas, U.S.A.: Chemical Geology, 99, 65–82. [ Links ]
Hebbeln, P., Eitinger, T., 2004, Heterologous production and characterization of bacterial nickel/cobalt permeases: FEMS Microbiology Letters, 230, 129 – 135. [ Links ]
Hühne, C., 2005, Geochemie Porifera Reicher Mud–Mounds und Mikrobialithe des Mittel– und Oberdevons (Westaustralien, Nordfrankreich): Göttingen, Alemania, Universidad de Göttingen, tesis doctoral, 133 p. [ Links ]
Jasionowski, M., 2004, Geochemistry of the Sarmatian (Middle Miocene) reefal carbonates of the medobory region (Paratethys, western Ukraine): paleoenvironmental implications (resumen), en 23rd IAS Meeting of Sedimentology: Coimbra, Portugal, International Association of Sedimentologists, 152. [ Links ]
Jones, B., Manning, D.A.C., 1994, Comparison of geochemical indices used for the interpretation of paleoredox conditions in ancient mudstones: Chemical Geology, 111, 111–129. [ Links ]
Jørgensen, B.B., Kasten, S., 2006, Sulfur cycling and methane oxidation, en Schulz, H.D., Zabel, M. (eds.), Marine Geochemistry: Berlin–Heidelberg, Springer, 271–310. [ Links ]
Kamber, B.S., Webb, G.E., 2001, The geochemistry of late Archaean microbial carbonate: Implications for ocean chemistry and continental erosion history: Geochimica et Cosmochimica Acta, 65, 2509–2525. [ Links ]
Kamber, B.S., Webb, G.E., 2007, Transition metal abundances in microbial carbonate: A pilot study based on in situ LA–ICP–MS analysis: Geobiology, 5, 375–389. [ Links ]
Kappler, U., Bennett, B., Rethmeier, J., Schwartz, G., Deutzmann, R., McEwan, A.G., Dahl, C., 2000, Sulfite: Citochrome c–oxidoreductase from Thiobacillus novellus Purification, characterization, and molecular biology of a heterodimeric member of the sulfite oxidase family: The Journal of Biological Chemistry, 275, 13202–13212. [ Links ]
Korte, C., Kozur, H., Veizer, J., 2005, δ13C and δ18O values of Triassic brachiopods and carbonate rocks as proxies for coeval seawater and palaeotemperature: Palaeogeography, Palaeoclimatology, Palaeoecology, 226, 287–306. [ Links ]
Krüger, M., Meyerdierks, A., Glöckner, F.O., Amann, R., Widdel, F., Kube, M., Reinhardt, R., Kahnt, J., Böcher, R., Thauer, R.K., Shima, S., 2003, A conspicuous nickel protein in microbial mats that oxidizes methane anaerobically: Nature, 426, 878 – 881. [ Links ]
Laghi G.F., Martinelli, G., Russo, F., 1984, Localization of minor elements by EDS microanalysis in aragonitic sponges from the St. Cassian Beds, Italian Dolomites: Lethaia, 17, 133 – 138. [ Links ]
Lewan, M.D., 1984, Factors controlling the proportionality of vanadium to nickel in crude oils: Geochimica et Cosmochimica Acta, 48, 2231–2238. [ Links ]
Lowenstein, T.K., Timofeeff, M.N., Brennan, S.T., Hardie, L.A., Demicco, R.V., 2001, Oscillations in Phanerozoic seawater chemistry: Evidence from fluid inclusions: Science, 294, 1086 – 1088. [ Links ]
Mathews C.K., Van Holde, K.E., Ahern, K.G., 1999, Biochemistry: San Francisco, E.U.A., Addison Wesley, 1190 p. [ Links ]
McLennan, S., 1989, Rare earth elements in sedimentary rocks: Influence of provenance and sedimentary processes, en Lipin, B.R., McKay, G.A. (eds.), Geochemistry and Mineralogy of Rare Earth Elements: Reviews in Mineralogy, 21, 169–200. [ Links ]
Michard, A., Albarède, F., 1986, The REE content of some hydrothermal fluids: Chemical Geology, 55, 51–60. [ Links ]
Morse, J.W., McKenzie, F.T., 1990, Geochemistry of sedimentary carbonates: Developments in Sedimentology 48: Nueva York, E.U.A., Elsevier Science, 724 p. [ Links ]
Moser, V.C., McGee, J.K., Ehman, K.D., 2009, Concentration and persistence of tin in rat brain and blood following dibutyltin exposure during development: Journal of Toxicology and Environmental Health Part A, 72, 47–52. [ Links ]
Müller Wille, S., Reitner, J., 1993, Palaeobiological Reconstructions of selected sphinctozoan sponges from the Cassian Beds (Lower Carnian) of the Dolomites (Northern Italy): Berliner geowissenschaftliche Abhandlungen, 9, 253–281. [ Links ]
Nagarajan, R., Sial, A.N., Armstrong–Altrin, J.S., Madhavaraju, J., Nagendra, R., 2008, Carbon and oxygen isotope geochemistry of Neoproterozoic limestones of the Shahabad Formation, Bhima basin, Karnataka, southern India: Revista Mexicana de Ciencias Geológicas, 25, 225–235. [ Links ]
Norton, T.A., Melkonian, M., Andersen, R.A., 1996, Algal biodiversity: Phycologia, 35, 308 – 326. [ Links ]
Nothdurft L.D., Webb, G.E., Kamber, B.S., 2004, Rare earth element geochemistry of Late Devonian reefal carbonates, Canning Basin, Western Australia: Confirmation of a seawater REE proxy in ancient limestones: Geochimica et Cosmochimica Acta, 68, 263–283. [ Links ]
Nützel, A., Joachimski, M., López Correa, M., 2009, Seasonal climatic fluctuations in the Late Triassic tropics – high–resolution oxygen isotope records from aragonitic bivalve shells (Cassian Formation, Northern Italy): Palaeogeography, Palaeoclimatology, Palaeoecology, 285, 194–204. [ Links ]
Olivier, N., Boyet, M., 2006, Rare earth and trace elements of microbialites in Upper Jurassic coral and sponge microbialite reefs: Chemical Geology, 230, 105–123. [ Links ]
Piepgras, D.J., Jacobsen, S.B., 1992, The behavior of rare earth in seawater: precise determination of variations in the North Pacific water column: Geochimica et Cosmochimica Acta, 56, 1851–1862. [ Links ]
Pingitore, N.E., 1978, The behavior of Zn2+ and Mn2+ during carbonate diagenesis: theory and applications: Journal of Sedimentary Research, 48, 799–814. [ Links ]
Prasada Rao, T., 1996, Modern carbonates, tropical, temperate, polar. Introduction to sedimentology and geochemistry: Howrah, Tasmania, Australia, University of Tasmania Press, 206 p. [ Links ]
Prokoph, A., Shields, G.A., Veizer, J., 2008, Compilation and time–series analysis of marine carbonate δ18O, δ13C, 87Sr/86Sr and δ34S databases through Earth history: Earth Science Reviews, 87, 113–134. [ Links ]
Rech, H., 1998, Geobiologie der sogenannten "Cipit–Kalke" der Beckenfazies der Cassianer–Schichten, S' St. Kassian, Dolomiten: Göttingen, Alemania, Universidad de Göttingen, tesis de maestría, 133 p. [ Links ]
Reitner, J., 1987, A new calcitic sphinctozoan sponge belonging to the Demospongiae from the Cassian Formation (Lower Carnian; Dolomites, Northern Italy) and its phylogenetic relationship: Geobios, 20, 571–589. [ Links ]
Reitner, J., 1992, "Coralline Spongien" der Versuch einer phylogenetisch–taxonomischen Analyse: Berliner geowissenschaftliche Abhandlungen E, 1, 1–352. [ Links ]
Reitner, J., 1993, Modern cryptic microbialite/metazoan facies from Lizard Island (Great Barrier Reef, Australia). Formation and concepts: Facies, 29, 3–40. [ Links ]
Reitner, J., Engeser, T., 1989, Chaetosclera klipsteini n. gen. n. sp. (Halichondriida, Demospongiae) aus dem Unterkarn der Cassianer–Schichten (Dolomiten, Italien): Mitteilungen aus dem Geologisch– Paläontologischen Institut der Universität Hamburg, 68, 159–165. [ Links ]
Rimmer, S., 2004, Geochemical paleoredox indicators in Devonian – Mississippian black shales, Central Appalachian Basin (USA): Chemical Geology, 206, 373 – 391. [ Links ]
Robson, R.L., Eady, R.R., Richardson, T.H., Miller, R.W., Hawkins, M., Postgate, J.R., 1986, The alternative nitrogenase of Azotobacter chroococcum is a vanadium enzyme: Nature, 322, 388–390. [ Links ]
Russo, F., Neri, C., Mastandrea, A., Baracca, A., 1997, The Mud Mound nature of the Cassian Platform margins of the Dolomites. A case history: the Cipit boulders from Punta Grohmann (Sasso Piatto Massif, northern Italy): Facies, 36, 25–36. [ Links ]
Russo, F., Neri, C., Mastandrea, A., Laghi, G., 1991, Depositional and diagenetic history of the Alpe di Specie (Seelandalpe) fauna (Carnian, northeastern Dolomites): Facies, 25, 197–210. [ Links ]
Sánchez–Beristain, J.F., 2010, Paleoecological and geochemical studies on sponge/microencruster –bearing communities contained in selected Cipit Boulders from the St. Cassian Formation (Lower Carnian, Upper Triassic) of the Dolomites, northeastern Italy: Göttingen, Alemania, Universidad de Göttingen, tesis doctoral, 146 p. [ Links ]
Sánchez–Beristain, J.F., Schäfer, N., Simon, K., Reitner, J., 2011, New geochemical method to characterise microbialites from the St. Cassian Formation, Dolomites, Northeastern Italy: Lecture Notes in Earth Sciences, 131, 435–451. [ Links ]
Sandberg, P.A., 1983, An oscillating trend in Phanerozoic non–skeletal carbonate mineralogy: Nature, 305, 19–22. [ Links ]
Schäfer, N., 2006, Ni–Anomalien in Cold–Seep Karbonaten aus dem nordwestlichen Schwarzen Meer: Ist Ni ein kritisches Element bei der anaeroben Oxidation von Methan?: Göttingen, Alemania, Universidad de Göttingen, tesis de maestría, 80 p. [ Links ]
Scherer, M., 1977, Preservation, alteration and multiple cementation of aragonitic skeletons from the cassian beds (U. Triassic, Southern Alps): petrographic and geochemical evidence: Neues Jahrbuch für Geologie und Paläontologie Abhandlungen, 154, 213–262. [ Links ]
Sugarman, B., 1983, Zinc and infection: Clinical Infectious Diseases, 5, 137–147. [ Links ]
Tucker, M.D., Barton, L.L., Thomson, B.M, 1997, Reduction and immobilization of molybdenum by Desulfovibrio desulfuricans: Journal of Environmental Quality, 26, 1146–1152. [ Links ]
Valbuena, O., Pereira, J.C., Daza, R., González, F., Hernández, A., Mora, M., Morales, G., Medina, L., 2010, Actividades sulforeductora y desulfurizadora por bacterias termófilas aisladas de lodos hidrotermales de Las Trincheras, Venezuela: Interciencia, 35, 414–420. [ Links ]
Van Kranendonk, M.,Webb, G., Kamber, B.S., 2003, Geological and trace element evidence for a marine sedimentary environment of deposition and biogenicity of 3.45 Ga stromatolitic carbonates in the Pilbara Craton, and support for a reducing Archaean ocean: Geobiology, 1, 91–108. [ Links ]
Veizer, J., 1983, Chemical diagenesis of carbonates. Theory and application of trace element technique, en Arthur, M.A., Anderson, T.F., Kaplan, I.R., Veizer, J., Land, L.S. (eds.), Stable isotopes in sedimentary geology: Dallas, Texas, E.U.A., Society of Economic Paleontologists and Mineralogists Short Courses 10, 1–100. [ Links ]
Veizer, J., Ala, D., Azmy, K., Bruckschen, P., Buhl, D., Bruhn, F., Carden, G.A.F., Diener, A., Ebneth, S., Godderis, Y., Jasper, T., Korte, C., Pawellek, F., Podlaha, O.G., Strauss, H., 1999, 87Sr/86Sr, δ13C and δ18O evolution of Phanerozoic seawater: Chemical Geology, 161, 59–88. [ Links ]
Voet, D., Voet, J.G., 2010, Biochemistry: Nueva York, E.U.A., John Wiley and Sons, 1520 p. [ Links ]
Von Hauer, F., 1858, Erläuterungen zu einer geologischen Übersichtskarte der Schichtgebirge der Lombardei: Jahrbuch der Kaiserlich Königlich Geologischen Reichsanstalt, 9, 445–496. [ Links ]
Von Richthofen, F., 1860, Geognostische beschreibung der umgegend von Predazzo, Sanet Cassian und der Seisser Alpe in Süd–Tyrol: Gotha, Turingia, Alemania, J.Perthes, 327 p. [ Links ]
Wang, Y., Tong, J., Wang, J., Zhou, X., 2005, Calcimicrobialite after end–Permian mass extinction in South China and its paleoenvironmental significance: Chinese Science Bulletin, 50, 665–671. [ Links ]
Webb, G., Kamber, B.S., 2000, Rare earth elements in Holocene reefal microbialites: A new shallow seawater proxy: Geochimica et Cosmochimical Acta, 64, 1557 – 1565. [ Links ]
Wedepohl K.H., 1995, The composition of the continental crust: Geochimica et Cosmochimica Acta, 59, 1217 – 1232. [ Links ]
Wendt, J., Fürsich, F.T., 1980, Facies analysis and paleogeography of the Cassian Formation, Triassic, Southern Alps: Rivista Italiana de Paleontologia e Stratigrafia, 85, 1003 – 1028. [ Links ]
Wiedner, E.A., 2004, Laborexperimente zur kinetischen Fraktionierung stabiler Isotope bei der Sinterbildung: Heidelberg, Alemania, Universidad de Heidelberg, tesis doctoral, 94 p. [ Links ]
Yoshioka, H., Asahara,Y., Tojo, B., Kamakami, S., 2003, Systematic variations in C, O and Sr isotopes and elemental concentrations in Neoproterozoic carbonates in Namibia: implications for a glacial to interglacial transition: Precambrian Research, 124, 69–85. [ Links ]
Zankl, H., 1993, The origin of High–Mg–Calcite microbialites in cryptic habitats of Caribbean coral reefs – their dependence on light and turbulence: Facies, 29, 55–59. [ Links ]














