Introducción
La agricultura convencional desarrollada en décadas recientes se caracteriza por el uso intensivo de fertilizantes y pesticidas, para aumentar la producción agrícola. Esto degrada los suelos y altera sus propiedades físicas, químicas y biológicas, porque la mayoría son altamente tóxicos, alteran las comunidades microbianas y contaminan el suelos y el agua superficial y subterránea (Jiménez, 2011)[3].
La alternativa actual para optimizar los cultivos son los productos biológicos o biofertilizantes. La incorporación al sistema productivo de organismos seleccionados por sus funciones en diversos procesos biológicos. Entre los elementos más valiosos en la producción de estos biofertilizantes están los microorganismos promotores de crecimiento vegetal, conocidos como PGPM (Plant Growth-Promoting Microorganism), aislados de ambientes diversos, con la habilidad potencial de afectar positivamente el crecimiento de las plantas (Elein et al., 2005; Bashan et al., 2014).
Entre los PGPR más utilizados está Pseudomonas fluorescens, que estimula el crecimiento de la planta mediante producción de antibióticos, con lo que evita enfermedades a la planta por otras bacterias y hongos patógenos. También acelerara la germinación de las semillas y el crecimiento de las plantas por la síntesis de hormonas, como auxinas, giberelinas y citoquininas, y otras sustancias, como aminoácidos y promotores específicos del crecimiento (Uribe et al., 1999).
Algunas bacterias son versátiles y pueden presentar varios mecanismos, es el caso de Bacillus subtilis que produce auxinas que promueven el crecimiento de tomate e inducen resistencia sistémica contra Fusarium oxysporum; este provoca marchitez y pudrición de las raíces (Gupta et al., 2000).
Diferentes especies de Trichoderma se utilizan para el control de hongos patógenos del suelo, principalmente de los géneros Phytophthora, Rhizoctonia, Sclerotium, Colletotrichum, Pythium y Fusarium, además tienen efecto promotor de crecimiento por la producción de fitohormonas y solubilización de fosfatos (Cubillos-Hinojosa, 2009).
Ciertos microorganismos, propios de la rizósfera, favorecen el desarrollo radicular, la fijación del N atmosférico, la solubilización del P del suelo y la producción de ácidos orgánicos y metabolitos secundarios que actúan análogamente a las fitohormonas, por lo que influyen directamente en la disponibilidad de nutrientes y en la estimulación del crecimiento vegetal. Este es el caso de Pseudomonas spp. y Trichoderma spp. (Puente et al., 2010; Cano, 2011). Los biofertilizantes a base de esos esos microorganismos minimizan notablemente el impacto ambiental que producen los fertilizantes químicos y mejoran el rendimiento de los cultivos, por lo que pueden limitar el uso de los productos tóxicos (Hernandez-Leal et al., 2011; Patiño-Flores y Sanclemente-Reyes, 2014).
La calidad del suelo la define su capacidad para mantener un ecosistema natural o modificado, sostener la productividad vegetal y animal, o mejorar la calidad de agua y aire, y contribuir a la salud humana y habitabilidad. La calidad del suelo la influencian los procesos microbianos que ocurren en él; por lo tanto, la permanencia de la estructura de la comunidad microbiana puede ser indicador de la degradación o empobrecimiento del suelo (Abril, 2003). Los microorganismos expresan variedad de funciones y versatilidad bioquímica, que incluye oxidación, reducción y precipitación de los elementos en el suelo (Atlas, 1984).
Una de las fuentes de Ca usada ahora, por su abundancia y costo bajo, es el yeso agrícola (Ca2SO4). Este se recomienda como fertilizante (fuente de Ca y S), enmienda que facilita el desplazamiento del Na de los sitios de intercambio, como mejorador de impedimentos físicos (encostrado o compactación), y acidulante temporal, que favorecen el desarrollarse de microorganismos (Gambaudo, 2006). En el primer caso aporta S y Ca; en el segundo caso, facilita el desplazamiento del Na de los sitios de intercambio y mejora impedimentos físicos (encostrado y compactación) (Gambaudo, 2006).
La necesidad de mecanismos que eleven la productividad del campo ha impulsado la búsqueda de métodos alternativos al control químico para enfermedades agrícolas, con menos riesgo ambiental, sanitario y para la salud humana. Esto es ahora un gran reto para la agricultura y su desarrollo. El objetivo de este estudio fue evaluar el potencial del yeso agrícola, combinado con microorganismos promotores de crecimiento (B. cereus, B. subtilis, Pseudomonas fluorescens y Trichoderma harzianum) aplicados al suelo, mediante análisis microbiológico, nutrimental y variables fisiológicas y de rendimiento en papa.
Materiales y métodos
Los tratamientos experimentales se realizaron en el Centro Experimental y Transferencia de Tecnología (CETT-910), del Instituto Tecnológico de Sonora (Block 910 del Valle del Yaqui, Sonora, México). El diseño experimental fue completamente al azar simple con tres tratamientos, área experimental útil de 2 m2 y 10 repeticiones por tratamiento (elegidas al azar). Las unidades experimentales fueron 30 (Cuadro 1). La comparación de medias o prueba de múltiples rangos se evaluó por el método LSD (p≤0.05), con el software Statgraphics Centurión XVI.
Cuadro 1 Tratamientos evaluados con los microorganismos promotores del crecimiento vegetal combinado con yeso agrícola en el cultivo de papa (Solanum tuberosum L.) en casa sombra.
| Tratamiento | Descripción |
| T1 | Testigo |
| T2 | 40 kg ha-1 de Ca + Trichoderma harzianum |
| T3 | 40 kg ha-1 de Ca + (Bacillus subtilis, Bacillus cereus, Pseudomonas fluorescens, Trichoderma harzianum) |
La siembra se hizo con tubérculos-semilla, variedad Atlantic, densidad de cinco tubérculos por metro lineal, en camas separadas 1.50 m y longitud de 30 m, en casa sombra. Las plantas se fertilizaron con 250-100-250 N:P:K, con urea, nitrato de potasio y ácido fosfórico agrícola; el riego fue semanal y por goteo.
Los tratamientos incluyeron aplicación de 108 UFC mL-1 por m2 mezcladas con 0.5 kg de yeso agrícola (equivalente a 40 kg de Ca por ha), se aplicaron a 150 m2 del cultivo, en seis dosis, desde la emergencia, cada 15 d y a través del sistema de riego.
Variables fisiológicas y de rendimiento evaluadas
Altura de planta
La altura (cm) de la planta se midió con un flexómetro, de la base del tallo al ápice, cada semana desde la primera aplicación de los tratamientos.
Índice de contenido de clorofila
El índice del contenido de clorofila se midió cada semana en la hoja fisiológicamente madura, de las 11 a las 14 h, con Spad 502 (Minolta), y se reportó en unidades de clorofila (UC).
Rendimiento y número de tubérculos
El rendimiento fue el peso total de los tubérculos por tratamiento y se extrapoló a t ha-1. El número de tubérculos representó a las unidades experimentales por tratamiento.
Incidencia de Fusarium y Streptomyces
La incidencia de dos de los microorganismos patógenos más comunes se determinó. La identificación fue por medio del daño producido por Fusarium y Streptomyces, con base en el manual de calidad “Muestreo y análisis de papa en campo” (PEPSICO Alimentos México, 2014). Todos los tubérculos de las unidades experimentales se inspeccionaron, la relación de infectadas y sanas se obtuvo, y se reportó como porcentaje de incidencia.
Análisis nutrimental de hoja
La concentración de macronutrimentos (N, P, K, Ca y Mg) y micronutrimentos (Mn, Zn, Fe y Cu) se determinó en una muestra compuesta del tejido vegetal, en floración, con un espectrofotómetro (DR2100) y el método HACH (Alcántar y Sandoval, 1999), con modificaciones ajustadas a la naturaleza de las muestras.
Microbiología de la rizósfera
El recuento viable se hizo al inicio, a la mitad y al término del ciclo de cultivo. Una muestra de cada unidad experimental se usó para formar una muestra compuesta por tratamiento. La técnica de diluciones 10-4, 10-5 y 10-6 se utilizó para vaciado en placa, por triplicado, en los medios para B. subtilis y B. cereus (agar manitol-yema de huevo-polimixina, MYP), T. harzianum (agar dextrosa de papa) y P. fluorescens (agar aislamiento de Pseudomona F); para bacterias se mantuvieron a 30 °C y para hongos a 25 °C. El recuento se hizo después de 24-48 h y 120 h, respectivamente, con un contador manual de colonias; los resultados se reportaron como UFC g-1 de suelo (Pepper y Gerba, 2004).
Prueba de calidad de fritura de papa
La calidad de fritura se evaluó con el método usado en el laboratorio de AGROBO y con base en el manual de Muestreo y análisis de papa en campo (PEPSICO Alimentos México, 2014).
Resultados y discusión
Altura
La altura en T1, con excepción de la primera semana, fue mayor que en T2 y superó a T3 sólo en la semana 5 (Cuadro 2).
Cuadro 2 Efecto de microorganismos y yeso agrícola en altura (cm) de plantas de papa (Solanum tuberosum L.).
| Tratamientos | †S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 |
| Testigo | 19a | 43b | 61b | 76b | 87b | 86b | 86b | 86b | 93b |
| 40 kg ha-1 de Ca Trichoderma harzianum | 12a | 31a | 45a | 56a | 71a | 72a | 73a | 70a | 73a |
| 40 kg ha-1 de Ca + (Bacillus subtilis, Bacillus cereus, Pseudomonas fluorescens, Trichoderma harzianum) |
18a | 42b | 60b | 73b | 78a | 81 ab | 82ab | 79ab | 85b |
Medias con distinta letra en una columna son estadísticamente diferentes (LSD; p≤0.05). †S: semanas.
Las plantas en T2 y T3 podrían ser las más altas, por efecto de los microoorganismos del género Bacillus, promotores de crecimiento (Izzeddin y Medina, 2011), aplicados en los tratamientos, con crecimiento mayor de raíces y pelos absorbentes por la presencia de T. harzianum (Calvo y Zuñiga, 2010; Jiménez et al., 2011) y por la solubilización de grupos fosfatos por la presencia de P. fluorescens (Molina-Romero et al., 2015). Pero T1 y T3 presentaron crecimiento mayor que T2.
Índice de contenido de clorofila
T2 presentó índices mayores de clorofila que el testigo en las semanas 3, 6 y 7 y mayor a T3 sólo en la semana 8 (Cuadro 3).
Cuadro 3 Efecto de microorganismos y yeso agrícola en el contenido de unidades de clorofila en plantas de papa (Solanum tuberosum L.).
| Tratamientos | Unidades de clorofila | |||||||
| S†1 | S†2 | S†3 | S†4 | S†5 | S†6 | S†7 | S†8 | |
| Testigo | 42a | 38a | 37a | 41a | 41a | 34a | 34a | 34a |
| 40 kg ha-1 de Ca + Trichoderma harzianum | 43a | 40a | 40b | 41a | 43a | 37b | 38b | 37b |
| 40 kg ha-1 de Ca + (Bacillus subtilis, Bacillus cereus, Pseudomonas fluorescens, Trichoderma harzianum) |
43a | 40a | 41b | 42a | 42a | 36ab | 36ab | 34a |
Medias con distinta letra en una columna son estadísticamente diferentes (LSD; p≤0.05). †S: semanas.
Todos los valores estuvieron entre las 43 y 34 unidades de clorofila (Cuadro 3). Esto pudo deberse a que la fertilización con N fue adecuada. La caída de los valores hacia el final se debió a la senescencia del cultivo. Giletto et al. (2010) compararon el índice verde del cultivo de papa en dependencia del contenido de N en la planta; ellos confirmaron que la fertilización adecuada (30 a 50) con N se asocia al aumento en las unidades de clorofila.
Variables de rendimiento
Número de tubérculos
Los rendimientos mayores del número de tubérculos se obtuvieron en T2 y T3, este último superó con 51.5 % al testigo y fue ligeramente mayor que T2 (47 %) (Figura 1).
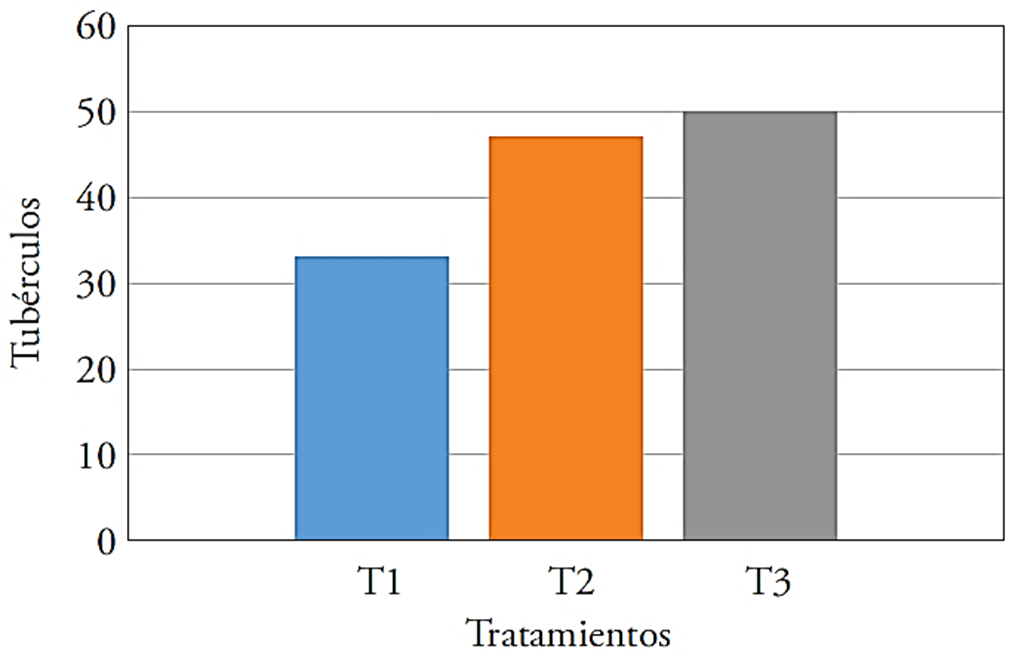
Figura 1 Número de tubérculos por tratamiento en el cultivo de papa, T1: testigo, T2: 40 kg ha-1 de Ca + T. harzianum, T3: 40 kg ha-1 de Ca + Bacillus subtilis, Bacillus cereus, Pseudomonas fluorescens, Trichoderma harzianum.
El efecto favorable de T. harzianum, B. subtilis y P. fluorescens en el desarrollo fue evidente con el número de tubérculos mayor en T2 y T3. Este efecto se debe a que los microorganismos producen hormonas de crecimiento, que favorecen el desarrollo del sistema radicular y mejoran la nutrición (Cubillos-Hinojosa et al., 2009). Pozo (1997) señaló que la presencia de hormonas de crecimiento incrementó la tuberización; por lo que T1, sin inocular, mostró número menor de tubérculos.
Rendimiento
T3 mostró rendimiento mayor (26.5 t ha-1) y superó con 49.4 % al testigo (Figura 2). El rendimiento en T3 fue el mayor. En este caso también se demostró la acción de la promoción de crecimiento de T. harzianum (Cubillos-Hinojosa et al., 2009). Puente et al. (2010) señalaron que B. cereus, B. subtilis y P. fluorescens se utilizan por su función promotora directa, basada en producción de fitohormonas y solubilizadores de P, en el aumento del rendimiento del cultivo.
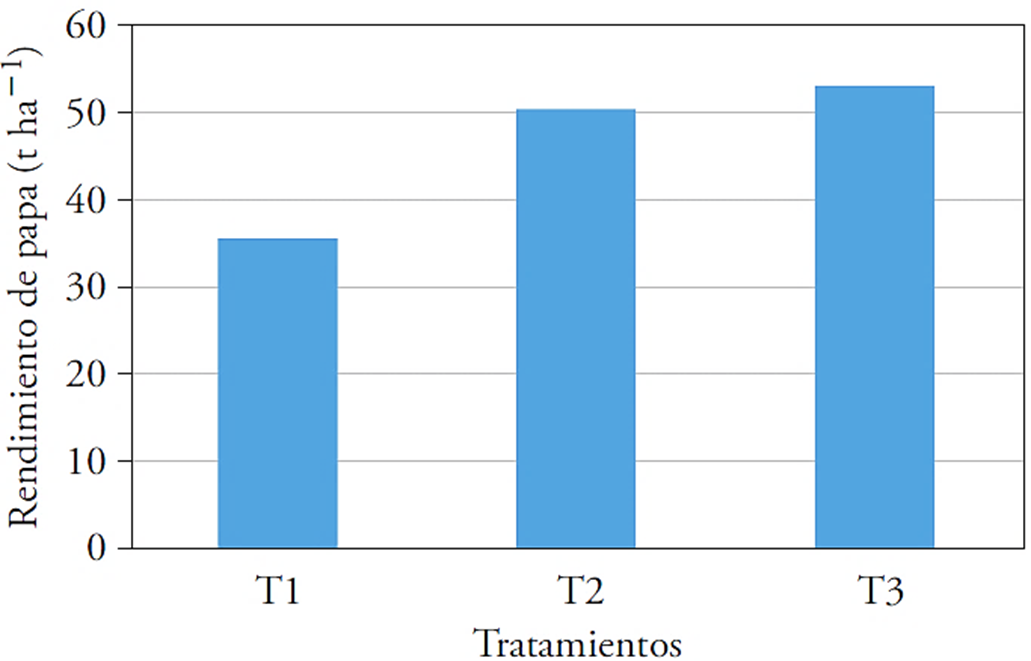
Figura 2 Efecto de microorganismos y yeso agrícola en el rendimiento de papa (t ha-1). T1: testigo 1, T2: 40 kg ha-1 de Ca + T. harzianum, T3: 40 kg ha-1 de Ca + Bacillus subtilis, Bacillus cereus, Pseudomonas fluorescens, Trichoderma harzianum.
La incidencia de Fusarium y Streptomyces en el tubérculo cosechado de las unidades experimentales fue mayor en T1, con un porcentaje de incidencia de ambos patógenos de 32.14 % y 1 %, respectivamente. Por el contrario, el T3 tuvo menos incidencia con sólo el 9 % para Streptomyces y sin presencia de Fusarium (Figura 3).
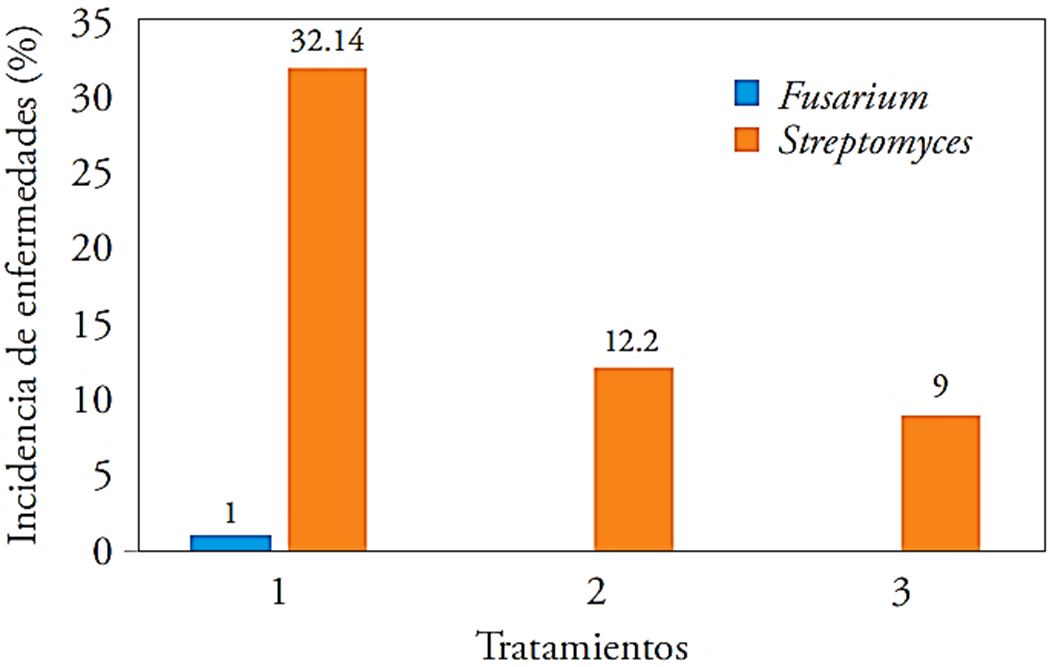
Figura 3 Incidencia de Fusarium y Streptomyces en tres tratamientos aplicados al cultivo de papa. 1: testigo, 2: 40 kg ha-1 de Ca + T. harzianum, 3: 40 kg ha-1 de Ca + B. subtilis, B. cereus, P. fluorescens, T. harzianum.
Los efectos de los microorganismos aplicados en los tratamientos fueron positivos con respecto al testigo sin recibir tratamiento, el que mejor calidad o menor incidencia de Streptomyces o Fusarium, por la acción de los microorganismos presentes en el T3 que actuaron como antagónicos para estos patógenos. Esto se puede comparar con estudios realizados donde los bacilos se utilizan como antagónicos ante microorganismos precursores de enfermedades como lo mostraron Sharga y Lyon (1998), al usar B. subtilis para inhibir el crecimiento del Pectobacterium carotovorum que causa la podredumbre blanda en la papa. Ezziyyani et al. (2004) usaron como biocontrol a Trichoderma harzianum frente a Phytophthora capsici causante de la “tristeza” en el cultivo de pimiento verde, obteniendo resultados de inhibición de hasta 65 % en macetas y 80 % en invernadero. Si a todo lo anterior, se suma que Pseudomonas spp. también se ha demostrado que tiene poder antagónico para diversos microorganismos patógenos, según Walsh et al. (2001).
Los macro y micronutrimentos en hoja se cuantificaron en valores cercanos a los promedios referenciados. Los contenidos de Cu fueron superiores a los documentados por Jones et al. (1991), debido al tratamiento preventivo con Cu(OH)2 para posibles enfermedades en el cultivo de papa. En T3 la concentración de P fue superior a los valores estándar, debido a que P. fluorescens produce metabolitos solubilizadores de P que lo hace disponible para la planta. Katiyar y Goel (2003) indicaron que la presencia de Pseudomonas aumenta los las concentraciones de P porque solubiliza los fosfatos inorgánicos. En el caso de N, la acción solubilizadora de los microorganismos permitió su absorción y transporte eficiente, lo que condujo al llenado del tubérculo, productividad alta y su concentración en el tejido foliar en los niveles documentados por Jones et al. (1991) y Gilleto et al. (2010); en este caso el índice verde, en unidades de clorofila, fue 40 (Cuadro 4).
Cuadro 4 Efecto de la aplicación de microorganismos y yeso agrícola en el contenido nutrimental de la hoja de papa (Solanum tuberosum L.).
| Tratamiento | N | P | K | Ca | Mg | Cu | Fe | Zn | Mn |
| (%) | (ppm) | ||||||||
| Testigo | 2.4 | 0.20 | 6.1 | 1.32 | 0.75 | 232 | 20 | 24 | 80 |
| 40 kg ha-1 de Ca + T. harzianum | 3.09 | 0.32 | 5.7 | 1.19 | 1.22 | 48 | 132 | 32 | 280 |
| 40 kg ha-1 de Ca + (B. subtilis, B. cereus, P. fluorescens, T. harzianum | 3.84 | 0.68 | 6.5 | 1.76 | 1.17 | 182 | 44 | 88 | 160 |
| Referencia † | 3.0-4 | 0.25-0.4 | 6.00-8.0 | 1.5-2.5 | 0.70-1.0 | 7.0-20 | 40-100 | 30-200 | 30-250 |
Análisis microbiológico del suelo de la rizósfera
El recuento viable de la microflora de cada tratamiento se realizó a los 50 y 90 d de la emergencia, y se determinó el número de microorganismos por g de peso seco. Este mostró que las condiciones ambientales y nutrimentales fueron aceptables para el desarrollo óptimo y prevalencia en el suelo rizosférico (Cuadro 5).
Cuadro 5 Microorganismos viables aplicados directo al suelo con cultivo de papa, a los 50 y 90 días después de la emergencia (UFC g-1 de suelo seco).
| Tratamiento | Cuenta de microorganismos viables (UFC g-1 de suelo) | |||
| B. Subtilis | B. Cereus | Pseudomona sp. | Trichoderma sp. | |
| Testigo | † | † | † | † |
| 40 kg ha-1 de Ca + T. harzianum | † | † | † | 1.0×104 |
| ††1.0×104 | ||||
| 40 kg ha-1 de Ca + (B. subtilis, B. cereus, P. fluorescens, T. harzianum) |
7.9×104 ††1.02×105 |
2.0×103 ††6×105 |
3.0×105 ††2.9×106 |
1.0×104 ††1.0×104 |
†No detectado; †† conteo 90 días.
Las poblaciones de microorganismos en los tratamientos en este estudio fueron similares a los de González et al. (1999), cuantificados en rizosfera, de 4.3×105±17 460 (microorganismos g-1 de suelo seco) de papas tratadas con conidias de T. harzianum.
Reinoso et al. (2006) indicaron que las bacterias del género Bacillus integran un grupo con efecto inhibitorio importante en el crecimiento de P. carotovorum, que es el agente causal de la pudrición blanda de la papa. Sharga y Lyon (1998) obtuvieron resultados similares de inhibición de este patógeno con Bacillus subtilis. Por lo tanto, es importante que estos microorganismos estén presentes en la rizósfera.











 text in
text in 


