Introducción
México es un país con amplio potencial para la producción y exportación de flores de corte y plantas en maceta: posee climas satisfactorios para el cultivo de diferentes especies, cuenta con buena oferta de mano de obra, un gran mercado y cercanía al gran consumidor que es Estados Unidos de América (Tejeda y Arévalo, 2012; Hernández, 2007; van Vliet, 2004). Sin embargo, el potencial del país es mermado por el atraso tecnológico, falta de organización, mal aspecto laboral del país y las bajas exportaciones (Tejeda-Sartorius y Arévalo-Galarza, 2012; van Vliet, 2004).
En las flores de corte las causas comunes de senescencia son la inhibición de la absorción de agua, la deshidratación por mal manejo, el bajo abastecimiento de carbohidratos para sostener la respiración, la presencia de etileno y otros eventos metabólicos asociados (Halevy y Mayak, 1981). La contaminación microbiana en la base de los tallos es la principal causa del bloqueo de los vasos del xilema, lo cual reduce la absorción de agua y en consecuencia la longevidad de los tallos florales (Zagory y Reid, 1986).
Algunos requerimientos necesarios para la sobrevivencia de las flores de corte son la calidad y la acidez (pH 3-5) del agua, los cuales afectan el crecimiento microbiano (Hayat et al., 2012). Las soluciones florero, contribuyen a alargar la vida de las flores cortadas. Estas soluciones tienen varias funciones: reducir la síntesis de etileno; inhibir el desarrollo de microorganismos patógenos; mantener el equilibrio hídrico y respiratorio; contribuir a la conservación del color e inducir la apertura de los botones florales (Halevy y Mayak, 1981).
La plata (Ag+) se usa en soluciones preservativas como tiosulfato de plata o nitrato de plata, debido a sus propiedades antimicrobianas y para inhibir producción de etileno en flores de corte prolongando la vida de florero; pero el desecho de estas soluciones en las empacadoras de flores es un daño potencial al ambiente, por lo que se debe encontrar alternativas para reducir su uso. Los materiales nanoestructurados tienen al menos una dimensión en escala nanométrica (1-100 nm) entre los que podemos encontrar a las nanopartículas, nanobarras, nanoalambres, y películas delgadas (Cao y Wang, 2011). Cuando el tamaño de la partícula decrece hay un aumento en la fracción del volumen de los límites de la partícula o intercaras y uniones triples, con el aumento de la densidad de defectos, los átomos en los límites de las partículas y las uniones triples comienzan a compararse con los que residen en los núcleos (Murty et al., 2013). Debido a la alta relación superficie/volumen, entre otras propiedades químicas y físicas, las nanopartículas son eficientes por el contacto con microrganismos lo que las hace muy efectivas como germicidas (Monge, 2009), por lo que las concentraciones de plata son mucho menores cuando se usan nanoparticulas que cuando se usa sales de plata. Además, la biosíntesis de nanopartículas consiste en la producción de NPs usando sistemas biológicos, el cual se basa en la propiedad reductora de las biomoléculas y este método de síntesis se considera ecoamigable (Sadowski, 2010), ya que los reactivos para síntesis (extracto vegetal) no son tóxicos ni requieren sustancias estabilizadoras, a diferencia de los métodos químicos y físicos. (Iravani, 2014). Varios extractos acuosos de plantas se usan en la reducción de NPs de Ag, como Phlomis sp. (Allafchian et al., 2016), Pteris tripartita (Baskaran et al. 2016), Acacia leucophloea (Murugan et al., 2014) y Opuntia ficus-indica (Rico-Moctezuma et al., 2010) para la biosíntesis de NPs de Ag.
El tamaño y la morfología de las nanoestructuras depende de la interacción de las biomoléculas con los iones metálicos (Makarov et al., 2014; Shiv Shankar et al., 2004). Compuestos fenólicos como flavonoides y antocianinas contienen grupos hidroxilos que poseen fuerte habilidad para enlazar iones de plata e involucrarlos en la biosíntesis de nanopartículas y funcionar como agente reductor de iones de plata (Ag+) a NPs de Ag (Ag0) (Jain et al., 2009; Solgi y Taghizadeh, 2012). Los NPs de Ag originadas con métodos químicos se usan en soluciones florero o pulso en experimentos. El efecto biocida de las NPs de Ag se ha investigado en soluciones florero y pulso (Nemati et al., 2013; Solgi et al., 2009), pero poco se conoce del efecto de la sacarosa y ácido cítrico en soluciones florero preparadas con NPs de Ag como agente microbicida.
El objetivo de la presente investigación fue estudiar el efecto de sacarosa y ácido cítrico en soluciones preservativas adicionadas con NPs de Ag sintetizadas con extractos de Camellia sinensis en la vida florero, población bacteriana, apertura floral, transpiración y relaciones hídricas de Rosa hybrida cultivar Freedom.
Materiales y Métodos
Biosíntesis de nanopartículas de plata
El extracto vegetal se obtuvo mediante la ebullición (95 °C) por 5 min de 2 g de te verde Lagg®. (Camellia sinensis) en 100 mL de agua desionizada, se enfrió a 22 °C y se filtró con papel Whatman No. 4. De una solución 10 mM de AgNO3 (Sigma Aldrich de México, ACS ≥ 99.0 %) preparada con agua desionizada, se tomaron 5 mL, se adicionaron 3 mL de extracto acuoso de Camellia sinensis, y después la solución se aforó a 15 mL con agua desionizada (modificación de Carrillo, 2014 y Nakhjavani et. al., 2017) y se expuso 5 min a la luz solar.
Caracterización de las NPs de Ag
La formación de las NPs se evaluó con espectroscopia (UV-vis) en un Espectrofotómetro HP 845x UV-visible System en un rango de 350 a 700 nm, para verificar la presencia del plasmón de resonancia superficial (PRS). La estabilidad en el tiempo de las NPs se verificó a 1 h, 2h, 3 h, 4 h, 5 h, 24 h, 48 h, 72 h, 5 d, 12 d, 30 d, 60 d, 90 d, 130 d, 160 d, 200 d, y 9, 10, 11, 12, 13 y 14 meses. La morfología y dimensiones de las NPs Ag se estudiaron con un Microscopio Electrónico de Transmisión (MET, Tecnai 2 Spirit, ThermoFisher-Fei Copany), en la modalidad de campo claro, en x150,000 y x300,000 aumentos y a 120 kV. El diámetro mayor (DMa) y menor (DMe) se midió en 251 partículas con el procesador de imágenes TIA 4.7 SP3 (Tecnai: Imagining & Analysis, USA) para obtener el diámetro promedio y el índice de redondez (IR= DMa/DMe).
Material biológico y establecimiento del experimento
Tallos de Rosa hybrida cv. Freedom se obtuvieron del invernadero comercial de la empresa “Flores Selectas de Tequexquinahuac”, S. de P R. de R. L. (19°28'51.26"N, 98°50'23.03"O), en Tequexquinahuac, Texcoco, Estado de México. Los tallos florales se cortaron el mismo día, con un índice de cosecha 2 de acuerdo con De la Cruz et al., (2015) y se usaron sin recibir ningún tratamiento postcosecha. Los tallos se ajustaron a 35 cm ±2 de longitud y 6 hojas.
En un estudio preliminar la concentración de 1 ppm de NPs mostró ser la más eficiente para reducir la obstrucción del tejido vascular y la población bacteriana en la solución preservativa, por lo cual esta concentración se uso en el presente estudio. Las soluciones se prepararon con agua destilada a partir de una solución con 1 ppm de NPs de Ag, con y sin sacarosa (2 %) y dos pH (5.8 y 3.4) por la adición de ácido cítrico. El tratamiento testigo fue agua destilada pH 5.6.
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar con los siguientes tratamientos: 1) 1 ppm NPs de Ag, 2) 1 ppm NPs de Ag + 2% sacarosa (pH 6), 3) 1 ppm NPs de Ag +ácido cítrico (pH 3), 4) 1 ppm NPs de Ag + ácido cítrico+ 2% sacarosa, y 5) testigo (agua destilada, pH 6). La unidad experimental fue un tallo floral colocado en un florero (250 mL) con 200 mL de solución preservativa, con 15 repeticiones por tratamiento. Los tallos se colocaron en un cuarto a 25 ± 2 ºC y 60 % de humedad relativa y se cortaron 2 cm en la base los días 4 y 9. Los floreros se cubrieron con parafilm para evitar la evaporación. Los resultados se analizaron con un ANDEVA y las medias de los tratamientos se compararon con la prueba de Tukey (p ≤ 0.05) con el software SAS System 9.0.
Variables evaluadas
El consumo de agua se evaluó cada día con una balanza digital (Setra, S1-2000, USA), para calcular el volumen (mL) de agua consumida por el tallo. El cambio de peso fresco se obtuvo mediante la diferencia entre el peso fresco inicial (PF0) y el peso fresco a las 24 h (PF1) x 100 hasta el término de la vida de florero. La vida de florero (d) o longevidad se midió al inicio del experimento hasta la senescencia de los tallos, la cual se determinó considerando la presencia de alguna de las siguientes características: marchitez de los pétalos, oscurecimiento de ≥ 30 % del borde de los pétalos externos, doblamiento de cuello y peso relativo del 85 % (Hernández et al., 2009). La apertura floral y la apertura floral máxima se evaluó con la medición diaria del diámetro del botón (mm) con un vernier digital (Trupper, México). El conteo bacteriano (Log 10 CFU mL-1) de la solución preservativa se midió el tercer y séptimo día en 5 floreros por tratamiento por fecha, para lo cual se usaron placas 3MTM PetrifilmTM (3M MEXICO S.A. DE C.V.); para ello se depositó 1 mL de solución florero por placa y después se incubaron a 22 °C por 24 h, en condiciones asépticas. En los casos de presentarse excesivas colonias bacterianas, la solución se diluyó 1:10 y 1:20 con agua destilada según el caso.
Resultados y Discusión
Caracterización de nanopartículas
La formación de NPs de Ag con extracto de C. sinensis se observó por el cambio de coloración de la solución coloidal de amarillo a café rojizo. Estas observaciones coinciden con las realizadas durante la síntesis de NPs de Ag con Chenopodium ambrosioides (Carrillo et al., 2014). Los polifenoles en el extracto de té verde son responsables de la reducción y estabilización o “capping” de nanopartículas de Ag y Au (Sun et al., 2014; Loo et al., 2012; Konwar Boruah et al., 2012; Kamal et al., 2010). Brahmachari et al. (2014) sugieren que en Oncimum sanctum el eugenol es el compuesto químico predominante, por lo que bajo radiación solar el enlace fenólico O-H se somete a escisión homolítica para formar un radical que eventualmente transfiere su electrón al ión plata (Ag+) para formar NPs de Ag. Los espectros de absorción UV-Vis proporcionan información sobre las propiedades ópticas dependientes del tamaño, la distribución y las propiedades superficiales de las NPs metálicas (Ider et al., 2016).
Con el método de biosíntesis con 5 mL de AgNO3 10 mM + 3 mL de extracto acuoso de Camellia sinensis el pico de absorción se encontró en los 436.8±2.154 nm desde la primera hora de reacción, el cual aumentó en el tiempo, y la mayor absorbancia se obtuvo en el mes 14 (Figura 1), lo cual indica un aumento en la cantidad de NPs de Ag sintetizadas en el tiempo (Carrillo et al., 2014). La amplitud del pico del plasmón depende de la distribución de tamaños de las NPs (Pastoriza et al., 2002). Vilchis-Nestor et al. (2008) observaron que en las soluciones con AgNO3, 10 mM y extracto acuosos de C. sinensis de 1 a 10 mL la reducción de iones de plata y la formación de NPs estables ocurrió dentro de las primeras 4 h de reacción. Las longitudes de onda de la máxima absorción de las NPs de Ag a las 4 h (440, 445 y 430 nm), fueron semejantes con las obtenidas por Hussain y Khan (2014), Kamal et al. (2010) y Vilchis-Nestor et al. (2008). La absorbancia máxima (20.89 u.a.) fue mayor en nuestro estudio comparado con los ya mencionados. El experimento realizado por Begum et al. (2009) con té negro (C. sinensis) muestra una absorbancia máxima similar (460 nm) a la reportada. Las absorbancias máximas aumentaron en función del tiempo. A los 60 min (1h) la absorbancia máxima fue de 11.99 u.a. (λ de 433 nm), pero a los 14 meses la absorbancia aumentó a 31.06 u.a. (λ de 446 nm). Los PRS fueron simétricos, indicador de la estabilidad del sistema en el tiempo (Ider et al., 2016; Carrillo et al., 2014). La forma simétrica del pico del PRS indica la existencia de NPs de Ag con forma esférica y una distribución uniforme (Ider et al., 2016).
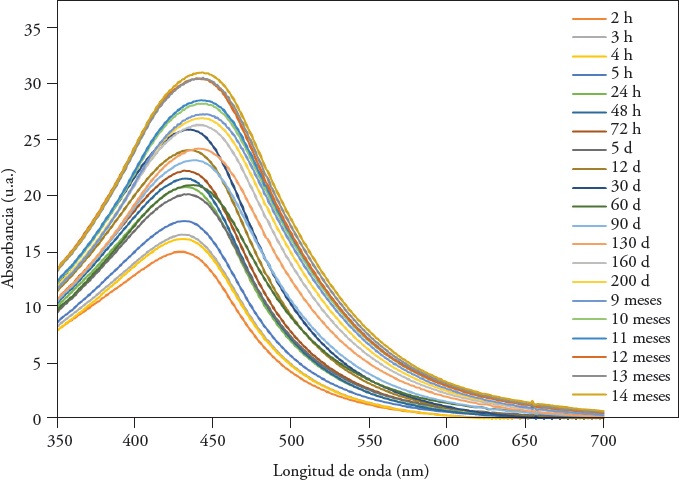
Figura 1 Espectros de absorción (PRS) de nanopartículas de plata sintetizadas con AgNO3 10 mM (5 mL) y extracto acuosos de C. sinensis (3 mL) a 24 °C tomados a diferentes tiempos.
Una mayor absorción registrada en el pico del plasmón de resonancia superficial (PRS) refleja mayor reducción de iones de plata y, a su vez, una concentración más alta de NPs de Ag (Ider et al., 2016; Carrillo et al., 2014).
El 80 % de las NPs de Ag sintetizadas y almacenadas durante 14 meses a 4 °C mostraron diámetros entre 10-40 nm y forma cuasi esférica (índice de redondez 0.893±0.006) (Figura 2).

Figura 2 Microscopía Electrónica de Transmisión de NPs de Ag sintetizadas con + 5 mL 10 mM de AgNO3 + 3 mL de extracto de C. sinensis. A y B, morfología y distribución. D, medición del diámetro mayor y menor para indice de redondez. Tecnai 2G Spirit, a 120 kV.
Las NPs de Ag producidas presentaron un tamaño promedio de 21.509 ± 0.634 nm y el 81.6 % fueron menores a los 30 nm. Los intervalos de tamaño con mayor frecuencia fueron de 10 a 20 y de 20 a 30 (Figura 3). Hussain y Khan (2014) obtuvieron nanodiscos de 47 nm de largo y 10 de ancho, sintetizadas con AgNO3 1 mM y 4% de extracto con catequinas, y Sun et al. (2014) sintetizaron NPs de 20-90 nm con AgNO3 10 mM y con diferentes concentraciones de extracto de té. Además, Rastogi y Arunachalam (2011) obtuvieron NPs de Ag esféricas de 7.3±4.4 nm al exponer una solución de [Ag(NH3)2]+ 0.1 M con extracto de Allium sativum (ajo) a luz solar por 15 min.
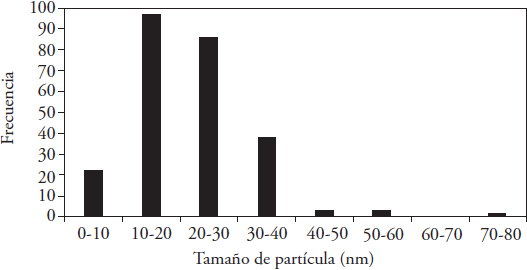
Figura 3 Distribución de tamaños de NPs de Ag sintetizadas con 5 mL de AgNO3 10 mM + 3 mL de extracto acuoso de C. sinensis y 5 min de exposición a luz solar, (n=251).
El índice de redondez (IR) fue alto, 0.893±0.006, y esto indicó una forma cuasi-esférica.
Cambios en peso fresco y consumo de agua
En el tratamiento con ácido cítrico (pH 3) se obtuvo el mayor peso fresco relativo (PFR) (104.77 %) el tercer día y durante todo el experimento fue significativamente mayor que el testigo (pH 6) (PFR, 86.24 %), lo cual se reflejó en una reducción de la vida florero. Safa et al. (2015), Liu et al. (2012) y Lü et al. (2010) observaron que el uso de NPs de Ag en soluciones florero disminuyen significativamente la pérdida de PFR en tallos de Gerbera jamesonii cv. ‘Balance’, Acacia holasericea y R. hybrida cv. ‘Movie Star’. En todos estos experimentos el PFR fue significativamente menor en el tratamiento testigo. La reducción de pH mediante la adición de ácido cítrico a una solución con NPs mejoró el efecto preservativo de la NPs Ag y permitió una mayor absorción de agua por el tallo. El tratamiento de NPs de Ag con sacarosa (pH 6) tuvo pérdida acelerada de PF desde el día 4. Los tratamientos de NPs de Ag sin sacarosa causaron ganancia de PF hasta el día 3, y después perdieron peso de manera progresiva (Figura 4).
Cuadro 1 Efecto de sacarosa y ácido cítrico en soluciones con 1 ppm de NPs de Ag, en el peso fresco relativo de tallos de Rosa hybrida cv. Freedom.
| Tratamientos | Peso fresco relativo (%) | ||||
| Día 1 | Día 3 | Día 5 | Día 7 | M.A.F (días) | |
| Testigo (agua) | 104.44 a | 82.41 c | 67.86 c | 57.68 b | 3.13 c |
| NPs de Ag | 102.97 ab | 96.56 ab | 92.48 a | 82.12 a | 5.33 ab |
| NPs de Ag + sacarosa | 98.45 b | 92.05 bc | 80.41 b | 66.82 b | 3.87 bc |
| NPs de Ag + Ác. cítrico | 104.15 a | 100.40 a | 96.30 a | 89.50 a | 6.80 a |
| NPs de Ag + Ác. cítrico + sacarosa | 99.33 b | 97.05 ab | 93.02 a | 85.67 a | 4.73 bc |
| C.V. (%) | 7.43 | 10.23 | 12.73 | 16.69 | 38.31 |
MAF: Días a la máxima apertura floral. Letras diferentes en columnas indican diferencias estadísticas significativas (Tukey; p ≤ 0.05; n=15).

Figura 4 Tallos de Rosa hybrida cv. Freedom a los diez días de evaluación. T-1: Agua; T-2: 1 ppm de NPs de Ag; T-3: 1 ppm de NPs de Ag + sacarosa; T-4; 1 ppm de NPs de Ag + ácido cítrico y; T-5: 1 ppm de NPs de Ag + ácido cítrico +sacarosa.
El balance de agua es determinado por la diferencia entre el consumo de agua y la pérdida de agua en el tallo (Ried y Jiang, 2012). La absorción de agua es suspendida durante el manejo en seco debido al fenómeno de embolismo, en el que la columna de agua en el xilema es interrumpida por la oclusión bacteriana o formación de tampones por tilosas, y geles en los vasos (Van Doorn y Reid, 1995). El testigo y los tratamientos con NPs de Ag sin sacarosa registraron mayor consumo de agua durante los primeros 2 d (54.16 mL) (Cuadro 2). El tratamiento con NPs de Ag + ácido cítrico tuvo el mayor consumo acumulado (147.08 mL) en el día 8. Según Nazemi y Ramezanian (2013), tratamientos con NPs de Ag aumentan la tasa de absorción de agua en rosa cv. Avalancha, pero en nuestro estudio se corroboró el efecto positivo de la acidificación del medio en la absorción de agua, debido a la reducción del bloqueo vascular (Reid y Jiang, 2012; Reid y Kofranek, 1980).
Cuadro 2 Efecto de sacarosa y ácido cítrico en soluciones con NPs de Ag en el consumo de agua acumulado de R. hybrida cv. Freedom.
| Tratamientos | Consumo de agua acumulado (mL) | |||
| Día 2 | Día 4 | Día 6 | Día 8 | |
| Testigo (agua) | 54.16 a | 77.96 bc | 88.78 bc | 96.88 cd |
| NPs de Ag | 50.67 ab | 89.10 ab | 110.03 ab | 126.40 ab |
| NPs de Ag + sacarosa | 39.42 b | 67.22 c | 78.45 c | 86.29 d |
| NPs de Ag + ác. cítrico | 54.94 a | 98.73 a | 128.04 a | 147.08 a |
| NPs de Ag + ác. cítrico + sacarosa | 44.07 ab | 79.33 abc | 98.19 bc | 116.86 bc |
| C.V. (%) | 26.33 | 24.27 | 22.31 | 21.78 |
Letras diferentes en una columna indican diferencias estadísticas significativas (Tukey; p ≤ 0.05; n=15).
Los tratamientos testigo y con sacarosa tuvieron menor consumo acumulado de agua. Esta variable estuvo relacionada con vida de florero, y los tallos con menor consumo de agua presentaron temprana marchitez, pérdida de color y doblez del cuello (Figura 5). El tratamiento NPs Ag+ ácido cítrico promovió una mayor vida de florero, aumentó el consumo de agua y se obtuvo mayor peso fresco y mejor calidad de vida de florero (Figura 5). El etileno es una fitohormona que tiene efectos negativos en la longevidad floral de especies sensibles a esta molécula, pero este efecto puede ser inhibido por el ion Ag+ (Reid y Jiang, 2012).
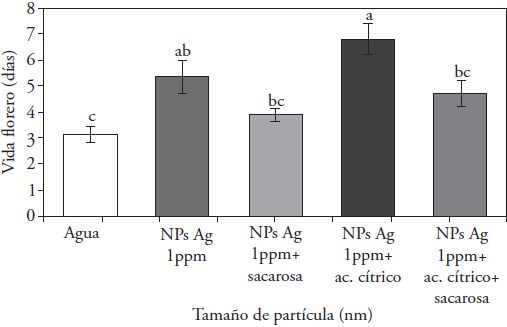
Figura 5 Efecto de NPs de Ag con sacarosa y ácido cítrico en la vida de florero de tallos de Rosa hybrida cv. Freedom. Letras diferentes indican diferencias significativas (Tukey, p ≤ 0.05, n=15).
En nuestro experimento no se encontraron diferencias significativas entre tratamientos respecto al diámetro de la máxima apertura floral, pero sí en la velocidad de apertura floral la cual fue retrasada en la solución con ácido cítrico + 1 ppm de NPs de Ag (Figura 5), variable relacionada con la longevidad de la flor.
Vida de florero
El tratamiento con mayor vida de florero fue NPs + ácido cítrico (7.3 d). En Gerbera jamesonii la máxima vida de florero se obtuvo solo con la adición de NPs de Ag a la solución florero (Geshnizjany et al., 2014). En el experimento con el cv. de rosa Freedom, la adición de sacarosa a las soluciones florero con 1 ppm de NPs Ag disminuyó la vida de florero, en contraste con la sola presencia de NPs de Ag (Figura 5). El uso de sacarosa en las soluciones florero tiene beneficios: mayor vida de florero y peso fresco relativo en tallos, mejoramiento en la apertura floral, pigmentación, reducción de sensibilidad a etileno y mejora de las relaciones hídricas (Asgari et al., 2013; Reid y Jiang, 2012; Hayat et al., 2012; Lü et al., 2010), pero en nuestro estudio la sacarosa tuvo un efecto adverso en soluciones con NPs Ag, lo cual aumentó el conteo bacteriano en la solución y redujo la vida de florero. Este efecto adverso fue contrarrestado por el ácido cítrico, el cual disminuyó los efectos adversos de la sacarosa al acidificar la solución (Figura 7). La disminución del pH limita la proliferación de microorganismos (Hayat et al., 2012; Jowkar et al., 2012), los cuales se relacionan con la obstrucción de los vasos y disminución de la absorción del agua (Macnish et al., 2008; Van Doorn, 1997).
Recuento bacteriano de la solución
En nuestro estudio la adición de sacarosa en la solución preservativa con NPs Ag promovió el crecimiento bacteriano en la solución al tercer día, pero en el séptimo día el mayor recuento bacteriano fue del testigo (agua) (Cuadro 3). El tratamiento con menor conteo bacteriano (UFC mL-1 0.85) fue el tratamiento de NPs de Ag + ácido cítrico (pH3). Los tratamientos con ácido cítrico, con pH 3, tuvieron menor UFC mL-1 que los demás tratamientos, pH 6, por lo que la acidificación de las soluciones contribuyó con la inhibición del crecimiento bacteriano.
Cuadro 3 Recuento bacteriano en la solución (Log 10 UFC mL-1) por tratamiento
| Tratamientos | Log 10 UFC mL-1 | |
| Día 3 | Día 7 | |
| Control (agua) | 2.42 a | 3.51 a |
| NPs de Ag | 1.85 ab | 2.36 ab |
| NPs de Ag + sacarosa | 2.60 a | 2.91 a |
| NPs de Ag + ác. cítrico | 0.17 c | 0.85 b |
| NPs de Ag + ác. cítrico + sacarosa | 0.64 bc | 1.26 b |
| C.V. (%) | 42.34 | 33.95 |
Letras diferentes en una columna indican diferencias estadísticas significativas (Tukey; p ≤ 0.05; n=5).
El número de UFC aumentó con el tiempo al igual que en el experimento de Liu et al. (2009, 2012), quienes no encontraron diferencias significativas entre el tratamiento testigo (agua destilada) y el tratamiento con NPs de Ag (5 mg L-1), en soluciones pulso. Según Okafor et al. (2013), concentraciones de 4 ppm de NPs de Ag sintetizadas con extractos vegetales (aloe, geranio, magnolia y cohosh negro) y con un tamaño de 3-9 nm, inhibieron el crecimiento bacteriano de E. coli.
En un estudio previo todos los tratamientos presentaron crecimiento bacteriano en la solución, pero los tratamientos con 1, 5 y 10 ppm de NPs de Ag (21.5 nm) sintetizadas con extracto acuoso de C. sinensis tuvieron actividad antimicrobiana que evitó la oclusión de un gran número de vasos del xilema (datos no presentados). Okafor et al. (2013) observaron que las NPs de Ag sintetizadas con extracto de aloe tuvieron la mayor actividad antibacterial comparada con los tratamientos con 2 y 4 ppm de NPs de Ag (3-9 nm) sintetizadas con extracto de geranio, magnolia y cohosh negro. Según Jowkar et al. (2013), no hubo crecimiento microbiano en soluciones florero tratadas con 1, 2.5 y 5 % de NPs de Ag, pero estas concentraciones son más altas que las de nuestro estudio. Sin embargo, Carrillo et al. (2016) reportaron que soluciones florero con 0.01, 0.05, 0.1, 0.5, 1 y 5 mM de NPs de Ag (10.3 nm) no presentaron UFC en la solución. Reid y Jiang (2012) mencionaron que la reducción del pH de la solución, ya sea con ácido cítrico o Al2 (SO4)3, ayuda a reducir el crecimiento bacteriano, pero es insuficiente por sí mismo porque levaduras acidófilas y bacterias pueden rápidamente colonizar la solución florero.
Se propone que no todas las especies de microorganismos afectan de la misma forma a la vida de florero. Zagory y Reid (1986) observaron que una levadura no identificada causó más daño en la vida de florero de clavel (Dianthus caryophyllus) con un inóculo de 103 UFC mL-1 que Pseudomonas sp. con un inóculo de 106 UFC mL-1.
Conclusiones
La adición de extracto acuoso de Camellia sinensis en una solución de AgNO3, con exposición a luz solar, produjo NPs de Ag de formas cuasiesféricas, con distribución de tamaños uniformes. Las NPs obtenidas fueron estables durante 14 meses almacenadas a 4°C, lo cual se corroboró con la presencia del plasmón de resonancia superficial en las soluciones con NPs de Ag. Las NPs de Ag no ocasionaron la eliminación total de las bacterias aeróbicas mesófilas en las soluciones florero, pero el aumento de las UFC entre el primer y el segundo conteo fue menor en las soluciones con NPs de Ag que en el testigo.
Los tratamientos con sacarosa presentaron mayor número de UFC en la solución y menor vida de florero. La adición de NPs de Ag y ácido cítrico a las soluciones florero mejoró la calidad de los tallos; el periodo de apertura se alargó, y hubo mayor absorción de agua por el tallo y vida de florero.
Una baja concentración de NPs de Ag permitió mejorar la calidad de la vida de florero de tallos de Rosa hybrida cv. Freedom. Pero es necesaria la formulación de alternativas para el uso de NPs de Ag en soluciones florero a base de agua potable, por ser la usada por los productores locales y los consumidores finales. No obstante, la concentración de 1 ppm de NPs de Ag es baja, se requieren más estudios para evaluar el impacto de las disposiciones de estas nanopartículas en el ambiente.











 texto en
texto en 


