Introducción
Los ornamentales del género Rosa L. (Rosales: Rosaceae) se producen en todo el mundo (Chow et al., 2009) y en muchas zonas las pérdidas en cantidad y calidad causadas por Tetranychus urticae Koch (Acari: Tetranychidae) son considerables. Esto ha aumentado los costos de producción y ha reducido las posibilidades de exportación por el aspecto estético de la flor cortada y, por lo tanto, disminuye la captación de recursos (Otero, 2002). Por esta razón, T. urticae es una de las plagas más importantes en ornamentales en invernadero (Otero, 2002; Grbic et al., 2011), principalmente en rosales (Casey et al. 2007, Grbic et al. 2011). Sin embargo, existen especies de ácaros depredadores utilizados para su control biológico y uno de los más efectivos es Phytoseiulus persimilis Athias-Henriot (Acari: Phytoseiidae), debido a su alta capacidad de depredación (Chacón et al., 2017) y tasa elevada de incremento poblacional, lo que le permite disminuir rápidamente la población de la plaga (Escudero y Ferragut, 2005).
La relación de la calidad de la planta y tasa de crecimiento, y emigración de T. urticae (Park y Lee, 2002; Nachman y Zemek, 2002a y 2002b; Reddall et al., 2004) se ha demostrado mediante el control biológico (Nachman y Zemek, 2003; Eisa y Mostafa, 2013), pero se desconocen algunos aspectos como la condición de la planta que pueden incluirse en un análisis. El principal indicador de la condición de la planta es el contenido de clorofila en la hoja (Nachman y Zemek, 2002a) y la remoción de dicha clorofila afectará negativamente la actividad fotosintética y por ende reducirá el crecimiento de la planta (Tomczyk y Kropczynska, 1985; Park y Lee, 2002).
Una técnica no destructiva que permite establecer la condición de la planta mediante la estimación del contenido de clorofila en la hoja es con un medidor de clorofila portátil. Por lo tanto, las hipótesis del estudio fue: P. persimilis reduce las poblaciones de T. urticae y por ende la clorofila no es afectada. Los objetivos fueron: 1) determinar la susceptibilidad o resistencia de variedades de rosal al ataque de T. urticae, 2) determinar la relación entre la condición de la planta y la densidad poblacional de T. urticae, 3) conocer el efecto de depredación de P. persimilis en el control de T. urticae y su eficiencia, y 4) determinar la variedad en la cual se desempeña mejor P. persimilis.
Materiales y Métodos
El estudio se realizó en las instalaciones del Departamento de Parasitología de la Universidad Autónoma Agraria Antonio Narro en Buenavista, Saltillo, Coahuila, México. Las especies usadas fueron T. urticae, P. persimilis y dos variedades de rosal (Rosa sp.), Ojo de Toro, variedad nueva introducida a México, y Virginia, resistente al ataque de T. urticae (Flores-Canales et al., 2011). La colonia de T. urticae se inició con ninfas y adultos recolectados en huertas de manzano en la localidad de Huachichil, Municipio de Arteaga, Coahuila. Estos ácaros ya identificados fueron liberados en plantas de frijol crecidas bajo condiciones de invernadero a 27 ± 4°C. Los ácaros depredadores P. persimilis fueron proporcionados por la empresa KOPPERT Biological Systems S.A., México.
Para el estudio se sembraron 10 plantas por variedad a una distancia de 10 cm en una cama para siembra de 60 cm × 9 m y como sustrato fue tierra negra. Las plantas se fertilizaron con N-P-K, por 75 semanas, una vez por semana, con fosfato monoamónico (12-61-0) (36.10 g), nitrato de amonio (12-00-46) (35.16 g), y urea (46-00-00) (13.75 g) diluido en 20 L de agua; en la semana siguiente no se fertilizó para evitar efecto de los macroelementos sobre T. urticae (Najafabadi et al., 2011; Ribeiro et al., 2012). Veinticinco días antes de la infestación se aplicó el insecticida Dibrol® 2.5 CE (Deltametrina: (S)-alfa-ciano-3-fenoxibencil (1R, 3R)-3-(2,2-dibromovinil)-2,2-dimetil ciclopropanocarbo- -xilato), con 1 mL L-1 de agua, para prevenir la presencia de plagas como: Myzus persicae (Sulzer) (Hemiptera: Aphididae), Trialeurodes vaporariorum (Westwood) (Hemiptera: Aleyrodidae), y Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae). El estudio se efectuó a 27 ± 4 ºC y HR de 60 ± 15 %.
Diecinueve meses después de la siembra (76 semanas), se realizó una infestación inducida en forma aleatoria con 100 hembras adultas de T. urticae recién apareadas por planta, una semana después se realizó un muestreo de la población de este ácaro en tres foliolos por estrato (superior, medio e inferior) por variedad, y de inmediato se liberaron 12 hembras adultas de P. persimilis por planta (4 hembras por estrato: superior, medio e inferior). El número de fitoseidos liberados fue de acuerdo con la densidad de T. urticae liberada y al consumo promedio de P. persimilis (aproximadamente ocho individuos en 20 h; Argüelles et al., 2013). La densidad del depredador se ajustó multiplicando la densidad a liberar, la cual es la relación depredador-presa determinada mediante la tasa máxima de consumo de la respuesta funcional, por el porcentaje de mortalidad 7 % (Hilarión et al., 2008); y 7 d después se iniciaron los muestreos poblacionales de T. urticae y P. persimilis por estrato/variedad, respectivamente, y después se realizaron cada semana observando tres foliolos por estrato en tres plantas aleatorias por muestra por variedad. El conteo se realizó con una lupa de 30X.
Para determinar el contenido de clorofila se usó un SPAD 502 (Konica Minolta, Osaka, Japón) y el equipo LI3100C (LICOR Biosciences, EUA) para medir el área foliar. El índice de daño (IDF) fue estimado visualmente para cada foliolo usando una escala arbitraria de 0 (sin daño o 0 % daño) a 5 (marca densa o marchitez por consumo de todo el foliolo (81 a 100 % de daño; Hussey y Parr, 1963; Nachman y Zemek, 2002a).
Diseño experimental
El diseño experimental se estableció en dos parte y la primera fue de una vía. Los efectos de T. urticae se analizaron en ausencia del depredador mediante las variables contenido de clorofila en unidades SPAD cm-2, porcentaje de daño cm-2 y número de ácaros cm-2 en las plantas de rosal. Tres muestras se realizaron por estrato (superior, medio e inferior) por variedad de rosal por semana. La segunda parte fue un diseño de medidas repetidas en el cual se analizaron las mismas variables más el efecto de la liberación de P. persimilis. Una planta de rosal se consideró como unidad experimental en la cual se analizaron los efectos de la liberación de T. urticae y P. Persimilis. En total se analizaron 72 muestras por variedad.
Análisis estadístico
El análisis estadístico se realizó en tres etapas: 1) antes de la liberación de P. persimilis, 2) después de la liberación de P. persimilis y, 3) regresiones simples lineales y múltiples y no lineales. En la etapa 1 se realizó un ANDEVA de una vía para comparar variedad y estrato de la planta con mayor resistencia a T. urticae, mayor porcentaje de daño y menor contenido de clorofila causado por T. urticae. Los datos se analizaron mediante PROC GLM y para separar las medias se aplicó la prueba de diferencias mínimas significativas (p≤0.05).
La etapa 2 se efectuó en dos partes: 1) para determinar diferencias significativas por estrato por variedad, se realizó el ANDEVA de medidas repetidas (ANDEVAmr) para las variables T. urticae cm-2, porcentaje de daño cm-2 y la cantidad de clorofila en unidades SPAD cm-2, P. persimilis cm-2; 2) se realizó un ANDEVAmr para determinar diferencias significativas entre variedades y estratos respecto a las variables antes mencionadas. Las partes 1 y 2 incluyen las ocho semanas de observación de P. persimilis. El factor de medidas repetidas fue ocho semanas de muestreo. Los datos se analizaron mediante PROC MIXED y para separar las medias de las variables se aplicó la prueba diferencias mínimas significas (p £ 0.05), SAS versión 9.0 (SAS, 2002).
En la etapa 3 se ajustaron varios modelos de regresión lineal simple, múltiple y cuadrática entre las variables: número de T. urticae cm-2, porcentaje de daño cm-2, cantidad de clorofila (unidades SPAD) cm-2 (y) y el tiempo de exposición de las plantas ante T. urticae (x). El método de Pearson se utilizó para medir la asociación entre las variables. El PROC GLM de SAS versión 9.0 (SAS, 2002) se usó para estimar los parámetros y sus desviaciones estándares mediante regresión; para estimar el grado de asociación mediante el método de Pearson se utilizó PROC CORR PEARSON. Las pruebas de t-Student y F se usaron para la prueba de significancia de los modelos (p≤0.05).
Resultados y Discusión
Previo a la liberación de Phytoseiulus persimilis
Por estrato
En la variedad Virginia se observaron diferencias significativas en la abundancia de T. urticae (F2, 6 = 10.73, p ≤ 0.01), pero no en contenido de clorofila ni en el porcentaje de daño (F2, 6 = 1.32, p > 0.05; F2, 6 = 0.43, p > 0.05). Ojo de Toro presentó diferencias en el porcentaje de daño (F2, 6 = 8.42, p ≤ 0.05), pero no en la abundancia de T. urticae (F2, 6 = 0.13, p > 0.05) y el contenido de clorofila (F2, 6 = 0.09, p > 0.05) (Cuadro 1). Virginia, el contenido de clorofila y el porcentaje de daño por estrato no presentaron diferencias, lo que indica que T. urticae se alimenta y daña a la planta con la misma intensidad, independientemente de la posición que tenga en la planta, pero en Ojo de Toro el fitófago dañó más el estrato inferior. El mayor porcentaje de daño fue causado por un número menor de fitófagos comparados donde se observaron más (Cuadro 1).
Cuadro 1 Promedio de Tetranychus urticae cm-2, contenido de clorofila en unidades SPAD cm-2 y porcentaje de daño cm-2 en dos variedades de rosal.
| Estrato | T. urticae cm-2 | Cantidad de clorofila cm-2 | Porcentaje de daño cm-2 | |||
|---|---|---|---|---|---|---|
| Ojo de Toro | Virginia | Ojo de Toro | Virginia | Ojo de Toro | Virginia | |
| Superior | 0.83a* | 2.86b | 3.69a | 3.63a | 0.29c | 2.25a |
| Medio | 0.95a | 1.61b | 4.66a | 3.07a | 1.75b | 1.33a |
| Inferior | 0.65a | 4.52a | 3.85a | 3.88a | 3.18a | 3.07a |
| General | 0.81B** | 2.99A | 4.07Y | 3.52Z | 1.74Q | 2.22Q |
*Medias con diferente letra en un renglón son estadísticamente diferentes (p ≤ 0.05). ** Medias con diferente letra en una columna son estadísticamente diferentes (p ≤ 0.05).
Por y entre variedad
Las diferencias entre variedades fueron significativas con respecto a la abundancia de T. urticae (F1, 16 = 17.54, p≤0.01), pero no en la cantidad de clorofila (F1, 16 = 1.68; p>0.05) ni en el porcentaje de daño (F1, 16 = 0.30, p>0.05; Cuadro 1), probablemente por el promedio de ácaros cm-2 que presentaron las variedades. Según Poskuta et al. (1975), T. urticae no influyó sobre el contenido de clorofila a o b en fresas variedad Talisman con densidades de hasta 4 ácaros cm-2; además, Bounfour et al. (2002) no observaron diferencias significativas entre el número de T. urticae y el contenido de clorofila en hojas de frambuesa roja, aunque las mediciones de fluorescencia indicaron una interrupción del aparato fotosintético.
El número de T. urticae cm-2 sobre las variedades de rosal fue estadísticamente diferente, lo cual se puede atribuir a las condiciones que involucran aspectos químicos, nutritivos, físicos como pubescencia, resistencia de los tejidos, estructura superficial de las hojas, superficie disponible para cada individuo y los metabolitos secundarios de las plantas (Agrawal, 2000; Balkema-Boomstra et al., 2003; Biswas et al., 2004). Estos factores pueden reducir la calidad alimenticia, reduciendo la digestibilidad y afectando a la fertilidad, el crecimiento, la densidad poblacional, la supervivencia, el desarrollo y la mortalidad de los estados juveniles de T. urticae (Peralta y Tello, 2011).
Después de la liberación del depredador
Por estrato
Las diferencias fueron significativas entre estratos en ambas variedades con respecto a la abundancia de T. urticae (F2, 48 = 5.69, p ≤ 0.01; F7, 48 = 6.85, p ≤ 0.01). En Ojo de Toro la cantidad de clorofila no fue diferente por estrato (F2, 48 = 1.63, p > 0.05), pero si en Virginia (F2, 48 = 5.80, p ≤ 0.01). En el porcentaje de daño por T. urticae en ambas variedades no se observaron diferencias (F2, 48 = 0.77, p > 0.05; F2, 48 = 0.21, p > 0.05; Cuadro 2).
Cuadro 2 Promedios de Tetranychus urticae cm-2, contenido de clorofila en unidades SPAD cm-2, porcentaje de daño cm-2 y Phytoseiulus persimilis cm-2 por estrato en dos variedades de rosal.
| Estrato | Ojo de Toro | Virginia | Ojo de Toro | Virginia | Ojo de Toro | Virginia | Ojo de Toro | Virginia |
|---|---|---|---|---|---|---|---|---|
| T. urticae cm-2 | Cantidad de clorofila en unidades SPAD cm-2 | Porcentaje de daño cm-2 | P. persimilis cm-2 | |||||
| A | ||||||||
| Superior | 0.45b§ | 0.31b | 3.18a | 3.35b | 0.28a | 0.46a | 0.01a | 0.01a |
| Medio | 0.46b | 0.29b | 3.24a | 3.42b | 0.46a | 0.30a | 0.01a | 0.01a |
| Inferior | 1.41a | 1.03a | 3.62a | 4.57a | 0.53a | 0.27a | 0.01a | 0.01a |
| General | 0.77A¥ | 0.54A | 3.35Y | 3.78Z | 0.42M | 0.34M | 0.001Q | 0.01Q |
§ Medias con letra diferentes en un renglón son significativamente diferentes (p ≤ 0.05). ¥ Medias con letra diferente en una columna son significativamente diferentes (p ≤ 0.05).
Ambas variedades presentaron diferencias significativas durante el estudio con respecto a la abundancia de T. urticae con presencia del depredador (F2, 48 = 2.57, p ≤ 0.05; F7, 48 = 8.28, p ≤ 0.01). En Ojo de Toro el contenido de clorofila no fue diferente (F7, 48 = 2.08, p >0.05). Mientras que en Virginia se observaron diferencias en la cantidad de clorofila (F7, 48 = 2.88, p ≤ 0.01). Respecto al porcentaje de daño se encontraron diferencias durante las ocho semanas en la variedad Ojo de Toro (F7, 48 = 5.30, p ≤ 0.01), pero no en Virginia (F7, 48 = 1.04, p > 0.05) (Cuadro 3).
Cuadro 3 Promedios de Tetranychus urticae cm-2, contenido de clorofila en unidades SPAD cm-2, porcentaje de daño cm-2 y Phytoseiulus persimilis cm-2 por semanas en dos variedades de rosal.
| Semana | Ojo de Toro | Virginia | Ojo de Toro | Virginia | Ojo de Toro | Virginia | Ojo de Toro | Virginia |
|---|---|---|---|---|---|---|---|---|
| T. urticae cm-2 | Cantidad de clorofila en unidades SPAD cm-2 |
Porcentaje de daño cm-2 | P. persimilis cm-2 | |||||
| 1 | 1.60a§ | 2.09a | 4.11a | 4.25ab | 0.38b | 0.58a | 0.01a | 0.00a |
| 2 | 1.37ab | 1.29b | 3.58a | 3.83abc | 0.13b | 1.01a | 0.00a | 0.01a |
| 3 | 1.12ab | 0.55bc | 3.55a | 3.66bc | 0.018b | 0.02a | 0.01a | 0.00a |
| 4 | 1.03ab | 0.25c | 3.38a | 4.41ab | 0.08b | 0.57a | 0.01a | 0.01a |
| 5 | 0.60ab | 0.06c | 3.37a | 5.08a | 0.17b | 0.00a | 0.01a | 0.02a |
| 6 | 0.45ab | 0.10c | 3.18a | 3.31bc | 1.49a | 0.21a | 0.02a | 0.01a |
| 7 | 0.01b | 0.00c | 2.80a | 2.85c | 1.11a | 0.35a | 0.00a | 0.00a |
| 8 | 0.00b | 0.00c | 2.78a | 2.81c | 0.00c | 0.00a | 0.00a | 0.00a |
§Medias con diferente letra en un renglón son significativamente diferentes (p ≤ 0.05).
Después de la liberación de los fitoseidos, el mayor promedio de clorofila y el número de T. urticae cm-2 se observó en el estrato inferior en ambas variedades, lo que indica que el fitófago busca las mejores condiciones tales como calidad del alimento.
Entre variedades
Entre variedades no se encontraron diferencias significativas en la abundancia de T. urticae (F1, 96 = 2.00, p > 0.05), ni entre estratos durante las ocho semanas (F2, 96 = 0.21, p > 0.05). Sin embargo, en el contenido de clorofila si se observaron diferencias entre variedades (F1, 96 = 4.78, p ≤ 0.05), pero no entre estratos (F2, 96 = 1.75, p > 0.05). Mientras que, el porcentaje de daño no fue diferente entre variedades (F1, 96 = 0.26, p > 0.05), y estratos (F2, 96 = 0.76, p > 0.05) (Cuadro 2).
Con respecto al número de P. persimilis cm-2, en ambas variedades no se observaron diferencias significativas por estratos (F2, 48 = 0.59; p > 0.05; F2, 48 = 0.10, p > 0.05), tampoco respecto a la abundancia de P. persimilis cm-2 (F7, 96 = 0.11, p > 0.05) (Cuadro 2), y de igual manera en la abundancia del fitoseido en las ocho semanas (F7, 48 =1.07, p > 0.05; F7, 48 = 0.78, p > 0.05) (Cuadro 3). En el estudio se observó menor abundancia del depredador comparada con lo reportado por Nachman y Zemeck (2003) y Eisa y Mostafa (2013). Las plantas posiblemente afectan positiva y negativamente al ácaro depredador directamente o indirectamente (Dicke y Sabelis, 1988). Al respecto Vázquez et al. (2008) mencionan que las plantas hospederas y el refugio también afectan al depredador. Mientras que De Bach (1964) reportó que los semioquímicos influyen en el depredador para su establecimiento. Estos factores probablemente influyeron sobre la población de P. persimilis, ya que en ambas variedades los promedios fueron similares.
Asociación
Variedad Ojo de Toro
El contenido de clorofila, porcentaje de daño (correlación parcial r = -0.2384, p ≤ 0.05) y el número de T. urticae se correlacionaron negativamente con el tiempo de exposición de la planta al ácaro T. urticae (Figura 1). Lo que indica que las variables cuantificadas disminuyen con el paso del tiempo (Figura 1A, 1B y 1C).
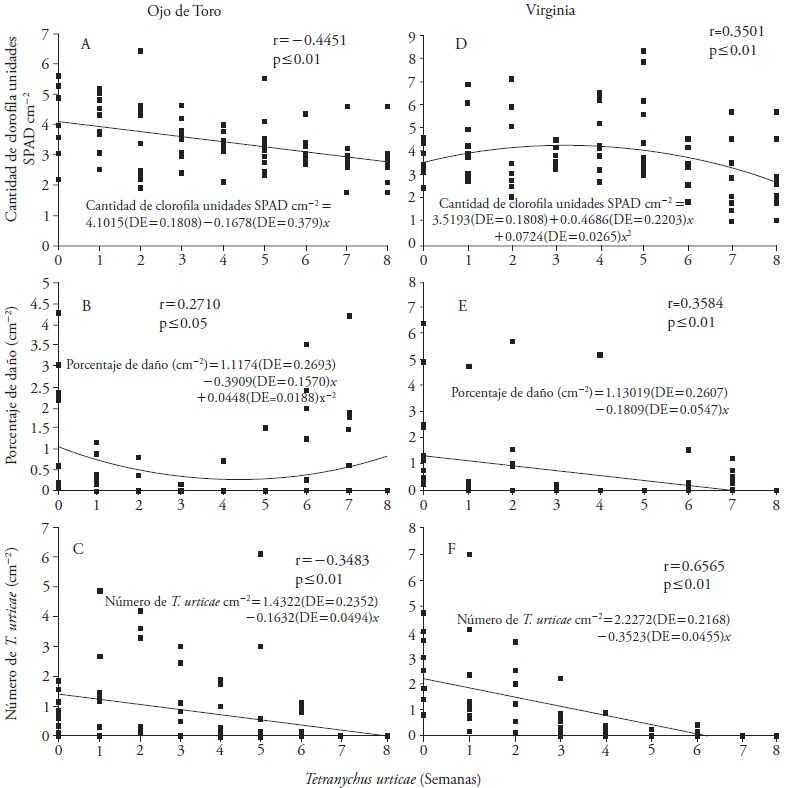
Figura 1 Relación entre el número de semanas (x) en que las plantas fueron expuestas a T. urticae y la cantidad de clorofila en unidades SPAD cm-2, daño causado y número de T. urticae cm-2.
Hubo una asociación entre el contenido de clorofila en unidades SPAD cm-2, y el tiempo de exposición de la planta al ácaro T. urticae x1 y el número de ácaros por cm2x2:
Cantidad de clorofila (unidades SPAD)/cm-2 = 3.7614
(DE = 0.2098) - 0.1290 (DE = 0.03897) x1 + 0.2374
(DE = 0.827) x2
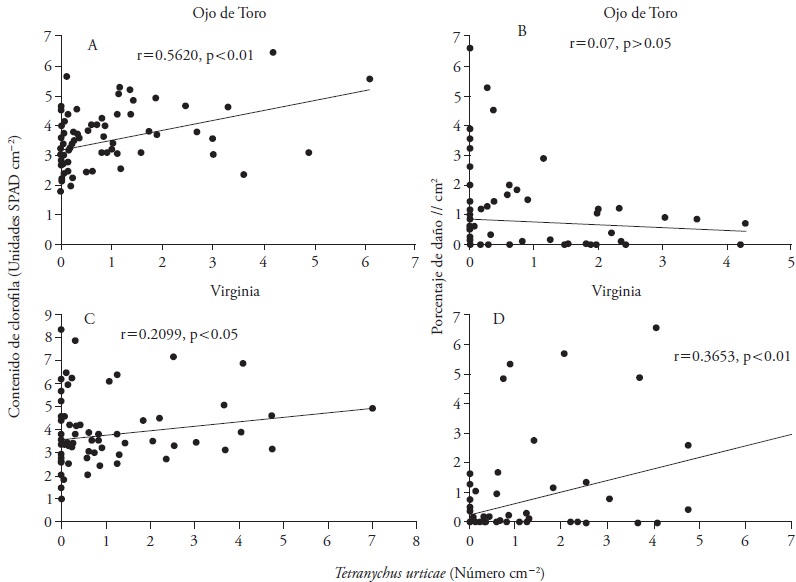
El valor de R2 (0.2747; F2, 78 = 14.77; p ≤ 0.01) indicó que el 27.47% de la variación en la cantidad de clorofila en unidades SPAD cm-2 se encontró asociado con el tiempo de exposición de la planta a T. urticae y el número de ácaros por cm2. El factor más importante fue el tiempo de exposición x 1 (F1, 78 = 11.08; p ≤ 0.01) seguido por el número de T. urticae por cm2 x2 (F1, 78 = 8.23; p ≤ 0.01). El modelo de regresión múltiple no arrojo alguna dependencia significativa entre el porcentaje de daño y el tiempo de exposición de la planta a T. urticae y el número de ácaros por cm2 (R2 = 0.0176, F2, 78 = 0.70, p > 0.05). El número de fitófagos se correlacionó positivamente con la cantidad de clorofila (Figura 2), lo que indica que T. urticae busca mayor alimentación (Figura 2A), pero no así con el porcentaje de daño por cm2 (Figura 2B).
Variedad Virginia
La correlación entre el contenido de clorofila unidades SPAD cm-2 (r = -0.2355, p ≤ 0.05), el porcentaje de daño por cm2, el número de fitófagos cm-2 y el tiempo de exposición de la planta a T. urticae fueron negativas y significativas (Figura 1D, 1E, y 1F). Esto indica que las variables decrecen con el transcurso del tiempo.
La regresión múltiple arrojó una relación entre el contenido de clorofila en unidades SPAD cm-2 y el número de ácaros por cm2 (x1) y el tiempo de exposición de la planta a T. urticae (x2).
Contenido de clorofila (unidades SPAD)/cm-2 = 2.5529
(DE = 0.6042) + 0.3272 (DE = 01615) x1 + 0.7876
(DE = 0.2673) x2 - 0.0979 (DE = 0.0288) x22 (R2 = 0.1670;
F3, 77 = 5.15; p≤0.01).
El factor más importante fue el tiempo de exposición al cuadrado x22 (F1, 77 = 11.51; p≤ 0.01) seguido por el tiempo de exposición x2 (F1, 77 = 8.68; p ≤ 0.01) y por último el número de ácaros por cm2 x1 (F1, 77 = 4.10; p ≤ 0.05).
El número de fitófagos se correlacionó positivamente con la cantidad de clorofila y el porcentaje de daño (Figura 2), lo que indica que el ácaro de dos manchas busca hojas de mejor calidad nutricional (Figura 2A), y que a mayor número de ácaros mayor es el daño (Figura 2D).
La asociación entre la cantidad de clorofila y el índice de daño en ambas variedades fue no significativa (r = -0.637, p > 0.05 y r = -0.1076, p > 0.05). No se encontró una asociación lineal entre las variables, número de P. persimilis cm-2 y el número de fitófagos cm-2 para ambas variedades (r = -0.0331, p > 0.05; r = -0.0053, p > 0.05).
Los resultados obtenidos coinciden con los de Tomczyk y Kropczynska (1985), quienes mostraron que la concentración de componentes bioquímicos (como la clorofila) también puede ser afectada por los hábitos alimenticios de T. urticae. Los cambios en las concentraciones de este compuesto también pueden influir sobre la fisiología de las plantas. La disminución del contenido de clorofila en las hojas también se puede atribuir a los cambios en el contenido de cloroplasto de las células adyacentes a las células dañados por los ácaros (Tomczyk y Kropczynska 1985). Tetranychus urticae afecta a las plantas de rosal, ya que la clorofila tiene una asociación directa con la fotosíntesis y la productividad de la planta (De Angelis et al., 1983; Iatrou et al., 1995; Haile y Higley, 2003; Reddall et al., 2004). Según Bounfour et al. (2002), períodos más largos de alimentación por T. urticae resultan en una disminución significativa de la clorofila fluorescente y el contenido de clorofila, como sucedió en nuestro estudio, en el cual se mostró que el contenido de clorofila cm-2 y el porcentaje de daño cm-2 disminuye con el transcurso del tiempo sobre las plantas expuestas a T. urticae. Nachman y Zemeck (2002a), encontraron que la asociación principal fue el tiempo en que se expusieron las plantas al ácaro T. urticae. En ambas variedades, se observó una relación negativa entre el contenido de clorofila cm-2 y el índice de daño, lo cual concuerda con los resultados obtenidos por Nachman y Zemek (2002a). La liberación de P. persimilis no presentó ningún beneficio para ambas variedades de rosal, ya que, la disminución del contenido de clorofila cm-2 continuó conforme transcurría el tiempo (Figuras 1A y 1D). Contrario a lo reportado por Eisa y Mostafa (2013) quienes registraron en plantas de la vid menores pérdidas de clorofila al liberar dos y cuatro ácaros depredadores Typhlodromips capsicum Mostafa por rama, en comparación con plantas infestadas solo de T. urticae. Al disminuir el número de T. urticae cm-2 por la depredación de P. persimilis cm-2 decreció el porcentaje de daño cm-2 en ambas variedades. Nachman y Zemek (2002b) observaron que las plantas infestadas con P. persimilis fueron más altas, presentaron menos fitófagos y mostraron un nivel más bajo de lesiones en comparación con las plantas sin depredadores. El efecto de los depredadores fue más pronunciado cuando las plantas se infestaron con cinco fitoseidos que con tres.
Los resultados indican que en la variedad Ojo de Toro, existe una correlación positiva entre el contenido de clorofila cm-2 y el número de ácaros cm-2, es decir, el fitófago se mueve a hojas de mayor calidad, mientras que en Virginia no se encontró relación significativa ( > 0.05) aunque la pendiente fue positiva. Al respecto, Johnson (1983) no encontró ninguna correlación entre el número de Panonychus ulmi (Koch) y el contenido de clorofila de hojas de manzano, lo cual se atribuye a que el ácaro se mueve entre las hojas en una forma que no determina la calidad de la hoja. Sances et al. (1979a) no encontraron tal relación entre el número de ácaros d-1 cm-2 en un rango de 0 a 50. En la variedad Virginia se observó que entre mayor es el número de ácaros cm-2, mayor es el porcentaje de daño cm-2. Sances et al. (1979b) señalan que la principal razón de la reducción del contenido de clorofila probablemente es el daño mecánico de los cloroplastos durante la alimentación del ácaro, la pérdida de la cantidad del contenido de clorofila depende de la especie de ácaro y de la variedad de la planta hospedera; así como la duración del tiempo de alimentación y de la densidad poblacional del fitófago.
En la variedad Virginia se observó que liberando 12 hembras de fitoseidos por planta se controla al fitófago en seis semanas y en Ojo de Toro en ocho semanas. Dado que la movilidad de P. persimilis no depende de la densidad de tricomas (Krips et al., 1999) y las hojas de Rosa sp. no presentan tricomas, es probable que la respuesta funcional del depredador sea favorecida, porque no existe barrera física que limite la capacidad de búsqueda (Forero et al., 2008). Según Nachman y Zemek (2003), el número inicial de depredadores también tiene una función importante. Estos autores reportaron que tres individuos de P. persimilis por planta pueden no ser suficientes para garantizar el control del ácaro T. urticae de las cinco semanas después de su liberación. En contraste, cinco depredadores por planta pueden ejercer un control más eficiente, en nuestro estudio tardó una semana adicional para controlar a la plaga, ya que hay diferencias entre los hospederos utilizados como la altura.
Conclusiones
La variedad Ojo de Toro presentó mayor resistencia a T. urticae. Phytoseiulus persimilis ayuda a reducir el daño causado por T. urticae, pero no en detener el decrecimiento del contenido de clorofila por la alimentación del fitófago en ambas variedades de rosal. Tetranychus urticae causó porcentajes de daño cm-2 similares en ambas variedades y presentaron contenidos diferentes de clorofila. Phytoseiulus persimilis fue más eficiente en la variedad Virginia.











 texto en
texto en