Introducción
La ganadería basada en el pastoreo es corresponsable del cambio en el paisaje de bosques y selvas tropicales; además, es una actividad económica con repercusiones ambientales y sociales (Chará et al., 2011). Leucaena leucocephala (Lam.) de Wit. (guaje) es una alternativa sostenible para la reforestación de espacios dedicados a la producción pecuaria en la zona intertropical de climas cálidos (Bacab et al., 2013), debido al impacto positivo en el restablecimiento del estrato arbóreo que contribuye a contrarrestar la desertificación, proporcionar servicios ambientales y aumentar la productividad y calidad de los productos de origen animal (Cuartas et al., 2014).
Las semillas ortodoxas de guaje (Arriaga et al., 1994) están cubiertas por una ligera capa de los polisacáridos galactosa y manosa (Gutiérrez et al., 2007) que impide el paso de agua y oxígeno, disminuye el vigor germinativo y propicia porcentajes de germinación inferiores a 20 %, lo cual limita su utilización (Sánchez-Paz y Ramírez-Villalobos, 2006). Los tratamientos pregerminativos, como la escarificación, ayudan a incrementar la respuesta de germinación de diversas semillas, incluyendo las de guaje, interrumpiendo su periodo de dormancia. Los métodos de escarificación son mecánicos y químicos, como la remoción manual de la testa, escarificación con papel lija, tratamientos hidrotérmicos, inmersión en agua a temperatura ambiente o inmersión en ácido sulfúrico (Teles et al., 2000; Gómez-Merino et al., 2010; González et al., 2012). Para la escarificación de semillas duras como las de los géneros Prosopis y Acacia, Ffolliott y Thames (1983) recomiendan el alcohol etílico y para la escarificación de semillas de Heliconia diluyentes orgánicos como el aguarrás.Barba-Espín et al. (2012) consideran al peróxido de hidrógeno como potenciador metabólico de la germinación en otras leguminosas.
La germinación total de semillas de guaje aumentó en más de 20 % al escarificar con agua a 80 °C con 2 a 10 min de inmersión (Sánchez-Paz y Ramírez-Villalobos, 2006; González y Mendoza, 2008; González et al., 2009; González et al., 2012). Según Teles et al. (2000), la germinación fue superior a 90 % al escarificar con agua a 80 °C por 5 y 10 min. Al escarificar con agua caliente ocurre un efecto positivo en la germinación total, pero en los estudios realizados no se consideró la velocidad de germinación. El comportamiento heliófilo del guaje, su lento crecimiento y desarrollo en los primeros 90 d después de la siembra, indican que se debe tratar la semilla para mejorar su establecimiento y tener una germinación temprana menor a 7 d, porque la plántula tiene dificultades para propagarse debido a la competencia con otras especies en terrenos con dosel denso (Calle et al., 2011).
La energía germinativa definida como el porcentaje de semillas de una muestra que emerge hasta llegar al momento de germinación máxima (Pece et al., 2010 b) o un periodo corto de 7 d para especies forestales, y el valor de germinación, que combina la energía germinativa y la velocidad de germinación (Djavanshir y Pourbeik, 1976), son indicadores pertinentes del vigor de la semilla durante los primeros días de la germinación. Estos indicadores son apropiados porque las semillas que germinan con rapidez y vigor en condiciones controladas, tienen mayor probabilidad de generar plántulas vigorosas en terrenos naturales (Ffolliott y Thames, 1983). Aunque el tratamiento hidrotérmico de la semilla de guaje ha mostrado efectos positivos en la germinación total, se desconoce su efecto en la velocidad de germinación, por lo que es conveniente compararlo con otros tratamientos que han mostrado mejor efecto en la viabilidad y velocidad de germinación y se usan para escarificar semillas.
Por lo tanto, el objetivo de estudio fue comparar la germinación total y viabilidad de cinco métodos de escarificación de la semilla de guaje, considerando el efecto en su energía germinativa y valor de germinación, como indicadores de la velocidad de germinación en condiciones semicontroladas de invernadero.
Materiales y Métodos
Localización
El estudio se realizó en el predio El Huilango, municipio de Cotaxtla, Veracruz, México, a 18o 53' N y 96o 15' O y 30 msnm durante octubre y noviembre de 2014. La temperatura y precipitación media anuales son 25.4 °C y 1,042 mm, clima Aw0(w)(i')g cálido subhúmedo, con poca oscilación térmica tipo Ganges, sin canícula y con lluvias en verano (García, 1988).
Material vegetal
La semilla de guaje utilizada fue del ciclo de producción Otoño-Invierno 2012/2013, tratada con N-triclorometiltio-4-ciclohexeno-1,2-dicarboximida 50 % (Captan®) y Deltametrina a una dosis de 1.5 L Mg-1 y 60 mL Mg-1. Las semillas tenían 18 meses de almacenadas al realizar el estudio.
Variables de respuesta
Las variables fueron la germinación total (GT, %), semillas viables no germinadas (SV, %) y viabilidad (VI, %, VI = GT + SV), medidas el día 25 después de la siembra. La germinación diaria acumulada (GDA, %) se determinó como la sumatoria del porcentaje de germinación diario al día de conteo, y la velocidad de germinación diaria (VGD, semillas d-1) como GDA d-1, donde d corresponde al día después de la siembra en que se realizó la observación.
La energía germinativa (EG, %) se estimó de manera indirecta calculando la germinación diaria acumulada al momento en que la mayoría de los tratamientos alcanzaron su velocidad de germinación diaria máxima, denominado periodo de energía (Pece et al., 2010b), el día 7 después de iniciado nuestro estudio. El valor de germinación (VG) se obtuvo con la ecuación VG = VGDf x EG, propuesta por Czabator (1962), donde VGDf es la velocidad de germinación diaria al final de la prueba, calculada 25 d después de la siembra y EG es la energía germinativa.
Desarrollo experimental
El diseño experimental fue completamente al azar, con tres repeticiones por tratamiento y las unidades experimentales fueron grupos de 100 semillas. Los tratamientos fueron: 1) sin escarificación; 2) inmersión por 3 min en agua a 80 °C (hidrotérmico); inmersión por 12 h en 3) agua a 24 °C; 4) alcohol etílico de 70 °GL; 5) diluyente orgánico thinner (tolueno 50 %, alcohol metílico 15 %, acetona 5 %, hexano 5 %, alcohol etílico 5 %, xileno 5 % y acetato de etilo 15 %); y 6) peróxido de hidrógeno diluido a 2 %. Las semillas, después de escarificadas, se enjuagaron a chorro de agua y se colocaron 3 h en papel absorbente a la intemperie.
Todas las semillas se sembraron en charolas de plástico termoformado de 200 cavidades y 3.81 cm de altura con un sustrato de suelo franco arcilloso (pH de 6.8, 2.15 % de materia orgánica y densidad aparente de 1.1 g cm-3), a una profundidad de siembra de 1 cm. Las charolas se mantuvieron en un vivero cubierto con malla sombra (50 % filtración de irradiación solar) para evitar que la lluvia descubriera las semillas. Las condiciones de temperatura y precipitación durante el experimento se muestran en la Figura 1. Los riegos de auxilio se aplicaron los días 0, 2 y 13 de la prueba.

Figura 1 Climograma, precipitación (mm) y temperatura media (°C) registradas en el periodo 15/oct/2014 - 08/nov/2014 (INIFAP, 2014).
Las semillas germinadas se contaron cada 48 h desde la fecha de siembra durante 25 d, y se consideró como semilla germinada cuando el hipocótilo y los cotiledones emergieron a la superficie. El día 25 después de la siembra se extrajeron de las charolas las semillas no germinadas y se consideraron como semillas viables no germinadas aquellas que no mostraban daño físico evidente.
Análisis estadístico
Para analizar los resultados de germinación total, semillas viables no germinadas, viabilidad, energía germinativa y valor de germinación se utilizó un modelo correspondiente a un diseño experimental completamente al azar, en tanto que los datos de germinación diaria acumulada se analizaron con un modelo mixto con mediciones repetidas:
donde, Yijk = medición del i-ésimo tratamiento del j-ésimo día de la k-ésima repetición; μ = constante que caracteriza a la población; Ti = efecto fijo del i-ésimo tratamiento (i = 1, 2, 3, 4, 5, 6); Rk(i)= efecto aleatorio de la k-ésima repetición anidada en el i-ésimo tratamiento (k = 1, 2, 3), Rk(i) ~ IIDN (0,
Los datos se procesaron con los procedimientos GLM y MIXED del SAS® 9.4 con estructura de covarianzas en modelo autorregresivo integrado de promedios móviles (SAS Institute, 2010). La comparación de medias de tratamientos se realizó con la prueba de Tukey (p ≤ 0.05).
Resultados y Discusión
El intervalo de germinación total fue 45 a 55 % en los tratamientos hidrotérmico e inmersión en agua (Cuadro 1). El tratamiento hidrotérmico mostró la germinación total más alta respecto a los demás tratamientos, excepto para la inmersión en agua (p > 0.05). Los demás tratamientos no mostraron diferencias respecto a las semillas sin escarificar (p > 0.05), y sus porcentajes de germinación fueron inferiores a 40 %.
Cuadro 1 Comportamiento germinativo de las semillas de guaje (Leucaena leucocephala cv. Cunningham) con diferentes métodos de escarificación.
| Tratamiento | Variable de respuesta | ||||
|---|---|---|---|---|---|
| GT (%) | SV (%) | VI (%) | EG (%) | VG | |
| SE | 39.0 b | 54.3 a | 93.3 a | 20.3 bc | 5.0 ab |
| IA80 | 55.0 a | 0.7 b | 55.7 c | 10.3 c | 8.1 a |
| IA24 | 45.3 ab | 48.7 a | 94.0 a | 31.7 a | 8.9 a |
| IAE | 36.0 b | 54.0 a | 90.0 a | 26.3 ab | 5.9 ab |
| IDO | 31.0 b | 40.3 a | 71.3 b | 22.0 ab | 4.0 b |
| IPH | 37.0 b | 53.0 a | 90.0 a | 26.0 ab | 5.7 ab |
| Error Estándar ± | 2.6 | 2.9 | 2.2 | 2.6 | 0.8 |
*SE: sin escarificación; IA80: inmersión en agua a 80 °C por 3 min; IA24: inmersión en agua a 24 °C por 12 h; IAE: inmersión en alcohol etílico de 70 °GL por 12 h; IDO: inmersión en diluyente orgánico thinner por 12 h; IPH: inmersión en peróxido de hidrógeno diluido al 2 % por 12 h. GT: germinación total; SV: semillas viables no germinadas; VI: viabilidad (GT + SV); EG: energía germinativa; VG: valor de germinación. Medias con diferente literal en cada variable son estadísticamente diferentes (Tukey p ≤ 0.05).
Las semillas viables no germinadas fueron superiores a 40 % en todos los tratamientos (p ≤ 0.05), excepto en el hidrotérmico, en el cual fue menor a 1 % y solo se encontraron restos de semilla en estado de descomposición al finalizar el experimento. Con el diluyente orgánico las semillas no viables tuvieron un aspecto seco y poroso, lo que probablemente se debió a daño físico por el solvente utilizado.
La viabilidad fue superior a 90 %, excepto en el tratamiento hidrotérmico (55.7 %) y el diluyente orgánico (71.3 %) (p ≤ 0.05).
En el día 3 de la prueba todos los tratamientos tuvieron una germinación diaria acumulada menor de 5 % (Figura 2). A los 5 y 7 d, la germinación diaria acumulada fue variable en todos los tratamientos con diferencia de 20 % entre los de mayor y menor respuesta (p ≤ 0.05). El tratamiento hidrotérmico mostró la menor germinación diaria acumulada durante los primeros 7 d, con respuesta a los otros tratamientos a los 9 d (p > 0.05), con tendencia superior a los demás desde el día trece, y mayor que el diluyente orgánico, alcohol etílico y peróxido de hidrógeno (p ≤ 0.05).

Figura 2 Germinación diaria acumulada (GDA) de semillas de guaje (Leucaena leucocephala cv. Cunningham) bajo seis métodos de escarificación. SE: sin escarificación; IA80: inmersión en agua a 80 °C por 3 min; IA24: inmersión en agua a 24 °C por 12 h; IAE: inmersión en alcohol etílico de 70 °GL por 12 h; IDO: inmersión en diluyente orgánico thinner por 12 h; IPH: inmersión en peróxido de hidrógeno diluido al 2 % por 12 h.
La velocidad de germinación diaria alcanzó valores máximos a los 5 d para los tratamientos de inmersión en agua y diluyente orgánico, y a los 7 d para el alcohol etílico y peróxido de hidrógeno, mientras que las semillas sin escarificar y el tratamiento hidrotérmico presentaron el valor máximo a los 9 d y 11 d, respectivamente (Figura 3). El periodo de energía considerado para el cálculo de energía germinativa fue de 7 d, porque la mayoría de los tratamientos alcanzaron el valor máximo de VGD durante ese periodo (Ffolliott y Thames, 1983).
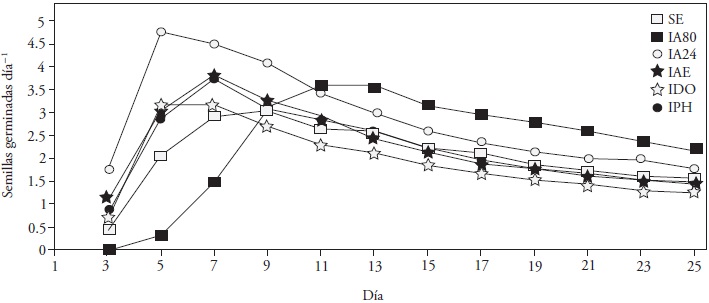
Figura 3 Velocidad de germinación diaria (VGD) de semillas de guaje (Leucaena leucocephala cv. Cunningham) bajo seis métodos de escarificación. SE: sin escarificación; IA80: inmersión en agua a 80 °C por 3 min; IA24: inmersión en agua a 24 °C por 12 h; IAE: inmersión en alcohol etílico de 70 °GL por 12 h; IDO: inmersión en diluyente orgánico thinner por 12 h; IPH: inmersión en peróxido de hidrógeno diluido al 2% por 12 h.
La velocidad de germinación diaria fue superior para la inmersión en agua con respecto a los demás tratamientos hasta el día nueve (p ≤ 0.05), después del cual los tratamientos fueron similares y con pendientes negativas (Figura 3). Para la energía germinativa, la inmersión en agua (31.7 %) fue superior al hidrotérmico (10.3 %) (p ≤ 0.05; Cuadro 1), aunque ambos tratamientos tuvieron un valor de germinación superior de 8 unidades, a diferencia del diluyente orgánico con 4 unidades (p≤0.05, Cuadro 1); los demás tratamientos mostraron valores en el intervalo de 5 a 6 unidades.
La germinación total de 55 % de la semilla de guaje con el tratamiento hidrotérmico fue mayor a la de otras leguminosas tropicales de uso forrajero como Neonotonia wightii (Wight & Arn.) Verdc. (soya forrajera) 33.5 %, Pueraria phaseoloides (Roxb.) Benth (kudzú) 39 % y Macrotiloma axilare (E. Mey.) Verdc. 18.8 %. Un efecto similar se observó en las semillas de guaje sin escarificar 39 % y 26, 18 y 24.5 % para las mismas leguminosas forrajeras, respectivamente (Morais, 2014). Para semillas de guaje provenientes de diferentes cultivares y accesiones y sin escarificar, los valores de germinación total oscilaron de 5 a 35 % y con el tratamiento hidrotérmico de 45 a 96 % (González et al., 2009).
Con semillas de guaje cv. Perú almacenadas 18 meses al ambiente sin escarificar e inmersión en agua a 80 °C por 2 min, la germinación total fue 81.8 y 97.7 % (González y Mendoza, 2008), superiores a las de nuestro estudio. Pero González et al. (2012) reportaron germinaciones totales de 51 % en semillas sin escarificar y de 61.3 % en semillas con tratamiento hidrotérmico, similares a las de nuestro estudio. Lo anterior sugiere una alta variabilidad en la germinación total de esta especie entre cultivares y para mismos tiempos de almacenamiento.
La temperatura ambiental pudo afectar la germinación total y durante el experimento las temperaturas medias 21.5 a 26.6 °C (Figura 1) pudieron disminuir la respuesta de germinación en las semillas de guaje, porque una mejor respuesta se obtiene entre 25 y 30 °C (Sánchez et al., 2005). Sin embargo, una germinación total inferior de 60 % en semillas escarificadas es frecuente en leguminosas poco domesticadas debido a que la latencia actúa como mecanismo evolutivo para obtener la probabilidad más alta de sobrevivencia de la semilla y de la progenie (Jara, 1996).
González et al. (2012) contaron semillas podridas (no viables) y reportan de 30 a 40 % con tratamiento hidrotérmico más un periodo de hidratación parcial de 28 h en semillas de guaje almacenadas 18 meses; ello es similar a la viabilidad en nuestro estudio. Estos resultados sugieren que la escarificación en agua a 80 °C por 3 min puede afectar negativamente la viabilidad de la semilla por exceso de humedad Doria (2010) señaló que semillas en humedad excesiva son vulnerables al ataque por hongos y a deficiencias en la disponibilidad de oxígeno para el embrión.
La germinación diaria acumulada está relacionada con la velocidad de germinación diaria; una alta acumulación de semillas germinadas por periodo indica una mayor velocidad de germinación. Una pendiente positiva en la curva de germinación diaria acumulada mayor a la de la semilla sin escarificar (Figura 2) sugiere el inicio del efecto del tratamiento y una pendiente casi constante el final. La menor germinación diaria durante el intervalo de 3-7 d en el tratamiento hidrotérmico indicó una velocidad de germinación cercana a cero y retrasó 2-4 d el ascenso inicial de la curva respecto a los demás tratamientos.
En nuestro estudio la germinación diaria acumulada del tratamiento hidrotérmico a los 7 d fue 10.3 %. Sánchez-Paz y Ramírez-Villalobos (2006) reportan 22 % con un tratamiento hidrotérmico de 10 min y una germinación casi constante desde el día 20, lo cual es similar a nuestro estudio.
Las leguminosas arbóreas germinan a mayor velocidad que las no leguminosas y al remover por completo la capa externa protectora de semillas de leguminosas la germinación diaria aumentó de 15 a 33 % a 10 d después de la siembra (Vargas et al., 2015). En nuestro estudio, las semillas de guaje escarificadas con agua a los 7 d de sembradas se comportaron de manera similar a semillas de leguminosas sin capa externa, con 31 % de germinación diaria acumulada, mientras que para las semillas no escarificadas y el tratamiento hidrotérmico fueron de 20 y 10 % (Figura 2). Es posible incrementar la energía germinativa (Cuadro 1) utilizando un método de escarificación que suprima la dormancia de las semillas en leguminosas, como ocurrió en el guaje en nuestro estudio y en otras leguminosas (Vargas et al., 2015).
Para Pterogyne nitens (Tul.), leguminosa arbórea de América del Sur, la inmersión en agua por 1.5 h también mejoró la energía germinativa cercano a 10 %, respecto a la semilla sin escarificar (Pece et al., 2010a), y en nuestro estudio el aumento fue 11.4 %. La energía germinativa es un indicador de la germinación de la semilla durante los primeros días postsiembra; con más semillas que germinen durante los primeros días postsiembra se reduce el riesgo de afectación por plagas y enfermedades, lo que posibilita el desarrollo de plántulas con mecanismos adaptativos, como una mayor tasa de crecimiento bajo condiciones adversas.
El peróxido de hidrógeno actúa como potenciador de la germinación durante los primeros días en algunas leguminosas como el guisante (Barba-Espín et al., 2012). Pero en muestro estudio la energía germinativa fue similar a los demás tratamientos y superó solo al tratamiento hidrotérmico. El peróxido de hidrógeno actúa a nivel metabólico a concentraciones de 20 a 40 mM y si no penetra la capa externa de la semilla de guaje, como lo hace en otras especies, su efecto es negligible.
La imbibición en agua favorece la remoción de sustancias inhibidoras del tegumento de la semilla y acelera la absorción de agua (Pece et al., 2010a). En nuestro estudio, todos los tratamientos de inmersión de la semilla de guaje en una sustancia líquida durante 12 h mostraron una energía germinativa superior al tratamiento hidrotérmico (p ≤ 0.05). Dicho tratamiento no tuvo un periodo de imbibición previo a la siembra, por lo que su energía germinativa pudo ser afectada debido a un retraso en la absorción de agua o al efecto de la alta temperatura del tratamiento en el metabolismo, que puede inducir baja viabilidad.
El valor de germinación es el único indicador que ajusta en un solo valor la capacidad germinativa de la semilla al final de una prueba de germinación y la velocidad con que ésta germina, pero es muy sensible a cambios en sus componentes (Djavanshir y Pourbeik, 1976). Los tratamientos de inmersión en agua e hidrotérmico, con valores de germinación similares (p > 0.05), fueron favorecidos por su alta velocidad de germinación diaria máxima y final, respectivamente. Esto es similar al valor de germinación de 1.76 en las semillas de la leguminosa arbórea Enterolobium cyclocarpum (Jacq.) Griseb tratadas con escarificación hidrotérmico, debido a sus valores bajos de velocidad de germinación máxima (Suárez et al., 2014). Al usar el valor de germinación como criterio para seleccionar un método de escarificación en semillas de guaje, se debe tener en cuenta el método de siembra, porque el tratamiento de inmersión en agua aumenta la velocidad de germinación en los primeros días. Esto implica reducir las prácticas de control de especies no deseadas y plántulas más vigorosas cuando la siembra de la semilla se realiza en campo, mientras que la escarificación con el tratamiento hidrotérmico favorece el porcentaje de germinación total y puede ser favorable cuando la siembra se realiza en viveros y después se trasplanta a campo.
Conclusiones
En semillas de Leucaena leucocephala cv. Cunningham la escarificación por inmersiones en agua a 80 °C por 3 min y a 24 °C por 12 h favorecieron la germinación; sin embargo, en el primero se redujo la viabilidad de la semilla y en el último se observó la mayor velocidad de germinación durante los primeros días después de la siembra.











 texto en
texto en 


