Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.52 no.4 Texcoco may./jun. 2018
Biotecnología
Los derivados de quitosano inducen la expresión local y a distancia de genes de protección en plántulas de trigo (Triticum aestivum L.)
1 Coordinación de Tecnología de Alimentos de Origen Vegetal, Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD), Km. 0.6, Carretera a La Victoria, 83304. Hermosillo, Sonora, México. (norawa@ciad.mx)
2 Coordinación de Ciencia de los Alimentos, CIAD.
3 Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA). Km. 3.5, Carretera Tapaste, 32700. San José de las Lajas, Mayabeque, Cuba.
El quitosano y sus derivados son activadores de respuestas de protección en las plantas. Las características físicas y químicas, como el peso molecular y el grado de acetilación, determinan el efecto y la especificidad. Aunque las reacciones enzimáticas y bioquímicas inducidas por el quitosano en trigo (Triticum aestivum) se conocen, la activación transcripcional de marcadores de protección por derivados del quitosano no se han estudiado. La hipótesis de nuestro estudio fue que las características estructurales de los derivados del quitosano influirían en los patrones transcripcionales de respuesta de protección en trigo. El objetivo fue comparar las propiedades inductivas locales y sistémicas del quitosano y los quitooligosacáridos (COS) en plántulas de trigo mediante la expresión de los genes relacionados con la protección: quitinasa (CHI), β-1-3 glucanasa (GLU) y fenilalanina amonio liasa (PAL). Soluciones de quitosano y COS se caracterizaron por MALDI-TOF y se aplicaron en el sustrato o por aspersión foliar a plantas cultivadas en condiciones controladas. La expresión génica en las hojas de las plantas tratadas se analizó con RT-PCR. Los patrones de expresión se relacionaron con el gen evaluado y el tipo de activador. Los COS indujeron expresión local y distal de CHI y GLU, pero disminuyeron la de PAL. El quitosano incrementó la expresión distal de CHI y GLU, y la expresión local y distal de PAL. Nuestros resultados mostraron que el quitosano y los COS median diferencialmente las respuestas transcripcionales transitorias de marcadores de protección en trigo.
Palabras clave: quitinasa; quitooligosacáridos; glucanasa; fenilalanina amonio liasa; resistencia sistémica
Chitosan and its derivatives are elicitors of defence responses in plants. The physical and chemical characteristics, like the molecular weight and acetylation degree determine the type of effect and specificity. Although chitosan-induced biochemical and enzymatic reactions in wheat (Triticum aestivum) are reported, the transcriptional activation of defensive markers by chitosan derivatives remains unaddressed. The hypothesis of our study was that the different structural features of chitosan derivatives would influence the transcriptional patterns related to protective responses in wheat. The aim of our study was to compare the local and systemic inductive properties of chitosan and chitooligosaccharides (COS) in wheat seedlings through the expression of the defence-related genes chitinase (CHI), β-1-3 glucanase (GLU) and phenylalanine ammonia-lyase (PAL). Chitosan and COS solutions were characterized by MALDI-TOF and applied by soil drench or foliar spray to seedlings grown under controlled conditions. Gene expression levels in the leaves of treated plants were analysed by RT-PCR. Different expression patterns were observed according to the gene evaluated and the type of elicitor. COS induced the local and distal expression of CHI and GLU, but decreased PAL; while chitosan increased the distal expression of CHI and GLU and the local and distal expression of PAL. Our results showed the capacity of chitosan and COS to differentially mediate transient transcriptional responses of defensive markers in wheat.
Key words: chitinase; chitooligosaccharide; glucanase; phenylalanine ammonia-lyase; systemic resistance
Introducción
El trigo (Triticum spp.) es el cereal más cultivado para el consumo humano en el mundo y, a pesar de su producción creciente, las pérdidas de rendimiento del grano provocadas principalmente por roya pueden alcanzar de 30 a 60 %, incluso pérdida total en situaciones extremas (Roelfs et al., 1992; Curtis, 2002). Para enfrentar los desafíos mundiales actuales para la provisión de alimentos, se destacó la necesidad de contar con sistemas de cultivos de cereales más eficientes e integrados, los cuales pueden incluir estrategias para disminuir el desarrollo de poblaciones de plagas sin amenazar el medio ambiente y la salud humana (FAO, 2014). Variedades de plantas resistentes a patógenos mostraron una inducción temprana y pronunciada de mecanismos de defensa intrínsecos al ser atacadas (Moloi y van der Westhuizen, 2006). Esto ha promovido el uso de estresores bióticos y abióticos para mejorar las respuestas de defensa en plantas vulnerables, lo cual puede contribuir a evitar o minimizar las pérdidas de cultivos. Varias respuestas fisiológicas y bioquímicas indican que algunos elicitores mejoran la resistencia sistémica adquirida de plantas a través de la estimulación de síntesis de metabolitos y enzimas relacionados con la defensa (Gozzo, 2003). En el trigo, la infestación de áfidos aumentó los niveles de H2O2 y la actividad de NADPH oxidasa (Moloi y van der Westhuizen, 2006). Una inducción sistémica temprana de los niveles de expresión de peroxidasa y los genes relacionados con patogénesis (PR) se observó después de la infección fúngica en espigas de trigo (Pritsch et al., 2001), mientras que la infiltración de hojas jóvenes de trigo desprendidas con micotoxinas de Fusarium desencadenó la acumulación de ROS y transcritos y proteínas relacionadas con la defensa (Desmond et al., 2008). La lignificación en hojas de trigo heridas e intactas (Barber et al., 1989) así como la inducción de la actividad de las enzimas relacionadas con la defensa fenilalanina amonio liasa y peroxidasa (Vander et al., 1998) fueron estimuladas por el quitosano; un polisacárido de D-glucosamina unido por enlaces β-(1-4) (acetilado o desacetilado). Las propiedades inductoras del quitosano se estudiaron durante décadas en diferentes plantas y dependen de características fisicoquímicas, como el grado de polimerización y acetilación. La naturaleza química y la longitud de los oligosacáridos del quitosano pueden influir diferencialmente en la transcripción, acumulación y actividad de proteínas PR en arroz (Lin et al., 2005) y durazno (Ma et al., 2013) e incrementar la actividad de las enzimas y la síntesis de metabolitos de defensa en trigo (Vander et al., 1998) y tabaco (Falcón-Rodríguez et al., 2009). De acuerdo con Li et al. (2016), los oligoquitosanos derivados de hongos son capaces de ejercer una actividad fungitóxica directa contra fitopatógenos y simultáneamente estimular la actividad de enzimas de defensa y la acumulación de compuestos fenólicos en la planta medicinal Z. bungeanum. Sin embargo, hasta ahora no se ha estudiado la influencia de los derivados de quitosano en los patrones de transcripción de los genes relacionados con la defensa en el trigo. Por lo tanto, la hipótesis de nuestro estudio fue que las diferentes características estructurales de los derivados de quitosano podrían influir en los patrones transcripcionales relacionados con las respuestas de protección en el trigo. El objetivo de nuestro estudio fue evaluar la inducción de la acumulación local y sistémica de transcritos relacionados con la defensa en plántulas de trigo por quitosanos con diferentes características fisicoquímicas.
Materiales y Métodos
Preparación y caracterización del quitosano y de los derivados de quitosano
El quitosano disponible de manera comercial (Sigma-Aldrich, EUA) se disolvió en ácido acético al 1 %, pH 5.5 durante la noche. El peso molecular promedio del quitosano (M) se determinó con viscosimetría capilar (Cabrera y Van Cutsem, 2005) usando un viscosímetro Ubbelohde y la ecuación de Mark-Houwink, [η]=KMα , donde [η] es igual a la viscosidad intrínseca, K es igual a 0.076 y α es igual a 0.76. El grado de acetilación (GA) se determinó mediante espectroscopía infrarroja usando la ecuación GA %=31.92 A1320/A1420-12.2 de acuerdo con Brugnerotto et al. (2001). Para la producción de quitooligómeros, una solución de 10 g L-1 de quitosano se hidrolizó con papaína (Sigma-Aldrich, EUA), a 35 °C por 24 h, según Vishu et al. (2004). Los quitooligosacáridos (COS) se caracterizaron por espectrometría de masas de tiempo de vuelo desorción/ionización por láser asistida en matriz (MALDI-TOF-MS por sus siglas en inglés) en el Complex Carbohydrate Research Center, en la Universidad de Georgia. En breve: una solución de 5 mg mL-1 de COS en agua desionizada se sonicó 1 hora para disolver el material soluble, se filtró a través de filtros de membrana Durapore de 0.22-µm (Millipore, Irlanda) y se mezcló con una matriz de ácido 2,5-dihidroxibenzoico (Cabrera y Van Cutsem, 2005). Los espectros de masas se registraron en un Applied Biosystems 5800 MALDI-TOF en el modo de iones positivos.
Material vegetal y tratamientos
Las plántulas de trigo (Triticum aestivum cv. Tacupeto F2001) se cultivaron en una cámara de ambiente controlado, con un fotoperiodo de 16 h y una temperatura de día/noche de 28/24 °C. Dos experimentos se realizaron de acuerdo con el tipo de derivado de quitosano evaluado (quitosano polimérico o COS). Para cada experimento, 18 macetas con plántulas de 25 días de edad se asignaron de manera aleatoria a seis grupos diferentes, donde se les aplicó quitosano o COS a 1 g L-1 y a 0.1 g L-1 ya sea por aspersión sobre las hojas o aplicados al sustrato de las plantas en crecimiento. Tales concentraciones fueron elegidas de acuerdo con Falcón-Rodríguez et al. (2009; 2011). Los grupos testigo se trataron con agua dd. De cada maceta se recogieron muestras de hojas de cuatro a cinco plántulas, se juntaron y se consideraron una repetición. Después, las hojas se congelaron y molieron con nitrógeno líquido a las 0, 6 y 12 h después de los tratamientos para un análisis de expresión de los genes relacionados con la defensa: quitinasa (CHI), β-1-3 glucanasa (GLU) y fenilalanina amonio liasa (PAL).
Extracción de ARN y reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR)
El ARN total se extrajo con el reactivo comercial Concert Plan Reagent (Invitrogen, EUA), según las instrucciones del fabricante y el ADN genómico se eliminó con el reactivo comercial DNA-free (Ambion, EUA). Un microgramo del ARN total, se retrotranscribió utilizando la SuperScript II Reverse Transcriptase (Invitrogen, EUA) y el cebador oligodT como recomendó el proveedor. La PCR semicuantitativa se realizó utilizando el kit GoTaq® Flexi DNA Polymerase (Promega, EUA) con diluciones en serie del templado (ADNc) en 28 ciclos de 95 °C por 1 min, 58 °C por 1 min y 72 °C por 1 min. Las reacciones de control para normalizar la amplificación mediante RT-PCR se realizaron con cebadores para gliceraldehído-3-fosfato deshidrogenasa (GAPDH). Los pares de cebadores específicos utilizados para la PCR se diseñaron desde secuencias en la base de datos de GenBank (Tabla 1). Los productos de la amplificación se analizaron mediante electroforesis en gel de agarosa al 1 % teñida con Gel-Red (Biotium, EUA) y se visualizaron bajo luz UV con el sistema Kodak Gel Logic 100 Imaging System. Las densidades de las bandas se cuantificaron usando el software 1D Image Analysis (Kodak, EUA). Los resultados se expresaron como una relación entre la intensidad densitométrica de la banda total de cada gen analizado y el gen de referencia GAPDH.
Cuadro 1 Cebadores utilizados en el análisis semicuantitativo de la expresión génica por la reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR).
| Gene | Primer sequence | GenBank accession number |
| Chitinase (CHI) | Sense 5’- GTTCTACACGTACGACGCCTTCTT-3’ Antisense 5’- CCCGCCGTTGATGACGTTGGTGAT-3’ |
AB029935.1 |
| β-1,3-Glucanase (GLU) | Sense 5’-ATCGACCTCATCATGGACGTGG-3’ Antisense 5’-GTCGAAGAGGTTTGTGTAGGTGAG-3’ |
AB244639.2 |
| Phenylalanine ammonia-lyase (PAL) | Sense 5’-CCAATGTTCTGTCCGTCCTTGCT-3’ Antisense 5’-AACTGCGCGAACATCAGCTTGC-3’ |
AY005474.1 |
|
Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) |
Sense 5’-GATTTGGTCTCCACTGACTTTGTCG-3’ Antisense 5’-CAACTAACATGAACCAGGCGTCG-3’ |
AY290728.1 |
Resultados y Discusión
Caracterización del quitosano y derivados del quitosano
La solución de quitosano mostró desacetilación de 84.5 %, calculada con base en la relación de intensidad de las bandas de absorción infrarroja asignadas a N-acetilglucosamina y glucosamina. La viscometría mostró que el quitosano en solución tuvo peso molecular de 50.8 kDa, considerado bajo para un quitosano polimérico. Los derivados de quitosano hidrolizado se caracterizaron y el análisis de espectrometría de masas reveló que las especies oligoméricas en la mezcla de COS tenían tres o cuatro unidades monoméricas (quitotriosas y una quitotetraosa) con diferentes grados de acetilación (Figura 1). Cuatro especies de iones principales se detectaron como aductos de sodio o potasio a valores m/z de 580.6, 607, 663.6 y 783.1, donde m/z 580.6 corresponde a una quitotriosa monoacetilada, mientras que en m/z 663.6 se detectaron COS completamente acetilados. El peso molecular y el grado de acetilación influyen directamente en la actividad biológica del quitosano y sus derivados (Kauss et al., 1989; Falcón-Rodríguez et al., 2009). Los COS altamente activos tienen un grado de polimerización de cuatro a seis unidades con grupos acetilo (Barber et al., 1989), mientras que los COS totalmente desacetilados carecen de la capacidad de provocar reacciones de defensa en las plantas.
El quitosano exhibe propiedades inductivas incluso cuando el grado de acetilación varía de 1 % a 60 %, pero con diferente intensidad (Vander et al., 1998). Además, esta característica se asocia con la modulación selectiva de las enzimas PAL y peroxidasa en plantas de tabaco (Falcón-Rodríguez et al., 2011). Es interesante que un COS lineal desacetilado con un grado de polimerización de cinco redujo la incidencia de infección por Fusarium en Z. bungeanum y aumentó la actividad de enzimas relacionadas con los mecanismos de protección (Li et al., 2016). Esto puede sugerir cierta especificidad entre las características estructurales en derivados de quitosano con respecto a las especies de plantas estudiadas.
Expresión de los genes quitinasa (CHI), β-1-3 glucanasa (GLU) y fenilalanina amonio liasa (PAL)
Los tratamientos con quitosano y COS indujeron respuestas locales y sistémicas en las hojas de las plántulas de trigo, pero con diferente velocidad e intensidad en dependencia del tipo de elicitor, concentración y gen evaluados (Figuras 2 y 3). La expresión de CHI y GLU se incrementó a diferentes grados en plántulas tratadas con ambos tipos de elicitor, mientras que la expresión de PAL se reguló diferencialmente: los niveles de transcritos de PAL se incrementaron con quitosano (Figura 2E, F) pero disminuyeron con COS (Figura 3E, F), comparados con los controles.
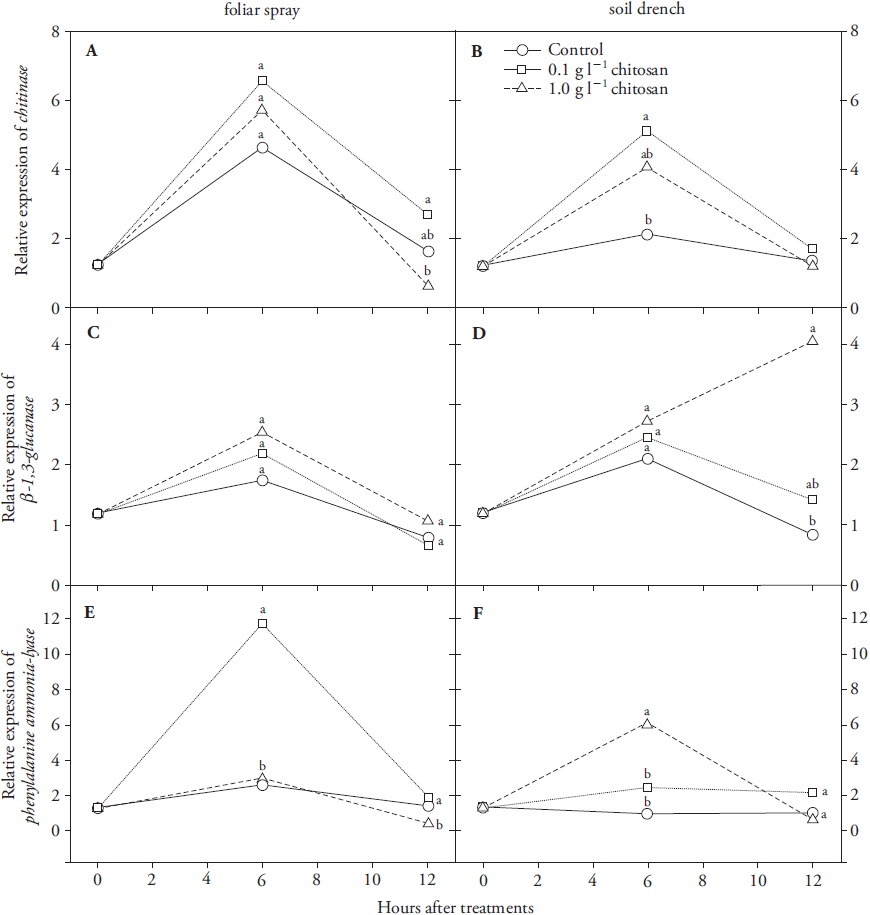
Los valores medios de tres repeticiones se presentan. Letras diferentes indican medias significativamente diferentes (p≤0.05).
Figura 2 Cambios en los niveles de expresión génica relativos de los marcadores relacionados con la defensa quitinasa (CHI) (A, B), β-1-3 glucanasa (GLU) (C, D) y fenilalanina amonio liasa (PAL) (E, F) en hojas de plántulas de trigo tratadas con quitosano por aspersión foliar o aplicación en el sustrato.
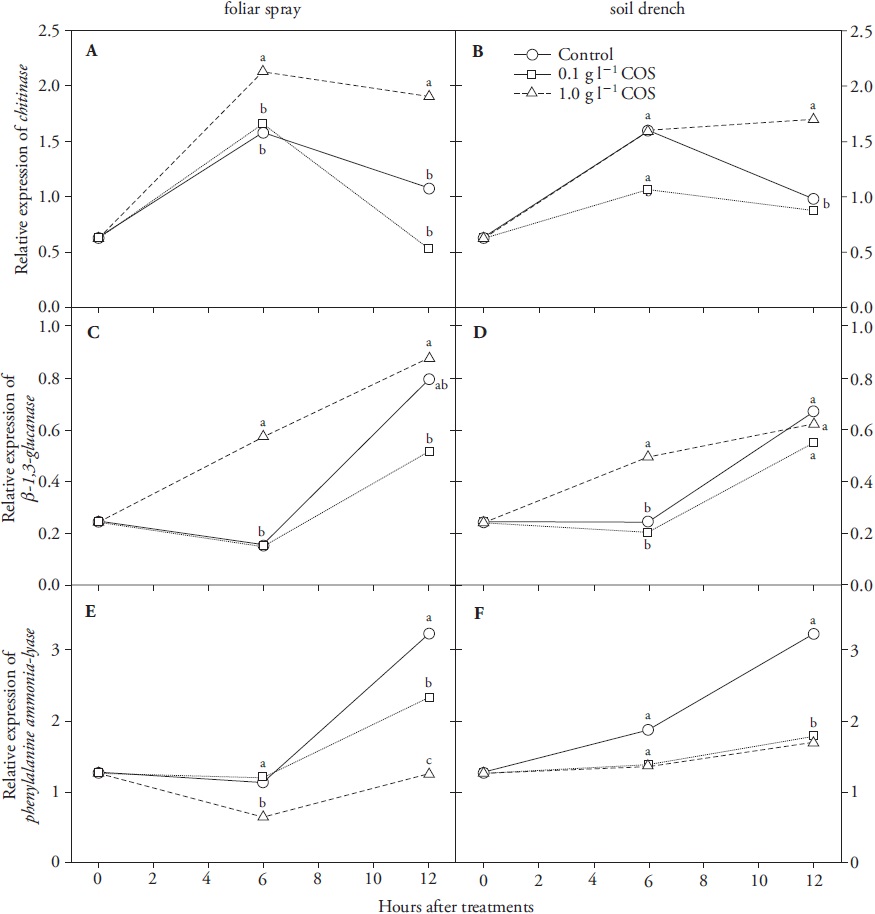
Los valores medios de tres repeticiones se presentan. Letras diferentes indican medias significativamente diferentes (p≤0.05).
Figura 3 Cambios en los niveles relativos de expresión génica de los marcadores relacionados con la defensa quitinasa (CHI) (A, B), β-1-3 glucanasa (GLU) (C, D) y fenilalanina amonio liasa (PAL) (E, F) en hojas de plántulas de trigo tratadas con quitooligosacáridos (COS) por aspersión foliar o aplicación en el sustrato.
Los tratamientos con quitosano provocaron la expresión distal de los tres genes evaluados; los transcritos de CHI y PAL alcanzaron su punto máximo a la hora 6 y volvieron a la normalidad después de 12 h (Figura 2B, F). Los transcritos de GLU aumentaron 12 h después de la aplicación de 1 g L-1 (Figura 2D). Las diferencias en la expresión entre los genes analizados pueden depender de una sensibilidad diferente al estímulo, donde una cierta concentración puede ser suficiente para desencadenar una respuesta particular. En nuestro estudio, la influencia de la concentración del elicitor para la inducción transitoria de PAL, en las primeras 6 h después del tratamiento, fue evidente (Figura 2 E y F): menor concentración de quitosano (0.1 g L-1) aumentó los transcritos de PAL en hojas rociadas de forma directa. La inducción distal de PAL solo se favoreció por una solución más concentrada (1 g L-1) aplicada a las raíces. Esto puede mostrar que la percepción del quitosano polimérico por el tejido radicular quizá fue obstaculizada por la matriz del sustrato, lo que influye en la disponibilidad de moléculas activas que desencadenan la acumulación de transcritos de PAL. El aumento de la actividad de PAL puede mejorar indirectamente el rendimiento de protección de los tejidos de las plantas reforzando las barreras físicas con lignina (Barros et al., 2015) y permite la producción de fitoalexinas (Hasan et al., 2013).
El efecto dosis respuesta no lineal en la acumulación de compuestos fenilpropanoides e incremento de las actividades enzimáticas de PAL, GLU y CHI para células cultivadas de perejil, tratadas con elicitores fúngicos se documentó (Kombrink y Hahlbrock, 1986). Por lo tanto, curvas de dosis-respuesta del quitosano serían necesarias para probar este efecto en las plántulas de trigo. La aplicación foliar de derivados de quitosano aumentó la actividad enzimática de PAL y GLU en plántulas de tabaco y promovió la protección sistémica contra el patógeno oomiceto Phytophthora nicotianae (Falcón-Rodriguez et al., 2011). Sin embargo, cuando el quitosano se aplicó directamente a las hojas de trigo la inducción no fue significativa en los niveles de transcritos de CHI y GLU (Figura 2A, C), lo que indica especificidad diferente entre las especies de plantas. Lin et al. (2005) encontraron que el quitosano polimérico era menos efectivo que los COS pequeños para aumentar los niveles de H2O2 e inducir la expresión de los genes PR CHI y GLU en células de arroz. El incremento en los niveles de H2O2 es uno de los primeros mecanismos de señalización celular para la activación de las respuestas de defensa en las plantas.
Un g L-1 de COS fue una concentración más efectiva que 0.1 g L-1 para mejorar los niveles de expresión de CHI y GLU en plántulas de trigo tratadas de manera foliar o por raíz (Figura 3). En las plantas tratadas de manera foliar, los niveles de transcritos de CHI fueron más altos que los controles dentro de las primeras 6 h después del tratamiento y este efecto se mantuvo hasta la hora 12 (Figura 3A). Experimentos posteriores mostraron que la inducción de niveles de transcritos de CHI en plantas de trigo tratadas foliarmente era evidente antes de la hora 6 (datos no mostrados). La expresión de GLU aumentó transitoriamente después de 6 h en hojas de plántulas tratadas de manera foliar o por raíz con 1 g L-1 de COS (Figura 3C, D), pero en la hora 12 los testigos alcanzaron los niveles de las plantas tratadas. Nuestros resultados son similares a los reportados por Ma et al. (2013), quienes mostraron que la expresión de GLU se indujo en duraznos a las 12 y 24 h después de ser tratados por inmersión en quitosano o COS a una concentración de 5 g L-1. En cambio, los COS redujeron significativamente la expresión de PAL local y distal (Figura 3E, F). Esto probablemente indica un efecto regulador, donde los COS podrían inducir o reprimir de manera diferencial algunas vías relacionadas con la defensa durante un período de tiempo limitado. Tal comportamiento dinámico en los perfiles de expresión entre PAL y los genes PR CHI y GLU podría optimizar el gasto de energía celular debido a la síntesis de proteínas de novo a partir de transcritos inducidos.
Falcón-Rodriguez et al. (2011) observaron una actividad enzimática mejorada de GLU en plántulas de tabaco tratadas con COS. El incremento en la expresión y la actividad de las enzimas GLU y CHI se asoció a una mayor tolerancia de las plantas a las infecciones fúngicas (Zhu et al., 1994). Estas enzimas hidrolizan los componentes de la pared celular de diversos fitopatógenos y la cutícula de los insectos; por lo tanto, son efectores clave de la resistencia sistémica adquirida en las plantas, la cual es desencadenada principalmente por la fitohormona ácido salicílico (Durner et al., 1997).
La relación entre los aumentos del contenido de ácido salicílico y la actividad de GLU en las hojas de cacahuate tratadas con quitosano fue informada por Sathiyabama y Balasubramanian (1998). Una de las vías conocidas para la biosíntesis del ácido salicílico en las plantas es liderada por la PAL (Chen et al., 2009). Sin embargo, la disminución de los niveles de transcritos de PAL observados en las plántulas de trigo tratadas con COS, no evitó el aumento de los transcritos PR CHI y GLU, lo cual pudo ocurrir por una acumulación de ácido salicílico inducida por COS predominantemente a través de una vía alternativa controlada por la enzima isocorismato sintasa (Catinot et al., 2008). Por lo tanto, sería muy interesante estudiar el efecto de los derivados de quitosano en la expresión de isocorismato sintasa, pero también determinar si la inducción de estos transcritos relacionados con la defensa, correlaciona con una disminución in vivo de la susceptibilidad de plántulas de trigo, tratadas con quitosano y COS contra las infecciones fúngicas.
Las diferencias entre los patrones de expresión provocados por el quitosano y los COS indican que las especies moleculares en la mezcla de COS pueden tener un mecanismo de acción particular diferente al del quitosano polimérico, el cual es una molécula más compleja con un patrón de acetilación diferente. Los patrones de reconocimiento de células para especies no acetiladas parecen carecer de receptores específicos; entonces, las propiedades inductoras del quitosano parecen estar mediadas por la interacción entre sus cargas positivas y los fosfolípidos de membrana cargados negativamente (Silipo et al., 2010). Algunos receptores potenciales que se unen con alta afinidad a las especies más acetiladas se caracterizaron desde la membrana plasmática de plantas modelo (Kaku et al., 2006; Miya et al., 2007), lo que sugiere que un COS N-acetilado puede desencadenar respuestas específicas, lo cual explica, en parte, los diferentes patrones de expresión entre las plántulas de trigo tratadas con COS o quitosano. Nuestros resultados concuerdan con Vander et al. (1998), quienes encontraron que los quitosanos N-acetilados parcialmente inducían actividades enzimáticas de marcadores de resistencia en las hojas de trigo, mientras que las especies oligoméricas fallaron al inducir la deposición de lignina. La biosíntesis de precursores de lignina se realiza en la ruta de fenilpropanoides, que está regulada por PAL. Por lo tanto, sería interesante ver si (o no) un tratamiento combinado de quitosano polimérico y COS podría mejorar la inducción de respuestas de defensa en mayor medida.
Conclusión
Nuestra investigación muestra la capacidad de los derivados de quitosano para modular diferencialmente la expresión local y sistémica de genes relacionados con la protección en el trigo. El tipo y la concentración de activadores parecen determinantes para la respuesta: los COS con un grado de polimerización de tres a cuatro unidades ejercen efecto mayor con dosis mayores. Pero las concentraciones de quitosano polimérico, aparentemente, no siguen una relación lineal directa con la inducción de la acumulación de transcritos relacionados con la protección. Estos resultados pueden ayudar a entender la activación de procesos protectores provocados por derivados del quitosano en plántulas de trigo y su posible relación con la inducción de la resistencia sistémica.
Literatura Citada
Barber, M. S., R. E. Bertram, and J. P. Ride. 1989. Chitin oligosaccharides elicit lignification in wounded wheat leaves. Physiol. Mol. Plant Pathol. 34: 3-12. [ Links ]
Barros, J., H. Serk, I. Granlund, and E. Pesquet. 2015. The cell biology of lignification in higher plants. Ann. Bot. 115: 1053-1074. [ Links ]
Brugnerotto, J., J. Lizardi, F. M. Goycoolea, W. Argüelles-Monal, J. Desbrieres, and M. Rinaudo. 2001. An infrared investigation in relation with chitin and chitosan characterization. Polymer. 42: 3569-3580. [ Links ]
Cabrera, J. C., and P. Van Cutsem. 2005. Preparation of chitooligosaccharides with degree of polymerization higher than 6 by acid or enzymatic degradation of chitosan. Biochem. Eng. J. 25: 165-172. [ Links ]
Catinot, J., A. Buchala, E. Abou-Mansour, and J. P. Metraux. 2008. Salicylic acid production in response to biotic and abiotic stress depends on isochorismate in Nicotiana benthamiana. FEBS Lett. 582: 473-478. [ Links ]
Chen, Z., Z. Zheng, J. Huang, Z. Lai, and B. Fan. 2009. Biosynthesis of salicylic acid in plants. Plant Signaling Behav. 4: 493-496. [ Links ]
Curtis, B. C. 2002. Wheat in the world. In: Curtis, B. C., S. Rajaram, and H. Gomez M. (eds). Bread Wheat: Improvement and Production. Plant Production and Protection Series No. 30. FAO, Rome. [ Links ]
Desmond, O. J., J. M. Manners, A. E. Stephens, D. J. Maclean, P. M. Schenk, D. M. Gardiner, A. L. Munn, and K. Kazan. 2008. The Fusarium mycotoxin deoxynivalenol elicits hydrogen peroxide production, programmed cell death and defence responses in wheat. Mol. Plant Pathol. 9: 435-445. [ Links ]
Durner, J., J. Shah, and D. F. Klessig. 1997. Salicylic acid and disease resistance in plants. Trends Plant Sci. 2: 266-274. [ Links ]
Falcón-Rodríguez, A. B., J. C. Cabrera, E. Ortega, and M. A. Martínez-Téllez. 2009. Concentration and physicochemical properties of chitosan derivatives determine the induction of defense responses in roots and leaves of tobacco (Nicotiana tabacum) plants. Am. J. Agric. Biol. Sci. 4: 192-200. [ Links ]
Falcón-Rodríguez, A. B., D. Costales, J. C. Cabrera, and M. A. Martínez-Téllez. 2011. Chitosan physico-chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae. Pestic. Biochem. Physiol. 100: 221-228. [ Links ]
FAO. 2014. Maize, rice, wheat farming must become more sustainable. FAO, Rome. http://www.fao.org/news/story/en/item/273303/icode/ (Accessed: April 2017). [ Links ]
Gozzo, F. 2003. Systemic acquired resistance in crop protection: from nature to a chemical approach. J. Agric. Food Chem. 51: 4487-4503. [ Links ]
Hasan, M. M., M. Cha, V. K. Bajpai, and K. H. Baek. 2013. Production of a major stilbene phytoalexin, resveratrol in peanut (Arachis hypogaea) and peanut products: a mini review. Rev. Environ. Sci. Bio/Technol. 12: 209-221. [ Links ]
Kaku, H., Y. Nishizawa, N. Ishii-Minami, C. Akimoto-Tomiyama, N. Dohmae, K. Takio, E. Minami, and N. Shibuya. 2006. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor. Proc. Natl. Acad. Sci. U.S.A. 103: 11086-11091. [ Links ]
Kauss, H., W. Jeblick, and A. Domard. 1989. The degrees of polymerization and N-acetylation of chitosan determine its ability to elicit callose formation in suspension cells and protoplasts of Catharanthus roseus. Planta. 178: 385-392. [ Links ]
Kombrink, E., and K. Hahlbrock. 1986. Responses of cultured parsley cells to elicitors from phytopathogenic fungi timing and dose dependency of elicitor-induced reactions. Plant Physiol. 81: 216-221. [ Links ]
Lin, W., X. Hu, W. Zhang, W. J. Rogers, and W. Cai. 2005. Hydrogen peroxide mediates defence responses induced by chitosans of different molecular weights in rice. J. Plant Physiol. 162: 937-944. [ Links ]
Li, P., R. J. Linhardt, and Z. Cao. 2016. Structural characterization of oligochitosan elicitor from Fusarium sambucinum and its elicitation of defensive responses in Zanthoxylum bungeanum. Int. J. Mol. Sci. 17: 2076. [ Links ]
Ma, Z., L. Yang, H. Yan, J. F. Kennedy, and X. Meng. 2013. Chitosan and oligochitosan enhance the resistance of peach fruit to brown rot. Carbohydr. Polym. 94: 272-277. [ Links ]
Miya, A., P. Albert, T. Shinya, Y. Desaki, K. Ichimura, K. Shirasu, Y. Narusaka, N. Kawakami, H. Kaku, and N. Shibuya. 2007. CERK1, a LysM receptor kinase, is essential for chitin elicitor signaling in Arabidopsis. Proc. Natl. Acad. Sci. U.S.A. 104: 19613-19618. [ Links ]
Moloi, M. J., and A. J. van der Westhuizen. 2006. The reactive oxygen species are involved in resistance responses of wheat to the Russian wheat aphid. J. Plant Physiol. 163: 1118-25. [ Links ]
Pritsch, C., C. P. Vance, W. R. Bushnell, D. A. Somers, T. M. Hohn, and G. J. Muehlbauer. 2001. Systemic expression of defense response genes in wheat spikes as a response to Fusarium graminearum infection. Physiol. Mol. Plant Pathol. 58: 1-12. [ Links ]
Roelfs, A.P., R. P. Sing, and E. E. Saari. 1992. Rust diseases of wheat: Concepts and methods of disease management. CIMMYT, México. 81 p. [ Links ]
Sathiyabama, M., and R. Balasubramanian. 1998. Chitosan induces resistance components in Arachis hypogaea against leaf rust caused by Puccinia arachidis Speg. Crop Prot. 17: 307-313. [ Links ]
Silipo, A., G. Erbs, T. Shinya, J. M. Dow, M. Parrilli, R. Lanzetta, N. Shibuya, M. A. Newman, and A. Molinaro. 2010. Glyco-conjugates as elicitors or suppressors of plant innate immunity. Glycobiology. 20: 406-419. [ Links ]
Vander, P., K. M. Vårum, A. Domard, N. E. El Gueddari, and B. M. Moerschbacher. 1998. Comparison of the ability of partially N-acetylated chitosans and chitooligosaccharides to elicit resistance reactions in wheat leaves. Plant Physiol. 118: 1353-1359. [ Links ]
Vishu K., A. B., M. C. Varadaraj, R. G. Lalitha, and R. N. Tharanathan. 2004. Low molecular weight chitosans: preparation with the aid of papain and characterization. Biochim. Biophys. Acta. 1670: 137-146. [ Links ]
Zhu, Q., E. A. Maher, S. Masoud, R. A. Dixon, and C. J. Lamb. 1994. Enhanced protection against fungal attack by constitutive co-expression of chitinase and glucanase genes in transgenic tobacco. Nat. Biotechnol. 12: 807-812. [ Links ]
Recibido: Mayo de 2017; Aprobado: Octubre de 2017











 texto en
texto en 



