Introducción
La presencia de arsénico (As) en concentraciones de 500 a 500 000 μg L-1 en agua superficial y de pozos compromete su uso para consumo humano y agrícola (Núñez et al., 2016; Rosas-Castor et al., 2016; Yazdani et al., 2016). Al respecto, la Organización Mundial de la Salud recomienda como límite máximo permisible 10 μg L-1 y 20 000 μg kg-1 de As en el agua para consumo humano y en el suelo, respectivamente (Ng et al., 2003). En respuesta a estas recomendaciones, México bajó paulatinamente la concentración de As permitida en agua potable de 50 a 25 μg L-1 (NOM, 2000).
México ocupa uno de los primeros lugares en el mundo en contaminación de cuerpos de agua por concentraciones altas de As, principalmente en agua subterránea. Armienta y Segovia (2008)) indicaron que las fuentes principales de As en reservorios de agua son naturales, como meteorización de rocas, mineralizaciones, geotermalismo y erupciones volcánicas (Bundschuh et al., 2008). Un área con esta problemática es la región del Bajío Guanajuatense, en la provincia fisiográfica de la Faja Volcánica Transmexicana (FVTM). En esta área existe vulcanismo activo, su relieve está conformado por conos volcánicos basálticos y dominan fallas geológicas de extensión (Ferrari, 2000). Esta combinación de factores geológicos y geomorfológicos permite contenidos elevados de As y facilidad de su transporte a través de las fracturas. Hay pocos estudios regionales que aborden el origen y los mecanismos de movilización del As en acuíferos usados para riego de cultivos.
En acuíferos de la Cuenca La Independencia, en el norte del estado de Guanajuato las concentraciones de As son 25 a 120 μg L-1, y podrían deberse a la disolución de minerales ricos en este elemento dentro de los acuíferos (Ortega-Guerrero, 2009). Morales-Arredondo et al. (2015) señalaron un origen geogénico del As en el agua subterránea, asociado especialmente a rocas riolíticas y a la influencia de la actividad geotermal en el municipio de Juventino Rosas, en el centro del estado de Guanajuato. Rodríguez et al. (2016) cuantificaron 330 μg As L-1 en agua de pozo para riego en la localidad de El Copal, comunidad de Irapuato, Guanajuato.
Los humanos estamos continuamente expuestos a fuentes naturales de As por actividades antropogénicas, como consumo de alimentos con este metaloide proveniente del sistema agua-suelo-cultivo (Ongley et al., 2007). La agricultura es la actividad antropogénica que usa la mayor proporción de agua, por lo cual la absorción de As por los cultivos a través de su sistema radicular, desde el suelo y el agua de riego debe investigarse (Dahal et al., 2008; Marques et al., 2009; Rothwell et al., 2009). El incremento de la concentración de As en el sistema agua-suelo-cultivo por actividad agrícola, como riego con aguas profundas, uso de pesticidas que contienen As y agua residual de la minería es evidente (Zhao et al., 2008; Vamerali et al., 2009; Lu et al., 2010). El incremento se agudiza en cultivos con consumo mayor, como la cebada (Hordeum vulgare L.), y en Guanajuato se produce un tercio del volumen nacional de cebada, por lo que ocupa el primer lugar en México.
La tolerancia al As es variable entre los cultivos agrícolas, los límites varían en la misma planta y dependen de la saturación de agua, la aireación y otras características del suelo (Srivastava et al., 2012). La acumulación de As en planta también depende de la presencia en el medio de fosfatos, sulfatos, carbonatos y otros compuestos químicos (Lu et al., 2010; Brackhage et al., 2014). El fosfato y el arseniato son químicamente similares y compiten por intercambio de iones en los intersticios del suelo, por lo cual en suelos con contenido alto de fosfato pueden existir menos espacios para la adsorción del arseniato (Violante y Pigna, 2002). El arseniato en la planta interrumpe el metabolismo del fosfato y reacciona con los grupos sulfhídricos de enzimas, lo que inhibe la función celular y provoca la muerte de la planta (Wang et al., 2002). El arseniato y el fosfato se transportan por la misma vía en las plantas superiores, con transportadores que tienen afinidad mayor por el fosfato (Zhao et al., 2002; Zhao et al., 2008).
Los fertilizantes minerales con sales fosfatadas son comunes para el cultivo de cereales, pero hay pocos estudios acerca del efecto del contenido de P en el agua de riego sobre la acumulación de As en las plantas. Smith et al. (2002) demostraron que el P aplicado al cultivo puede desplazar al As del suelo, dejarlo disponible para la planta, en la cual aumenta la concentración de As. En plantas de cebada maltera cultivada en macetas, con suelos con 10 450 a 13 580 μg As kg-1, de Zimapán, Hidalgo, México, y regada con agua de pozo contaminada con 400 μg As kg-1, la concentración de As alcanzó hasta 33 130 μg kg-1 (Prieto et al., 2010).
Por la afinidad química de As y P la presencia de ambos elementos en el agua de riego podría generar competencia entre ellos tanto en el suelo como en la planta (Moreno-Jiménez et al., 2012; Bolan et al., 2013; Lee et al., 2016). Por lo tanto, el objetivo de nuestra investigación fue evaluar el efecto de la concentración de P en el agua de riego contaminada con As sobre la acumulación de P en plantas de cebada cultivadas en suelo contaminado con As, en Irapuato, Guanajuato. Los transportadores en la planta son más afines al P (Zhao et al., 2008), por lo cual la hipótesis fue que la planta de cebada acumula menos As proveniente del suelo y el agua si la concentración de P es mayor en el agua de riego.
Materiales y Métodos
Características del sitio del experimento
Este estudio se realizó en la localidad El Copal, ubicada a 10 km de Irapuato, en el centro-sur del estado de Guanajuato (20° 44’ 42.10’’ N, 101° 19’ 39.63’’ O y altitud media de 1800 m). En la región existen valles intermontanos extensos, rellenos de sedimentos continentales modernos. El clima es cálido subhúmedo, con precipitación anual entre 550 y 700 mm y temperatura media anual de 18 °C. La evaporación media anual es de 1300 mm, con un déficit hídrico de 600 mm; por lo que la profundidad de extracción del agua de pozo dedicada al riego aumenta cada año. Debido a los cuerpos rocosos y sus orígenes el agua de riego puede ser fuente de metales pesados.
Los suelos cultivados en la zona El Copal son Vertisoles (USDA, 2014), de coloración oscura, formados en climas templados bajo un régimen rústico de humedad y se caracterizan por un contenido alto en minerales de arcilla (Eash et al., 2008).
Suelo empleado
En el estudio se utilizaron 1.82 m3 de suelo, en la capa con 0.3 m de profundidad, de una parcela agrícola, con densidad aparente de 1.11 g cm-3, 55.96 % de arcilla, pH de 8.17 y 2.76 % de materia orgánica. El riego en El Copal es con agua de pozo profundo y su concentración media anual es 330 μg L-1.
Diseño experimental
El efecto del P se evaluó con un diseño experimental multifactorial, con nivel variable de tipo 3x3x2. En esta etapa se evaluaron la concentración de As y de P en el agua de riego y en el desarrollo de la cebada en el tiempo. Los niveles de P en el agua de riego (PAR) fueron 120, 210 y 300 μg L-1 y los de As (AsAR) fueron 50, 200 y 400 μg L-1; y el tiempo de desarrollo (t) fue 45 y 90 d después de la siembra. Un testigo o blanco (B) fue agua destilada (libre de As y P) para el riego (Cuadro 1). La variable de respuesta fue la concentración de As en la planta (AsPP). Todos los tratamientos se realizaron en triplicado.
Cultivo de las plantas
La siembra se hizo con semilla certificada (var. Esmeralda) el 20 de diciembre de 2009, en 57 pilas de suelo de 0.126 m2 de área, con 38 kg cada una. En cada pila se sembraron manualmente 45 semillas, por el método al tresbolillo (plantas en filas paralelas en las que cada planta de una fila queda frente a un hueco, entre dos plantas, de la fila siguiente). Sulfato de amonio al 19 % por ha (75 kg de N) se aplicó al inicio y 45 d después de la siembra. Las plantas se mantuvieron en el campo cercano al laboratorio.
Riego
El riego se realizó con agua destilada mezclada con As (Na2HAsO4·7H2O 99.98 % de pureza; Sigma-Aldrich, México) y P (NaH2PO4 99.00 % de pureza; Sigma Aldrich, México) en concentraciones definidas para cada tratamiento (Cuadro 1). El Na2HAsO47H2O en agua se disocia en arseniato (AsO4 -3), la forma presente comúnmente en el agua de riego y en el suelo en condiciones aeróbicas (Zhao et al., 2008). El NaH2PO4 en agua se disocia en fosfato (PO4 -3), como ocurre con los fertilizantes fosfatados en suelo en condiciones aeróbicas. Los riegos se aplicaron al inicio de la siembra (día 0) y 30 y 51 d después de la siembra (dds). En el primer riego se aplicó una lámina de 40 mm de espesor de solución acuosa (5.04 L), en el segundo y tercer riego se aplicaron 60 mm (7.56 L). De acuerdo con el área de las pilas (0.126 m2), un volumen total de 20.16 L de solución con concentraciones de As y P se aplicó según los tratamientos (Cuadro 1).
Determinación de arsénico total
AsPP se determinó en cada pila, a los 45 y 90 dds. De cada pila se extrajeron 15 plantas (con raíz), se lavaron con agua destilada y deshidrataron a 70 °C por 72 h, se trituraron en un mortero y se pasaron por un tamiz de 1 mm. El contenido de As del suelo se determinó al inicio y al final del estudio y en el fertilizante nitrogenado.
Para la digestión de las muestras de planta, suelo y fertilizante se usó el método EPA3051A/2007. El As total se cuantificó con el método EPA 6010C 2007/ICP: se pesa 0.5 g de muestra homogenizada, se agregan 10 mL de HNO3 concentrado (grado traza metal, 69 %; Fisher Scientific) y se colocan en horno de microondas (CEM, Modelo MARSX 230/60). La digestión se desarrolla en dos etapas: 1) con presión de 0.827 MPa (120 psi) a 90 °C y temperatura constante por 15 min; 2) la mezcla se calienta a 130 °C (se alcanzaron en cerca de 5 min) y se mantiene así 25 min. Las muestras digeridas se enfrían a temperatura ambiente, se filtran (papel Watman 41) y se aforan a 50 mL con agua tridestilada. El contenido de P y As se determinó en un espectroscopio de emisión atómica de plasma acoplado por inducción (ICP-AES; modelo Iris Intrepid Thermo Elemental, Thermo Scientific Company, Waltham, MA, EUA), que se calibró con un blanco y cinco estándares.
Resultados y Discusión
Arsénico en suelo
La concentración media de As en el suelo al inicio del estudio fue 1372 ± 20 μg kg-1. Esta concentración fue baja en comparación con la reportada por Dahal et al. (2008) (6 100 y 16 700 μg kg-1) en suelo superficial del distrito Nawalparasi, Nepal, y por Roychowdhury et al. (2005) (hasta 19 400 μg kg-1) en India. En la zona dedicada a la actividad minera de Zimapán, Hidalgo, la concentración de As en el suelo fue 52 000 μg kg-1 (Ongley et al., 2007) y la acumulación de As en el tejido de las plantas fue de 8 440 a 12 390 μg kg-1, en algunos de los 62 cultivos que incluyen epazote (Chenopodium ambrosoides), chayote (Sechium edule), chilacayote (Cucurbita ficifolia) y perejil (Petroselinum crispum) (Prieto et al., 2005). La concentración de As en el suelo en nuestro experimento (1 370 ± 20 μg kg-1) fue menor que en los estudios mencionados, principalmente porque el cultivo de arroz, hortalizas y bulbos requieren más riego que los granos, como cebada, trigo, maíz y sorgo. Al respecto, Mukherjee et al. (2017) señalaron que el volumen agua de riego para la producción de arroz en la India es 12 000 a 14 000 m3 ha-1 y, según Perez et al. (2011), la cebada en Guanajuato emplea un volumen máximo de riego de 7 540 m3 ha-1. Aunque en Guanajuato hay una zona minera, la zona de nuestro estudio está a más de 45 km, por lo que no es fuente de As para los suelos agrícolas; además, el fertilizante utilizado no aportó As.
Arsénico en la planta
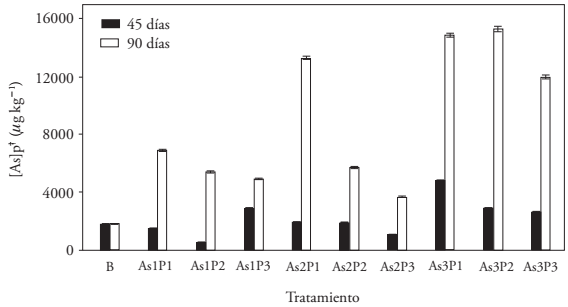
La concentración promedio de AsPP a los 90 dds fue mayor que a los 45 ddds, pero en el testigo (B) aumentó 1.1 % (Figura 1). Esto indica que la velocidad de absorción de As por la planta aumentó y acumuló 4.7 veces más As en los últimos 45 d (entre el macollaje y la elongación del tallo). Malhi et al. (2012) señalaron que la cebada absorbe el P en forma sigmoidea, desde su emergencia hasta la etapa del llenado de grano. La competencia del P y As explica el incremento en la velocidad de absorción de As por la planta. La concentración de AsPP en B no aumentó entre los 45 y 90 dds, y la planta creció manteniendo la tasa de absorción de As del suelo por kg de tejido. Además, la concentración promedio de AsPP en los tratamientos con 400 µg L-1 de AsAR, a los 90 dds, fue 2.4 veces mayor a la de los tratamientos con 50 µg L-1 de AsAR. El promedio de As acumulado en las plantas de los tratamientos con 300 µg L-1 de PAR fue 6 871 ± 1 051 µg kg-1, y el promedio de AsPP para los tratamientos con 120 µg L-1 de PAR fue 11 733 ± 4 229 µg kg-1. Esto representó 41.4 % menos As acumulado en la cebada, debido a la mayor concentración PAR. Además, AsPP de la cebada con el tratamiento AS3P1 fue 2.2 veces mayor que con As1P1. También, el tratamiento As1P3 mostró menos acumulación AsPP que As1P1 y As1P2; similarmente, en As2P3 respecto a As2P1 y As2P2, y en As3P3 comparado con As3P1 y As3P2. La acumulación mayor de As en la planta se obtuvo a los 90 dds en los tratamientos As3P2 (15 354 ± 91 µg kg-1) y As3P1 (14 926 ± 67 µg kg-1) que usaron agua de riego con la cantidad mayor de As y las menores de P. Las dos concentraciones de AsPP menores (a 90 dds) se observaron en los tratamientos As1P3 (4 920 ± 39 µg kg-1) y As2P3 (3 670 ± 35 µg kg-1), los cuales tenían la concentración mayor de PAR. Este comportamiento es similar al descrito por Saldaña-Robles et al. (2012).
Arsénico en suelo al final del experimento
Al inicio del estudio el suelo contenía 1 370 ± 20 μg As kg-1 (As0, Figura 2) y al final (CASFIN) presentó 1 386 ± 2, 1 469 ± 12 y 1 568 ± 5 μg kg-1 en los tratamientos con agua de riego con 50, 200 y 400 µg As kg-1, respectivamente, lo que son aumentos de 1.1, 7.1 y 14.2 % en CASFIN, con correlación lineal significativa (R2 = 0.999) entre porcentaje y concentración de AsAR. Las pilas de cada tratamiento (misma AsAR) tuvieron variación baja, con un máximo de 20 µg kg-1. Por lo tanto, la cantidad acumulada de As en el suelo dependió sólo de la concentración AsAR y no de la concentración PAR. Estos resultados coincidieron con los de Dahal et al. (2008), quienes monitorearon la influencia de la contaminación de As por agua de riego en suelos alcalinos y la toma de As por las plantas en campo, y concluyeron que la concentración de As en suelo y planta es influenciada por el contenido de As en el agua de riego.

† [As]s: Concentración de As en suelo al final del experimento.
¶ As0: Concentración de As en suelo al inicio del experimento.
Figura 2 Concentración de As en suelo (( DE) al final del cultivo de cebada (B: testigo).
Las plantas con la misma concentración AsAR mostraron diferencias en el As absorbido y distinta concentración PAR, lo que sugiere que PAR afectó la concentración de AsPP, pero no en CASFIN. El efecto de PAR se explica por su intervalo amplio en diferencia de masa de As acumulado entre el suelo y la planta (principalmente en edades tempranas), el aumento de ocurrencia de procesos de intercambio iónico, en los que As en el agua de riego se acumula, en términos de masa total, en proporción alta en el suelo en comparación con la cantidad de As absorbido por la planta. A pesar de lo anterior, la concentración de As en la planta de cebada puede ser hasta 12 veces mayor que la del suelo.
La concentración de As y P en el agua de riego y por efecto de t en el desarrollo de las plantas fue significativa (p ≤ 0.05) en la concentración de As en la planta. Las interacciones AsAR-AsAR, AsAR-t y PAR-t también fueron significativas (Cuadro 2).
Cuadro 2 Análisis de varianza para planta As.
| Fuente | Suma de cuadrados (108) | F | Grados de libertad | p ≤ |
|---|---|---|---|---|
| AsAR | 2.31527 | 111.02 | 1 | 0.0000† |
| PAR | 0.67871 | 32.54 | 1 | 0.0000† |
| t | 6.68840 | 320.71 | 1 | 0.0000† |
| AsAR-AsAR | 0.19412 | 9.31 | 1 | 0.0039† |
| AsAR-PAR | 0.05268 | 2.53 | 1 | 0.1193 |
| AsAR-t | 0.99640 | 47.78 | 1 | 0.0000† |
| PAR-PAR | 0.04137 | 1.98 | 1 | 0.1662 |
| PAR-t | 0.41813 | 20.05 | 1 | 0.0001† |
| Bloques | 0.00114 | 0.03 | 2 | 0.973 |
| Error total | 0.89675 | 43 | ||
| Total (correl.) | 12.1168 | 53 |
† Diferencia significativa (p≤0.05).
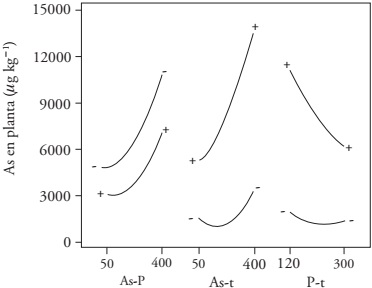
Los efectos estadísticos simples mostraron que la combinación de la concentración más alta de AsAR (400 μg L-1), la menor de PAR (120 μg L-1) y t mayor (90 d) tendieron a acumular más AsPP (> 7 400 μg kg-1). Al contrario, la combinación de la concentración menor de AsAR (50 μg L-1), la mayor de PAR (300 μg L-1) y el t menor (45 d) mostró que AsPP disminuyó (< 3 400 μg kg-1) (Figura 3). El efecto de PAR en AsPP acumulado pudo deberse a la similitud de la forma química de fosfatos y arseniatos, lo que generaría competencia en su absorción por la planta, y en los sitios de adsorción en el suelo. Lee et al. (2016) confirmaron este mecanismo mediante la descripción del arseniato como análogo del fosfato y la ruta de acceso a la planta de arroz, con los mismos transportadores. Smith et al. (2002) indicaron que la adición de fosfatos en el suelo puede liberar arseniatos y favorecer su absorción por la planta. En nuestro estudio se observó un efecto opuesto, con lo que se fortalecen antecedentes que demuestran que el arseniato compite con el fosfato como sustrato en la toma de nutrientes de la planta, con afinidad mayor por los fosfatos (Zhao et al., 2008; Moreno-Jiménez et al., 2012). Entonces, el fosfato adicionado causa competencia con el arseniato por los sitios de adsorción en el suelo, lo que a su vez afecta la disponibilidad de As para la planta que de preferencia incorpora P, y el suelo es el medio que acumula la mayor parte de As. Bolan et al. (2013) observaron que el P puede inhibir la absorción de As por la planta; por lo tanto, la presencia de P en el agua de riego disminuye la acumulación de As en la planta de arroz, de acuerdo con Lu et al. (2010).
La interacción AsAR-PAR no fue significativa (p > 0.05) para la acumulación de As en la planta y la interacción AsAR-AsAR sí lo fue (Cuadro 2 y Figura 4). Esto indica un aumento exponencial de la concentración de AsPP dependiente del aumento en la concentración de AsAR. La significancia de la interacción AsAR y t (p ≤ 0.05) se observó en el incremento de As en la planta, que en promedio fue 4.7 veces entre la siembra, a los 45 d y 90 d de desarrollo del cultivo. PAR-t tuvo efecto significativo en la acumulación de As en la planta, pues a 45 d de desarrollo, AsPP se acumuló en la planta casi en la misma cantidad que cualquier concentración PAR y a los 90 d, a mayor concentración de PAR AsPP fue menor (Figura 4).
Conclusiones
La planta de cebada incrementa su contenido de As con la concentración de este elemento en el agua de riego; en contraste, a mayor contenido de P en el agua de riego, la acumulación de As decrece en la planta de cebada. Este efecto se acentúa con el desarrollo del cultivo. Arsénico y P compiten en el suelo y la planta, pero la afinidad es mayor por el P en la planta. El suelo acumula el As que proviene del agua de riego, en forma lineal, sin influencia significativa de la concentración de P en esa agua.











 texto en
texto en