Introducción
La mayor parte de población rural en México (cerca de 24 millones de personas) vive en zonas áridas o semiáridas y 60 % de ellas vive en condiciones de pobreza alimentaria. La inclusión de nuevos alimentos puede contribuir a mejorar el estado nutricional de dichas poblaciones, así como ampliar la oferta de agro productos susceptibles de ser comercializados.
Dentro de las zonas áridas de México, el género Yucca es el segundo más importante en distribución y diversidad, después del género Agave (Flores-Hernández et al., 2011), y está conformado por unas 47 especies distribuidas principalmente en las zonas áridas o semiáridas de México (Piña, 1979). Estas especies se usan como material para construcción, materia prima en la industria de la cordelería, combustible, y fuente de alimentos, principalmente las inflorescencias y, con menor frecuencia, los frutos o dátiles (Granados-Sánchez y López-Ríos, 1998; Aguirre, 2008).
Entre los compuestos químicos presentes en el género Yucca, los de mayor interés son las saponinas que se usan en productos con propiedades surfactantes (Balandrin, 1996); en alimentos como aditivos (Jensen y Elgaard, 2001; Aoun et al., 2003); cosméticos (Balandrin, 1996); y como materia prima de productos con actividad farmacológica, precursores hormonales, anti cancerogénicos y anti virales (Man et al.,2010; Saleem et al., 2010; Son et al.,2012). No hay un uso pleno de los frutos de diferentes especies de yuca, como complemento dietético, como aditivo en alimentos funcionales ni como fuente de moléculas con actividad biológica.
A pesar del potencial del aprovechamiento de los frutos, no existe información referente a las características físicas y nutricionales para ninguna especie del género Yucca, por lo que es difícil analizar su aporte como parte de la ingesta en nutrición humana. Por lo tanto, el objetivo del presente estudio fue determinar las variables nutricias relevante de los frutos de Yucca mixtecana, para evaluar su empleo en nutrición humana.
Materiales y Métodos
Material vegetal
Frutos maduros de Y. mixtecana se seleccionaron con base a su color y la textura. Los frutos se clasificaron por su color, amarillo uniforme en el mesocarpio y amarillo con manchas obscuras en el epicarpio; firmeza del mesocarpio y facilidad de separación del pedúnculo; todas características físicas indicadoras de la madurez. La recolección se realizó dentro de la colección viva del jardín botánico Dr. Cassiano Conzatti del Centro de Investigación para el Desarrollo Integral regional (CIIDIR- IPN) unidad Oaxaca, México.
Caracterización morfológica
Las variables físicas se determinaron sobre el fruto en el segundo estadio de maduración (fruto maduro) y para su cuantificación se aproximó el contorno del fruto al de un cilindro, en donde el ancho corresponde a la dimensión del radio en la parte central del cilindro.
El epicarpio, el endocarpio y el mesocarpio se removieron mediante disección mecánica, para después cuantificar su peso (base húmeda). El mesocarpio removido se usó para determinar las propiedades nutricias.
Cuantificación de color
El color del mesocarpio se determinó con un colorímetro MiniScan EZ (HunterLab, Reston Eter, EUA) y los resultados se registraron en una escala CIE La*b*. El parámetro L representa la luminosidad de la muestra de 0 a 100 (mayor luminosidad); la coordenada a* representa el cambio de color de rojo (+) a verde (-), y la coordenada b* representa el cambio de color de amarillo (+) a azul (-).
Los parámetros de matiz de color (h° y C*) se calcularon con las Ecuaciones 1 y 2. Los parámetros de matiz de color oscilan de 0° (color rojo puro), 90° (color amarillo puro), 180° (color verde puro) hasta 270° (color azul puro) (Sant´Anna et al., 2013).
Acidez titulable
Esta evaluación se realizó mediante potenciometría (HANNA HI-98172, EUA) de acuerdo con la Norma Mexicana NMX-F-102 (2010). El resultado se expresó en mg de equivalentes de ácido cítrico por 100 g de endocarpio (EAC 100g-1).
Sólidos totales
Los sólidos totales se cuantificaron por refractometría (Westover RHB-32ATC, EE. UU. A) de acuerdo con la Norma Mexicana NMX-F-112-NORMEX-2010 (2010). El contenido de sólidos totales se expresó como grados Brix.
Humedad
La humedad se cuantificó con el método 934.06 modificado de la AOAC (1996) en 5 g de mesocarpio fresco. La temperatura de secado en vacío fue 105 °C (Shell lab SVAC1, EUA), con intervalos de cuantificación de 24 h (30 min de atemperado en desecador), hasta que la variación fuera menor de 0.01 g (Denver Instrument TP-1114), y el peso se expresó en g de agua por g de sólido seco (gH20 gss -1).
Cenizas totales
El contenido de materia inorgánica se cuantificó con el método 923.03 de la AOAC (2005), mediante mufla (Thermolyne Furnace 1400, EUA) y el contenido de cenizas se expresó como % compuestos inorgánicos (base seca).
Proteína cruda (PC)
La cuantificación de la PC se realizó con el método 960.52 de la AOAC (1995), empleando un equipo de micro digestión y destilación (Foss tecator 2100 Kjetlec EUA), y un factor de conversión de 6.25 se usó para expresar el contenido de PC como el % de proteína (base seca).
Determinación de azúcares reductores y totales
El contenido de azúcares totales se determinó de acuerdo con la Norma Oficial Mexicana NMX-F-312-NORMEX-2016 (2016) y se expresó como el % de azúcares (base seca).
Contenido de lípidos
El contenido de lípidos totales se determinó con el método 991.36 de la AOAC (2006) y se expresó como % de lípidos (base seca).
Contenido de fibra cruda (FC) total
El contenido de FC se determinó con la metodología de Olvera et al. (1993) y se expresó como el % de FC (base seca).
Contenido de fenoles totales
Este contenido se determinó mediante la técnica espectrofotométrica de Folin-Ciocalteu (espectrofotómetro BBC Cintra 4040, EUA), con la metodología de Almaraz-Abarca et al. (2004) y se usó ácido gálico como estándar de referencia. El contenido total de fenoles se expresó como mg de equivalentes de ácido gálico por g de muestra base seca (EAG g ss -1).
Contenido de saponina
El contenido de saponinas se determinó mediante el método afrosimétrico reportado por Guzmán et al. (2013) y se maceraron 10 g de mesocarpio fresco en agua destilada, (1:3 v/v), por 15 min - 25 °C. El contenido de saponinas se expresó como mg de saponinas por g de muestra base seca (ST gss -1).
Perfil de ácidos grasos (AG)
La evaluación del perfil de AG se realizó mediante la identificación y cuantificación de su funcionalización (metil-esteres) y la funcionalización de acuerdo con la metodología de Martínez et al. (1999). Por cada 100 mL de extracto etéreo proveniente de los frutos, se adicionaron 800 µL de solución de cloroformo-metanol (J. T. Baker) en una proporción (2:1 v/v). A 200 µL de esta solución se adicionó 1 mL de HCl-metanol (J.T. Baker) en una concentración [1 N]. La reacción ocurrió a 80 °C durante 20 min, se agregaron 200 µL de agua destilada, y se extrajeron los metil-esteres mediante una extracción liquido-liquido con hexano cromatográfico (Fermont); para remover los residuos de la solución polar se usó sulfato de sodio anhidro (J. T. Baker). La solución se decantó y se evaporó bajo una corriente de nitrógeno; los metil-ésteres se suspendieron en 1.4 mL de hexano cromatográfico (Fermont) antes de su inyección.
Los metil-ésteres se identificaron en un cromatógrafo de gas con un detector de ionización de flama (Perkin-Elmer Clarus 580, EUA) y se usó una columna capilar Elite-SMS-30 (30 m x .32 x 0.25 μm; Perkin-Elmer), una relación de inyección “split” de 100:1, la temperatura de inyección y la del detector fue 220 °C y la del horno fue 186 °C en un método isotérmico de 16 min. El volumen de inyección fue 2 μL de muestra. La identificación se realizó por comparación de los tiempos de retención con respecto a estándares de referencia (Supelco fatty acid methyl esters, C4 - C24).
Para cuantificar el perfil de AG se uzó hexadecano (Sigma-Aldrich) como estándar interno, de acuerdo con la Ecuación 3 y la Ecuación 4
Donde: Cx: concentración del AG en la muestra (mg 100 mg-1 de extracto etéreo), Ve: volumen de solvente.
Donde: Ci: concentración de AG en el extracto final (mg mL-1); Cs: concentración del estándar interno en el extracto (mg mL-1); Ax: área del compuesto de interés; As: área del estándar interno
Determinación de minerales
Esta determinación se realizó mediante espectrometría de emisión atómica de plasma (Termo Electron Corporativo IRIS INTREPID II XSP Duo, EUA). La cuantificación de potasio se efectuó mediante espectrofotometría y se usóortofosfato dihidrógeno de potasio (Sigma-Aldrich) como estándar. Los resultados se expresaron en mg del elemento por 100 g de sólido seco.
Tamaño de la muestra
El tamaño de muestra se determinó con la Ecuación 4 (Levin y Rubin, 2004). Por cada elemento de la muestra se realizaron las determinaciones por triplicado.
Donde: N: total de frutos en la población; za 2 = 2.57, para α = 0.01; p: posibilidad de obtener información de la muestra (0.5); q: posibilidad de no obtener información de la muestra (0.5); d: margen de error máximo porcentual admitido (0.5)
Resultados y Discusión
Análisis de datos
De acuerdo con número total de frutos contabilizados en las plantas de la colección viva, se determinó una muestra de siete frutos por planta, para un total de 35 frutos analizados, sin considerar el número de réplicas determinadas.
Caracterización morfológica
Los frutos de Y. mixtecana, (Figura 1) tienen forma capsular, epicarpio fino y delgado, mesocarpio blando y ligeramente amarillento, que rodean un tejido capsular donde están las semillas (color negro mate de forma lacriformes).
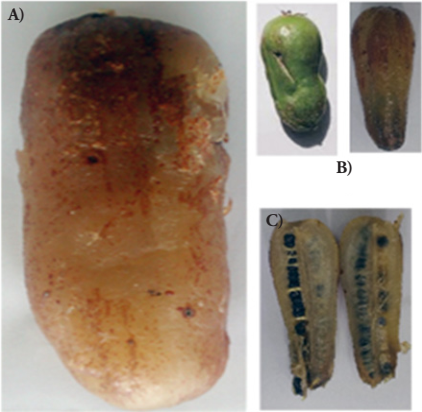
Figura 1 Frutos de Yucca mixtecana. A) Frutos maduros; B) frutos en el primer y tercer estado de maduración; C) vista transversal del fruto.
Los frutos son climatéricos y se constató al menos tres estados de maduración. El más evidente fue el tercer estado caracterizado por un obscurecimiento acentuado del epicarpio y mesocarpio.
En el primer estado de maduración, el epicarpio y el mesocarpio tienen un color verde y una textura compacta; el epicarpio está fuertemente adherido. El pedúnculo del fruto es difícil de separar de la planta.
En el segundo estado de madurez el epicarpio se encuentra ligeramente adherido y la firmeza del mesocarpio disminuye sin perder su consistencia. El pedúnculo es fácilmente separable de la planta, ocasionando la caída del fruto con facilidad. El color del mesocarpio cambia hacia un amarillo uniforme. De acuerdo con la metodología empleada para evaluar el color, el mesocarpio y el epicarpio tienen a exhibir un color luminoso y orientado a tonos rojizos (Cuadro 1).
Cuadro 1 Parámetros de color de fruto
| Tejido | Segundo estado de madurez | Tercer estado de madurez | ||||
|---|---|---|---|---|---|---|
| L* | C* | h° | L* | C* | h° | |
| Epicarpio | 49.80 | 25.78 | 1.01 | 39.52 | 22.48 | 0.96 |
| Mesocarpio | 55.59 | 44.95 | 0.82 | 46.32 | 38.62 | 0.84 |
En el tercer estado de madurez el mesocarpio adquiere una coloración más obscura (Cuadro 1) la adherencia del epicarpio es similar al del segundo estado de madurez y la consistencia es blanda perdiendo su estructura en el mesocarpio. El epicarpio y el mesocarpio pierden luminosidad aunque siguen exhibiendo un matiz rojizo característico.
La sensación gustativa del mesocarpio es dulce con regusto astringente con respecto al epicarpio, que exhibe un gusto neutro.
Características físicas
La mayor parte del peso del fruto lo constituye el mesocarpio (Cuadro 2), el cual representa una fracción del peso similar al endocarpio. La principal fuente de proteínas en la dieta humana es tejidos de origen animal o leguminosas (cacahuates, garbanzos, soja, y otros), pero su consumo posee inconvenientes relacionados con la calidad de las proteínas, y con la presencia de diversos compuestos con actividad biológica indeseada o perjudicial para la salud humana (hormonas del crecimiento, pesticidas, presencia de aflatoxinas, entre otras).
Cuadro 2 Propiedades físicas de frutos frescos de Yucca mixtecana.
| Peso (g) | 100.49 ± 19.73 |
| Ancho (cm) | 5.68 ± 0.50 |
| Largo (cm) | 11.70 ± 3.72 |
| Biomasa del epicarpio (g) | 10.10 ± 0.45 |
| Biomasa del mesocarpio (g) | 49.48 ± 10.42 |
| Biomasa del endocarpio (g) | 40.90 ± 12.74 |
| Humedad (gH2O gss -1) | 31.50 ± 1.78 |
| Sólidos totales, mesocarpio | 11.10 ± 0.70 |
| Acidez titulable (EAC 100 g-1) | 0.03 ± 0.00 |
† Los resultados son el promedio de tres réplicas
La ingesta proteínica diaria recomendada para dietas en humanos, varía de 16.2 g a 65 g d-1 (Latham, 2002), que se puede satisfacer de forma adecuada por la ingesta de los frutos la cual puede cubrir 3 % a 13.5 % de la ingesta diaria recomendada para seres humanos.
Composición de las variables nutritivas del mesocarpio
Proteína cruda (PC)
El contenido de PC de los frutos (Cuadro 3) es más elevado respecto a la mayoría de las frutas de consumo frecuente, cuyo contenido promedio es cercano al 1 % (Silva, 1994), con excepción a los frutos de Persea americana (aguacate) que tienen 2.1 % de PC (Silva, 1994).
Azúcares reductores totales
El contenido de azúcares totales (Cuadro 3) es sensiblemente más bajo que los encontrados en la mayoría de las frutas de consumo frecuente y varía de 6 a 22 % (Silva, 1994; Latham, 2002). Por lo tanto, su incorporación en la ingesta diaria como complemento energético no sería significativa.
Lípidos totales
El contenido de lípidos del fruto de Y. mixtecana (Cuadro 3) indica que tiene características no oleaginosas, con valores muy inferiores a otros frutos con alto contenido de lípidos, por ejemplo, P. americana y Oleae europeae, con valores promedio de 20 % (Silva, 1994).
Perfil de ácidos grasos (AG)
Los AG predominantes fueron palmítico 42.40 mg 100 mg-1 de extracto etéreo, oleico, 39.40 mg 100 mg-1, y esteárico 18.10 mg 100 mg-1 de extracto etéreo.
Dietas cuya relación de concentración entre ácidos insaturados y saturados es mayor a la unidad (denominadas dietas mediterráneas) se han correlacionado con una disminución del riesgo de enfermedades cardiovasculares, así como alteraciones en la generación de energía en las mitocondrias (Siri-Tarino et al., 2010). Aun así, dietas con relación de concentración de AG más equilibrado tienen correlación positiva con mejores tasas metabólicas de generación y aprovechamiento energético, y con menores tasas de oxidación fraccional de sustratos biológicos ocasionados por el consumo en exceso de oxígeno post trabajo (BØrsheim et al., 2006).
Nuestros resultados muestran que la concentración de grasas saturadas es superior que las insaturadas, pero la proporción de estas últimas es cercana a la encontrada en los frutos de Helianthus annuus, Arachis hypogaea y Cocos nucifera. El fruto de Y. mixtecana podría ser una fuente importante de energía. La Organización Mundial de la Salud recomienda consumir dietas con perfiles lipídicos en donde las ácidos poli insaturados deben constituir del 6 al 11 % del total de lípidos ingeridos, pero los ácidos saturados deben ser menos del 10 % del total (WHO, 2003; FAO, 2010).
Compuestos fenólicos
El contenido de fenoles totales (Cuadro 4) fue comparable al reportado para frutos de Prosopis alba, 0.6 EAG g ss -1 (González-Galán et al., 2008), y mayor al de diversas especies de Opuntia, 0.153 EAG g ss -1 (Aquino et al., 2012).
Cuadro 4 Fenoles totales y saponinas en frutos frescos de Yucca mixtecana.
| Fenoles totales (EAG g ss -1) | Saponinas (ST gss -1 ) |
|---|---|
| 0.63 ± 0.03 | 0.01 ± 0.00 |
† Los resultados son el promedio de tres replicas.
Nuestros resultados muestran que el contenido de fenoles y saponinas es bajo por lo que su efecto anti nutricio es mínimo. Las actividades biológicas de los compuestos fenólicos de los alimentos son como vasodilatadores, anti carcinogénicos, moduladores de la respuesta anti inflamatoria, bactericidas y estimuladores de la respuesta inmune (Jiang y Dusting, 2003). La inhibición de la acción oxidativa de radicales libres (Owen et al., 2000) y la modulación de genes mutagénicos pro carcinógenos e inductores de procesos de inflamación (Bravo, 1998) son sobresalientes.
Entre los aspectos anti nutricios de la ingesta de compuestos fenólicos se encuentra la disminución de las tasas de adsorción de proteínas, la inactivación de enzimas digestivas (Martínez-Valverde et al., 2000); y la disminución de la biodisponibilidad de minerales, principalmente fierro y zinc (Hurrell et al., 1997; Martínez-Valverde et al., 2000). La actividad biológica de los compuestos fenólicos depende de la concentración, tipo de compuesto fenólico y biodisponibilidad (Jiang y Dusting, 2003; Galati y O´Brien, 2004).
Contenido de saponinas
El contenido de saponinas en frutos de Y. mixtecana es sensiblemente menor al reportado en el epicarpio y del mesocarpio de Prosopis alba, 0.80 mg g-1 de sólido seco (González-Galán et al., 2008), y en frutos de diversas especies del género Opuntia relacionadas con los hábitats donde prospera el género Yucca (0.70 ST gss -1) (Aquino et al., 2012).
Las moléculas agliconas (sapogeninas) y glucósidas de las saponinas se relacionan con efectos indeseados o nocivos para la nutrición humana y animal. Las moléculas glucósidas ocasionan la formación de espuma en el aparato digestivo, mientras que las moléculas agliconas están relacionadas con actividad biológica (Forturbel, 2003; Güclü-Üstündağ y Mazza, 2007). La actividad biológica derivada de las sapogeninas (hidrólisis ácida de las saponinas) se relaciona con efectos hipo colesterolémicos (López et al., 1993), anti micóticos (Zamilpa et al., 2002); anti virales (Aquino et al., 1991), anti cancerígenos (Sung et al., 1995);, hipoglucémica (Kato et al., 1995), anti trombóticos (Zhang et al., 1999), diuréticos (Silva et al., 2005) anti inflamatorios (da Silva et al., 2002), y molusquicidas (Abdel-Gawad et al., 1999). No existe información referente a la ingesta media máxima de sapogeninas recomendada; aunque se desaconseja la ingesta elevada de las mismas (Southonh et al., 1988).
Minerales
Los frutos de Y. mixtecana (Cuadro 5) son ricos en magnesio y calcio. La concentración de minerales en frutos tiene una correlación significativa con la concentración de los mismos en el suelo, el régimen hídrico al cual está sujeta la planta durante el periodo de fructificación, el clima y el genotipo (Vig et al., 2003; Barceló y Poschenrieder, 2003; Rooney, et al., 2006). Por lo tanto, la inferencia referente al aporte de los frutos de Y. mixtecana a la dieta diaria se debería realizar en un marco multifactorial. Entre los minerales cuantificados en el fruto, solamente el hierro y el calcio son considerados esenciales (James y Schofield. 1999). El consumo de los frutos de yuca suplementa parcialmente el consumo recomendado de hierro 21a 48 mg d-1 y calcio de 400 a 700 mg d-1.
Conclusiones
La composición nutricional evaluada en los frutos de Yuca mixtecana indica que se pueden considerar como complementos nutricionales de la dieta, ya que el consumo moderado del fruto puede aportar los requerimientos nutricionales de proteínas y fibras necesarios en una dieta equilibrada.
La relación entre los ácidos grasos indica una proporción mayor de ácidos saturados, la que se desaconseja en la dieta para humanos. Pero en los frutos de yuca la concentración de lípidos totales es baja en comparación con la mayoría de los alimentos.
La concentración de compuestos fenólicos y saponinas no es un factor limitante en la ingesta de este fruto. Las bajas concentraciones de estos compuestos mejoran las características sensoriales y aseguran una baja toxicidad.











 texto en
texto en 


