Introducción
El jiló (Solanum gilo Raddi) (Solanaceae) es originario de India y los esclavos lo introdujeron en Brasil. Sus frutos son comestibles, de color verde claro o verde oscuro, volviéndose rojizo anaranjados cuando maduros (Filgueira, 2003). El jiló, también conocido como berenjena escarlata o berenjena roja brasileña, es un vegetal con buena aceptación en el mercado, especialmente en la región sureste de Brasil. Sin embargo, existen pocos estudios sobre esta especie, en su mayoría dedicados a las semillas (Alves et al., 2012).
El grado de maduración de las semillas impacta su calidad, y las semillas inmaduras tienen bajo vigor y poder de germinación (Carvalho et al., 2009). El periodo de antesis a maduración fisiológica varía de una especia a otra, y en ocasiones de una variedad a otra (Araújo et al., 1982). Para algunas especies con frutos carnosos, las semillas continuarán su maduración después de la cosecha (Barbedo et al., 1994; Justino et al., 2015). Esta es una ventaja porque el número de cosechas disminuye y permite cosechar frutos con distintas etapas de maduración (Mengarda y Lopes, 2012).
La definición de la maduración fisiológica de las semillas es importante para estimar el tiempo de cosecha. Por ende, es necesario evaluar la calidad fisiológica de las semillas y estas evaluaciones generalmente se llevan a cabo a través de pruebas de germinación y de vigor. Sin embargo, el análisis de rayos X es una técnica prometedora para la evaluación de la calidad de la semilla (Gomes Júnior et al., 2012), ayudando a estimar el tiempo de maduración.
Simak y Gustafsson (1953) realizaron la primera evaluación de semillas con especies coníferas utilizando el análisis de rayos X. Esta técnica analiza la estructura interna de la semilla a través de su exposición a una fuente de baja energía de rayos X; las fracciones de radiación entran en la semilla y llegan a la capa, permitiendo la formación de una imagen caracterizada por distintos tonos de gris. El principio de la técnica es la absorción de rayos X en distintas cantidades por los tejidos de la semilla debido a su estructura, composición y densidad, además del periodo de exposición a radiación (ISTA, 2004).
El análisis de imagen para evaluar la calidad fisiológica de las semillas puede ayudar a reducir la subjetividad del análisis, ya que elimina el error humano, volviéndolo un proceso más rápido y más eficiente. El análisis de imagen de las plántulas y las semillas es extraordinario en este sentido para muchas especies (Nunes et al., 2014), pero para las semillas de Solanaceae, como jiló, todavía hay poca información.
Los resultados de la prueba de rayos X han relacionado exitosamente la morfología interna de las semillas con la germinación o la morfología del jitomate (Lycopersicon esculentum) (Van der Burg et al., 1994), pimienta (Capsicum annuum) (Gagliardi y Marcos-Filho, 2011; Dell’Aquila, 2007), berenjena (Solanum melongena) (Silva et al., 2012), Acca sellowiana (Silva et al., 2013) y plántulas de calabaza (Cucurbita pepo) (Silva et al., 2014). Sin embargo, en la mayoría de los casos esta clasificación se realiza visualmente; por lo tanto, para desarrollar modelos de evaluación consistentes para definir categorías de extensión de desarrollo embrionario o espacio libre dentro de las semillas, se requieren métodos más precisos (Marcos-Filho et al., 2010).
No existen estudios para S. gilo que relacionan la morfología interna de las semillas con su etapa de maduración a través del análisis de imagen de rayos X. Por lo tanto, el objetivo de este estudio fue relacionar la morfología interna de las semillas de jiló en distintas etapas de maduración, con la germinación, usando imágenes radiográficas.
Materiales y Métodos
La producción de semilla de jiló se efectuó entre julio de 2014 y enero de 2015 en la granja Palmital en Ijaci, MG, Brasil (21° 9' 24" S, 44° 55' 34" O). Esta granja tiene una altitud promedio de 918 m y su suelo está clasificado como Oxisol arcilloso.
En la primera etapa del estudio, las plántulas de jiló provinieron de variedades de Morro redondo (verde oscuro redondos - VOR) y Tinguá (verde claro largo - VCL). Las semillas de ambas variedades de jiló se sembraron en charolas de plástico (poliestireno) de 128 celdas, con sustrato comercial Tropstrato HA - Vegetales, y después se cubrieron con vermiculita. Cuarenta días después de la siembra, las plántulas se trasplantaron a un invernadero y se plantaron en camas con 38 m de largo con 21 plantas cada una, espaciadas a 1 m entre filas y 0.60 m entre plantas.
Las flores se marcaron diariamente en el día de antesis para obtener el número de frutos para garantizar suficientes cantidades de semillas para todos los análisis. Los tratamientos para cada variedad fueron: T1) frutos cosechados 35 d después de antesis (DDA); T2) 40 DAA; T3) 45 DAA; y T4) 45 DAA + 7 d. En T4, los frutos cosechados 45 DDA permanecieron en descanso por 7 d en un espacio oscuro y ventilado en el laboratorio de semillas (LAS). El diseño experimental fue completamente aleatorio con cuatro réplicas de 50 semillas de cada tratamiento.
Las semillas se extrajeron manualmente y se lavaron en agua corriente. Después de su extracción, las semillas se colocaron en pantallas durante 24 h en un laboratorio ambiental y después se trataron con secado lento en un horno de circulación de aire (Nova Ética - 420) a 35 °C hasta llegar a un contenido de agua de alrededor de 8 % (Queiroz et al., 2011). Se tomaron radiografías de estas semillas y subsecuentemente se sometieron a una prueba de germinación. En los análisis radiográficos se colocaron cuatro réplicas de 50 semillas en cinta adhesiva transparente (bifaz) y se fijaron en film de plástico transparente. Las semillas de cada tratamiento se numeraron de acuerdo a la posición ocupada en la hoja. El film de plástico se colocó dentro del equipo digital de rayos X, Faxitron® marca MX-20 modelo DC-12, y se sometió a radiación por 12 s a 26 kV.
Después de retirarlas del film transparente, las semillas se transfirieron a cajas de acrílico (tipo gerbox) (110 x 110 x 35mm) siguiendo el mismo orden que tuvieron en las imágenes de rayos X. Después, se realizó la prueba de germinación en dos hojas de papel secante humedecidas con agua destilada en una proporción equivalente a 2.5 veces el peso del papel. Las semillas se distribuyeron en cajas acrílicas (tipo gerbox) en las mismas posiciones que estaban en las imágenes radiográficas y se mantuvieron en una cámara de germinación de semillas (tipo B.O.D.) bajo temperatura y luz alternadas, 20 °C / 16 h oscuridad, 30 °C / 8 h luz, según RAS (BRASIL, 2009).
El conteo se realizó 14 d después de la siembra (BRASIL, 2009). Las plántulas normales (PN), anormales (PA) y semillas muertas (SM) se fotografiaron con una cámara digital Canon SX50®. Las imágenes de las semillas radiografiadas se guardaron en formato JPEG y se analizaron con el programa ImageJ, adaptando la metodología de análisis utilizada en otros estudios a la medición del área foliar y las áreas internas de las semillas (Silva et al., 2013).
Los pasos de análisis en el programa ImageJ Versión 1.50i fueron los siguientes: apertura de imagen y su conversión a escala de grises en 8 bits seguida de una selección del área de interés para su análisis; selección de escala para calibración de la imagen, y en este estudio el número de mm de cada imagen (231 x 210 mm) se consideró como referencia. Las variables fueron: área del objeto, perímetro, desviación estándar y área de fracción, que representa las áreas libres internas de las semillas. El ajuste de color se hizo para separar las áreas de interés de otros componentes de la imagen; y finalmente, la medición de variables para obtener resultados. Todos los procedimientos se realizaron manualmente para cada semilla.
El espacio libre en la cavidad interna de la semilla se calculó utilizando el programa ImageJ con cuatro réplicas de 50 semillas para cada tratamiento. Para prevenir sesgos por posibles daños en las semillas debido a la extracción manual, evaluamos los promedios de espacio libre en la cavidad interna de la semilla, la germinación, las plántulas normales y anormales, y las semillas muertas de cada tratamiento. Los datos de la prueba de germinación y del análisis de imagen de las semillas se usaron para realizar un análisis ANOVA, y las medias de los tratamientos se compararon con la prueba Scott-Knott (p ≤ 0.05).
Resultados y Discusión
Los tonos en el análisis de imagen radiográfica se definen por el nivel de absorción de radiación en distintas áreas de la semilla, lo cual se determina por el grosor, la densidad y la composición de tejidos en la semilla (Simak, 1991; ISTA, 1993). Por ende, las semillas que carecen de tejido embrionario proporcionan imágenes oscuras porque no tienen resistencia a los rayos X.
Las imágenes radiográficas muestran el área interna de jiló con distintos porcentajes de áreas libres entre la capa y el endospermo de la semilla - embrión a distintas etapas de maduración. Todos los tratamientos para ambas variedades tuvieron áreas libres dentro de las semillas. La Figura 1 muestra semillas de variedades Morro Redondo y Tinguá, de frutos cosechados a T1 (35 DAA), T2 (40 DAA), T3 (45 DAA) y T4 (45 DAA + 7 d).
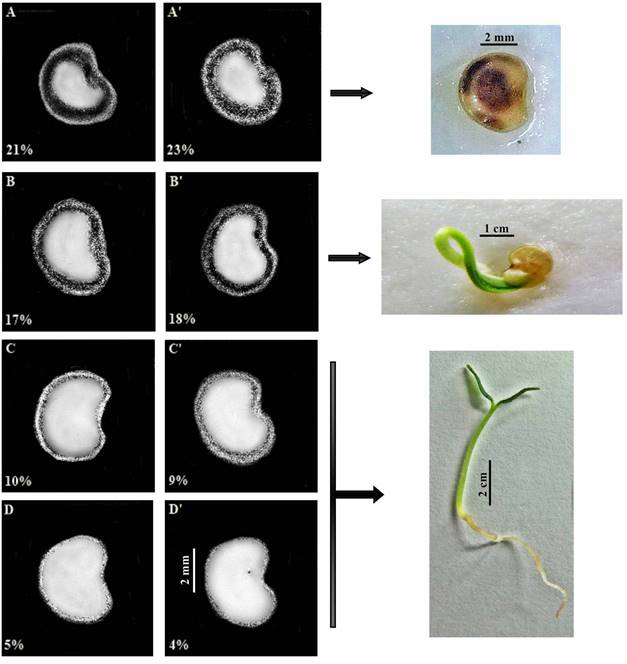
Figura 1 Imágenes radiográficas de semillas de jiló (Solanum gilo), variedades Morro Grande (A-D) y Tinguá (A’-D’), en distintas etapas de maduración. Semillas muertas en T1 - 35 DDA (A, A’), Plántulas anormales en T2 - 40 DDA (B, B’), y Plántulas normales en T3 - 45 DDA (C, C’), y T4 - 45 DDA + 7 d. (D, D’). El porcentaje representa el área libre interna.
Otros estudios también verificaron la eficiencia del análisis de imagen de rayos X al evaluar el área interna de semillas de pimentón (Gagliardi y Marcos-Filho, 2011), berenjena (Silva et al., 2012), melón (Cucumis melo), calabaza y sandía (Citrullus lanatus) (Gomes Júnior et al., 2012), y calabaza (Silva et al., 2014).
El programa ImageJ permitió la medición de las áreas libres internas de las semillas, que permitieron la evaluación de la relación entre el área interna libre de las semillas y la germinación. Este resultado es interesante porque las aproximaciones de software recomendadas para el análisis de imagen son: Tomato Analyzer® (Marcos-Filho et al., 2010) e Image ProPlus® (Dell’Aquila, 2007; Silva et al., 2012). Sin embargo, no encontramos ningún estudio de análisis de imagen con semillas de jiló que utilice el programa ImageJ en la literatura revisada; solamente hay un estudio con semillas de Acca sellowiana realizado por Silva et al. (2013) que utiliza este programa.
Por lo tanto, los resultados prometedores de este estudio mostraron una alternativa para explorar distintos tipos de semillas, ya que los métodos computarizados que usan captura de alta velocidad y procesamiento de imágenes, son la técnica no invasiva más avanzada que proporciona un alto nivel de eficiencia para analizar la calidad de las semillas (Dell’Aquila, 2009).
Con respecto a la temporada de cosecha del fruto (días antes de antesis), no hubo una diferencia estadísticamente significativa en cada etapa de maduración entre las variedades Morro Grande y Tinguá, que tienen distintos colores y formas, verde oscuro redondo y verde claro largo, respectivamente. Sin embargo, hubo una diferencia estadísticamente significativa en las áreas libres de semillas de ambas variedades (Cuadro 1). Los frutos T1 de variedades Morro Redondo y Tinguá cosechadas a 35 DDA tenían una mayor área promedio libre de 21 y 23 %, respectivamente, comparadas con frutos T2 cosechados a 40 DDA con un área promedio libre de 17 y 18 %. Los frutos T3 cosechados a 45 DDA tuvieron un área promedio libre de 10 y 9 %, y los frutos cosechados T4 a 45 DDA y que descansaron 7 d mostraron un área promedio libre de 5 y 4 %, para variedades Morro Grande y Tinguá, respectivamente (Cuadro 1 y Figura 1). Por ende, hubo una reducción en el área libre conforme avanzó la madurez en ambas variedades evaluadas. Las Figuras 2 y 3 muestran la distribución de áreas libres de semillas de variedades de Morro Redondo y Tinguá (n = 200) para todos los tratamientos.
Cuadro 1 Área libre (FA) interna de las semillas de jiló (Solanum gilo), porcentaje de germinación (G), porcentaje de plántulas normales (NS), plántulas anormales (AS), y semillas muertas (DS) para las variedades Morro Grande y Tinguá. (Siglas por el original en inglés)
| STAGE | FA (%) | G (%) | NS (%) | AS (%) | DS (%) | |
| Morro Grande | T1 - 35 DAA | 21 d | 0 d | 0 | 0 | 100 |
| T2 - 40 DAA | 17 c | 10 c | 0 | 20 | 80 | |
| T3- 45 DAA | 10 b | 86 b | 86 | 0 | 14 | |
| T4- 45 DAA + 7 d | 5 a | 100 a | 100 | 0 | 0 | |
| CV | 7.9 | 5.5 | ||||
| Tinguá | T1 - 35 DAA | 23 d | 0 d | 0 | 0 | 100 |
| T2 - 40 DAA | 18 c | 9 c | 0 | 17 | 83 | |
| T3- 45 DAA | 9 b | 84 b | 84 | 0 | 16 | |
| T4- 45 DAA + 7 d | 4 a | 100 a | 100 | 0 | 0 | |
| CV | 6.8 | 5.2 |
Los porcentajes con distintas letras en una columna son estadísticamente diferentes (Scott-Knott; p ≤ 0.05) para cada variedad.
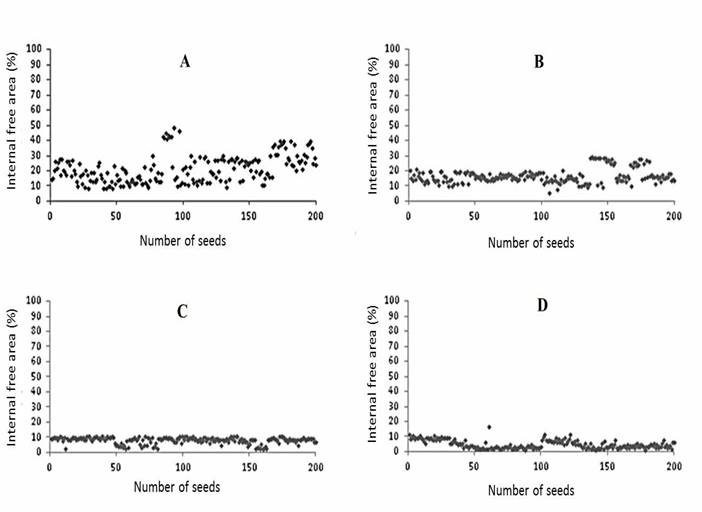
Figura 2 Área libre interna (%) ocupada por embrión y endospermo de cada semilla de jiló (Solanum gilo) en una muestra de 200 semillas, tratamiento - Morro Redondo. T1 - 35 DDA (A), T2 - 40 DDA (B), T3 - 45 DDA (C), y T4 - 45 DDA + 7 d (D).
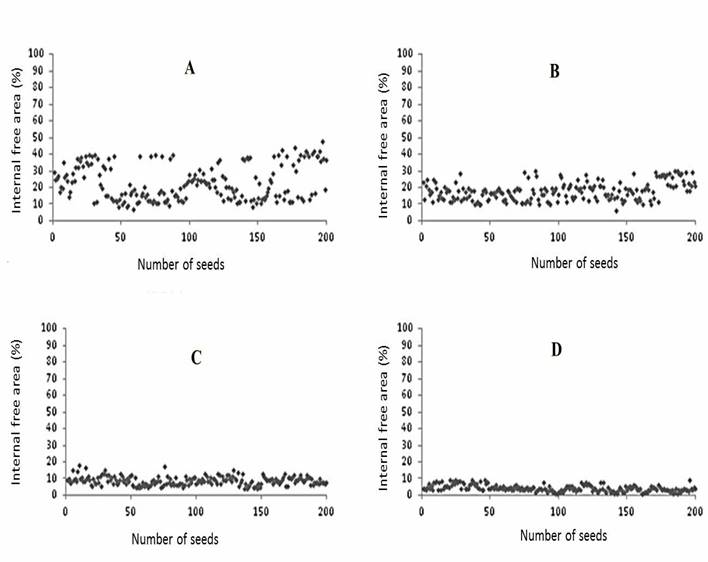
Figura 3 Área libre interna (%) ocupada por embrión y endospermo de cada semilla de jiló (Solanum gilo) en una muestra de 200 semillas, tratamiento - Tinguá. T1 - 35 DDA (A), T2 - 40 DDA (B), T3 - 45 DDA (C), y T4 - 45 DDA + 7 d (D).
Según Carvalho y Nakagawa (2000), entre más lejos de la antesis se separe la semilla de los frutos, más pesada será la semilla hasta llegar a la madurez fisiológica. Miranda et al. (1992) estudiaron la madurez del fruto de berenjena y concluyeron que no hubo diferencia en el aumento de peso seco entre las semillas recolectadas a 50 DDA y las semillas cosechadas a 60 DDA. Las semillas de paprika a 55 DDA llegaron a una madurez fisiológica completa, que es el punto donde las semillas llegaron al mayor peso, y por lo tanto, el mejor momento de cosecha (Oliveira et al., 1999). De manera similar, para las variedades Morro Grande y Tinguá de semillas de jiló, con el avance en la etapa de maduración, ocurrió una mayor acumulación de reserva, que se evidenció en el aumento en el peso de la semilla evaluado (Alves et al., 2017).
La evaluación de la morfología interna de la semilla es importante para caracterizar algunas especies poco estudiadas, para mejorar la calidad de los lotes de semillas, respecto a sus atributos físicos y fisiológicos, dado que las semillas defectuosas o vacías afectan los resultados de germinación (Gomes Júnior, 2010). Por ende, los análisis que realizamos en nuestro estudio son útiles para separar los lotes de semillas de alta y baja calidad, contribuyendo al control de calidad de semillas de jiló.
Al final de la prueba de germinación (14 d) contamos el porcentaje de plántulas normales y anormales y las semillas muertas de variedades Morro Redondo y Tinguá. Los resultados tanto para las variedades Morro Redondo como Tinguá fueron: T1 no tuvieron germinación y 100 % de las semillas muertas para ambas variedades; T2 tuvieron un porcentaje de germinación de 10 y 9 %, sin plántulas normales, 20 y 17 % de plántulas anormales, y 80 y 83 % de semillas muertas, respectivamente; T3 tuvieron tasas de germinación y porcentaje de plántulas normales de 86 y 84 %, no hubo plántulas anormales y resultaron en un 14 y 16 % de semillas muertas, respectivamente; T4 tuvieron 100 % de plántulas normales para ambas variedades. No hubo diferencias estadísticamente significativas entre las variedades Morro Grande y Tinguá para estas características. Sin embargo, las semillas T4 fueron estadísticamente superiores a las T3, que fueron mayores a las T2 y T1 en ambas variedades para el porcentaje de germinación (Figura 1 y Cuadro 1).
Hubo una relación entre la germinación y el área libre interna porque, de acuerdo al momento de cosecha (días después de antesis), los resultados fueron significativamente mayores de T1 a T4, lo cual significa que las semillas tuvieron una reducción en el área vacía y un aumento en el porcentaje de germinación directamente proporcional a la etapa de maduración, como se observó en la Figura 1 y el Cuadro 1. Por lo tanto, se recomienda la cosecha a 45 DDA + 7, ya que la germinación de semillas fue 100 % y resultó en 100 % plántulas normales en ambas variedades. Oliveira et al. (1999), Carvalho and Nakagawa (2000), Nakada et al. (2011) y Santos et al. (2015) encontraron resultados similares para aumento de peso seco, es decir, una reducción del área libre y mayor germinación de frutos cosechados en distintas etapas de maduración y días después de antesis.
Es de notarse que la ausencia de plántulas normales para T1 y T2 puede estar directamente relacionada a la inmadurez de las semillas y el alto porcentaje de área libre interna de la semilla, como se muestra en la evaluación de imágenes de rayos X junto con el programa ImageJ. Además, se relaciona con el potencial fisiológico, ya que, según Sediyama et al. (1991), la cosecha temprana puede resultar en menor germinación de la semilla y mayor número de semillas inmaduras.
En un estudio similar, Dell’Aquila (2007) encontró que en semillas de paprika, cuando el espacio libre entre el embrión y el endospermo era mayor de 2.7 %, es decir, semillas con área de endospermo y menos de 97.3 % embrión, hubo una reducción de la germinación con mayor porcentaje de plántulas anormales y no germinadas.
En estudios con Cecropia pachystachya (Pupim et al., 2008), aroeira (Schinus terebinthifolius) (Machado y Cicero, 2003), paprika (Dell’Aquila, 2007), berenjena (Silva et al., 2012), sandía (Gomes Júnior et al., 2012) y calabaza (Silva et al., 2014), las semillas parcialmente formadas con área libre interna no fueron capaces de producir plántulas normales en la prueba de germinación. No obstante, para muchas especies de frutos carnosos, la cosecha de frutos seguida de un periodo de descanso de 7 o 10 d interfiere positivamente en la calidad de la semilla (Dias y Nascimento, 2009).
Por lo tanto, el análisis de imagen radiográfico con el programa ImageJ parece ser una buena alternativa para la identificación de áreas libres internas de semillas de jiló (Solanum gilo), ayudando a un mayor o menor potencial fisiológico de los lotes en distintas etapas de maduración.
Conclusiones
El análisis radiográfico de imágenes de semillas de jiló (Solanum gilo), utilizando el programa ImageJ, permite la medición de áreas vacías internas en distintas etapas de maduración, así como la determinación de la relación entre el grado de vacío y la germinación. Por ende, es posible correlacionar estos datos con otros atributos de calidad de la semilla. Además, el uso de sistemas de análisis de imagen, como se reporta en este estudio, puede contribuir a mejorar la calidad de los lotes de semillas, permitiendo la identificación de semillas con mayor potencial para germinar, ayudando a los vendedores en el control de la calidad de jiló, y permitiendo reducir las pérdidas económicas.











 texto en
texto en 


