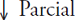Introducción
El incremento de CO2 atmosférico (Ca) influye en las relaciones de energía de la atmósfera y la fisiología de las plantas (Saurer et al., 2004; Huang et al., 2007; Battipaglia et al., 2013). El intercambio pasivo de gases entre la hoja y la atmósfera sugiere que el aumento de Ca puede reflejarse en el crecimiento mayor de la vegetación, pues el CO2 es un insumo de la fotosíntesis (A) (Goetz et al., 2011; Pieter y Scott, 2011). Sin embargo, el intercambio de gases entre la vegetación y la atmósfera es complejo y se requiere investigación detallada para explicar los efectos de incremento de Ca en el crecimiento arbóreo en condiciones ambientales diferentes y especies diversas (Silva et al., 2009; Xu et al., 2009; Roden et al., 2011).
Los experimentos controlados indican que al aumentar Ca las plantas tienden a cerrar los estomas y reducir su conductancia estomática (gs). Este efecto se traduce en un ahorro de agua, que puede conducir al aumento en la eficiencia de uso de agua (Algs), aunque esto no se refleja necesariamente en crecimiento mayor (Saurer et al., 2004; Lammertsma et al., 2011; Xu et al., 2014). El movimiento de CO2, de la atmósfera a las hojas, involucra dos procesos de fraccionamiento isotópico; el primero debido al proceso de difusión a través de los estomas y el segundo por la carboxilación de la enzima RUBIS-CO. Así, el cierre parcial de estomas, causado por un incremento en Ca, también limita la fotosíntesis y modifica la composición de isótopos de carbono y oxígeno en la madera (Farquhar et al., 1989; Mc Carroll y Loader, 2004). De acuerdo con las especies y las condiciones ambientales, el aumento de Ca puede influir de manera positiva o negativa en el crecimiento (Saurer et al., 2004; Peñuelas et al., 2011; Silva et al., 2015).
El estudio directo del intercambio de gases entre las especies forestales y la atmósfera en ambientes naturales es difícil, por lo que es común recurrir a técnicas de isótopos estables en combinación con el análisis de anillos de crecimiento (Silva et al., 2015; Dietrich et al., 2016). La composición de isótopos estables en anillos de crecimiento es una huella natural que sirve como un registro de información del estado hídrico y de la eficiencia de uso de agua en especies forestales que crecieron en décadas o siglos pasados (Mc Carroll y Loader, 2004; Barnard et al., 2012; Gómez-Guerrero et al., 2013).
Dado que el carbono y oxígeno son dos elementos integrados a la madera, el análisis de la composición de sus isótopos estables, paralelo con el estudio de los anillos de crecimiento, permite dilucidar los efectos de Ca sobre el crecimiento y estado hídrico histórico en especies forestales. Mientras que el 13C en los anillos de crecimiento ayuda a identificar eventos pasados de estrés hídrico (sequías) y cambios netos de discriminación de 13C de la atmósfera hacia la hoja, el 18O está relacionado con el proceso de evapotranspiración y apertura estomática (Dawson et al., 2002; Barnard et al., 2012). En tanto que las series de anillos de crecimiento proveen información de periodos favorables o desfavorables durante el crecimiento de los arboles (Fritts, 1976; Cook y Holmes, 1984).
Por la independencia de 13C y 18O, con relación a procesos fisiológicos de las plantas, para reconstruir el desempeño fisiológico de los árboles, se ha recurrido a una estrategia dual de isótopos de 13C, 18O y el análisis de crecimiento del árbol (Barnard et al., 2012; Roden y Farquhar, 2012). La eficiencia de uso de agua intrínseca (iWUE, sus siglas en inglés) estimada desde la composición de isótopos carbono en la madera, es un indicador fisiológico importante que permite entender como responden las especies forestales a los cambios de CO2 atmosférico en décadas recientes (Peñuelas et al., 2008; Peñuelas et al., 2011).
En este estudio se empleó una técnica dual δ13C y δ18O) de isótopos estables en la madera en combinación con el análisis de los anillos de crecimiento, para investigar la respuesta fisiológica del ahuehuete (Taxodium mucronatum Ten.) ante el aumento de CO2 atmosférico. Hay estudios en bosques boreales, templados y tropicales, pero las comunidades arbóreas de ambientes riparios como el ahuehuete no se han investigado. El ahuehuete es una especie sensible a la cantidad de precipitación y a la calidad del agua, y se asocia a reservorios permanentes o semipermanentes de agua (Suzán-Azpiri et al., 2007; Villanueva et al., 2010). El objetivo del presente estudio fue evaluar la composición de isótopos (δ13C y δ18O), la discriminación neta de 13C (Δ13C), la tasa de crecimiento en área basal y eficiencia de uso de agua intrínseca (iWUE) de T. mucronatum Ten. en los últimos 100 años, en tres regiones del centro de México con un gradiente de precipitación. Dada la sensibilidad del ahuehuete a la humedad, las variables fisiológicas mencionadas se analizaron con relación a periodos históricos secos y húmedos extremos en el siglo XX. Los periodos extremos se identificaron con métodos dendrocronológicos.
Las hipótesis fueron: 1) la respuesta fisiológica de T. mucronatum Ten. a la variación climática es diferente entre regiones; 2) los cambios en la tasa de crecimiento en área basal y variables fisiológicas de ahuehuete sugieren efectos de fertilización en el siglo XX.
Materiales y Métodos
Sitios de estudio
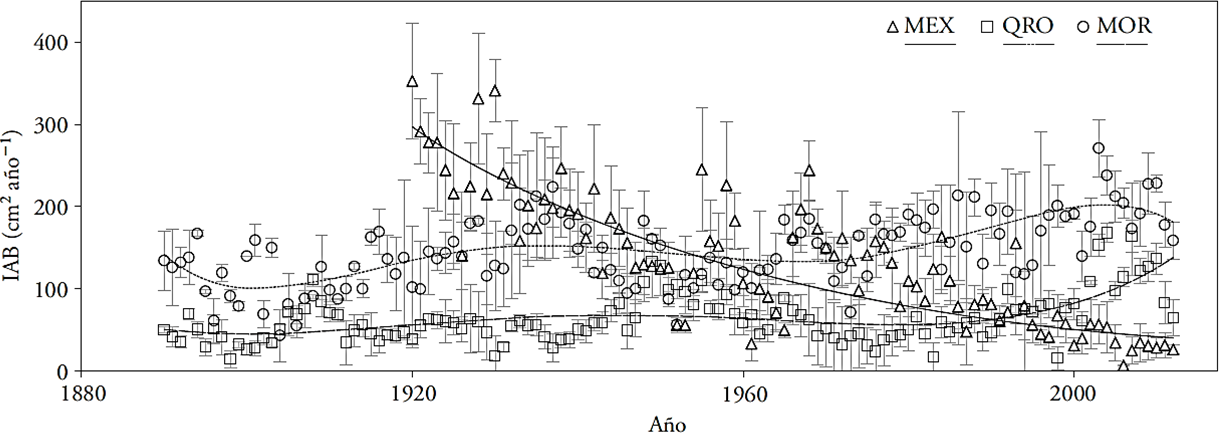
Los tres sitios de estudio se localizan en la región central de México, en poblaciones naturales de T. mucronatum Ten., en el Estado de México (MEX) y los estados de Querétaro (QRO) y Morelos (MOR); entre 18° 43’ 8.4’’ a 20° 33’ 00’’ N y 98° 44’ 06’’ a 100° 05’ 38.4’’ O (Figura 1). El régimen de humedad de los sitios MEX y QRO es ústico y en MOR údico. El régimen térmico de MEX es térmico y el de QRO y MOR isotérmico (Cuadro 1 y Figura 1).
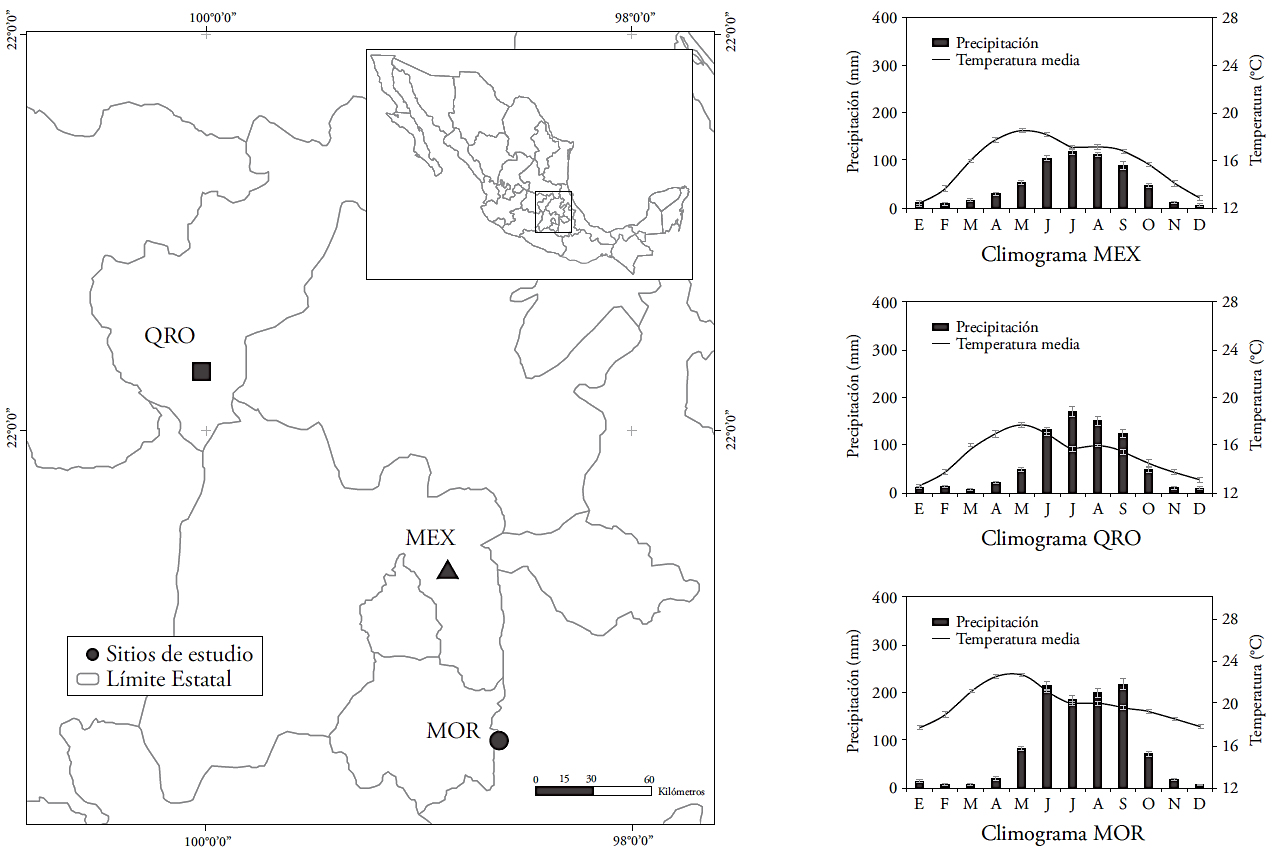
Figura 1 Sitios de estudio y climogramas. Estado de México (MEX), Querétaro (QRO) y Morelos (MOR). Los climogramas se elaboraron con la información de la base de datos ERIC III Versión 3.2 (Extractor Rápido de Información Climática) (IMTA, 2013) considerando de tres a cinco estaciones meteorológicas cercanas.
Cuadro 1 Información de los sitios de estudio.
| Variable | Sitio | ||
| MEX | QRO | MOR | |
| T. máx.(°C) | 24.7 | 22.9 | 27.5 |
| T. med. (°C) | 16.0 | 15.0 | 20.0 |
| T. min. (°C) | 7.0 | 7.5 | 12.5 |
| Precipitación (mm) | 600.0 | 750.0 | 1038.0 |
| Altitud (msnm) | 2330.0 | 1950.0 | 1400.0 |
| Tipo de suelo | Vertisol | Vertisol | Feozem |
| Clima | Templado Subhúmedo | Templado Subhúmedo | Cálido Subhúmedo |
| Fuente de agua | Manto freático | Corriente semipermanente | Corriente semipermanente |
Muestreo y fechado dendrocronológico
Nueve árboles se muestrearon por sitio, procurando una sección transversal del tronco en forma circular. De cada árbol se tomaron tres núcleos de madera distribuidos alrededor del tronco del árbol, a una altura de 1.3 m desde el nivel del suelo, con un taladro de Pressler marca HAGLÖF, modelo BS009 de 12 mm de diámetro interno. Las muestras de madera se secaron a temperatura ambiente y se lijaron con diversos grados de lija, para mejorar el contraste de los anillos de crecimiento. El ancho de anillo total se midió con un sistema VELMEX de precisión 0.001 mm (Robinson y Evans, 1980). El fechado se realizó con técnicas dendrocronológicas estándar (Stokes y Smiley, 1968). La calidad del fechado se verificó con el programa COFECHA (Holmes, 1983).
Estimación del incremento en área basal
El incremento en área basal (IAB) se estimó a partir de las mediciones de anchura de anillo, asumiendo anillos concéntricos regulares y con la siguiente fórmula:
donde R es el radio y n el año de formación del anillo. La ventaja del IAB para representar el crecimiento del árbol es que a diferencia del ancho de anillo permanece estable por más tiempo durante el desarrollo del árbol y permite una interpretación directa de la tasa de crecimiento, expresadas como área en cm2 año-1 (Poage y Tappeiner, 2002). La tendencia del IAB a través de tiempo se estimó con polinomios de orden cinco y con el modelo exponencial.
Identificación de eventos extremos de humedad (periodos secos y húmedos)
Las tendencias geométricas y biológicas no relacionadas con el clima (competencia, supresión y liberación) se removieron con el programa ARSTAN (Cook y Holmes, 1984), lo que permitió generar una serie de crecimiento anual estandarizada en cada población. Para resaltar eventos extremos de baja frecuencia (periodos secos y húmedos), se insertó una línea flexible suavizada (spline) en cada serie de índice de ancho de anillo (IAA) (Fritts, 1976; Cook y Peters, 1981). Después, los periodos secos y húmedos detectados en las series de crecimiento de T. mucronatum Ten. se cotejaron con otras series dendroclimáticas desarrolladas en México para corroborar respuestas en común a eventos climáticos extremos a nivel regional (Fritts, 1991; Stahle et al., 2009; Cook et al., 2010).
Análisis de isótopos en madera
De los nueve árboles muestreados en campo se seleccionaron los tres más representativos por sitio de acuerdo con su significancia en la cronología y para cada árbol y cada periodo extremo (seco y húmedo) identificado se obtuvo una muestra de aserrín. Se tomaron muestras por periodos de seis años para recolectar suficiente muestra y realizar el análisis de isótopos. Cuatro periodos secos fueron analizados: I: 1895-1900, III: 1947-1952, VI: 19962001 y VII: 2007-2012; y tres periodos húmedos: II: 1910-1915, IV: 1965-1970 y V: 1988-1993. Las muestras de aserrín de cada periodo se pesaron en una microbalanza (Sartorius, 0.01 mg) y se colocaron en capsulas de estaño y plata (Elemental Microanalysis Limited, Okehampton, Devon, UK) para el análisis de δ13C y δ18O, respectivamente. La determinación de δ13C se realizó en un analizador Europa ANCA-GSL acoplado a un espectrómetro de masas PDZ Europa 20-20 (Sercon, Cheshire, UK) y la determinación de δ18O se realizó en un analizador de oxigeno Hekatech HT (Wegberg, Germany) con interface al espectrómetro de masas mencionado. Todos los análisis se realizaron en el Laboratorio de Isótopos Estables de la Universidad de California Davis y los valores se expresaron en términos de sus respectivos estándares (δ13C, VPDB- Vienna Pee Dee Belemnite y δ18O, VSMOW- Vienna Estándar Mean Ocean Water).
Estimación de variables fisiológicas (δ13C, Ci y iWUE)
Para estimar las variables fisiológicas se consideró la evolución de la composición de isótopos de carbono 12C y 13C) en la atmósfera. La abundancia de 13C en la planta se expresa en términos relativos de fuente-producto (Δ13C, discriminación de carbono) considerando la variabilidad atmosférica (2) (Farquhar et al., 1982).
donde Δ es la discriminación contra 13C, δ13Caire es la composición de isótopos de carbono en el aire (fuente) y δ13Cplanta es la composición de isótopos de carbono del producto (biomasa de la planta). La discriminación de carbono se usa en fisiología ambiental para periodos de tiempo amplios con cambios en la composición de 13C en la atmósfera (época pre-industrial vs. actual) (Mc Carroll y Loader, 2004).
La concentración intercelular de CO2 (Ci) se estimó con la Ecuación 3.
donde a es la discriminación contra 13CO2 durante la difusión a través del estoma (≈4.4 ‰), b es la discriminación neta debido a la carboxilación (≈27 ‰), Ci y Ca son las concentraciones de CO2 interna y del ambiente, respectivamente. Considerando la Primer Ley de Fick (A = gCO2 (Ci/Ca)) esta ecuación se puede expresar de la siguiente Forma (4).
donde A es la tasa de asimilación de CO2, gCO2 es la conductancia estomática a CO2, y dado que gH2O o conductancia de la hoja a vapor de agua es 1.6 gCO2, los valores de (13C pueden relacionarse con el cociente entre A/gH2O; que representa la eficiencia de uso de agua intrínseca de la planta (iWUE) (Farquhar y Richards, 1984; Mc Carroll y Loader, 2004).
Análisis estadístico
Los datos se analizaron con un modelo de muestras repetidas en el tiempo con espaciado variable, usando el procedimiento MIXTO de SAS 9.3 (SAS, 2011). Los interceptos para cada árbol y el sitio se consideraron aleatorios; el efecto del tiempo, régimen de humedad e interacción se probaron a (p≤0.05) (Fitzmaurice et al., 2004). Para probar diferencias entre sitios, se realizó un análisis multivariado de la varianza (MANOVA), complementado por pruebas de contrastes entre sitios.
Interpretación de las tendencias en las variables fisiológicas
Los cambios en las variables fisiológicas se interpretaron considerando los escenarios propuestos por Saurer et al. (2004), y las relaciones entre δ13C y δ18O con relación a las variables fisiológicas (Scheidegger et al., 2000). Los tres escenarios de Saurer et al. (2004) consideran que: 1) Ci es constante (aumento de iWUE); 2) Ci / Ca es constante (aumento de iWUE) y; 3) Ci - Ca es constante (iWUE sin cambios). En el mismo orden, la interpretación es que Ci es independiente de los cambios de Ca, que Ci se ajusta proporcionalmente a los cambios Ca y que los cambios de Ci y Ca ocurren a la misma tasa. Una explicación detallada de estos escenarios se encuentra en Linares y Camarero, (2012). El método de Scheidegger et al. (2000) emplea relaciones entre δ13C y δ18O para deducir los cambios en la conductancia estomática (gl), capacidad fotosintética (Amax) y la eficiencia intrínseca de uso de agua (iWUE).
Resultados y Discusión
Series cronológicas e importancia de los periodos de baja frecuencia
La extensión cronológica varió de 109 a 233 años. Así, los árboles estudiados no se consideran seniles dada la longevidad de T. mucronatum Ten. que puede ser de varios siglos o rebasar el milenio (Villanueva-Díaz et al., 2010). La intercorrelación de las series fue significativa para todos los sitios, entre 0.36 y 0.51; mientras que la sensibilidad media varió de 0.34 a 0.43 (Cuadro 2). Ambos indicadores, muestran la influencia y variación de una señal climática común registrada en el ancho de los anillos; por lo cual, las series de crecimiento se consideran adecuadas para detectar eventos de alta y de baja frecuencia (Fritts, 1976; Constante et al., 2010). Por ejemplo, la intercorrelación de 0.32 se considera adecuada para fines de la tendencia general (Holmes, 1983). El grado de correlación entre series tiende a aumentar en lugares secos (Stahle et al., 2009), pero la mayor intercorrelación fue en el sitio de humedad intermedia, QRO. La sensibilidad media es un índice relativo del cambio de ancho de anillo de un año a otro y en este caso los valores de 0.34 a 0.43 son los esperados ya que la sensibilidad media varia de 0.15 a 0.65 dependiendo del tipo de clima. El parámetro de autocorrelación en las cronologías indica la relación que tiene una medición del año anterior con la del siguiente. Los valores de 0.64 a 0.78 en este estudio, se consideran altos y se explican por los ciclos anuales de humedad y sequía en los sitios de estudio (Cuadro 1). La mayor variación en ancho de anillo del sitio MEX puede estar relacionada con la menor precipitación del sitio y mayor abatimiento en mantos freáticos (Correa-Díaz et al., 2014).
Cuadro 2 Parámetros dendrocronológicos en los sitios de estudio.
| Sitio | Periodo | Extensión (años) | Anillos totales | Intercorrelación entre series | Sensibilidad media | Desviación Std. | Autocorrelación (Lag) |
| MEX | 1904-2012 | 109 | 492 | 0.396† | 0.401 | 2.695 | 0.783(1) |
| QRO | 1870-2012 | 143 | 1036 | 0.509† | 0.433 | 1.171 | 0.648(1) |
| MOR | 1780-2012 | 233 | 1159 | 0.364† | 0.344 | 0.975 | 0.642(1) |
†Cronología altamente significativa (valores superiores al de referencia, 0.328).
La cronología de este estudio se asoció con 83 % de los eventos extremos secos y con 44 % de los eventos húmedos extremos detectados en otras cronologías de ahuehuete para los estados de Puebla, Guanajuato y Querétaro (Therrell et al., 2006; Cortés-Barrera et al., 2010; Stahle et al., 2011), así como la de abeto de Douglas (Pseudotsuga menziesii Mirb. Franco) en Nuevo León (Arreola-Ortiz y Návar-Cháidez, 2010). Una mayor correlación con los eventos extremos secos es porque en años secos los anillos son más angostos. Aunque los eventos húmedos generan mayores anchuras de anillo, el grado de influencia está limitado por la capacidad de almacenamiento de agua en el perfil del suelo y los excedentes, por escurrimiento o por evapotranspiración, no influyen en el crecimiento en particular en periodos de inactividad fisiológica (Sarris et al., 2013).
Cambios en la composición de isótopos (δ13C y δ18O)
Los valores medios de δ13C fueron (24.05±0.12 ‰, -24.59±0.18 ‰, y -25.38±0.11 ‰, para MEX, QRO y MOR, respectivamente. La firma de 13C en los anillos de crecimiento es controlada principalmente por la diferencia entre la concentración de CO2 en la atmósfera y el árbol; es decir, depende de la tasa de fotosíntesis (carboxilación) y conductancia estomática (Mc Carroll y Loader, 2004; Holzkämper et al., 2008). Los cambios de δ13C a través del tiempo o de acuerdo con el régimen de humedad no fueron significativos (p≤0.05) en los sitios de MEX y QRO. En el sitio MOR los cambios de δ13C a través del tiempo fueron dependientes del régimen de humedad (evento seco o húmedo) (Figura 2, Cuadro 3). En este sentido, la composición de 13C en la madera no reflejó los cambios δ13C atmosféricos como ha ocurrido para otras especies forestales (García-G et al., 2004; Gómez-Guerrero et al., 2013; Silva et al., 2015). Generalmente la firma de δ13C refleja la dilución de 13C causada por el uso de combustibles fósiles (Mc Carroll y Loader, 2004). Aunque las diferencias no fueron significativas en el tiempo, los valores medios de -24.05 ‰, -24.59 ‰ y -25.38 ‰ si presentan diferencias significativas (p≤0.0001) y reflejan un gradiente esperado de menor a mayor humedad en el orden MEX, QRO y MOR, respectivamente. La firma de δ13C en madera no muestra los cambios de δ13C atmosféricos posiblemente debido a que los ahuehuetes se desarrollan cerca de reservorios de agua y la discriminación de 13C es estable durante el año. Sin embargo, el cambio neto expresado como δ13C observado en los tres sitios si indica influencia en el intercambio de gases debido a cambios de Ca (Figura 2).
Figura 2 Composición de isótopos de carbono y oxígeno (δ13C y δ18O) en anillos de crecimiento, discriminación (Δ13C), eficiencia de uso de agua intrínseca (iWUE), presión parcial interna de CO2 (Ci) y concentración de CO2 atmosférica (Ca) en tres poblaciones naturales de ahuehuete (Taxodium mucronatum Ten.). Las barras indican errores estándar.
Cuadro 3 Prueba de efectos fijos para la variables fisiológicas en tres poblaciones de ahuehuete (Taxodium mucronatum Ten.).
| Sitio | Efecto | GL | Pr > F | ||||
| δ13C | δ18O | Δ13C | Ci | iWUE | |||
| Estado de México (MEX) | Tiempo | 10 | 0.641 | 0.030† | 0.0003† | 0.003† | <.0001† |
| Régimen | 10 | 0.076¶ | 0.091 ¶ | 0.673 | 0.022† | 0.181 | |
| Tiempo x Régimen | 10 | 0.074¶ | 0.092¶ | 0.669 | 0.021† | 0.180 | |
| Querétaro (QRO) | Tiempo | 14 | 0.569 | 0.008† | 0.0075† | 0.001† | <.0001† |
| Régimen | 14 | 0.798 | 0.915 | 0.924 | 0.674 | 0.459 | |
| Tiempo x Régimen | 14 | 0.796 | 0.923 | 0.917 | 0.667 | 0.445 | |
| Morelos (MOR) | Tiempo | 15 | 0.978 | <.0001† | <.0001† | <.0001† | <.0001† |
| Régimen | 15 | 0.016† | 0.874 | 0.190 | 0.006† | 0.980 | |
| Tiempo x Régimen | 15 | 0.015† | 0.882 | 0.188 | 0.006† | 0.994 | |
†Significancia (p≤0.05), ¶significancia marginal (p≤0.10).
El análisis de contrastes indicó diferencias significativas (p≤0.05) de δ13C entre los sitios MEX y MOR para los periodos III, IV y VII. No hubo diferencias entre periodos de MEX y QRO. Para QRO y MOR sólo el periodo IV fue estadísticamente diferente (Cuadro 4). Los sitios con precipitación contrastante, MEX y MOR, son los únicos que muestran diferencias entre ellos para δ13C, y si se considera una significancia marginal (p≤0.079), las diferencias son evidentes de los periodos III al VII (Cuadro 4). Los valores más negativos de δ13C de MOR indican menor discriminación y menor estrés hídrico por la mayor humedad en este sitio (Figura 2).
Cuadro 4 Prueba de contrastes entre tres poblaciones de ahuehuete (Taxodium mucronatum Ten.).
| Contraste entre sitio | Análisis multivariado | ||||
| Pr > F | |||||
| Periodo III (1947-1952) |
Periodo IV (1965-1970) |
Periodo V (1988-1993) |
Periodo VI (1996-2001) |
Periodo VII (2007-2012) |
|
| δ13C | |||||
| MEX y MOR | 0.030† | 0.026† | 0.061¶ | 0.079¶ | 0.044† |
| MEX y QRO | 0.283 | 0.654 | 0.076¶ | 0.281 | 0.288 |
| MOR y QRO | 0.152 | 0.014† | 0.874 | 0.387 | 0.220 |
| δ18O | |||||
| MEX y MOR | 0.943 | 0.591 | 0.144 | 0.869 | 0.100¶ |
| MEX y QRO | 0.062¶ | 0.052¶ | 0.007† | 0.242 | 0.031† |
| MOR y QRO | 0.067¶ | 0.098¶ | 0.036† | 0.294 | 0.290 |
| δ13C, Ci iWUE | |||||
| MEX y MOR | 0.031† | 0.027† | 0.061¶ | 0.078¶ | 0.044† |
| MEX y QRO | 0.285 | 0.647 | 0.077¶ | 0.280 | 0.285 |
| MOR y QRO | 0.155 | 0.014† | 0.877 | 0.388 | 0.220 |
†Significancia (p≤0.05), ¶significancia marginal (p≤0.10). Estado de México (MEX), Querétaro (QRO) y Morelos (MOR).
Los valores de δ13C en nuestro estudio son menores que los reportados para Pinus tabulaeformis y P. taiwanensis, en bosques subtropicales de China (Xu et al., 2014), pero similares a los reportados por Silva et al. (2009) para Araucaria angustifolia en Brasil y por Gómez-Guerrero et al. (2013) y Silva et al. (2015) para Abies religiosa y Pinus hartwegii en México.
Los valores de δ18O fueron diferentes (p≤0.05) en el tiempo en los tres sitios, con incremento medio de 4.0 ‰ en el último siglo. La interacción tiempo x régimen no fue significativa en ningún sitio. Los contrastes indicaron diferencias entre MEX y QRO en los periodos V y VII. Para MOR y QRO hubo diferencia estadística de δ18O en el periodo V (Cuadro 3 y 4).
El aumento de δ18O en el tiempo en los tres sitios indica posibles cambios en la fuente de agua o mayor evapotranspiración (Kohn y Welker, 2005). Dado que no hay datos de δ18O del agua de lluvia en los sitios de estudio, es difícil separar el efecto por la fuente de agua o demostrar que la evapotranspiración (y temperatura) aumentaron en el siglo XX. Pero al considerar las estaciones meteorológicas cercanas a cada sitio, sí hay evidencia de un aumento en la temperatura media anual en los últimos 50 años, entre 1.2 y 1.4 °C en todos los sitios. Por lo anterior, es probable que el incremento en 4.0 ‰ en los tres sitios de estudio sea un reflejo del aumento de la temperatura y la evapotranspiración que enriquecieron la firma de 18O en el agua utilizada por los árboles.
La explicación de un incremento en evapotranspiración y temperatura es congruente con la crisis de abastecimiento de agua en los sitios de estudio. De acuerdo con la Comisión Nacional del Agua (CNA) hay un abatimiento 111,755,911 m3 año-1 en los acuíferos de sito MEX y de 12 929 028 año-1 en el sitio QRO (CNA, 2015). La disminución de agua subterránea condiciona a los árboles de ahuehuete a extender su sistema radical a estratos más profundos con su costo en crecimiento aéreo (Enríquez-Peña y Suzán-Azpiri, 2011).
Variables fisiológicas (Δ13C), Ci y iWUE)
Las diferencias de Δ13C, Ci y iWUE en el tiempo fueron significativas (p≤0.05) en los tres sitios. El régimen de humedad y la interacción tiempo x régimen fueron significativos para Ci en los sitios MEX y MOR (Cuadro 3). La disminución de Δ13C y el aumento de iWUE fue más evidente después de 1950 en los tres sitios (Figura 2). El aumento de Ci fue notorio después de 1970 (Figura 2). Las diferencias estadísticas en Δ13C, Ci e iWUE entre los sitios MEX y MOR fueron en los periodos III, IV y VII, pero no hubo diferencias significativas en Δ13C, Ci e iWUE entre MEX y QRO. Para MOR y QRO sólo el periodo IV fue significativo (Cuadro 4).
El cambio de iWUE durante el siglo XX (p≤0.05) fue de 77 a 116 μmol mol-1, este es un aumento de 50 %. Pero es notorio que desde el evento extremo de 1950, la tasa anual aumentó de 0.35 a 0.65 μmol mol-1 (Figura 2). El incremento de iWUE se ha visto en diferentes ecosistemas forestales en décadas recientes (Saurer et al., 2004; Peñuelas et al., 2011; Battipaglia et al., 2013; Xu et al., 2014), pero su relación con el crecimiento de los árboles ha sido variada como ocurrió en los sitios de nuestro estudio. En teoría, el incremento en iWUE mejora la resistencia de la vegetación a sequias al reducir el costo asociado al transporte de agua dentro del árbol (Raven, 2002), pero el incremento en crecimiento de los árboles no se muestra en todos los sitios.
Independiente de la localidad, los árboles de ahuehuete responden a los cambios climáticos y al aumento en la concentración de CO2 atmosférico en el siglo XX. La variable más sensible fue Ci que varió de acuerdo con el tiempo y régimen de humedad en los sitios más contrastantes en clima, MEX y MOR. Los periodos con mayores diferencias significativas entre sitos fueron el IV y V, que corresponden a periodos húmedos. Este resultado indica que comparado con la precipitación, la temperatura ejerció mayor influencia en los cambios fisiológicos de los ahuehuetes. Este resultado es similar al de Linares y Camarero (2012), quienes observaron que las respuestas fisiológicas de Abies alba estaban más relacionadas con los cambios en temperatura. Nuestro estudio también muestra que la temperatura es la variable que más se relaciona con los cambios de iWUE. El aumento reciente en temperatura media anual se relaciona con un incremento de iWUE en todos los sitios (Figura 5).
La reducción neta de Δ13C en todos los sitios es una evidencia de la respuesta fisiológica de los árboles al incremento de Ca (Silva y Horwath, 2013). Con respecto a los eventos extremos, Ci ha aumentado a mayor tasa en los eventos secos que en los húmedos (Figura 3), pero el cambio es mayor en lugares húmedos y de régimen isotérmico como MOR. El aumento de Ci indica más carbono disponible dentro de la hoja aunque su asimilación no siempre aumenta, dado que las tasas de incremento en área basal del árbol aumentaron o disminuyeron (Figura 6). Los resultados indican que el agobio por incremento de temperatura en décadas recientes ha impactado diferencialmente el crecimiento de los árboles.
Interpretación de las variables fisiológicas (Δ13C, Ci, y iWUE)
Las tendencias de las variables fisiológicas mostraron correspondencia con los escenarios de Saurer et al. (2004), donde se mantiene constante Ci y Ci / Ca (Cuadro 5). Pero en el primer caso se esperaba un aumento en δ13C que ocurrió solo en periodos húmedos (Figura 3). En el segundo caso se esperaba que Δ13C no cambiara, pero decreció (Cuadro 5). El tercer escenario con Ci -Ca es el que presenta menos correspondencia con las variables fisiológicas. No hubo correlación entre los δ13C y δ18O (Figura 4) lo que de acuerdo con el modelo conceptual de Scheidegger et al. (2000), sugieren que la variación de iWUE se debe a ajustes proporcionales de la fotosíntesis y conductividad estomática. Para la representación de los datos se muestran las desviaciones de δ13C y δ18O con respecto a la media global como lo sugieren Barnard et al. (2012).
Cuadro 5 Tendencia esperada (en color negro) y observada (en color gris) de las variables fisiológicas.
Los escenarios corresponden a los planteados por Saurer et al. (2004). Las tendencias encontradas en este estudio se indican en color gris. Cuando el resultado de este estudio coincide parcialmente o difiere del modelo conceptual, se indica con “Parcial” y “NO”, respectivamente.
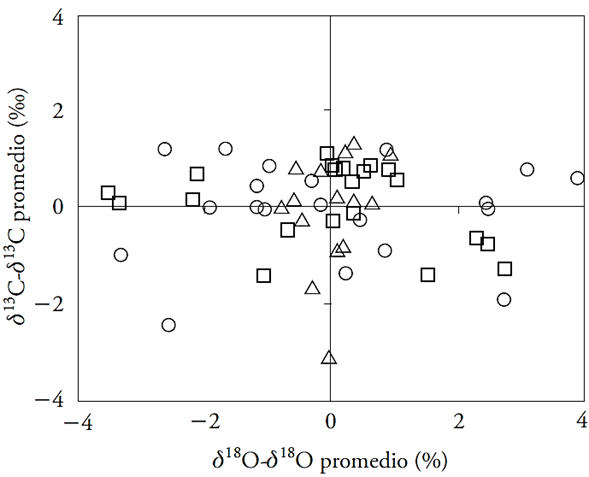
Figura 4 Desviación de δ13C y δ18O en anillos de crecimiento con respecto a la media global. Los datos son para los tres sitios, MEX (triángulo), QRO (cuadro) y MOR (círculo).
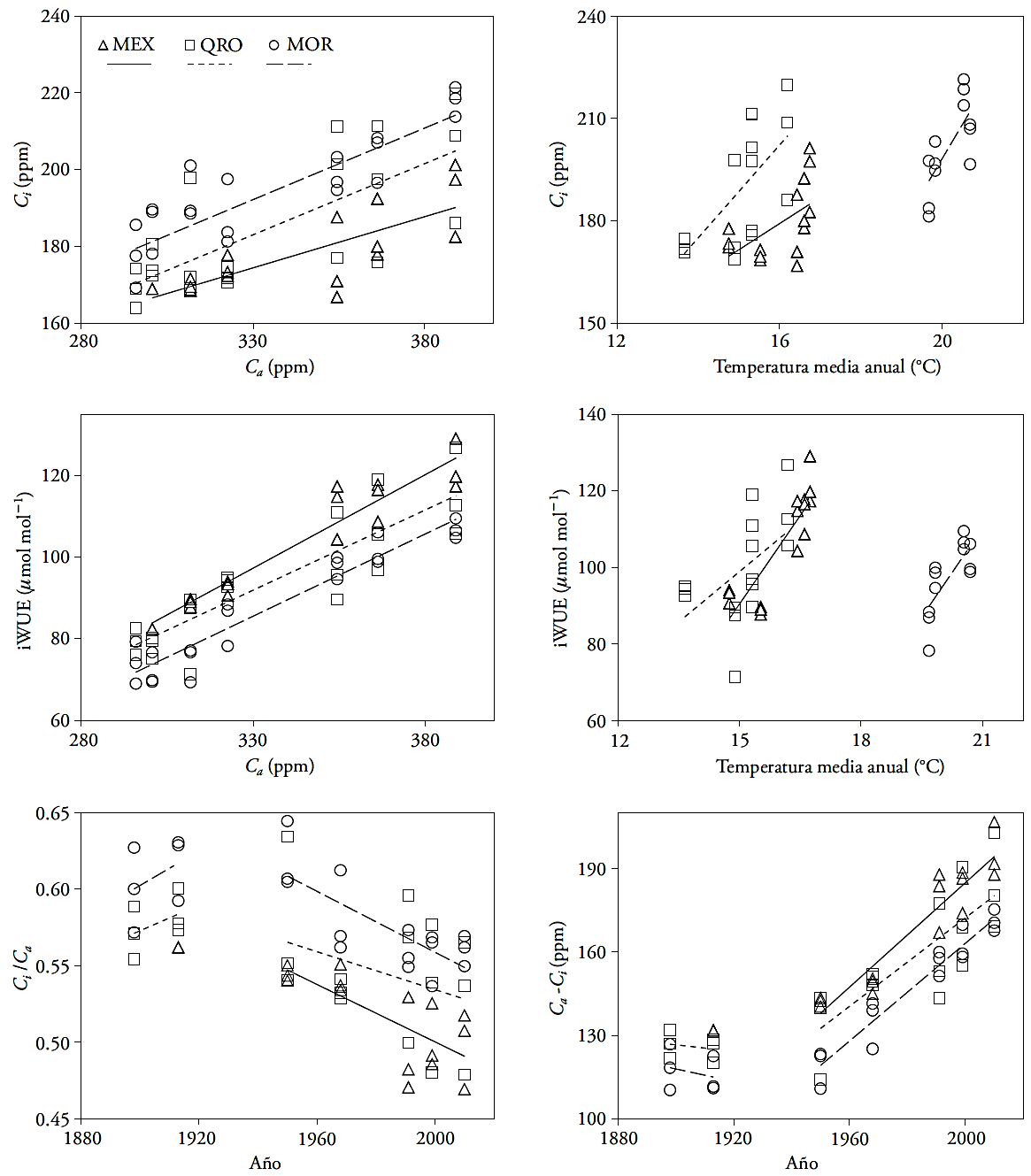
Figura 5 Relaciones entre concentración de CO2 atmosférico (Ca), presión parcial interna de CO2 (Ci), temperatura media anual (promedio de años extremos secos ó húmedos a partir de 1947-1952) y eficiencia de uso de agua intrínseca (iWUE), en tres áreas naturales de Taxodium mucronatum Ten.
La respuesta del ahuehuete a los cambios recientes de Ca coincide con resultados teóricos de dos escenarios de Saurer et al. (2004), con Ci y Ci /Ca constantes. No obstante, para el primer escenario el incremento esperado de δ13C fue parcial ya que sólo ocurrió en periodos húmedos. La inconsistencia con el segundo escenario (Ci /Ca constante) es que se esperaba que Δ13C se mostrara relativamente constante, pero su disminución después de 1950 fue altamente significativa en todos los sitios (Figura 2 y Cuadro 3). Los resultados indican que en ahuehuete Ci tiende a mantenerse constante ante los aumentos de Ca , mostrando la función activa de la apertura estomática. Específicamente, esto parece ocurrir durante los eventos extremos húmedos y en lugares de baja y alta humedad como en MEX y MOR. Los resultados indican que en los eventos extremos de sequía los árboles tienden al segundo escenario con ajustes proporcionales de Ci y Ca. De acuerdo con el modelo conceptual de Scheidegger et al. (2000) no se observa una correlación positiva entre δ13C y δ18O (Figura 4) lo que descarta que el incremento de iWUE se deba a una reducción en conductancia estomática (gs) y niveles estables de fotosíntesis (A). La tendencia horizontal de las desviaciones de δ13C y δ18O con relación a la media general sugiere ajustes proporcionales de A y que apoyan el segundo escenario de Saurer et al. (2004).
Relación de variables fisiológicas y clima
Las variables Ci y iWUE muestran un incremento lineal con respecto a Ca, en el siglo XX (Figura 5). Esto podría sugerir que el aumento de CO2 atmosférico se refleja en una mayor concentración del gas en los árboles. Si bien, los valores de Ci en cada sitio son diferentes, se encontró una misma pendiente o tasa de incremento en ambas variables. La temperatura media anual también tiene una función importante en iWUE y Ci, para MEX y QRO, se encontró una relación positiva entre temperatura y el incremento de Ci y iWUE, comparado con la temperatura, la precipitación no explicó los cambios en Ci y iWUE. Los resultados de este estudio son similares a los encontrados por Silva et al. (2009) en Araucaria angustifolia y por Tognetti et al. (2014) y en Fagus sylvatica y Nothofagus spp. Esta relación también depende del déficit de presión de vapor del lugar donde crecen los árboles; sin embargo, es posible que también sea reflejo de un proceso de regulación (homeostasis) de las especies forestales ante la variación del clima ya que la correlación entre iWUE y Ci tiende a aumentar en las últimas décadas (Tognetti et al., 2014).
Crecimiento en área basal
El crecimiento en área basal para los tres sitios, empleando una ecuación exponencial negativa para MEX y ecuaciones polimórficas de orden cinco para QRO y MOR, muestra tres tendencias: reducción en crecimiento, crecimiento estable e incremento de crecimiento, en el orden MEX, QRO y MOR (Figura 6). Pero desde la última década el crecimiento se ha reducido en todos los sitios. En 1920 el IAB de MEX superaba el de los otros sitios, la tasa de crecimiento en MEX, mostró una disminución progresiva de 1920 a 2012, hasta alcanzar valores cuatro a cinco veces menor que en los otros dos sitios, aunque en este sitio estaban los árboles más jóvenes. Una explicación probable es que los cambios en disponibilidad de agua y los efectos de cambio de uso de suelo han afectado de manera importante al arbolado (Correa-Díaz et al., 2014).
Conclusiones
La eficiencia de uso de agua intrínseca en los ahuehuetes ha aumentado en décadas recientes, pero la tasa de crecimiento en área basal ha aumentado solo en unos sitios, lo cual confirma que los individuos de esta especie presentan una respuesta fisiológica diferencial de acuerdo con el incremento de CO2 atmosférico y temperatura media anual del sitio.
En lugares de régimen isotérmico, con precipitación media anual de 1000 mm y corrientes semipermanentes, habría un efecto de fertilización que se manifiesta con mayores tasas de crecimiento en área basal. Pero en lugares de régimen térmico con precipitación de 600 mm y sin corrientes semipermanentes el aumento de temperatura y CO2 atmosférico se relacionan con una reducción en la tasa de crecimiento en área basal siglo XX. Los resultados apoyan parcialmente la segunda hipótesis del estudio sobre un efecto de fertilización generalizado en ahuehuete.
La composición de isotopos de carbono en los anillos de crecimiento de ahuehuetes es menos sensible a los cambios de CO2 atmosférico. Se esperaba una disminución progresiva en la composición de isótopos en el siglo XX ya que la atmósfera se ha diluido en 13C por el uso de hidrocarburos, pero solo hay una tendencia débil después de 1970. Así, se puede modelar la respuesta de especies forestales ante el cambio climático. Los cambios en las tasas de crecimiento de las especies forestales dependen de las condiciones ambientales de cada lugar y la fisiología de las especies, y no siempre se deben esperar efectos de fertilización por CO2.











 texto en
texto en