Introducción
Diversas especies de orquídeas cultivadas para flores de corte y para plantas en maceta tienen importancia económica, por lo que hay gran interés en el mejoramiento de los aspectos de valor comercial (da Silva, 2013), de los cuales la floración es el más importante. Sin embargo, para propósitos comerciales, la floración en orquídeas es un problema porque tienen periodos juveniles largos y las plantas deben alcanzar un cierto grado de madurez para florecer. Este periodo juvenil varía entre especies e híbridos (Lopez y Runkle, 2005). Como en otras angiospermas, el desarrollo de las flores de las orquídeas empieza con la transición floral, y continúa con el inicio y la formación de los órganos florales (Yu y Goh, 2000).
La información cuantitativa del proceso de floración es escasa para la mayoría de las orquídeas (Lopez et al., 2003), lo cual complica su manejo; además, el porcentaje de plantas que florece en una población puede tener gran variación entre años en muchas especies silvestres (Pfeifer et al., 2006). En diversas herbáceas perennes, entre ellas orquídeas (Kindlmann y Balounová, 1999; Kindlmann y Balounová, 2001), las variaciones entre años de latencia, de esterilidad y de floración, en individuos y en poblaciones, son llamadas rutas irregulares de floración (Pfeifer et al., 2006). En las orquídeas Liparis lilifolia (L.) Richard y Tipularia discolor (Pursh) Nutall, estas variaciones son el resultado de factores negativos asociados con la reproducción sexual y la herbivoría foliar (Whigham y O’Neill, 1991). Primack y Stacy (1998) en un estudio con tres poblaciones silvestres de Cypripedium acaule compararon plantas polinizadas manualmente y con producción frecuente de frutos, vs plantas sin polinizar y que raramente produjeron frutos; las plantas que florecieron sin producir fruto no afectaron su tamaño ni la probabilidad de florecer en años subsecuentes, pero las que sí fructificaron mostraron un costo de reproducción al reducir ambas variables. Para orquídeas terrestres algunas de las causas de la irregularidad en la floración son los costos de la reproducción sexual, las enfermedades de las hojas y el daño foliar por herviboría y, además, aspectos ambientales como el clima (Kindlmann y Balounová, 2001; Pfeifer et al., 2006).
La floración inicia en respuesta a aspectos ambientales y rutas endógenas, éstas últimas referidas como autónomas (controladas genéticamente) que funcionan independientemente de las señales ambientales y están relacionadas con el estado de desarrollo de la planta (Amasino y Michaels, 2010). El control genético de la floración fue investigado por Weigel y Nilsson (1995), Kobayashi y Weigel (2007), Barret (2008) y Andrés y Coupland (2012). La identificación de los genes DOMADS1, DOMADS2 y DOMADS3 es el primer paso hacia la elucidación de los mecanismos moleculares de la transición floral en orquídeas (Yu y Goh, 2000).
Entre los factores climáticos que influyen en la floración destacan los considerados secundarios (menos predecibles que los primarios), como la temperatura ambiental, la luz integral (irradiancia de la longitud del día) y la disponibilidad de agua (Bernier y Périlleux, 2005). Para Oncidium la proporción de óxido-reducción (REDOX) de AsA (ascorbato) bajo estrés ambiental por temperatura, representa un cambio maestro para mediar la fase de transición vegetativa a estado reproductivo (Chin et al., 2014).
El crecimiento de las plantas y el proceso de desarrollo son regulados por la calidad de la luz (color, longitud de onda); la cantidad (tasa de flujo); y el fotoperiodo (duración de iluminación) (Folta y Childers, 2008). Según Cerdán y Chory (2003), hay una ruta de calidad de luz que regula el periodo de floración en plantas. Un fotoperiodo apropiado genera un estímulo inductivo basado en un mecanismo de coincidencia externa, y la naturaleza de la señal móvil de floración, el florígeno, libera la información dependiente del fotoperiodo, de la hoja al ápice de crecimiento del tallo (Kobayashi y Weigel, 2007).
El efecto de la luz sobre la inducción floral ha estimulado el uso de la iluminación artificial para los cultivos, por lo cual las lámparas de alta presión de sodio y aditivos metálicos (HPS y MH, por sus siglas en inglés, respectivamente) y las lámparas fluorescentes (FL) se usan en horticultura en cámaras de crecimiento y en invernaderos (Krizek et al., 1998; Hemming, 2011; Runkle, 2008). Las lámparas HPS tienen una eficiencia energética alta y un espectro de 550 a 650 nm (Hemming, 2011), aunque es deficiente en la región UV y azul. Estas lámparas no se consideran apropiadas para iluminación cíclica debido a que el frecuente cambio de encendido-apagado reduce la esperanza de vida de los bulbos y balastas (Blanchard y Runkle, 2009), mientras que las lámparas MH emiten radiación en la región UV y azul, pero son deficientes en la porción del espectro rojo y rojo-lejano. Por ello, Krizek et al. (1998) sugirieron usar combinación de HPS y MH. Las lámparas o tubos fluorescentes emiten longitudes de onda entre los 400 y 700 nm, son más eficientes que las incandescentes por la conversión a energía más utilizable para el crecimiento de plantas y por tener un espectro más balanceado. Además, los tubos distribuyen la luz de manera más uniforme que las lámparas (Runkle, 2008). Un reto importante en el uso de luz artificial es la reducción del uso de energía y costos, por lo cual se espera que los diodos emisores de luz (LED, por sus siglas en inglés) cubran este requerimiento (Hemming, 2011).
Los LEDs son un avance tecnológico importante en la horticultura por estas ventajas: tamaño pequeño, largo periodo de operación, control de la composición espectral, baja emisión de calor y eficiencia en la conversión de energía (Morrow, 2008; Massa et al, 2008). Además, su potencial se advierte en la investigación y producción en ambientes controlados, y en cultivo in vitro; asimismo, los LEDs se usan como luz complementaria para fotoperiodos de luz en invernadero. Pero Morrow (2008) indica que estas aplicaciones están aún en desarrollo, y el reto es encontrar las correctas combinaciones espectrales y de intensidades (Massa et al., 2008; Olle and Viršilė, 2013). La investigación relacionada con el uso de LEDs para inducir floración de plantas adultas de orquídeas es escasa.
El objetivo de esta investigación fue evaluar la influencia del ambiente de invernadero y dos ambientes controlados, cada uno con fuentes de luz diferentes, sobre el crecimiento, la inducción floral e indicadores de desarrollo floral de plantas adultas de L. anceps Lindl. subesp. anceps con y sin floración en el año anterior. La hipótesis fue que el ambiente controlado con iluminación LED promueve el crecimiento vegetativo y la inducción floral de plantas adultas de L. anceps subesp. anceps, de manera similar a los que resultan de la combinación de las lámparas HPS+MH+FL y al de luz natural en invernadero; además, que el antecedente de floración influye en la inducción floral del ciclo actual.
Materiales y Métodos
Material vegetal y condiciones experimentales
En este estudio se usaron plantas adultas de L. anceps Lindl. subesp. anceps de cuatro años de edad y 30 cm de altura, con 3±1 pseudobulbos y hojas, y se trasplantaron en macetas traslúcidas de 1 L de capacidad, en corteza de pino como sustrato (Ecorteza®; partículas con diámetro medio de 1.3 cm). Las plantas se mantuvieron en invernadero por tres meses, separadas en dos grupos, de acuerdo con el antecedente de floración al momento del establecimiento del experimento: 1) plantas con floración anterior (CFA); 2) plantas sin floración anterior (SFA). Todas las plantas se fertilizaron con solución nutritiva preparada con 1 g L-1 de Peters® 30N-10P-10K (300, 100 y 100 mg L-1 de N, P y K, respectivamente). Cada 15 d se aplicaron 100 mL de solución por maceta.
En el ambiente invernadero (AInv), las plantas se colocaron en un invernadero construido con plástico blanco encima del cual se colocó malla sombra al 70 %. La temperatura promedio fue 29/13 °C diurna/nocturna y flujo de fotones fotosintéticos (FFF) de 90 μmol.m-2 s-1 (promedio diario durante el experimento). Para dicho ambiente se estimó un fotoperiodo natural aproximado de 12 h, entre mayo y julio (meses cuando ocurrió la inducción).
Para el manejo de los factores ambientales en ambiente controlado se usaron dos cámaras de crecimiento, cada una con diferentes FFF proporcionados por distintas fuentes de luz. En el ambiente controlado 1 (AC1), la luz se proporcionó con ocho tubos fluorescentes de luz de día (FL) cada uno de 32 watts, combinados con una lámpara de aditivos metálicos (MH) de 400 watts y una lámpara de alta presión de sodio (HPS) de 250 watts; todas las lámparas fueron marca Philips. La suma de estas fuentes de luz generó un FFF de 80 μmol m-2 s-1. En AInv y AC1, el FFF se estimó de acuerdo con Runkle (2008), y a partir de los luxes medidos con un data logger HOBOware® Pro Onset. En el ambiente controlado 2 (AC2), la luz fue proporcionada por una lámpara de diodos emisores de luz (LEDs), modelo GROW LED CUBE marca ADAPTA® de 50W, con luz roja a 660 nm y luz azul a 460 nm, en proporción 8:1, respectivamente. El FFF en las lámparas LED fue 64 μmol m-2s-1y se estimó por la transformación a lúmenes: (watts de la lámpara * 70), (erenovable.com), dividido por 54 (Runkle, 2008). En los ambientes controlados las fuentes de luz se distribuyeron en un área de 1 m2 y se colocaron a una distancia de 50 cm sobre las plantas en estudio. Con base en observaciones previas y dado que no hay información para la especie estudiada, ambos ambientes se establecieron con fotoperiodo 9 h luz y 15 h oscuridad, y temperatura 25/13 °C diurna/nocturna.
Desde su ingreso a las cámaras, las plantas se fertilizaron con Peters® 10N-30P-20K (100, 300 y 200 mg L-1 de N, P y K, respectivamente). En cada maceta se aplicaron 100 mL de solución nutritiva cada 7 d. Previo a cada fertilización, el material se regó con agua corriente acidificada a pH de 5.5, y entre cada fertilización se hicieron dos riegos adicionales para evitar la desecación del sustrato y la acumulación de sales.
Para el experimento y con base en observaciones previas que mostraron el aborto de los escapos antes de los 5 cm, la inducción a floración se consideró una vez que el tallo floral alcanzó 5 cm de altura por encima del ápice del pseudobulbo. En ese momento, las plantas se retiraron de las cámaras de crecimiento y el desarrollo de la floración se completó en condiciones de invernadero. La antesis se presentó en días cortos (fotoperiodo aproximado de 11 h), entre los meses de octubre y noviembre.
Diseño experimental y diseño de tratamientos
El diseño experimental fue completamente al azar con 20 repeticiones por tratamiento y la unidad experimental fue una maceta con una planta. Los tratamientos se generaron con las dos condiciones de floración (CFA y SFA) y los tres ambientes (AInv, AC1 y AC2) y fueron: 1) AInv+CFA (luz natural con FFF de 90 μmol.m-2.s-1+con floración anterior); 2) AInv + SFA (luz natural con FFF de 90 μmol.m-2 s-1 + sin floración anterior); 3) AC1 + CFA (HPS+MH+FL con FFF de 80 μmol m-2 s-1 + con floración anterior); 4) AC1 + SFA (HPS+MH+FL con FFF de 80 μmol m-2 s-1 + sin floración anterior); 5) AC2 + CFA (LED con FFF de 64 μmol m-2 s-1 + con floración anterior); 6) AC2 + SFA (LED con FFF de 64 μmol m-2 s-1 + sin floración anterior). El experimento de inducción floral duró 60 d.
Variables
Variables de crecimiento vegetativo
La altura total de la planta (AP) se midió desde la base del pseudobulbo hasta el ápice de la hoja más grande; también se midió el número total de hojas (NTH), pseudobulbos (NTPsb) y brotes (NTBr); así como el diámetro (DPsb) y la longitud del pseudobulbo (LPsb) del brote inducido y no inducido a floración, y la longitud de la hoja de los mismos (LH). Las variables se midieron cada semana durante el experimento.
Variables de floración
1) Días a antesis de la primera flor (DA); 2) vida de la flor (VF); 3) número de flores por racimo (NF); 4) longitud del tallo floral (LTF), desde el primer nudo del tallo, inmediato al ápice del pseudobulbo, hasta el inicio del racimo; 5) diámetro del tallo floral (DTF) medido en el primer nudo inmediato al ápice del pseudobulbo; 6) tamaño de la flor, que incluyó la longitud desde el ápice del sépalo superior al ápice del sépalo inferior (LS), así como el ancho desde el ápice del pétalo izquierdo al ápice el pétalo derecho (LP); 7) tamaño del labelo, que comprendió su longitud (LLab) y ancho (ALab).
Variables complementarias
1) Modelación de la probabilidad de inducción a floración, según efecto de la intensidad de luz (en los dos ambientes controlados) y la CFA (en los tres ambientes), mediante el número de plantas inducidas en cada tratamiento; 2) porcentaje de inducción floral; 3) correlación de variables de crecimiento vegetativo y reproductivo.
Análisis de datos
Para evaluar la relación entre las variables respuesta de crecimiento vegetativo y de floración se usó un ANDEVA y las medias se compararon con la prueba de Tukey (p≤0.05), para lo cual se usó SAS Enterprise Guide (SAS Institute, Inc., 2009). La probabilidad de la inducción floral en los tres ambientes se modeló con regresión logística. El coeficiente de correlación de Pearson se usó para estimar la relación de las variables de crecimiento vegetativo vs. las de floración, y la correlación entre las variables de floración.
Resultados y Discusión
Análisis del crecimiento vegetativo
Altura de plantas
La altura de las plantas que presentaron brotes inducidos o no inducidos a floración durante el experimento mostró diferencias significativas en ambiente controlado e invernadero: las plantas CFA en invernadero tuvieron la mayor altura, en relación con las de AInv + SFA, y mayor que en los tratamientos en AC2 + SFA (en plantas inducidas); AC1 + CFA y AC2 + CFA (plantas no inducidas), (p≤0.05; Figura 1).

Valores promedio con letras distintas en barras indican diferencias significativas entre tratamientos (Tukey, p≤0.05)
AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de 90 μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 μmol m-2 s-1); AC2: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1); CFA: plantas con floración anterior; SFA: plantas sin floración anterior.
Figura 1 Altura de plantas de L. anceps subesp. anceps con brotes vegetativos inducidos y no inducidos a floración, en diferentes ambientes de cultivo y con distintos antecedentes de floración, al final del ciclo experimental (60 d).
Lo anterior muestra que en los ambientes controlados analizados las plantas que florecieron el año anterior presentaron una altura menor, lo cual puede ser una de las causas de la no inducción a floración en nuestra investigación. Además, la altura de las plantas de L. anceps subesp. anceps inducidas o no inducidas a floración en ambiente controlado (luz LED o combinación de HPS+MH+FL) fue igual o inferior a las de plantas en invernadero, donde el factor CFA es un complemento importante para los resultados obtenidos de la fuente de luz por si misma. Nuestros resultados contrastan con los de Terfa et al. (2012), quienes analizaron parámetros de calidad de rosas en maceta (Rosa × hybrida ‘Toril’) crecidas con intensidad lumínica de 100 μmol m-2 s-1 con diferentes calidades de luz provistas por LED (80 % roja y 20 % azul), y lámparas HPS, tanto en cámaras cerradas de crecimiento como en invernadero. La longitud del tallo y del pedicelo fueron significativamente más cortos en plantas que crecieron bajo luz LED comparada con HPS, aunque el periodo de producción total no cambió. Yamada et al. (2008) usaron diferentes fuentes de luz: roja (660±30 nm) y roja lejana (730±30 nm), todas con FFF de 5 μmol·m2·s-1, en Eustoma grandiflorum ‘Neilpeach Neo’, y encontraron que la tasa de elongación del tallo fue más alta en plantas crecidas bajo lámparas fluorescentes rojo-lejano, fue similar con lámparas fluorescentes e incandescentes, y menor con lámparas fluorescentes tipo luz de día, comparado con el testigo (sin iluminación complementaria). Pero, en nuestro estudio hubo mayor FFF (64 μmol m-2 s-1) con luz LED, con componente de luz roja, y redujo la altura de las plantas en comparación con las de invernadero (sin luz roja complementaria). La naturaleza de la especie en estudio promueve respuestas diferentes.
Heo et al. (2006) usaron diferentes mezclas de radiación tipo LED (con FFF = 90±10 μmol m-2 s-1) en el crecimiento de agerato (Ageratum houstonianum Mill. cv. Blue Field), cempasúchil (Tagetes erecta L. cv. Orange Boy), y salvia (Salvia splendens E Sello ex Ruem & Schult. cv. Red Vista). Ellos encontraron que la longitud de los tallos fue mayor (257, 147 y 140 %, respectivamente) con el componente de luz roja-lejana combinada con luz azul o roja, en comparación con luz fluorescente (testigo). Nuestros resultados difieren porque el crecimiento en altura de plantas fue menor al usar luz LED (con combinación de luz roja y azul).
Número de órganos de crecimiento
Los resultados de crecimiento son a los 60 d porque los muestreos semanales no mostraron diferencias significativas. El crecimiento de la orquídea en estudio es lento y el periodo experimental fue corto para apreciar diferencias antes de ese periodo.
El NTH, NTPsb, y NTBr en plantas inducidas a floración no presentó diferencias significativas (p>0.05) entre los ambientes (Figura 2A). En las plantas no inducidas a floración el tratamiento AC2 + CFA tuvo un efecto negativo en el número de hojas, pseudobulbos y brotes (p≤0.01) en comparación con los otros tratamientos (Figura 2B). Al igual que para la variable altura total de la planta, las plantas CFA cultivadas en el AC2 (con luz LED), disminuyeron la producción de órganos de crecimiento, lo cual se reflejó en la ausencia de inducción floral. Esto puede indicar que para L. anceps subesp. Anceps el umbral de intensidad de luz para un crecimiento que promueva inducción podría ser más de 60 μmol m-2 s-1, pero la intensidad de luz no debe ser menor a 120 μmol m-2 s-1 porque las hojas se tornan amarillas, se marchitan y caen cuando se cultivan en invernadero con una intensidad lumínica superior.
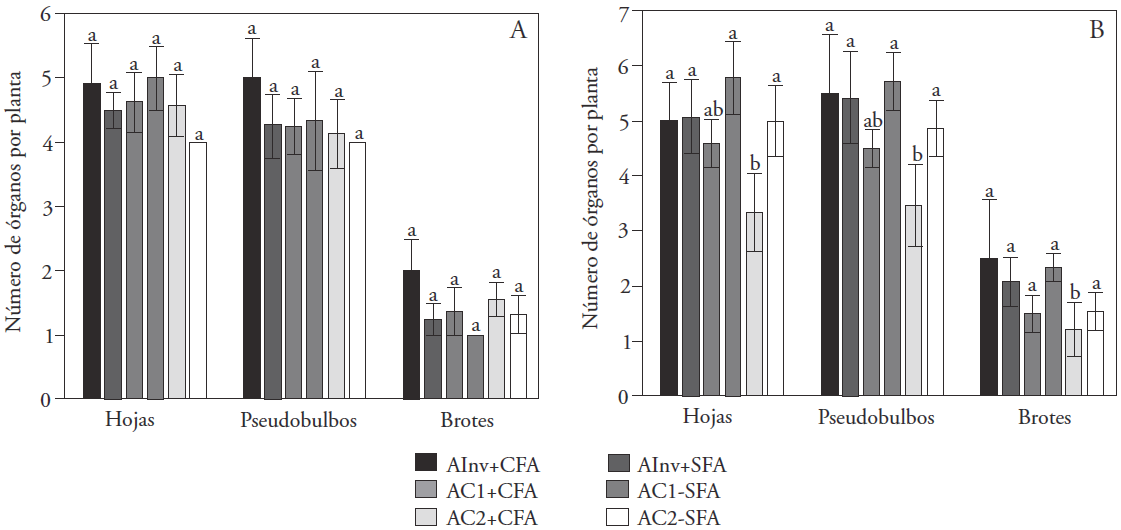
Valores promedio con letras distintas en barras indican diferencias significativas entre tratamientos (Tukey, p≤0.05). AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de 90 μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 μmol m-2 s-1); AC2: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1). CFA: plantas con floración anterior; SFA: plantas sin floración anterior.
Figura 2 Crecimiento vegetativo de plantas de L. anceps subesp. anceps con brotes inducidos (A) y no inducidos (B) a floración, en diferentes ambientes de cultivo y con distintos antecedentes de floración, al final del ciclo experimental (60 d).
Brotes vegetativos inducidos y no inducidos a floración
Los tratamientos no afectaron el crecimiento de los brotes vegetativos inducidos a floración, pero la longitud de la hoja (LH) de brotes que no se indujeron a floración disminuyó 17 % (p≤0.05) por acción de AC1+SFA y AC2+CFA, respecto al promedio de los otros tratamientos. Además, el diámetro de los pseudobulbos (DPsb) de brotes no inducidos fue 38 % menor (p≤0.01) por acción de AC2+CFA y AC2+SFA (Cuadro 1). Es importante resaltar que el DPsb de las plantas inducidas a floración en AInv y AC1, fue menor que los de plantas no inducidas. Es decir, bajo los mismos tratamientos hubo plantas que se indujeron teniendo un pseudobulbo más pequeño que las no inducidas; así, es probable que los pseudobulbos anteriores al brote nuevo sean responsables, al menos en parte, de la producción de fotosintatos para la inducción floral actual… En la producción de nuevos tallos del híbrido Cattleya forbesii Lindl. x Laelia tenebrosa Rolfe cultivado en mayor intensidad de luz (≅ 1650 μmol m-2 s-1) el desarrollo dependió de los compuestos en los pseudobulbos, en cambio, con menor intensidad de luz (≅ 400 μmol m-2 s-1) dependió de los compuestos almacenados en pseudobulbos y en la tasa fotosintética. Por lo tanto, niveles de luz adecuados optimizan el desarrollo de nuevos tallos y flores de C. forbesii X L. tenebrosa (Stancato et al., 2002).
Cuadro 1 Crecimiento de brotes vegetativos inducidos y no inducidos a floración de L. anceps subesp. anceps, en diferentes ambientes de cultivo y con distintos antecedentes de floración, al final del ciclo experimental (60 d).
| Tratamiento | Brote inducido a floración (cm) | Brote no inducido a floración (cm) | ||||
| DPsb | LPsb | LH | DPsb | LPsb | LH | |
| AInv + CFA | 1.61±0.22 a | 8.18±1.50 a | 17.71±1.22 a | 2.34±0.50 a | 8.60±0.95 a | 18.96±1.95 a |
| AInv + SFA | 1.78±0.69 a | 7.70±1.42 a | 18.10±2.72 a | 2.44±0.38 a | 7.83±1.23 a | 16.38±3.10 a |
| AC1 + CFA | 1.43±0.28 a | 6.94±1.29 a | 15.79±3.13 a | 2.33±0.48 a | 7.55±1.36 a | 15.84±2.51 a |
| AC1 + SFA a | 1.44±0.05 a | 8.63±1.28 a | 16.96±0.45 | 2.38±0.53 a | 7.02±1.59 a | 14.01±3.98 b |
| AC2 + CFA | 1.52±0.28 a | 7.96±1.96 a | 17.05±1.12 a | 1.45±0.33 b | 6.96±1.65 a | 14.23±5.03 b |
| AC2 + SFA | 1.59±0.10 a | 7.63±1.42 a | 14.93±0.40 a | 1.46±0.40 b | 7.98±1.50 a | 15.59±2.73 a |
| CV (%) | 21.96 | 19.34 | 11.69 | 21.85 | 18.96 | 22.11 |
Valores promedio con letras distintas en columnas indican diferencias significativas entre tratamientos (Tukey, p≤0.05). AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de 90 μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 μmol m-2 s-1); AC: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1). CFA: plantas con floración anterior; SFA: plantas sin floración anterior. DPsb: diámetro del pseudobulbo; LPsb: longitud del pseudobulbo; LH: longitud de la hoja.
Análisis de la floración
Inducción floral
El análisis de regresión utilizado para modelar la inducción floral mostró que en los ambientes controlados y en el invernadero, el antecedente de floración influyó significativamente en la inducción (Cuadro 2). Este resultado concuerda con los porcentajes de inducción en los diferentes ambientes, porque los más altos correspondieron a tratamientos donde las plantas tuvieron floración anterior en comparación con las que no la tuvieron (Figura 3). En los ambientes controlados (AC1+CFA y AC2+CFA con inducción floral de 50 y 35 %; y AC1+SFA y AC2+SFA, con inducción de 15 %), los porcentajes fueron menores en comparación con los de invernadero. Aun así, las plantas en invernadero tampoco presentaron 100 % de inducción floral (90 % en plantas CFA y 35 % en plantas SFA).
Cuadro 2 Probabilidad de la influencia del ambiente (intensidad de luz) y el antecedente de floración en la inducción a floración de L. anceps subesp. anceps.
| Factor de estudio | Ambiente controlado Pr | Ambiente invernadero Pr |
| Ambiente (intensidad de luz) | 0.570 ns | Factor no incluido¶ |
| Antecedente de floración | 0.009† | 0.0014† |
| Ambiente (intensidad de luz) X | 0.570 ns | Factor no incluido¶ |
| Antecedente de floración |
†Diferencias estadísticamente significativas (p≤0.05); ns: no significativo. Pr: probabilidad de que el factor de estudio tenga efecto sobre la inducción a floración.
¶El factor Ambiente (intensidad de luz) no fue constante en invernadero, y por consecuencia, dicho factor y Ambiente (intensidad de luz) X antecedente de floración no fueron analizados en el ambiente invernadero.
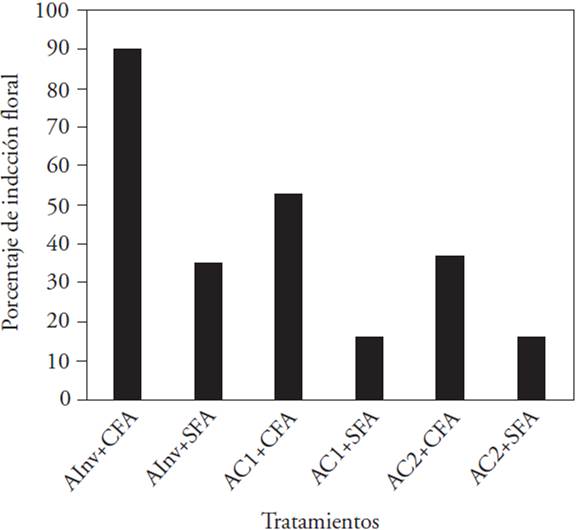
AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de 90 μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 μmol m-2 s-1); AC2: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1); CFA: plantas con floración anterior; SFA: plantas sin floración anterior.
Figura 3 Porcentaje de plantas inducidas a floración de L. anceps subesp. anceps en diferentes ambientes de cultivo y con distintos y antecedentes de floración.
Los resultados de crecimiento ya indicados sugieren que plantas no inducidas en el AC2, en combinación con plantas CFA, principalmente, disminuyeron el crecimiento vegetativo de la orquídea en estudio. Pero los resultados muestran que las plantas que sí se indujeron y con floración anterior tienen mayor probabilidad de que se induzcan el año siguiente (Cuadro 2). En tal situación, aunque la intensidad de luz no fue un factor significativo en la probabilidad de la inducción floral, cada ambiente (con diferentes intensidades de luz) en combinación con la floración anterior sugiere un efecto directamente proporcional al porcentaje de inducción (a mayor intensidad lumínica en el ambiente, mayor porcentaje de inducción) (Figura 3). Lo anterior muestra que las plantas SFA en ambientes controlados pudieron tener un costo de reproducción sobre la inducción actual asociado con la intensidad de luz.
Con base en la disminución del crecimiento de las plantas en el AC2 (menor intensidad de luz), se sugiere que el tamaño de la planta podría ser otro factor que participó en la inducción floral. Esta idea se puede fundamentar con el estudio de Jacquemyn et al. (2010), quienes señalan que plantas de Orchis purpurea en ambientes sombreados y con luz necesitan tener un cierto tamaño para iniciar la floración, pero este umbral de tamaño fue casi tres veces más grande en ambientes sombreados que en los de luz.
Variables de floración
Solo se observaron diferencias en los días a antesis (DA) de la primera flor cuando los tratamientos AInv+CFAyAC2+CFA promovieron los tiempos más largos a apertura floral, con un promedio de 47 y 17 d más que los otros tratamientos. Sin embargo, solo el AInv + CFA fue diferente estadísticamente (p≤0.01) a los tratamientos AInv + SFA, AC1 + CFA y AC1 + SFA (Cuadro 3). Los días a antesis se acortaron en el AC1, con y sin floración anterior, por 45 d, en comparación con AInv + CFA; además el AC2 + CFA promovió menor tiempo a antesis (30 d) en relación con el AInv. Paradiso y De Pascale (2014) mencionan que mayor intensidad de luz (350 μmol m-2 s-1 en los que 150 μmol m-2 s-1 se agregaron como luz complementaria) favoreció la fase inductiva de híbridos de Phalaenopsis, la cual redujo de 51 a 41 d el tiempo para obtener la emergencia del tallo floral en todas las plantas; además, anticipó la antesis de la primera flor por 6 d comparado con la luz de referencia (200 μmol m-2 s-1). Según Runkle (2010), una vez que una inflorescencia ha iniciado, el tiempo a apertura de la primera flor depende de la variedad y la temperatura promedio. En nuestro estudio es importante resaltar que, probablemente, una temperatura o fotoperiodos inductivos constantes en los ambientes controlados (fotoperiodo de 9/15 h y temperatura 25/13 °C diurna/nocturna.), promovieron también un menor tiempo a antesis. Después de la inducción, todas las plantas se desarrollaron en el mismo ambiente.
Cuadro 3 Variables de floración de L. anceps subesp. anceps, en diferentes ambientes de cultivo y con distintos antecedentes de floración.
| Tratamientos | DA | VF | NF | LS | LP | LLab | ALab | LTF | DTF |
| AInv + CFA | 168.33±35.53 a | 15.44±4.70 a | 2.77±0.80 a | 11.20±1.17 a | 11.15±1.23 a | 4.42±0.34 a | 1.99±0.24 a | 55.86±23.99 a | 0.34±0.03 a |
| AInv + SFA | 122.40±41.18 b | 15.60±5.12 a | 2.60±0.54 a | 11.80±0.26 a | 11.81±0.38 a | 4.51±0.11 a | 2.04±0.21 a | 46.28±21.81 a | 0.30±0.03 a |
| AC1 + CFA | 123.37± 7.96 b | 18.50±1.69 a | 2.62±1.06 a | 10.97±0.80 a | 10.97±0.90 a | 4.50±0.33 a | 1.97±0.11 a | 48.44±12.68 a | 0.32±0.04 a |
| AC1 + SFA | 119.33±21.12 b | 17.66±2.30 a | 1.66±0.57 a | 10.73±1.62 a | 10.46±1.58 a | 4.49±0.56 a | 2.04±0.34 a | 49.80±13.46 a | 0.34±0.06 a |
| AC2 + CFA | 138.50± 6.95 ab | 18.25±0.95 a | 2.00±0.00 a | 11.20±0.80 a | 11.00±0.65 a | 4.48±0.14 a | 1.77±0.27 a | 53.87±12.40 a | 0.36±0.06 a |
| AC2 + SFA | S/DF | S/DF | S/DF | S/DF | S/DF | S/DF | S/DF | S/DF | S/DF |
| CV (%) | 2.58 | 23.82 | 31.14 | 9.24 | 9.70 | 7.37 | 11.66 | 38.83 | 12.00 |
Valores promedio con letras distintas en columnas indican diferencias significativas entre tratamientos (Tukey, p≤0.05) v
AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 mmol μmol m-2 s-1); AC2: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1). CFA: plantas con floración anterior; SFA: plantas sin floración anterior; DA: días a antesis; VF: vida de la flor; NF: número de flores; LS: tamaño de la flor, de sépalo a sépalo; LP: tamaño de la flor, de pétalo a pétalo; Llab: largo del labelo; Alab: ancho del labelo; LTF: longitud del tallo floral; DTF: diámetro del tallo floral; S/DF: sin desarrollo floral.
En las demás variables de desarrollo floral analizadas no hubo efecto de tratamientos. En AC2+SFA hubo inducción, pero los tallos florales abortaron poco después de rebasar los 5 cm de largo (tamaño considerado como medida de brote inductivo en nuestra investigación) (Cuadro 3).
Algunas de las características más sobresalientes del desarrollo floral se observan en las flores individuales de cada uno de los tratamientos (Figura 4).

AInv: ambiente invernadero (luz natural con intensidad lumínica promedio de 90 μmol m-2 s-1); AC1: ambiente controlado 1 (HPS+MH+FL con intensidad lumínica de 80 μmol m-2 s-1); AC2: ambiente controlado 2 (LED con intensidad lumínica de 64 μmol m-2 s-1). CFA: plantas con floración anterior; SFA: plantas sin floración anterior. AC2 + SFA no presentó inducción.
Figura 4 Flores de L. anceps subesp. anceps, de plantas cultivadas en diferentes ambientes y con distintos antecedentes de floración: A) AC1+CFA; B) AC2+CFA; C) AInv + CFA; D) AC1+SFA; E) AInv+CFA.
Coeficiente de correlación
Las variables vegetativas correlacionadas con las variables de floración de plantas en ambiente controlado fueron diferentes a las correlaciones de plantas en invernadero (Cuadro 4). Las correlaciones negativas entre algunas características del crecimiento vegetativo y floral sugieren que la planta, bajo las condiciones experimentales, al invertir mayor energía al crecimiento vegetativo, disminuye el crecimiento floral y el número de flores. Al contrario, entre mayor sea el crecimiento del brote vegetativo, que es el encargado de la floración del año actual de la planta, promueve mayor crecimiento del tallo floral (correlación positiva) (Cuadro 4). En invernadero, un mayor crecimiento en la altura de la planta promueve que el tiempo a antesis sea mayor (correlación positiva) (Cuadro 4), como se observó previamente en el Cuadro 3. Amin et al. (2004), analizaron los coeficientes de correlación de nueve caracteres para seis especies de orquídeas epífitas nativas de Bangladesh (Aerides odoratum, Aerides multiflorum, Aerides jaintapuri, Rhynchostyles retusa alba, Rhynchostyles retusa pink y Vanda teres), y encontraron correlaciones positivas en 20 de 36 asociaciones. Algunos de nuestros datos tienen similitud parcial con los de esos autores: ellos encontraron correlación negativa significativa entre número de hojas con el número de flores y correlación no significativa entre altura de la planta con longitud de la inflorescencia (pero no con antesis como en nuestra investigación).
Cuadro 4 Correlación entre las variables de crecimiento vegetativo y las de floración de L. anceps subesp. anceps, en diferentes ambientes y con distintos antecedentes de floración.
| Variables correlacionadas | Ambiente invernadero | Ambiente controlado | |||
| Variable 1 | Variable 2 | Coeficiente de correlación R | Valor P | Coeficiente de correlación R | Valor P |
| AP | DA | 0.52 | 0.010* | 0.16 | 0.550 ns |
| NTH | NF | 0.13 | 0.550 ns | -0.60 | 0.010* |
| NTPsb | DTF | -0.04 | 0.830 ns | -0.57 | 0.020* |
| LTF | DPsb | -0.02 | 0.890 ns | 0.68 | 0.004* |
| LH | 0.01 | 0.950 ns | 0.67 | 0.005* | |
]Diferencias estadísticamente significativas (p≤0.05); ns: no significativo
AP: altura máxima de planta; NTH y NTPsb: número total de hojas y pseudobulbos; LTF: longitud del tallo floral; DA: días a antesis; NF: número de flores; DTF: diámetro del tallo floral; DPsb : diámetro del pseudobulbo del brote; LH: longitud de la hoja del brote.
El mayor número de caracteres de floración significativamente correlacionados se encontró en las plantas inducidas en invernadero, en comparación con las de ambiente controlado. Con excepción de una correlación (LP con ALab), los demás caracteres de plantas provenientes de los ambientes evaluados, como tamaño de la flor (LS y LP) y tamaño del labelo (LLab y ALab) tuvieron correlaciones positivas entre sí, y se sugiere que esto se debe a la característica de simetría bilateral (zigomórfica) de las orquídeas (Davenport y Kohanzadeh, 1982). Estos cuatro caracteres también tuvieron correlación positiva con el número de flores (NF) en las plantas inducidas en invernadero, pero no en las del ambiente controlado (Cuadro 5).
Cuadro 5 Correlación entre las variables de floración de plantas de L. anceps subesp. anceps, cultivadas en diferentes ambientes y con distintos antecedentes de floración.
| Variables correlacionadas | Ambiente invernadero | Ambiente controlado | |||
| Variable 1 | Variable 2 | Coeficiente de correlación R | Valor P | Coeficiente de correlación R | Valor P |
| LTF | DA | 0.16 | 0.45 ns | 0.56 | 0.02* |
| DTF | 0.57 | 0.003* | 0.75 | 0.001* | |
| ALab | -0.49 | 0.01* | -0.01 | 0.95 ns | |
| LS | LP | 0.97 | <.0001* | 0.95 | <0.0001* |
| LLab | 0.95 | <.0001* | 0.86 | <0.0001* | |
| ALab | 0.70 | 0.0002* | 0.57 | 0.02* | |
| NF | -0.64 | 0.0009* | -0.09 | 0.74 ns | |
| LP | LLab | 0.94 | <.0001* | 0.82 | 0.0001 |
| ALab | 0.72 | <.0001* | 0.45 | 0.06 ns | |
| NF | -0.63 | 0.001* | -0.14 | 0.60 ns | |
| LLab | ALab | 0.69 | 0.0002* | 0.60 | 0.01* |
| NF | -0.64 | 0.0008* | 0.07 | 0.79 ns | |
| ALab | DTF | -0.42 | 0.04* | -0.03 | 0.88 ns |
| NF | -0.52 | 0.01* | 0.04 | 0.88 ns | |
†Diferencias estadísticamente significativas (p≤0.05); ns: no significativo.
LTF: longitud del tallo floral; LS: tamaño de la flor, de sépalo a sépalo; LP: tamaño de la flor, de pétalo a pétalo; Llab: largo del labelo; Alab: ancho del labelo; DA: días a antesis; DTF: diámetro del tallo floral; NF: número de flores por racimo.
Asimismo, las plantas que se indujeron a floración en el ambiente controlado mostraron correlaciones positivas significativas entre la longitud del tallo floral (LTF) con el diámetro del mismo (DTF) y con los días a antesis (DA) (Cuadro 5). Con base en este último dato y la floración de la especie en estudio durante el experimento, se consideró que la LTF se correlacionaría con los DA en las plantas inducidas en el invernadero, ya que se ha observado que a mayor longitud, mayor es el tiempo a antesis. Sin embargo, no hubo correlación significativa entre estos caracteres debido probablemente a la variación del tamaño de los tallos de estas plantas en el invernadero, pero el dato se sustenta en el Cuadro 3 en lo referente a DA. Esos datos son contrarios de manera parcial a los de Moniruzzaman et al. (2012) para orquídeas Dendrobium, quienes encontraron que la longitud del tallo floral y de la inflorescencia se correlacionaron con el número de flores y vida de la flor. En nuestra investigación se sugiere que la característica de la longitud del tallo puede ser uniformizada por la influencia del ambiente controlado en las plantas inducidas en él.
En cuatro años de observaciones de la población de estudio, L. anceps subesp. anceps, en condiciones experimentales en invernadero, presenta variaciones en la floración (inducción floral, longitud del tallo floral, tamaño de flor, días a antesis) conforme cambia el manejo (según condiciones experimentales) o los factores ambientales (altas o más bajas temperaturas; años muy lluviosos que promueven alta nubosidad y baja intensidad lumínica), aunque prevalezca el mismo fotoperiodo. A pesar de los múltiplies factores, nuestra investigación muestra hallazgos importantes para la inducción y desarrollo floral de la especie en estudio, como la reducción de los días a antesis. También resalta el desarrollo de la flor sin anormalidades al retirarse de las cámaras a cierto tiempo después de la inducción floral.
Conclusiones
Las condiciones experimentales en el ambiente controlado 2 (con luz LED) disminuyen el crecimiento vegetativo de plantas de Laelia anceps subesp. anceps que tuvieron floración anterior. El antecedente de floración tiene efectos en el crecimiento e inducción floral, y es significativamente mayor la probabilidad de inducción floral en plantas con floración anterior. El ambiente invernadero promueve el mayor porcentaje de inducción floral, pero las tres condiciones ambientales evaluadas tienen efectos similares en el desarrollo floral.
La reducción de los días a antesis en cualquiera de los dos ambientes controlados contribuye al avance del establecimiento de un programa de floración en fechas específicas para la especie en estudio. Los análisis de correlación muestran asociaciones positivas y negativas según ambientes evaluados, lo que establece bases para la selección de la arquitectura vegetativa y las características florales. Con base en la necesidad de aplicación de tecnologías más compatibles con el ambiente, se advierte potencial en el uso de LEDs para la inducción floral de la especie de orquídea en estudio, pero se requiere mayor investigación respecto a otras intensidades lumínicas, temperaturas y fotoperiodos.











 texto en
texto en 


