Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.51 no.8 Texcoco nov./dic. 2017
Recursos Naturales Renovables
Enraizamiento y aclimatación de plantas de Apuleia leiocarpa
1Federal University of Santa Maria, Av. Roraima 1000, Camobi, 97105-900, Santa Maria, Rio Grande do Sul, Brazil. (khaygert@gmail.com)
Apuleia leiocarpa es una especie de árbol en peligro de extinción con madera de alta calidad. Su propagación por medio de semillas es difícil por que la aparición de frutos es irregular y por el tegumento impermeable al agua; así la propagación asexual es una alternativa prometedora. El objetivo de este estudio fue evaluar el enraizamiento in vitro y ex vitro de A. leiocarpa y la aclimatación de plántulas micropropagadas. La hipótesis fue que el tipo de explante, la concentración de ácido indolbutírico (IBA) y el sustrato influyen en la inducción de raíces adventicias en A. leiocarpa. Para el enraizamiento in vitro, se cultivaron segmentos nodales y microcortes en un Medio de Plantación de Árboles (Wood Plant Medium) (WPM) con 0, 4.9, 9.8, 14.7 y 19.6 μM de IBA. Para la aclimatización se probaron mezclas de sustrato comercial + vermiculita + arena gruesa y sustrato comercial + vermiculita, en proporciones iguales. Para el enraizamiento ex vitro, se trataron segmentos nodales y microcortes con 0 y 4920 μM de IBA durante 10 s y se cultivaron en proporciones iguales de: sustrato comercial + vermiculita + arena gruesa, sustrato comercial + vermiculita y sustrato comercial + arena gruesa. Los segmentos nodales presentaron mayor enraizamiento in vitro que los microcortes sin suplemento de IBA en el medio de cultivo. La composición del sustrato no afectó la supervivencia o el crecimiento de las plántulas enraizadas in vitro durante la aclimatación. El mejor enraizamiento ex vitro se encontró en segmentos nodales y explantes tratados con 4920 μM IBA y cultivados en sustrato comercial + vermiculita + arena gruesa. El enraizamiento ex vitro es una técnica prometedora para producir plántulas de apuleia; sin embargo, se necesitan ajustes a las condiciones ambientales, en el enraizamiento ex vitro y en la aclimatación para maximizar la supervivencia de las plántulas micropropagadas de A. leiocarpa.
Palabras clave: Apuleia leiocarpa; ácido indolbutírico; micropropagación; microcortes; composición del sustrato
Apuleia leiocarpa is an endangered tree species with high quality timber. Propagation by seed is difficult due to irregular fruiting and water-impermeable tegument, so asexual propagation is a promising alternative. This study aimed to evaluate in vitro and ex vitro rooting of A. leiocarpa and acclimatization of micropropagated plantlets. The hypothesis was that type of explant, indolebutyric acid (IBA) concentration and substrate influence the induction of adventitious roots in apuleia. For in vitro rooting, nodal segments and micro-cuttings were grown in Wood Plant Medium (WPM) with 0, 4.9, 9.8, 14.7 and 19.6 μM IBA. Compositions of commercial substrate + vermiculite + coarse sand and commercial substrate + vermiculite, in equal proportions, were tested for acclimatization. For ex vitro rooting, nodal segments and micro-cuttings were treated with 0 and 4920 μM IBA for 10 s and grown in equal proportions of: commercial substrate + vermiculite + coarse sand, commercial substrate + vermiculite, and commercial substrate + coarse sand. Nodal segments presented greater rooting in vitro than micro-cuttings without need for IBA supplementation in the culture medium. Substrate composition did not affect survival or growth of in vitro rooted plantlets during acclimatization. The best ex vitro rooting was found in nodal segments and explants treated with 4920 μM IBA and grown in commercial substrate + vermiculite + coarse sand. Ex vitro rooting is a promising technique for producing apuleia plantlets; however, adjustments to environmental conditions in both ex vitro rooting and acclimatization are necessary in order to maximize survival of micropropagated A. leiocarpa plantlets.
Key words: Apuleia leiocarpa; indolebutyric acid; micropropagation; micro-cuttings; substrate composition
Introducción
Apuleia leiocarpa (Vogel) J. F. Macbride es una especie de árbol de la familia Fabaceae nativa de los bosques tropicales y extensamente distribuida en Brasil. También crece naturalmente en Perú (Backes e Irgang, 2004), Uruguay (Sobral et al., 2006), noreste de Argentina (Martinez-Crovetto, 1963), sur de Bolivia y este de Paraguay (Lopez et al., 1987). Produce madera de excelente calidad y alto valor comercial, que se usa para estructuras externas, construcción y carpintería (Carvalho, 2003). Así, a pesar de su amplia distribución natural, el interés de la industria maderera en cosechar A. leiocarpa coloca a la especie en un alto riesgo de extinción (Rio Grande do Sul, 2014).
La producción de plántulas de A. leiocarpa está limitada por algunas de sus características inherentes, como tiempos inusitados e irregulares en dar fruto y semillas con impermeabilidad al agua por el tegumento, lo que puede retrasar la germinación (Carvalho, 2003). Además de la reproducción seminífera, la mayoría de las especies forestales son heterocigóticas en muchos lugares y poblaciones altamente heterogéneas, debido al proceso de reproducción de las plantas por alogamia. Una opción alternativa usada en silvicultura para obtener materiales reproductivos superiores y homogéneos para las plantaciones forestales es la propagación vegetativa (Xavier et al., 2013), lo que justifica el mayor costo de las plántulas clonales. Los estudios dirigidos a encontrar tecnologías de producción alternativas son importantes y la micropropagación puede ser una buena opción, porque se aplica con éxito a muchas especies de árboles (Erig y Schuch, 2005).
Los brotes adventicios producidos en la etapa de multiplicación en micropropagación pueden arraigarse in vitro o ex vitro; sin embargo, la capacidad de los tejidos para la formación de raíces depende de varios factores endógenos o exógenos y de su interacción (Rocha et al., 2008). El tipo de explante influye en las respuestas de enraizamiento adventicias de las plantas micropropagadas y su selección se basa en la búsqueda de propágulos vegetativos que pueden proporcionar una mejor respuesta al cultivo in vitro (Xavier et al., 2013).
El enraizamiento in vitro se caracteriza por la inducción de raíces adventicias en brotes alargados, mantenidos en un medio de cultivo con un suplemento de auxinas, con el fin de obtener plántulas completas que después serán aclimatadas (Oliveira et al., 2013). Para el enraizamiento ex vitro, los explantes se pueden tratar con auxinas y plantados en sustrato para la formación de raíces concomitante a la aclimatación. El ácido indolbutírico (IBA) ha mostrado alta eficacia en la promoción de raíces adventicias en las plántulas de especies forestales (Xavier et al., 2013).
La aclimatación es esencial para obtener nuevas plántulas (Wendling et al., 2006) y consiste en transferir plantas completas producidas in vitro a un ambiente externo. Este proceso se debe modificar gradualmente y con precaución. Para minimizar el estrés en esta etapa y maximizar la supervivencia, es importante manejar adecuadamente la humedad relativa del aire, las condiciones del sustrato, la temperatura y la luz (Oliveira et al., 2013). El sustrato usado durante la aclimatación debe presentar una porosidad adecuada y una alta capacidad de retención de agua (Girardi y Pescador, 2010); así, la elección del sustrato es determinante para la aclimatación efectiva en plántulas micropropagadas (Skrebsky et al., 2006).
La hipótesis de este estudio fue que el tipo de explante, la concentración de IBA aplicada y la composición del sustrato influyen en el proceso rizogénico y en la aclimatación. El objetivo de este estudio fue evaluar el efecto del tipo de explante y la concentración de IBA en el enraizamiento in vitro y la influencia del tipo de explante y la composición del sustrato en el enraizamiento ex vitro y la aclimatación de las plántulas micropropagadas de A. leiocarpa.
Materiales y Métodos
Los experimentos se realizaron de septiembre de 2012 a febrero de 2013 en el Departamento de Ciencias Vegetales de la Universidad Federal de Santa María en Brasil. En los experimentos con sustrato, una muestra de cada composición sometió a análisis físico según el método descrito en la Norma nº 14 del Ministerio de Agricultura, Ganadería y Abastecimiento de Brasil, para obtener la densidad seca, porosidad de aireación y capacidad de retención de agua bajo succión de una columna de agua de 10 cm.
Explantes para experimentos in vitro y ex vitro
Las plántulas asépticas obtenidas de la germinación in vitro de semillas de A. leiocarpa, de tres plantas madre, se establecieron en Wood Plant Medium (WPM) (Lloyd y McCown, 1980) por 15 d (Figura 1A). La parte aérea de las plántulas se seccionó en segmentos nodales (Figura 1B), que se mantuvieron 30 d en el medio WPM más suplemento con 8.8 μM de bencilaminopurina (BAP), y luego se transfirieron a un medio sin BAP otros 30 d. Los brotes formados al final de este período (Figura 1C) se seccionaron nuevamente en segmentos nodales, con sólo un brote y se usaron para el enraizamiento in vitro y ex vitro (Figura 1D). El sistema radicular y la parte aérea remanente en las plántulas asépticas, denominadas microcepas, se mantuvieron en el medio WPM más suplemento con BAP 8.8 μM por 30 d y después se trasladaron a un medio libre de BAP donde permanecieron 30 d más (Figura 1E). Los brotes formados desde las microcepas (Figura 1F) se seccionaron en microcortes de un brote, que también se usaron para experimentos de enraizamiento in vitro y ex vitro (Figura 1G). Así, los explantes difirieron en origen. Segmentos nodales se produjeron desde los segmentos aéreos, mientras que los microcortes se produjeron desde microcepas formados por el sistema radicular y la parte aérea restante.
Enraizamiento in vitro y aclimatación
Para el enraizamiento in vitro, se cultivaron segmentos nodales y microcortes de un brote de 1.0 a 1.5 cm de longitud en tubos de cultivo de vidrio (50 mL) que contenían aproximadamente 10 mL del medio WPM con 30 g de sacarosa L-1, 6 g de agar L-1, 0.1 g de inositol L-1 y 1.5 g de carbón activado L-1. El medio de cultivo se esterilizó 20 min por autoclave a 121 °C y presión de 1 atm. El pH se ajustó a 5.8 antes del autoclavado y todos los cultivos se mantuvieron en una habitación de crecimiento a una temperatura de 25±2 °C en un fotoperíodo de 16 h bajo una intensidad de luz de 14.3 μE m-2 S-1 suministrado por lámparas fluorescentes. Se probaron concentraciones de 0, 4.9, 9.8, 14.7 y 19.6 μM de ácido indolbutírico (IBA). El experimento fue un factorial 2 x 5 (tipo de explante y concentración de IBA), con cinco repeticiones de cuatro explantes. Los porcentajes de supervivencia y enraizamiento y el número y la longitud (cm) de las raíces se evaluaron después de 60 d en cultivo.
Para la aclimatación, los explantes arraigados in vitro en cinco concentraciones de IBA se retiraron de los tubos de cultivo de vidrio. Las raíces se lavaron con agua corriente y se transfirieron al azar a macetas de plástico individuales (330 mL), con cerca de 110 g de sustrato; antes, esto se esterilizó 1 h en autoclave. Se evaluaron proporciones iguales de sustrato comercial + vermiculita + arena gruesa y sustrato comercial + vermiculita. En todos los tratamientos se usaron sustrato comercial de corteza de pino (H.DECKER®), vermiculita mediana (partículas entre 0.50 y 1.19 mm de diámetro) y arena gruesa (partículas entre 1.0 y 3.0 mm de diámetro). Los recipientes se mantuvieron en una sala de cultivo en bandejas de plástico (55 x 34 x 15 cm) cubiertas con una película de PVC transparente. El riego se aplicó cada día con agua destilada para mantener la humedad del sustrato. Una vez a la semana, se aplicó un riego con una solución nutritiva (mmol): 0.61 nitrato de potasio, 1.0 nitrato de calcio, 1.67 sulfato de magnesio, 0.14 nitrato de amonio, 0.14 monofosfato de potasio y 0.16 % hierro quelado. Los micronutrientes se añadieron a la solución nutritiva en una solución preparada (mmol): 0.015 molibdato sódico, 0.089 ácido bórico, 0.125 sulfato de cobre, 0.123 sulfato de manganeso y 0.028 sulfato de zinc. El experimento se hizo con un diseño completamente aleatorio, con dos tratamientos y ocho repeticiones de cuatro contenedores con una plántula. Después de 30 d de crecimiento, se evaluó el porcentaje de supervivencia, la altura de la parte aérea (cm) y el número de hojas.
Enraizamiento y aclimatación ex vitro
Segmentos nodales y microcortes de un brote (Figura 1) de una longitud de 1.0 a 1.5 cm, excisados de los brotes producidos durante la multiplicación in vitro, se colocaron con la base sumergida en una solución con 0 o 4920 μM de IBA, por 10 s. Luego se cultivaron en recipientes de plástico (50 mL) que contenían cerca de 20 g de sustrato, ya esterilizados en autoclave 1 h. Proporciones iguales de las composiciones de sustrato fueron evaluadas: sustrato comercial + vermiculita + arena gruesa, sustrato comercial + vermiculita, y sustrato comercial + arena gruesa. Sustrato comercial de corteza de pino y vermiculita de grano medio se utilizaron. Los contenedores se mantuvieron 7 d en bandejas cubiertas con película de PVC transparente en una habitación a 25±2 °C y fotoperiodo de 16 h con una intensidad luminosa de 14,3 μE m-2s-1 suministrada por lámparas fluorescentes. Dos riegos con agua destilada se aplicaron cada día para mantener la humedad del sustrato. Luego los cultivos se trasladaron a una cámara húmeda en un invernadero aclimatado donde se cultivaron 45 d. El diseño experimental fue completamente al azar y con arreglo factorial 2 x 2 x 3 (tipo de explante, concentración de IBA y composición del sustrato), con cinco replicaciones de cinco contenedores con un explante. Después de 7, 15, 30 y 45 d en una cámara húmeda, se evaluó el porcentaje de supervivencia y enraizamiento y el número y longitud (cm) de las raíces en los explantes.
Los datos porcentuales fueron transformados por la función arco-seno de
Resultados y Discusión
Enraizamiento in vitro y aclimatación
Para el enraizamiento in vitro, no hubo interacción entre el tipo de explante y la concentración de IBA para todas las variables analizadas a los 60 d. Para la supervivencia, el enraizamiento y la longitud de la raíz, hubo diferencias en el tipo de explante, con los mejores resultados encontrados en segmentos nodales (97.5 % de supervivencia, 28.9 % de enraizamiento y 6.2 cm de longitud media de raíz) en comparación con microcortes (Cuadro 1). Tanto los segmentos nodales como los microcortes se originan de órganos meristemáticos preformados (yema axilar), que por lo general presentan un crecimiento y uniformidad satisfactorios (Watt et al., 2003). Creemos que las diferentes respuestas entre los tipos de explantes no derivan de diferentes competencias morfogénicas, ya que se forman a partir del mismo tejido meristemático, sino más bien porque presentan diferentes concentraciones endógenas de fitohormonas. La síntesis de auxina ocurre en el ápice de la planta y presenta un movimiento unidireccional en los tejidos parenquimatosos hacia el ápice de la raíz (Taiz y Zeiger, 2013). Debido a esto, la mayor capacidad de enraizamiento en los segmentos nodales de A. leiocarpa puede estar relacionada con una mayor cantidad de auxina endógena en comparación con la de los microcortes, ya que esta fitohormona actúa como un señalizador celular en el enraizamiento.
Cuadro 1 Porcentajes de supervivencia y enraizamiento y número y longitud de raíces formadas a partir de segmentos nodales y microcortes de Apuleia leiocarpa cultivadas in vitro durante 60 días en medio WPM con cinco concentraciones de IBA.
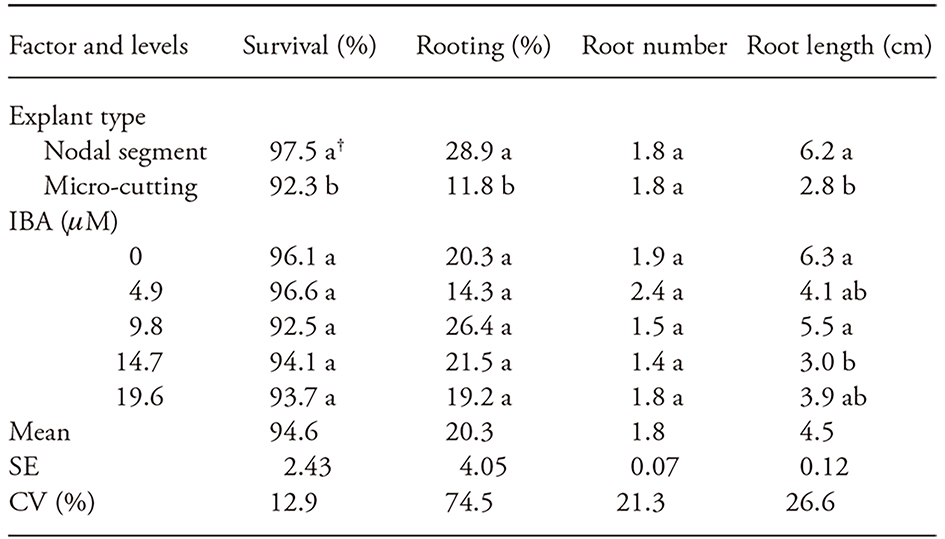
† Valores dentro del mismo factor con letra diferente son estadísticamente diferentes (p≤0.05). SE: Error estándar; CV: coeficiente de variación.
En contraste a nuestros resultados, Pimentel et al. (2016) encontraron que los explantes de microcortes de Handroanthus heptaphyllus mostraron una mejor respuesta de enraizamiento in vitro en comparación con los segmentos nodales.
Las concentraciones de IBA no influyeron en las variables evaluadas, excepto en la longitud de la raíz, donde se observaron los mejores resultados en explantes cultivados en un medio sin IBA o con 9.8 μM IBA (Cuadro 1). Muchas especies forestales presentan dificultades de enraizamiento adventicio, incluso en un medio de cultivo con suplemento de auxinas, lo que indica que otros factores influyen en la diferenciación de los tejidos durante este proceso (Souza y Junghans, 2006). Además, es posible que las concentraciones de IBA utilizadas no fueran adecuadas para favorecer el enraizamiento in vitro de A. leiocarpa. También se observó enraizamiento in vitro ineficiente en Lavandula angustifolia (Miller) tratado con 0.5, 1.0 y 2.0 -μM de IBA (Machado et al., 2013).
En la aclimatación de las plántulas de A. leiocarpa producidas in vitro, las composiciones de sustrato evaluadas no afectaron la supervivencia, la altura de la parte aérea y el número de hojas, con una media de 73.4 % de plántulas supervivientes después de 30 d de crecimiento (Cuadro 2). En la aclimatación de Cydonia oblonga Mill. de plántulas micropropagadas, hubo 81.8 % de supervivencia a los 30 d cuando se utilizó sustrato comercial y vermiculita (v/v 1: 1) (Erig et al., 2004). Las plántulas de Stryphnodendron adstringens Mart. obtenidas de un enraizamiento in vitro presentaron 41 % de supervivencia cuando se aclimataron en sustrato comercial y vermiculita (v/v 1: 1), a los 30 d de crecimiento (Nicioli et al., 2008).
La combinación de suelo y vermicompostación (v/v 3: 1) resultó en una supervivencia de 80 % de las plántulas de Azadirachta indica A. Juss después de 30 d de aclimatación (Reddy et al., 2006). La supervivencia promedio fue 73 % en las plántulas de Pterocarpus santalinus L. durante la aclimatación, en una combinación de estiércol orgánico y arena (v/v 1: 1) (Balaraju et al., 2011). En nuestro estudio, las condiciones de aclimatación proporcionadas durante la transición del estado heterotrófico al autotrófico pueden haber sido adecuadas para favorecer la supervivencia de las plántulas.
Cuadro 2 Porcentaje de supervivencia, altura de la parte aérea y número de hojas de las plántulas de Apuleia leiocarpa enraizadas in vitro y aclimatadas durante 30 días en sala de crecimiento.
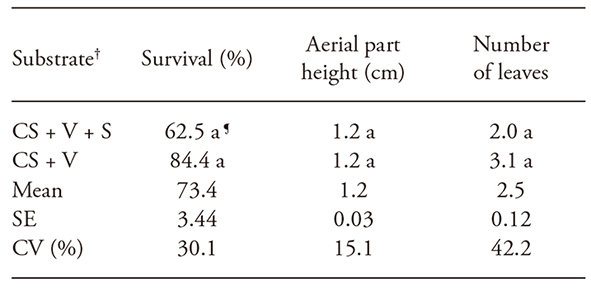
†Valores con diferente letra son estadisticamente diferentes (p≤0.05). SE: Error estándar; CV: coeficiente de variación.
¶Proporciones iguales (v/v) de sustrato comercial (CS), vermiculita (V) y arena gruesa (S).
Enraizamiento ex vitro y aclimatación
No hubo interacción significativa entre los tipos de explantes, la concentración de IBA o el sustrato para todas las variables analizadas a los 7, 15, 30 y 45 d. La formación de raíces ocurrió sólo a los 30 d de crecimiento, pero sin diferencias entre los tipos de explantes, la concentración de IBA o el sustrato para cualquiera de las variables analizadas. A los 45 d de evaluación, la supervivencia fue afectada sólo por el tipo de explante, con la mejor respuesta en los segmentos nodales, comparada con los microcortes (Cuadro 3). Para el enraizamiento ex vitro, las mejores respuestas fueron en los segmentos nodales (14.6 % de enraizamiento), 4920 μM de IBA (12 % de explantes enraizados) y en sustrato comercial + vermiculita + arena gruesa (14 % de explantes enraizados) (Cuadro 3).
Cuadro 3 Porcentaje de supervivencia y enraizamiento de los segmentos nodales de Apuleia leiocarpa y microcortes tratados con IBA y cultivados ex vitro durante 45 días en diferentes sustratos
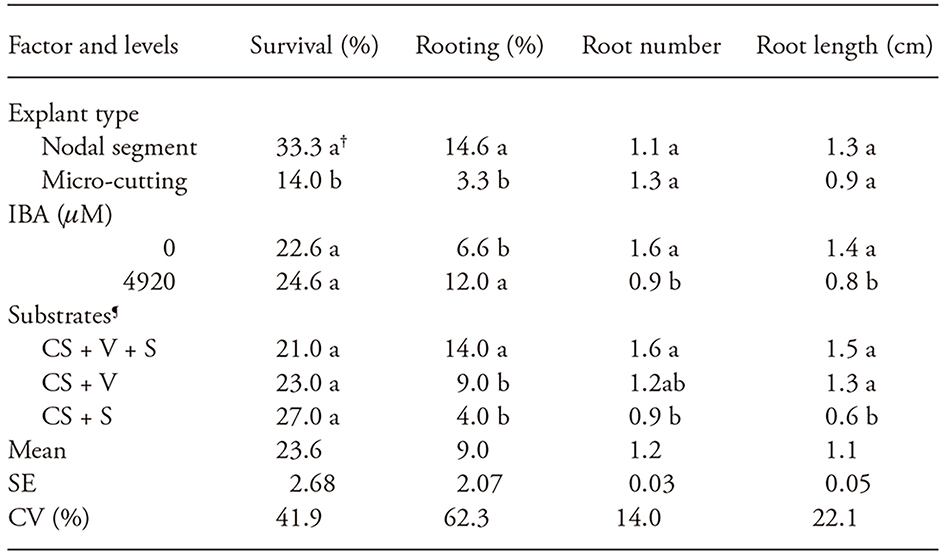
†Los valores dentro del mismo factor seguidos por la misma letra no difieren en la prueba de Tukey con p=0.05. SE: Error estándar; CV: coeficiente de variación.
¶Proporciones iguales (v/v) de sustrato comercial (CS), vermiculita (V) y arena gruesa (S).
A pesar del pequeño número de unidades experimentales evaluadas en nuesro estudio, estos resultados sugieren que los segmentos nodales responden mejor al enraizamiento ex vitro en comparación con los microcortes. Además, para el enraizamiento ex vitro en A. leiocarpa, el uso de IBA es necesario, contrario a los hallazgos en el enraizamiento in vitro. En los brotes obtenidos de la multiplicación in vitro de Tectona grandis L. tratada con 4920 μM IBA y cultivada en sustrato comercial o vermiculita, se observó un enraizamiento ex vitro de 100 % a los 30 días de crecimiento, mientras que en los no tratados con IBA se observó un 85 % de enraizamiento en vermiculita y 95 % de enraizamiento en sustrato comercial (Fermino et al., 2011). Los microcortes de T. grandis tratados con 2460 μM de IBA resultaron en 85 % de enraizamiento en vermiculita a los 30 d (Ramesh et al., 2009). Los microcortes de Dalbergia sissoo Roxb. tratados con 984 μM IBA presentaron 90 % de enraizamiento ex vitro en turba comercial, perlita y vermiculita (Vibha et al., 2014).
En número de raíces y longitud, hubo concentración de IBA y efectos de la composición del sustrato a los 45 d de crecimiento (Cuadro 3). El mayor número y longitud de raíces se obtuvieron en cultivos no tratados con IBA, con promedios de 1.6 y 1.4 cm respectivamente, o cultivados en sustrato comercial + vermiculita + arena o en sustrato comercial + vermiculita (Cuadro 3). Con base en el análisis físico, la composición de proporciones iguales de sustrato comercial + vermiculita + arena presentó densidad seca de 770.7 kg m-3, porosidad de aireación de 25.3 % y la capacidad de retención de agua de 38.7 %. Mientras que el substrato comercial + vermiculita presentó 277.8 kg m-3 de densidad seca, 19.9 % de porosidad de aireación y 57.2 % de capacidad de retención de agua, y el sustrato comercial + arena presentó densidad seca de 997.1 kg m-3, 29.6 % de porosidad de aireación y 30.9 % de capacidad de retención de agua. En el sustrato comercial + vermiculita + arena y sustrato comercial + arena, se reportó una mayor densidad seca en comparación con valores de referencia entre 400 y 500 kg m-3 (Bunt, 1973). Este resultado se puede explicar por la presencia de arena en estas mezclas, que es un componente altamente denso. Las tres combinaciones de sustratos probadas en muestreo estudio presentaron una porosidad de aireación adecuada, dentro del rango recomendado por De Boodt y Verdonck (1972), entre 20 y 40 %. Para la producción de plántulas de Sesbania virgata Cav. Pers, la porosidad de aireación de hasta 25 % aumentó la producción de raíces después de 150 d (Delarmelina et al., 2014).
Valores más altos de capacidad de retención de agua se observaron en el sustrato comercial + vermiculita + arena y sustrato comercial + arena, lo cual puede estar relacionado con la menor proporción de arena en comparación con el substrato comercial + arena. Así, los mayores explantados de A. leiocarpa enraizados en sustrato comercial + vermiculita + arena (Cuadro 3) pueden estar asociados a una mayor capacidad de retención de agua derivada de esta composición del sustrato.
Los resultados de muestreo estudio demuestran que A. leiocarpa es una especie con difícil enraizamiento in vitro y ex vitro, dado que los mayores porcentajes de enraizamiento fueron 28.9 % y 14.0 %, respectivamente. Tanto en el enraizamiento in vitro como en el ex vitro, los segmentos nodales presentaron una mayor capacidad de enraizamiento que los microcortes. Sin embargo, aunque hubo un enraizamiento significativamente mayor en los segmentos nodales, ambos explantes presentaron enraizamiento in vitro. Además, al considerar que el mantenimiento de microcepas puede ser una estrategia importante para aumentar la tasa de multiplicación en A. leiocarpa, es necesario realizar más estudios para encontrar soluciones que minimicen estas diferencias. En relación al uso de auxina, las concentraciones de IBA evaluadas no alteraron el porcentaje de enraizamiento in vitro, pero sí favorecieron el enraizamiento ex vitro. En el enraizamiento ex vitro, 14 % de los explantes enraizados en sustrato comercial + vermiculita + arena, muestran que ajustes son necesarios para definir mejor las condiciones ideales para el enraizamiento ex vitro y la aclimatación de las plántulas de A. leiocarpa. Además, estas plántulas pueden utilizarse en setos micro-clonales (para la producción de plántulas por microcortes), con lo cual su producción masiva sería técnicamente viable.
Conclusiones
El uso de IBA no es necesario para el enraizamiento in vitro de los segmentos nodales de A. leiocarpa y los microcortes, y la aclimatación no es afectada por las composiciones del sustrato. Para el enraizamiento y aclimatación ex vitro de las plántulas de A. leiocarpa, los segmentos nodales se pueden tratar con 4920 μM IBA y cultivar en sustrato comercial + vermiculita + arena gruesa, pero se requieren ajustes adicionales de éstos y otros factores para aumentar el porcentaje de enraizamiento y supervivencia de plántulas después del período de aclimatación.
Literature Cited
Backes, P. e B. Irgang. 2004. Mata Atlântica: As Árvores e a Paisagem. Ed. Paisagem do Sul, Porto Alegre. 396 p. [ Links ]
Balaraju, K., P. Agastian, S. Ignacimuthu, and K. Park. 2011. A rapid in vitro propagation of red sanders (Pterocarpus santalinus L.) using shoot tip explants. Acta Physiol. Plant. 33: 2501-2510. [ Links ]
Bunt, A. C. 1973. Some physical and chemical characteristics of loam less pot-plant substrates and their relation to plant growth. Plant Soil 38: 1954-1965. [ Links ]
Carvalho, P. E. R. 2003. Espécies Arbóreas Brasileiras. Embrapa Florestas. Brasília. 1039 p. [ Links ]
De Boodt, M., and O. Verdonck, 1972. The physical properties of the substrates in horticulture. Acta Hortic. 26: 37-44. [ Links ]
Delarmelina, W. M., M. V. W. Caldeira, J. C. T. Faria, E. O. Gonçalves, e R. L. F. Rocha. 2014. Diferentes substratos para a produção de mudas de Sesbania virgata. Flor@m 21: 224-233. [ Links ]
Erig, A. C., and M. W. Schuch. 2005. Micropropagação fotoautotrófica e uso da luz natural. Ciênc. Rural 35: 961-965. [ Links ]
Erig, A. C ., M. W. Schuch, e A. da C. Chaves. 2004. Enraizamento in vitro e aclimatização de mudas de marmeleiro Cvs. Mc e Adams, utilizadas como porta-enxerto para a pereira. Sci. Agraria 5: 61-68. [ Links ]
Estat. Sistema para análises estatísticas. 1994. Jaboticabal, Departamento de Ciências Exatas, FCAV-UNESP, v. 02. [ Links ]
Fermino, P. C. P., A. Raposo, e J. E. Scherwinski-Pereira. 2011. Enraizamento ex vitro e aclimatização de plantas micropropagadas de Tectona grandis. Floresta 41: 79-86. [ Links ]
Girardi, C. G., e R. Pescador. 2010. Aclimatação de gengibre (Zingiber officinale Roscoe) e a relação com carboidratos endógenos. Rev. Bras. Pl. Med. 12: 62-72. [ Links ]
Lloyd, G., and B. McCown.1980. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot tip culture. Int. Plant Propagation Soc. Proc. 30: 421-427. [ Links ]
Lopez, J., Little, E. L., Rombold Jr., J. S. and Hahn, W. J. 1987. Arboles communes del Paraguay. Washington, D. C., U.S.A.: Peace Corps. 425 p. [ Links ]
Machado, M. P., C. Deschamps, and L. A. Biasi.2013. Application of IBA on in vitro and ex vitro rooting microcutting of Lavandula angustifolia Miller. J. Biotec. Biodivers. 4: 153-161. [ Links ]
Martinez-Crovetto, R. 1963. Estudio taxonomico-biometrico de Schinus molle y Schinus areira (Anacardiaceae), Bonplandia, Corrientes 1: 225-244. [ Links ]
Nicioli, P. M., R. Paiva, R. C. Nogueira, J. R. F. Santana, L. C. Silva, D. P. C. Silva, e J. M. P. Porto. 2008. Ajuste do processo de micropropagação de barbatimão. Ciênc. Rural 38: 685-689. [ Links ]
Oliveira, L. S., P. C. Dias, e G. E. Brondani. 2013. Micropropagação de espécies florestais brasileiras. Pesq. Flor. Bras. 33: 439-453. [ Links ]
Pimentel, N., Bisognin, D. A., Rodrigues, M. B., Kielse, P., Lencina, K. H. 2016. Micropropagation of Handroanthus heptaphyllus (Vellosso Mattos). Aust. J. Basic App. Sci. 10: 79-87. [ Links ]
Ramesh, K., M. K. Chandra, and T. Vijaya. 2009. In vitro propagation and ex vitro rooting of Tectona (L. F.), APNBV-1 Clone. J. For. Sci. 25: 119-126. [ Links ]
Reddy, A. R., M. Bavaji, and J. V. S. Rao. 2006. Micropropagation of Azadirachta indica A. Juss. via cotyledonary nodes. Indian J. Biotechnol. 5: 309-311. [ Links ]
Rio Grande do Sul (Estado). Decreto nº 52.109, de 1 de dezembro de 2014. Available in: <Available in: http://www.al.rs.gov.br/legis/M010/M0100099.ASP?Hid_Tipo=TEXTO&Hid_TodasNormas=61669&hTexto=&Hid_IDNorma=61669 >. (Access: August, 2015). [ Links ]
Rocha, M. A. C., M.A.P. Costa, S.A. Silva, C. A. S. Ledo, M.J.S. Moreira, e L.P. Bastos. 2008. Enraizamento in vitro e aclimatização de genótipos de jenipapeiro (Genipa americana L.). Rev. Bras. Frutic 30: 769-774. [ Links ]
Skrebsky, E. C., F. T. Nicoloso, and J. Maldaner. 2006. Substratos na aclimatização de Pfaffia glomerata (Spreng) Pedersen produzidain vitrosob diferentes doses de sacarose. Ciênc. Rural 36: 1416-1423. [ Links ]
Sobral, M., J. A. Jarenkow, P. Brack, B. Irgang, J. Larocca, e R. S. Rodrigues. 2006. Flora Arbórea e Arborescente do Rio Grande do Sul. Ed. RiMA/Novo Ambiente, São Carlos. 350 p. [ Links ]
Souza, A. S. and T. G. Junghans. 2006. Introdução à Micropropagação de Plantas. 152p. [ Links ]
Taiz, L., and E. Zeiger. 2013. Fisiologia Vegetal. 5a. ed. Artmed, Porto Alegre. 918 p. [ Links ]
Watt, M. P., F. C. Blakeway, M. E. O. Mokotedi, and S. M. Jain. 2003. Micropropagation of Eucalyptus. In: Jain, S. M. and K. Ishii, K. (eds). Micropropagation of Woody Trees and Fruits. Kluwer Academic Publishers, Netherlands. pp: 217-244. [ Links ]
Vibha, J. B., N. S. Shekhawat, P. Mehandru, and R. Dinesh. 2014. Rapid multiplication of Dalbergia sissoo Roxb.: a timber yielding tree legume through axillary shoot proliferation and ex vitro rooting. Physiol. Mol. Biol. Plants. 20: 81-87. [ Links ]
Wendling, I., L. F. Dutra, e F. Grossi. 2006. Produção de Mudas de Espécies Lenhosas. Embrapa Florestas, Colombo. 54 p. [ Links ]
Xavier, A., I. Wendling, e R. L. Silva. 2013. Silvicultura Clonal, Princípios e Técnicas. Editora UFV, Viçosa. 279 p. [ Links ]
Recibido: Junio de 2016; Aprobado: Febrero de 2017











 texto en
texto en 



